агрегация тромбоцитов при коронавирусе что это такое
Медицинские интернет-конференции
Языки
Тромботические осложнения при коронавирусной инфекции
Ломовицкий Н.А., Клецова М.В., Красикова Н.С.
Научный руководитель: ассистент кафедры СНАРПиСТМ, Кабанова И.А.
Резюме
В данной работе говорится о выявление тромботических осложнений при коронавирусной инфекции. В целях работы лежит: изучение данных литературных источников и выявление тромбозов при коронавирусной инфекции. Задачами работы является: изучить обстоятельства внезапных смертей при covid-19; провести метаанализ тромбозных осложнений; провести аналогию и сравнительную характеристику летальных исходов тромбозов с иной патологией, на примере пневмонии. Полученные результаты в полном объеме соответствуют данным литературы и проведенным анализам.
Ключевые слова
Статья
Цели: изучить данные литературных источников и выявить тромбозов при коронавирусной инфекции.
Задачи исследования: изучить обстоятельства внезапных смертей при covid-19; провести метаанализ тромбозных осложнений; провести аналогию и сравнительную характеристику летальных исходов тромбозов с иной патологией, на примере пневмонии.
Материалы и методы: изучение научного материала базируется на материалах журнала
«JAMA Open Network» а также на материалах национального медицинского исследовательского центра кардиологии. Методология научного исследования основана на таких методах как: математический (статистический), теоретический (анализ и синтез), эмпирический (сравнение).
Плотные сгустки крови в сосудах помимо тромбоэмболии порой провоцируют инфаркт или инсульт. Именно поэтому нужно следить не только за признаками коронавирусной инфекции, но и отмечать любые симптомы тромбоза сосудов. Это поможет предотвратить опасные осложнения. По данным статьи в журнале CHEST, опубликованной 18.11.2020, были обследованы около 20 тысяч пациентов с коронавирусной инфекцией [6]. Результаты представлены в рисунке 2.
По данным реестра пациентов с коронавирусной инфекцией среди граждан США, тромботические осложнения возникали у 2,6 % из 229 госпитализированных пациентов в некритическом для жизни состоянии и у 35,3 % из 170 госпитализированных пациентов в критическом состоянии тромботические осложнения включают инфаркт миокарда, ишемический инсульт, венозную тромбоэмболию (ВТЭ). Результаты вскрытий демонстрируют микротромбозы во многих органах, например, в легких, сердце, почках. На основании этого предполагают, что тромбоз является одной из причин полиорганной недостаточности при тяжелом течении COVID-19. Один из факторов, способствующих активации системы свертывания крови является рост концентрации провоспалительных цитокинов, что укладывается в концепцию взаимосвязи между воспалением и тромбозом (так называемый “иммунотромбоз”). Высвободившиеся цитокины провоцируют интерстициальное воспаление, эндотелиальное повреждение и активацию коагуляции, в патогенезе которой ключевая роль принадлежит тканевому фактору. Он выделяется моноцитами, а также поврежденными либо активированными вследствие действия цитокинов эндотелиальными клетками. В результате образуется тромбин, что приводит к тромбозам альвеолярных капилляров. Также у пациентов с COVID-19 удалось обнаружить аномалии, ведущие к тромбозу [3]. В исследовании 19 пациентов в тяжелом состоянии были обнаружены повышенные значения ряда маркеров гиперкоагуляции: D-димер (у 100 %), фибриноген (у 74 %), VIII фактор свертывания крови (у 100 %). У 53 % испытуемых были обнаружены антифосфолипидные антитела; а сниженные показатели протеинов С и S, а также антитромбина — у всех пациентов. Аномалии свертывания крови были связаны с развитием инсульта, периферической артериальной ишемии и ВТЭ. Исследование 115 пациентов с COVID-19 (у 71 из которых было нетяжелое течение болезни, а у 44 — тяжелое) выявило наличие РНК коронавируса в тромбоцитах и высокие значения цитокинов, связанных с тромбоцитами. Как свидетельствует вышеизложенное исследование, агрегация тромбоцитов происходит при более низких, нежели чем ожидалось, концентрациях тромбина.[4] Согласно порталу MedPage Today, который подготовил обзор конгресса, прошедшего 12-14 июля 2020 года, анализ включал более 3200 пациентов в критическом состоянии. Согласно наблюдениям из трех центров в Нидерландах, тромботические осложнения развились у около 5,3% пациентов с COVID-19 в общих отделениях, суммарно в общих отделениях и ОРИТ – у 20,5% пациентов. Частота ВТЭ составила 3,8 и 18,7% соответственно. Фиксация тромбоза глубоких вен отображена на рисунке 3.
Тромбоз может развиться всего за пару дней и привести к летальному исходу. Исследователи полагают, что именно тромбозом можно объяснять, почему многие пациенты с COVID-19 страдают не только от нарушений в работе органов дыхания, но и теряют обоняние, а также испытывают проблемы с пищеварением и разнообразные сбои в работе кровеносной системы. У многих больных тромбоз развивается стремительным образом. Сгустки крови образуются в венах ног, вызывая тромбофлебит; в сосудах головного мозга, вызывая инсульт; в системе коронарного кровообращения, вызывая инфаркт; в легких, вызывая тромбоэмболию легочной артерии; в кишечнике, вызывая ишемию [5].
Для метаанализа были отобраны 42 исследования, суммарно включившие 8271 пациента [2]. В большинстве исследований не проводилось тотального скрининга для выявления тромботических осложнений, соответственно, учитывались преимущественно симптомные эпизоды. (таблица 4)
Метаанализ показал, что среди всех госпитализированных в связи с COVID-19 пациентов суммарная частота всех венозных тромбоэмболических осложнений составляет 21%, среди пациентов ПИТ 31%. Частота тромбозов глубоких вен составила в среднем 20%, в ПИТ 28%, у умерших пациентов по данным аутопсий 35%. Частота ТЭЛА составила, в среднем, 13%, в ПИТ 19%, у умерших пациентов по данным аутопсий 22%. Частота артериальных тромбозов суммарно составила 2% (1% инсульты, 0,5% инфаркты миокарда, 0,4% тромбозы периферических и мезентериальных артерий), в ПИТ 5% [2].
Выводы: тромбоз сосудов поражает сегодня около 70% людей во всем мире. Развитию тромбоза способствует поражение стенок кровеносных сосудов, повышение свертываемости крови и замедление кровотока. Тромбоз может возникать в результате травмы сосудов, неправильного образа жизни и питания, из-за постоянного чувства тревоги, стрессовых ситуаций. В группе риска находятся следующие категории людей: мужчины в возрасте от 40 лет; женщины, старше 50 лет; люди, страдающие ожирением; пациенты со злокачественными новообразованиями, с диагнозом тромбоз глубоких вен и тромбоэмболия легочной артерии; люди, перенесшие обширные хирургические вмешательства; пациенты на гормональных препаратах; люди, злоупотребляющие алкоголем, курильщики. Это характерно для всех тромбозов и поэтому усугубляется течение COVID-19. Тромбоз может развиться всего за пару дней и привести к летальному исходу. Исследователи полагают, что именно тромбозом можно объяснить, почему многие пациенты с COVID-19 страдают не только от нарушений в работе органов дыхания, но и теряют обоняние, а также испытывают проблемы с пищеварением и разнообразные сбои в работе кровеносной системы. Таким образом, делая вывод, нужно отметить, что тромбозы сосудов при коронавирусной инфекции встречаются в большинстве случаев и часто приводят к летальному исходу. Проведенный анализ показал, что тромботические осложнения не только часто осложняют течение СOVID-19, но и самым неблагоприятным образом сказываются на выживании таких пациентов. Необходима оптимизация подходов к профилактике и лечению тромботических осложнений у пациентов с COVID-19.
Тромбозы при короновирусе
Используйте навигацию по текущей странице

Почему развивается тромбоз в организме людей с коронавирусом?
Последние данные из Европы показывают, что у 30-70% пациентов с коронавирусом, поступающих в отделения интенсивной терапии (ОИТ) выявляются тромбы в глубоких венах ног или в лёгких. Вирус вызывает повреждение стенки сосудов, что запускает процесс тромбообразования, который в норме защищает человека от кровотечения. При ковиде поражение эндотелия приводит к активации системы комплимента, повышение активности иммунной системы, которая атакует собственные клетки организма.
Примерно у каждого четвёртого пациента с коронавирусом, поступившего в отделение интенсивной терапии, развиваются признаки тромбоэмболии лёгочной артерии. Постельный режим сам по себе повышает риск тромбоза нижних конечностей при коронавирусе. Частота тромбоза намного выше, чем мы обычно наблюдаем у пациентов, нуждающихся в госпитализации по другим причинам, отличным от COVID-19.
Экспертные аппараты и Лучшие специалисты
Повышенный риск инсульта
Пациенты, поступающие в больницу с COVID-19, также более подвержены инсульту по сравнению с неинфицированным населением. Вероятность инсульта обычно связана с возрастом, а также с другими факторами риска, такими как высокое кровяное давление, повышенный уровень холестерина или курение. Однако выявлена более высокая частота инсультов у пациентов с COVID-19 у людей в возрасте до 50 лет, без других факторов риска инсульта. У пожилых людей, принимающих лекарства против тромбов снижаются риски сосудистых катастроф при Covid-19.
Низкий уровень кислорода
COVID-19 также связан со сгустками крови в крошечных кровеносных сосудах, которые важны для переноса кислорода в органах. В отчётах о вскрытии обнаружены элементы SARS-CoV-2, вируса, вызывающего COVID-19, в клетках, выстилающих эти небольшие кровеносные сосуды в лёгких, почках и кишечнике.
Это может привести к образованию крошечных сгустков крови в этих мелких кровеносных сосудах, которые нарушают нормальный кровоток и способность крови доставлять кислород к этим органам. Важно отметить, что эти небольшие сгустки крови могут нарушить нормальную функцию лёгких. Это может объяснить, почему у пациентов с тяжёлой формой COVID-19 может быть очень низкий уровень кислорода.
Как лечить и диагностировать тромбы
Когда пациенты поступают в больницу из-за ковида, обычной практикой является введение низких доз антитромботических препаратов для предотвращения образования тромбов. С 2020 года проводятся испытания, чтобы уточнить схемы назначения этих препаратов для максимального эффекта. Диагностика этих тромбов у пациентов с COVID-19 также может быть особенно сложной задачей.
Симптомы обострения лёгочной инфекции, связанной с вирусом, могут быть неотличимы от симптомов тромбоэмболии лёгочной артерии. Симптомы тромбоза глубоких вен после коронавируса неотличимы от классических:
Основные лабораторные признаки тромбоза при коронавирусе включают изменения коагулограммы. Проблема, связанная с COVID-19, заключается в том, что вирус может влиять на лабораторные тесты, которые также могут использоваться для диагностики венозных сгустков крови. У некоторых пациентов это означает, что тест на D-димер возможно не помогает диагностировать тромбы и вовремя начать их лечить.
Каждому пациенту с диагностированной коронавирусной инфекцией необходимо проводить исследование вен нижних конечностей. Обычно для этой цели достаточно ультразвуковой диагностики. Важно понимать, что тромбы могут возникать и в отдалённом периоде после заболевания, поэтому стандартом должна быть ультразвуковая диагностика вен ежемесячно на протяжении полугода после перенесённого ковида. Точный диагноз тромбоза, как осложнения коронавируса может поставить флеболог с помощью УЗИ диагностики. Назначение лекарственных средств против тромбозов позволит предотвратить тяжёлые осложнения.
Почему COVID-19 вызывает свёртывание крови?
Одна из теорий заключается в том, что повышенная скорость образования тромбов при ковиде — это просто отражение общего недомогания и неподвижности. Однако текущие данные показывают, что риск образования тромбов и тромбоэмболии у пациентов с ковидом значительно выше, чем у пациентов, госпитализированных в стационар и в отделения интенсивной терапии.
Предварительные исследования показывают, что обычно используемый гепарин для профилактики тромбоза при коронавирусе, может оказывать противовирусное действие, связываясь с SARS-CoV-2 и подавляя ключевой белок, который нужно использовать вирусу для закрепления на клетках.
Что мы знаем точно, так это то, что осложнения со свёртыванием крови быстро становятся серьёзной угрозой COVID-19. В этой области нам ещё многое предстоит узнать о вирусе, о том, как он влияет на свёртываемость крови, и проверить данные о лучших вариантах профилактики и лечения этих тромбов.
Двойной удар
Сгустки крови, желеобразные сгустки клеток и белков, являются механизмом организма для остановки кровотечения. Тромбы образуются в сосудах в ответ на повреждение внутренней стенки. Некоторые исследователи рассматривают свёртывание крови как ключевую особенность COVID-19.
Воздействие вируса на иммунную систему также может проявляться повышенной свёртываемостью крови. У некоторых людей COVID-19 побуждает иммунные клетки высвобождать поток химических сигналов, усиливающих воспаление, которое связано с коагуляцией и свёртыванием крови различными путями. И вирус, похоже, активирует систему комплемента, защитный механизм, который вызывает свёртывание крови и повышает риск тромбоза при коронавирусе.
Как избежать тромбоза лёгких при коронавирусе?
Похоже, что также важно учитывать стадию течения болезни и место обследования пациента: обычная палата или отделение интенсивной терапии (ОИТ). Оба этих фактора будут влиять на количество антикоагулянтов, которое может получить пациент, что, в свою очередь, может повлиять на последующий тромбоз. Большинство исследований относится к тромбоэмболии лёгочной артерии (ТЭЛА), тогда как есть убедительные доказательства того, что большая часть этого может быть тромбозом лёгочной артерии « in situ». Высокая частота тромбоза лёгких при COVID-19, вероятно, обусловлена слиянием трёх процессов:
интенсивного эндотелиального воспаления, описанного выше, приводящего к тромбозу « in situ », включая тромбоз микрососудов;
уменьшение лёгочного кровотока в ответ на паренхиматозный процесс проявляется низкой скоростью движения крови в сосудах;
классический переход тромбоза глубоких вен в тромбоэмболию лёгочной артерии.
Срочно необходимо проверить результаты текущих испытаний для дальнейшего информирования клинической практики об использовании антикоагулянтов. Сюда входят как пациенты, госпитализированные в отделения интенсивной терапии, так и пациенты из группы риска, находящиеся в палате общего профиля.
Для пациентов, не нуждающихся интенсивной терапии важно решить: каковы поводы для более интенсивной антикоагуляции там, где визуализация недоступна? Можно ли назначать антикоагулянты, используя только анализ на D-димер, и какие пороговые значения следует использовать для точки отсчёта?
Антикоагулянтные препараты
Выбор антикоагулянта, который будет вам назначен, основан на различных факторах: функции почек, массе тела и других принимаемых вами лекарствах. Профилактика тромбозов при ковиде должна проводится с первого дня после установления диагноза и продолжаться не менее месяца после прекращения всех симптомов перенесённого заболевания. Стоит иметь в виду, что некоторые антитромботические препараты получены из животных (свиного происхождения). Существуют таблетированные и инъекционные формы лекарственных препаратов, которые выбирает врач.
Назначаемые схемы
Как долго нужно пить антикоагулянты?
Вам будет предоставлена подробная информация о том, как долго вам следует принимать антикоагулянтные препараты, а также инструкции на этикетке лекарства и больничной документации. Обычно срок антитромботической профилактики не менее месяца после исчезновения всех клинических проявлений. Перед окончанием профилактического курса необходимо провериться на УЗИ и определить необходимость его продолжения. Такой подход позволит предотвратить развитие поздних тромботических осложнений в виде постэмболической пневмонии и массивной ТЭЛА. В информационном поле постоянно появляются случаи преждевременной смерти от тромбоэмболии через несколько месяцев после перенесённой коронавирусной пневмонии. Важно, чтобы вы пили лекарства в течение рекомендованного времени и завершили курс.
Что делать, если вы пропустите приём?
Если вы пропустили приём и вспомнили об этом в тот же день, примите пропущенную дозу, как только вспомните, в этот день. Примите следующую дозу на следующий день и продолжайте принимать один раз в день. Не принимайте двойную дозу, чтобы восполнить пропущенную дозу. При любых подозрениях на тромбоз необходимо провериться флеболога, чтобы определить возможные тромбы.
Определить тяжесть состояния больного коронавирусом поможет простой показатель крови. Исследователи изучили данные более чем 1,5 тыс. госпитализированных и выяснили, что уровень тромбоцитов существенно падал у тех пациентов, лечение которых закончилось летальным исходом. Ученые предложили использовать данный показатель как маркер потенциальной угрозы смерти и ухудшения течения болезни. Российские специалисты считают, что это перспективная методика мониторинга здоровья при COVID-19. Более того, сдать такой анализ можно в любой клинической лаборатории уже сейчас, поэтому врачам не потребуется новых технических решений и больших финансовых затрат.
Научное предсказание
Исследователи из Университета Вероны и университетской клиники Падуи совместно с коллегами из США проанализировали ряд научных статей, в которых сообщалось об уровне тромбоцитов (компонентов крови, которые принимают активное участие в строительстве сосудов. — «Известия») у пациентов с COVID-19.
Были изучены истории болезни 1779 заболевших, 399 (22,4%) из них находились в тяжелом состоянии. Сравнив показатели клинических анализов, ученые сделали вывод, что низкое количество тромбоцитов связано с повышенным риском тяжелого течения заболевания и смертности у пациентов с коронавирусом (препринт статьи доступен в научных библиотеках).
Активированный тромбоцит на стекле с иммобилизованным фибриногеном
— Предлагается использовать этот показатель как маркер ухудшения состояния больного, — сообщил «Известиям» научный сотрудник лаборатории анализа показателей здоровья населения и цифровизации здравоохранения МФТИ Давид Наимзада. — Речь идет о возможности мониторинга состояния заразившихся и принятии врачебных решений.
По словам ученого, уровень тромбоцитов отражает некоторые стороны состояния системы гемостаза, функция которой заключается в сохранении жидкого состояния крови, остановке кровотечений при повреждениях стенок сосудов и растворении тромбов. Нарушение работы этой системы говорит о системных сбоях организма, что в какой-то степени может свидетельствовать о резком ухудшении его работы в целом.
Эффективный показатель
Выявленный критерий действительно может использоваться для диагностики тяжелых форм коронавируса, которые требуют особого внимания врачей, рассказал «Известиям» заведующий кардиохирургическим отделением Клинического центра Сеченовского университета Роман Комаров.
— При тяжелой форме заболевания коронавирусной инфекцией возникает синдром полиорганной недостаточности: нарушаются функции печени, почек, легких, — отметил кардиохирург. — Это провоцирует угнетение кроветворного ростка, следствием чего является снижение количества и качества тромбоцитов.
Этот показатель уже используется в клинической практике для мониторинга здоровья пациентов при различных патологических состояниях, сообщил «Известиям» профессор Санкт-Петербургского политехнического университета Петра Великого, доктор биологических наук, руководитель исследований в области молекулярной вирусологии и онкологии Андрей Козлов.
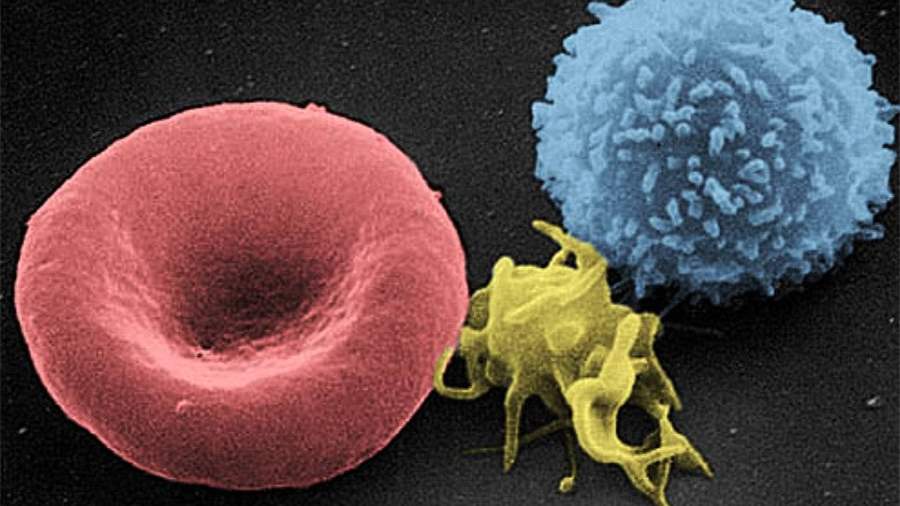
Сканирующая электронная микрофотография (SEM) клеток крови человека: эритроцит, активированный тромбоцит, лейкоцит (слева направо)
— Многие заболевания, в том числе онкологические, сопровождаются понижением уровня тромбоцитов (тромбоцитопения — патология, которая характеризуется проблемами с остановкой кровотечений. — «Известия»). Это важные сведения для врачей-клиницистов. Конечно, снижение тромбоцитов — это сигнал об ухудшении состояния пациента, — подчеркнул эксперт.
Ученый рассказал, что в целом показатели крови могут многое сообщить о тяжести заболеваний. К примеру, при СПИДе нарушается соотношение клеток CD4 (вид лимфоцитов, так называемые Т-хелперы, которые помогают другим клеткам уничтожать инфицирующие организмы) и CD8 (Т-киллеры, распознающие и уничтожающие ненормальные или инфицированные клетки). Их пропорция считается важным клиническим показателем, который используется для характеристики состояния больного и качества процесса его лечения. Что касается коронавируса и уровня тромбоцитов, то исследования их связи необходимо продолжать, отметил Андрей Козлов.
Доступный анализ
Как пояснил в разговоре с «Известиями» Давид Наимзада, метод определения уровня тромбоцитов в крови хорош тем, что доступен в каждой клинической лаборатории. Поэтому его внедрение не потребует особых затрат и технических средств.
Однако для COVID-19 такой относительно простой способ мониторинга состояния больного предлагается применить впервые. На сегодняшний момент в научной литературе представлено мало информации о патогенезе нового штамма.
Пока информации недостаточно, чтобы делать однозначные выводы об эффективности предложенного анализа, считает сотрудник Института биологии ТюмГУ (вуз — участник проекта повышения конкурентоспособности «5-100») Николай Карпов.
Сотрудники морга входят в крематорий кладбища Ла Альмудена с гробом человека, умершего от коронавирусной болезни, Мадрид, Испания, 23 марта 2020 года
Гематологические показатели COVID-19 и осложнения со стороны кровеносной системы
Краткое содержание
Введение
Тяжелый острый респираторный синдром Коронавируса 2 (SARS-CoV-2), вызывающий коронавирусную болезнь 2019 (COVID-19), из эпидемической вспышки в Ухане [1] быстро перерос в пандемию с более чем миллионом зараженных и миллиардами людей, вынужденных соблюдать меры социального дистанционирования. SARS-CoV-2 (SARS) примерно на 80% схож с вирусом атипичной пневмонии SARS-CoV, он также проникает в клетки хозяина, связываясь с рецептором ангиотензинпревращающего фермента 2 (АПФ2) [1]. Несмотря на то, что COVID-19 является, прежде всего, инфекцией дыхательных путей, свежие данные указывают на то, что его следует рассматривать как системное заболевание, затрагивающее сердечно-сосудистую, дыхательную, желудочно-кишечную, неврологическую, кроветворную и иммунную системы [2]–[4]. Смертность от COVID-19 ниже, чем от SARS и Ближневосточного респираторного синдрома (MERS) [5], но он куда опаснее обычного сезонного гриппа. В группе риска, прежде всего, пожилые или люди с хроническими заболеваниями, но и у молодых людей без хронических заболеваний также могут возникнуть потенциально летальные осложнения, такие как молниеносный миокардит и диссеминированная внутрисосудистая коагулопатия (ДВС-синдром) [6], [7]. В данном обзоре были собраны многочисленные гематологические данные, связанные с осложнениями COVID-19, а также приведено руководство по ранней их профилактике и лечению.
Общий анализ крови и результаты биохимии: прогноз протекания заболевания
В течение инкубационного периода, обычно в диапазоне с 1 по 14 день, и на ранней фазе заболевания, когда присутствуют неспецифические симптомы, количество лейкоцитов и лимфоцитов периферической крови соответствует норме или слегка снижено. При виремии SARS-CoV-2, в основном, поражает ткани, экспрессирующие высокие уровни АПФ2, такие как легкие, сердце и желудочно-кишечный тракт. Спустя приблизительно 7–14 дней после начальных симптомов обнаруживаются клинические проявления заболевания с выраженным системным повышением провоспалительных цитокинов, которое даже можно назвать «цитокиновым штормом» [8]. К этому моменту лимфопения становится совершенно очевидной. Несмотря на то, что этиология лимфопении в случае COVID-19 до конца не изучена, можно назвать некоторые факторы, приводящие к данному состоянию. Например, было показано, что лимфоциты тоже экспрессируют на своей поверхности АПФ2 [9], поэтому SARS-CoV-2 может непосредственно инфицировать эти клетки и, в конечном счете, приводить к их лизису. Далее, цитокиновый шторм характеризуется существенно возросшими уровнями интерлейкинов (в основном это IL-6; IL-2; IL-7; GM-CSF; CXCL10, MCP-1, MIP1-a) и TNFα, которые могут приводить к апоптозу лимфоцитов [10]–[12]. Активация цитокинов также может быть связана с атрофией лимфоидных органов, в т.ч. селезенки, что также снижает количество циркулирующих лимфоцитов [13]. Наконец, молочнокислый ацидоз, наиболее выраженный у пациентов с онкологией, также может ингибировать пролиферацию лимфоцитов [14], [15].
Лимфопения была также зарегистрирована примерно у 40% первых госпитализированных пациентов с COVID-19 в Сингапуре [21]. Позднее процент пациентов с лимфоцитопенией был подтвержден [22]. У 69% пациентов с низкими лимфоцитами выявлялась реактивная популяция лимфоцитов, включая подгруппу лимфоплазмоцитоидов, которая не присутствовала в периферической крови пациентов с SARS в 2003 году [22]–[24]. Проточная цитометрия не выявила никакой инверсии в соотношении CD4+/CD8+ лимфоцитов [22]. Однако функциональные исследования показали, что SARS-CoV-2 может нарушать функцию CD4+ Т-хелперов и регуляторных Т-клеток, вызывая раннюю гиперактивацию, за которой следует быстрое истощение цитотоксических CD8+ T-киллеров [25], [26]. В Сингапуре также было обнаружено, что у пациентов, нуждающихся в интенсивной терапии, уровень лимфоцитов был значительно ниже [22]. В другом ретроспективном исследовании лимфопения выявлялась у 85% критически больных пациентов Уханя [27].
Лимфопения также отмечена у критически больных пациентов с COVID-19 в Вашингтоне [28], [29]. Она оказалась более выраженной в случае летальных исходов [20]. Сообщалось также, что при тяжелом протекании заболевания и летальном исходе, уровень лимфоцитов/лейкоцитов, как при поступлении, так и в период госпитализации, был значительно ниже по сравнению с оным у выздоровевших пациентов [26], [30]. В отличие от умерших пациентов, у выживших минимум количества лимфоцитов наблюдался на 7-й день с момента появления симптомов и выздоровления [31]. Оценка динамики количества лимфоцитов может помочь прогнозировать исход заболевания. Tan и колл. предложили модель прогнозирования, основанную на подсчете лимфоцитов в двух временных точках: на 10-12 день с момента появления симптомов пациенты с менее чем 20% лимфоцитов и менее чем 5% на 17-19 день имеют неблагоприятный прогноз.
Согласно недавним исследованиям известно, что повреждения миокарда у госпитализированных с COVID-19 связаны с повышенным риском смертности [32], [33]. В одном проспективном исследовании, включающем 416 пациентов с подтвержденным COVID-19, у 82 (19,7%) были обнаружены повреждения миокарда. По сравнению с другими пациентами, у людей с повреждениями миокарда обнаружен более высокий уровень лейкоцитов, а также более низкие уровни лимфоцитов и тромбоцитов [32]. В другом ретроспективном исследовании с 187 пациентами из другой больницы Уханя было показало, что у пациентов с высокими уровнями тропонина Т наблюдались лейкоцитоз, увеличение нейтрофилов и снижение лимфоцитов [33].
Метаанализ девяти исследований показал, что тромбоцитопения тесно ассоциирована с тяжестью протекания COVID-19: более выраженное снижение количества тромбоцитов отмечено в случае летальных исходов [34].
Достойны упоминания результаты исследования Qu и колл.: пик числа тромбоцитов во время течения заболевания совпадал с более тяжелым протеканием заболевания [35]. Согласно многомерному анализу, отношение тромбоцитов к лимфоцитам во время пика тромбоцитов оказалось независимым прогностическим фактором для длительной госпитализации. Было высказано предположение, что высокое соотношение тромбоцитов к лимфоцитам свидетельствует о более интенсивном цитокиновом шторме, вызванном усиленной активацией тромбоцитов.
Использование прокальцитонина, ферритина и С-реактивного белка (СРБ) в качестве биомаркеров
В исследовании Guan и колл. [16], объединившем в себе данные из различных провинций Китая, были получены интересные биохимические результаты: С-реактивный белок (СРБ) был повышен у 60,7% пациентов, повышенный прокальцитонин, являющийся маркером вторичной бактериальной инфекции, осложняющей течение COVID-19, был обнаружен у 5,5%, а повышенная лактатдегидрогеназа (ЛДГ) у 41% пациентов. В случаях более тяжелого протекания заболевания по сравнению с умеренным/легким эти значения составили: 81,5% против 56,4% для СРБ; 13,7% против 3,7% для прокальцитонина; и 58,1% против 37,2% для ЛДГ) [16].
В ретроспективном когортном исследовании, включающем 191 пациента с COVID-19 из Ухани, у впоследствии умерших пациентов чаще наблюдались высокие уровни ЛДГ, прокальцитонина, ферритина и интерлейкина-6 (IL-6) в сыворотке крови [31]. Согласно исследованию, проведенному Wang и колл., повышенное содержание ЛДГ было связано также с более высоким риском развития ОРДС [17], необходимостью интенсивной терапии [22] и смертностью [17], [31]. В другом мета-анализе отмечено, что повышенные значения прокальцитонина связаны с почти 5-кратным увеличением риска тяжелого протекания заболевания [36]. Также было показано, что высокий уровень ферритина сопряжен с повышенным риском развития ОРДС. Однако, достоверной связи уровней прокальцитонина и ферритина с выживаемостью выявить не удалось [17], [31]. Повышенный уровень СРБ при COVID-19 также связан с развитием ОРДС [17], повреждениями миокарда [32] и летальным исходом [30].
Другим перспективным биомаркером протекания COVID-19 является интерлейкин-6. Высокие уровни IL-6 оказались связанными с повышенным риском летального исхода, при этом отмечалось, что у умерших пациентов в ходе госпитализации обнаруживалось постепенное увеличения уровня IL-6 [17], [19], [31].
Осложнения, связанные с нарушениями свертывания крови
Нарушения свертывания крови встречаются довольно часто среди пациентов при тяжелом протекании COVID-19 [30], [31]. В результате многоцентрового ретроспективного исследования в Китае в течение первых двух месяцев эпидемии у 260 из 560 пациентов (46,4%) обнаруживался повышенный уровень D-димера (≥0,5 мг/л), среди тяжелых случаев это повышение было выражено значительно сильнее (59,6% против 43,2% при умеренном течении заболевания) [16]. Динамика D-димера может отражать тяжесть заболевания, а повышенные уровни могут позволить прогнозировать неблагоприятные исходы [37]. Значения D-димера выше 1,5 мкг/л были зафиксированы у 36% пациентов в описательном исследовании с 99 случаями COVID-19 в Ухани [19]. В других исследованиях также подтверждалось, что при поступлении у пациентов, нуждавшихся в интенсивной терапии уровни D-димера и протромбинового времени (ПВ) были выше [18], [20].
У пациентов с повреждениями миокарда в результате COVID-19 чаще выявлялись нарушения свертывания крови [32]. Среди пациентов с высоким уровнем тропонина T чаще встречались случаи повышений ПВ, активированного частичного тромбопластинового времени (АЧТВ) и уровня D-димера [33]. Среди 201 пациента с пневмонией, вызванной COVID-19, увеличение ПТ было связано с высоким риском развития ОРДС, тогда как повышение уровня D-димера оказалось достоверно связанным с повышенными рисками развития ОРДС и летального исхода [17]. Различия между уровнями D-димера у выживших и погибших пациентов были больше, чем при сравнении групп с ОРДС и без него; это наблюдение может свидетельствовать о том, что связанные с ДВС-синдромом осложнения приводят к смерти множества пациентов вне зависимости от наличия ОРДС. На основании многофакторного анализа в многоцентровом ретроспективном когортном исследовании было установлено, что повышенные уровни D-димера (> 1 мкг/мл) достоверно связаны с летальным исходом [31]. В другом ретроспективном исследовании, проведенном Tang и колл. (183 пациента с COVID-19) отмечено, что у умерших пациентов наблюдались более высокие уровни D-димера, продуктов распада фибрина (ПРФ), а также увеличенные ПВ и АЧТВ по сравнению с выжившими. Примечательно, что симптомы во время течения заболевания у 71,4% из умерших пациентов и 0,6% выживших соответствовали клиническим критериям ДВС-синдрома. Среднее время от поступления до проявления ДВС-синдрома составляло 4 дня [6]. В проспективном исследовании, оценивающем профиль коагуляции у пациентов с COVID-19, уровни D-димера, ПРФ и фибриногена были значительно выше, чем у группы контроля (здоровых испытуемых). При тяжелом течении заболевания значения D-димера и ПРФ оказались выше, чем при легком [38].
Все приведенные сведения указывают на то, что повышение уровня D-димера и ДВС-синдром широко распространены у пациентов с тяжелой формой COVID-19 [39]. Судя по всему, нарушения регуляции иммунной системы и эндотелиальная дисфункция активно вовлечены в патофизиологию COVID-19, однако, детали этих процессов предстоит выяснить в будущих исследованиях.
Еще одним осложнением COVID-19 является венозная тромбоэмболия (ВТЭ). Частота развития ВТЭ у госпитализированных пациентов доходит до 10% [41]. Длительная иммобилизация в период болезни, обезвоживание, острый воспалительный процесс, риск-факторы сердечно-сосудистых заболеваний (гипертония, диабет, ожирение) или сердечно-сосудистые заболевания (заболевания коронарной или периферических артерий, перенесенный ишемический инсульт) и классическая генетическая тромбофилия (например, гетерозиготная мутация Фактора V Лейдена) – все перечисленные факторы являются частыми сопутствующими заболеваниями, потенциально увеличивающими риск ВТЭ, у госпитализированных пациентов с COVID-19. Активация/повреждение эндотелиальных клеток при связывании вируса с АПФ-2 также повышает риск ВТЭ. Выделение огромного количества медиаторов воспаления, гормоны и иммуноглобулины у тяжелых или критически больных пациентов могут привести к увеличению вязкости крови. Кроме того, искусственная вентиляция легких, катетеризация центральных вен и хирургическое вмешательство также приводят к повреждениям эндотелия сосудов. Сочетание всех вышеперечисленных факторов может привести к возникновению тромбоза глубоких вен (ТГВ) или даже к легочной эмболии (ЛЭ). Поэтому всем пациентам, госпитализированным с COVID-19 рекомендуется проводить оценку риска развития ВТЭ и, при высоком риске, назначать фармакологическую тромбопрофилактику [42].
Для этой задачи может быть полезной стандартизированная модель оценки риска, такая как IMPROVE-VTE. Модифицированная память IMPROVE-VTE, которая учитывает значения уровней Д-димера и других клинических биомаркеров ВТЭ, повышает точность идентификации пациентов с высоким риском ВТЭ, нуждающихся в адаптированной фармакологической тромбопрофилактике [43]. Кроме того, также важно обращать внимание на риск ВТЭ у бессимптомных или амбулаторных пациентов с легким протеканием COVID-19. Для улучшения клинических результатов также крайне важна ранняя диагностика ЛЭ при внезапном ухудшении оксигенации, дыхательной недостаточности или гипотонии. Несмотря на то, что существующие данные по этой проблеме пока ограничены, представляется разумным использование динамики уровней Д-димера в качестве одного из прогностических показателей ТГВ и/или ЛЭ, наряду со стандартными методами визуализации (Допплер-эхокардиография). В недавнем исследовании с участием 25 пациентов с подозрением на ЛЭ, обследованных с помощью КТ-ангиографии легких (КТАЛ), было показано, что у пациентов с подтвержденной ЛЭ (n = 10) уровни D-димера оказались выше, чем у пациентов без ЛЭ, и его значения превышали 7000 нг/мл [12].
Использование низкомолекулярных гепаринов (НМГ) или нефракционированного гепарина (НФГ) предпочтительнее прямых пероральных антикоагулянтов (ПППА) во избежание их возможного взаимодействия с противовирусными (особенно с ингибиторами протеазы против ВИЧ, такими как ритонавир) и антибактериальными (такими как азитромицин) препаратами [44]. Такое лечение, нарушающее сигнальные пути CYP3A4 и / или гликопротеина P, может увеличить риск кровотечения или уменьшить антитромботический эффект от ПППА. В китайском исследовании, включающем 449 пациентов с тяжелой формой COVID-19, введение НМГ пациентам с высокими уровнями D-димера или пациентам, отвечающих критериям индуцированного сепсисом ДВС-синдрома, достоверно ассоциировалось с улучшением общей выживаемости за 28 дней [45]. Кроме того, клиницистами рекомендуется регулярно оценивать всех пациентов с COVID-19, проходящих лечение гепарином, на предмет синдрома гепарин-индуцированной тромбоцитопении (ГИТ). Хотя риск развития ГИТ пока не определен, потенциально он существует из-за нарушений регуляции иммунного ответа, массивного воспалительного синдрома, вызванного вирусной инфекцией, нетоза и высвобождения тромбоцитарного фактора 4 (PF4).
Таким образом, существует четыре важных аспекта ведения пациентов с COVID-19: 1) ранняя диагностика и оценка рисков развития ДВС-синдрома (биомаркеры: количество тромбоцитов, ПВ, фибриноген, D-димер, антитромбин и белок С); 2) выявление пациентов с высоким риском вне зависимости от того, госпитализирован он или лечится амбулаторно; 3) определение индивидуального режима тромбопрофилактики, в котором прежде всего, рекомендуются НМГ; и 4) применение НМГ может быть дополнено другими антитромботическими препаратами, такими как антитромбин и рекомбинантный тромбомодулин, что может быть полезно при таких сложных состояниях как «иммунотромбоз».
Заключение
COVID-19 имеет выраженные проявления со стороны кроветворной системы и часто приводит к гиперкоагуляции. Отслеживание динамики биомаркеров крови в ходе заболевания помочь клиницистам осуществлять индивидуальный подход к лечению и предсказывать необходимость интенсивной терапии тем, кто в ней больше всего нуждается.
Список литературы
[1] N. Zhu et al., ‘A Novel Coronavirus from Patients with Pneumonia in China, 2019’, N. Engl. J. Med., vol. 382, no. 8, pp. 727–733, Feb. 2020, doi: 10.1056/NEJMoa2001017.
[2] E. Driggin et al., ‘Cardiovascular Considerations for Patients, Health Care Workers, and Health Systems During the COVID-19 Pandemic.’, J. Am. Coll. Cardiol., vol. 75, no. 18, pp. 2352–2371, 2020, doi: 10.1016/j.jacc.2020.03.031.
[3] M. N. Bangash, J. Patel, and D. Parekh, ‘COVID-19 and the liver: little cause for concern.’, lancet. Gastroenterol. Hepatol., vol. 5, no. 6, pp. 529–530, 2020, doi: 10.1016/S2468-1253(20)30084-4.
[4] P. Mehta et al., ‘COVID-19: consider cytokine storm syndromes and immunosuppression.’, Lancet (London, England), vol. 395, no. 10229, pp. 1033–1034, 2020, doi: 10.1016/S0140-6736(20)30628-0.
[5] Z. Wu and J. M. McGoogan, ‘Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China: Summary of a Report of 72 314 Cases From the Chinese Center for Disease Control and Prevention.’, JAMA, Feb. 2020, doi: 10.1001/jama.2020.2648.
[6] N. Tang, D. Li, X. Wang, and Z. Sun, ‘Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia’, J. Thromb. Haemost., vol. 18, no. 4, pp. 844–847, Apr. 2020, doi: 10.1111/jth.14768.
[7] M. Madjid, P. Safavi-Naeini, S. D. Solomon, and O. Vardeny, ‘Potential Effects of Coronaviruses on the Cardiovascular System’, JAMA Cardiol., Mar. 2020, doi: 10.1001/jamacardio.2020.1286.
[8] T. Li, H. Lu, and W. Zhang, ‘Clinical observation and management of COVID-19 patients.’, Emerg. Microbes Infect., vol. 9, no. 1, pp. 687–690, Dec. 2020, doi: 10.1080/22221751.2020.1741327.
[9] H. Xu et al., ‘High expression of ACE2 receptor of 2019-nCoV on the epithelial cells of oral mucosa’, Int. J. Oral Sci., vol. 12, no. 1, p. 8, Dec. 2020, doi: 10.1038/s41368-020-0074-x.
[10] S. Aggarwal, S. Gollapudi, L. Yel, A. S. Gupta, and S. Gupta, ‘TNF-alpha-induced apoptosis in neonatal lymphocytes: TNFRp55 expression and downstream pathways of apoptosis.’, Genes Immun., vol. 1, no. 4, pp. 271–9, Apr. 2000, doi: 10.1038/sj.gene.6363674.
[11] Y.-C. Liao, W.-G. Liang, F.-W. Chen, J.-H. Hsu, J.-J. Yang, and M.-S. Chang, ‘IL-19 induces production of IL-6 and TNF-alpha and results in cell apoptosis through TNF-alpha.’, J. Immunol., vol. 169, no. 8, pp. 4288–97, Oct. 2002, doi: 10.4049/jimmunol.169.8.4288.
[12] E. Terpos et al., ‘Hematological findings and complications of COVID ‐19’, Am. J. Hematol., p. ajh.25829, May 2020, doi: 10.1002/ajh.25829.
[13] J. F.-W. Chan et al., ‘Simulation of the clinical and pathological manifestations of Coronavirus Disease 2019 (COVID-19) in golden Syrian hamster model: implications for disease pathogenesis and transmissibility.’, Clin. Infect. Dis., Mar. 2020, doi: 10.1093/cid/ciaa325.
[14] K. Fischer et al., ‘Inhibitory effect of tumor cell-derived lactic acid on human T cells.’, Blood, vol. 109, no. 9, pp. 3812–9, May 2007, doi: 10.1182/blood-2006-07-035972.
[15] B. You et al., ‘The official French guidelines to protect patients with cancer against SARS-CoV-2 infection’, Lancet Oncol., vol. 21, no. 5, pp. 619–621, May 2020, doi: 10.1016/S1470-2045(20)30204-7.
[16] W. Guan et al., ‘Clinical Characteristics of Coronavirus Disease 2019 in China’, N. Engl. J. Med., vol. 382, no. 18, pp. 1708–1720, Apr. 2020, doi: 10.1056/NEJMoa2002032.
[17] C. Wu et al., ‘Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China’, JAMA Intern. Med., Mar. 2020, doi: 10.1001/jamainternmed.2020.0994.
[18] C. Huang et al., ‘Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China.’, Lancet (London, England), vol. 395, no. 10223, pp. 497–506, 2020, doi: 10.1016/S0140-6736(20)30183-5.
[19] N. Chen et al., ‘Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study’, Lancet, vol. 395, no. 10223, pp. 507–513, Feb. 2020, doi: 10.1016/S0140-6736(20)30211-7.
[20] D. Wang et al., ‘Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China.’, JAMA, vol. 323, no. 11, p. 1061, Feb. 2020, doi: 10.1001/jama.2020.1585.
[21] B. E. Young et al., ‘Epidemiologic Features and Clinical Course of Patients Infected With SARS-CoV-2 in Singapore’, JAMA, vol. 323, no. 15, p. 1488, Apr. 2020, doi: 10.1001/jama.2020.3204.
[22] B. E. Fan et al., ‘Hematologic parameters in patients with COVID-19 infection.’, Am. J. Hematol., vol. 95, no. 6, pp. E131–E134, 2020, doi: 10.1002/ajh.25774.
[23] W. J. Chng, H. C. Lai, A. Earnest, and P. Kuperan, ‘Haematological parameters in severe acute respiratory syndrome.’, Clin. Lab. Haematol., vol. 27, no. 1, pp. 15–20, Feb. 2005, doi: 10.1111/j.1365-2257.2004.00652.x.
[24] N. Lee et al., ‘A major outbreak of severe acute respiratory syndrome in Hong Kong.’, N. Engl. J. Med., vol. 348, no. 20, pp. 1986–94, May 2003, doi: 10.1056/NEJMoa030685.
[25] H.-Y. Zheng et al., ‘Elevated exhaustion levels and reduced functional diversity of T cells in peripheral blood may predict severe progression in COVID-19 patients.’, Cell. Mol. Immunol., vol. 17, no. 5, pp. 541–543, 2020, doi: 10.1038/s41423-020-0401-3.
[26] C. Qin et al., ‘Dysregulation of immune response in patients with COVID-19 in Wuhan, China.’, Clin. Infect. Dis., Mar. 2020, doi: 10.1093/cid/ciaa248.
[27] X. Yang et al., ‘Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study.’, Lancet. Respir. Med., vol. 8, no. 5, pp. 475–481, 2020, doi: 10.1016/S2213-2600(20)30079-5.
[28] M. Arentz et al., ‘Characteristics and Outcomes of 21 Critically Ill Patients With COVID-19 in Washington State.’, JAMA, vol. 323, no. 16, Mar. 2020, doi: 10.1001/jama.2020.4326.
[29] P. K. Bhatraju et al., ‘Covid-19 in Critically Ill Patients in the Seattle Region — Case Series’, N. Engl. J. Med., vol. 382, no. 21, pp. 2012–2022, May 2020, doi: 10.1056/NEJMoa2004500.
[30] Y. Deng et al., ‘Clinical characteristics of fatal and recovered cases of coronavirus disease 2019 (COVID-19) in Wuhan, China: a retrospective study.’, Chin. Med. J. (Engl)., Mar. 2020, doi: 10.1097/CM9.0000000000000824.
[31] F. Zhou et al., ‘Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study.’, Lancet (London, England), vol. 395, no. 10229, pp. 1054–1062, Mar. 2020, doi: 10.1016/S0140-6736(20)30566-3.
[32] S. Shi et al., ‘Association of Cardiac Injury With Mortality in Hospitalized Patients With COVID-19 in Wuhan, China.’, JAMA Cardiol., Mar. 2020, doi: 10.1001/jamacardio.2020.0950.
[33] T. Guo et al., ‘Cardiovascular Implications of Fatal Outcomes of Patients With Coronavirus Disease 2019 (COVID-19).’, JAMA Cardiol., Mar. 2020, doi: 10.1001/jamacardio.2020.1017.
[34] G. Lippi, M. Plebani, and B. M. Henry, ‘Thrombocytopenia is associated with severe coronavirus disease 2019 (COVID-19) infections: A meta-analysis.’, Clin. Chim. Acta., vol. 506, pp. 145–148, Jul. 2020, doi: 10.1016/j.cca.2020.03.022.
[35] R. Qu et al., ‘Platelet-to-lymphocyte ratio is associated with prognosis in patients with coronavirus disease-19.’, J. Med. Virol., Mar. 2020, doi: 10.1002/jmv.25767.
[36] G. Lippi and M. Plebani, ‘Procalcitonin in patients with severe coronavirus disease 2019 (COVID-19): A meta-analysis.’, Clin. Chim. Acta., vol. 505, pp. 190–191, 2020, doi: 10.1016/j.cca.2020.03.004.
[37] D. Snijders, M. Schoorl, M. Schoorl, P. C. Bartels, T. S. van der Werf, and W. G. Boersma, ‘D-dimer levels in assessing severity and clinical outcome in patients with community-acquired pneumonia. A secondary analysis of a randomised clinical trial.’, Eur. J. Intern. Med., vol. 23, no. 5, pp. 436–41, Jul. 2012, doi: 10.1016/j.ejim.2011.10.019.
[38] H. Han et al., ‘Prominent changes in blood coagulation of patients with SARS-CoV-2 infection’, Clin. Chem. Lab. Med., vol. 0, no. 0, Mar. 2020, doi: 10.1515/cclm-2020-0188.
[39] G. Lippi and E. J. Favaloro, ‘D-dimer is Associated with Severity of Coronavirus Disease 2019: A Pooled Analysis.’, Thromb. Haemost., vol. 120, no. 5, pp. 876–878, May 2020, doi: 10.1055/s-0040-1709650.
[40] W. H et al., ‘Guidance for Diagnosis and Treatment of DIC From Harmonization of the Recommendations From Three Guidelines’, J. Thromb. Haemost., 2013, doi: 10.1111/JTH.12155.
[41] K. SR et al., ‘Prevention of VTE in Nonsurgical Patients: Antithrombotic Therapy and Prevention of Thrombosis, 9th Ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines’, Chest, vol. 141, no. 2 Suppl, 2012, doi: 10.1378/CHEST.11-2296.
[42] W. DM et al., ‘American Society of Hematology 2018 Guidelines for Management of Venous Thromboembolism: Optimal Management of Anticoagulation Therapy’, Blood Adv., vol. 2, no. 22, 2018, doi: 10.1182/BLOODADVANCES.2018024893.
[43] S. AC et al., ‘Modified IMPROVE VTE Risk Score and Elevated D-Dimer Identify a High Venous Thromboembolism Risk in Acutely Ill Medical Population for Extended Thromboprophylaxis’, TH open companion J. to Thromb. Haemost., vol. 4, no. 1, 2020, doi: 10.1055/S-0040-1705137.
[44] J. Thachil et al., ‘ISTH interim guidance on recognition and management of coagulopathy in COVID‐19’, J. Thromb. Haemost., vol. 18, no. 5, pp. 1023–1026, May 2020, doi: 10.1111/jth.14810.
[45] N. Tang, H. Bai, X. Chen, J. Gong, D. Li, and Z. Sun, ‘Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy’, J. Thromb. Haemost., vol. 18, no. 5, pp. 1094–1099, May 2020, doi: 10.1111/jth.14817.