альбумин что это у собак
Лабораторная диагностика (анализы) животных, статьи. Ветклиника Котофей, Днепр
Альбумин (Albumin) в крови, биохимический анализ
Альбумин в крови, биохимический анализ крови животных
ОБЩИЕ СВЕДЕНИЯ
Материал для исследования: Кровь.
Во многих лабораториях количество альбумина определяется спекгрофотометрическим методом. Чаще всего проводится метод с использованием бромкрезола зеленого (БКЗ). Уровень альбумина можно также определить с помощью электрофореза сывороточного белка. Альбумины проходят через ацетат целлюлозы или агарозный гель в самую последнюю очередь вследствие сравнительно небольшой величины их молекулы и наличия анионного заряда.
Поскольку альбумин является отрицательным белком острой фазы, его уровень может снижаться при воспалительных заболеваниях.
Показания
Оцениваемые системы органов
РАБОТА С ОБРАЗЦОМ
Необходимо взять 0,5—2,0 мл венозной крови.
Обработка полученных результатов
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ ТЕСТА
Диапазон нормальных значениий
Возможные патологические изменения
Значения, превышающие показатели нормы или находящиеся ниже нормы.
Факторы, влияющие на результаты теста:
Препараты, которые могут повлиять на физиологические процессы в организме
Биохимия крови
Биохимический анализ крови.
Биохимический анализ крови – это метод лабораторной диагностики, позволяющий оценить работу многих внутренних органов. Стандартный биохимический анализ крови включает определение ряда показателей, отражающих состояние белкового, углеводного, липидного и минерального обмена, а также активность некоторых ключевых ферментов сыворотки крови.
На исследование берут кровь строго натощак в пробирку с активатором свертывания, исследуют сыворотку крови.
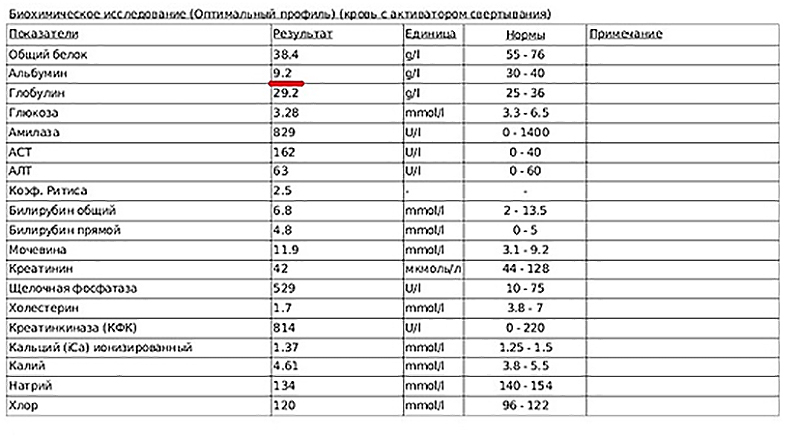
Общий белок.
Общий белок – это общая концентрация всех белков крови. Существуют различные классификации белков плазмы. Наиболее часто их разделяют на альбумин, глобулины (все другие белки плазмы) и фибриноген. Концентрация общего белка и альбумина определяется с помощью биохимического анализа, а концентрация глобулинов путем вычитания концентрации альбумина из общего белка.
— заболевания, сопровождающиеся активацией иммунной системы (аутоиммунные и аллергические заболевания, хронические инфекции и т.д.),
Ложное завышение белка может происходить при липемии (хилез), гипербилирубинемии, значительной гемоглобинемии (гемолиз).
— недостаток белка в пище,
— длительные хронические болезни, характеризующиеся истощением иммунной системы (инфекции, новообразования),
— лечение цитостатиками, иммунодепресантами, глюкокортикостероидами и др.
При кровотечении концентрация альбумина и глобулинов падает параллельно, однако при некоторых расстройствах, сопровождающихся потерей белка, снижается преимущественно содержание альбумина, так как размер его молекул меньше по сравнению с другими белками плазмы.
Альбумин
Гомогенный белок плазмы, содержащий небольшое количество углеводов. Важной биологической функцией альбумина в плазме является поддержание внутрисосудистого коллоидно-осмотического давления, благодаря чему предотвращается выход плазмы из капилляров. Поэтому существенное снижение уровня альбумина приводит к появлению отеков и выпотов в плевральную или брюшную полости. Альбумин служит молекулой – переносчиком, транспортируя билирубин, жирные кислоты, лекарственные средства, свободные катионы (кальций, медь, цинк), некоторые гормоны, различные токсические агенты. Так же собирает свободные радикалы, связывает медиаторы воспалительных процессов, представляющих опасность для тканей.
Расстройства, которые сопровождались бы усилением синтеза альбумина, не известны.
— нефропатии и энтеропатии,
— сильная экссудация (например, ожоги);
— хроническая недостаточность печени,
— недостаток белка в пище,
— недостаточность экзокринной функции поджелудочной железы
Билирубин.
Билирубин продуцируется в макрофагах путем ферментативного катаболизма фракции гема из различных гемпротеидов. Большая часть циркулирующего билирубина (около 80%) образуется из «старых» эритроцитов. Погибшие «старые» эритроциты разрушаются ретикулоэндотелиальными клетками. При окислении гема образуется биливердин, который метаболизируется до билирубина. Оставшаяся часть циркулирующего билирубина (около 20%) образуется из других источников (разрушение зрелых эритроцитов в костном мозге, содержащих гем, миоглобин мышц, ферменты). Образованный таким образом билирубин циркулирует в кровотоке, транспортируясь в печень в форме растворимого билирубин-альбуминового комплекса. Связанный с альбумином билирубин может быть легко извлечен из крови печенью. В печени билирубин связывается с глюкуроновой кислотой под влиянием глюкуронилтрансфераз. Связанный билирубин включает билирубин-моноглюкуронид, который преобладает в печени, и билирубин-диглюкуронид, который преобладает в желчи. Связанный билирубин транспортируется в желчные капилляры, откуда он поступает в желчевыводящие пути, а затем в кишечник. В кишечнике связанный билирубин подвергается ряду превращений с формированием уробилиногена и стеркобилиногена. Стеркобилиноген и небольшое количество уробилиногена выводятся с фекалиями. Основное количество уробилиногена вторично всасывается в кишечнике, достигая печени через портальное кровообращение и реэкскретируясь желчным пузырем.
Уровни сывороточного билирубина растут тогда, когда его продукция превышает его метаболизм и выведение из организма. Клинически гипербилирубинемия выражается желтухой (желтая пигментация кожи и склер).
Это связанный билирубин, растворимый и с высокой реакционной способностью. Повышение уровня прямого билирубина в сыворотке крови связано с пониженной экскрецией конъюгированного пигмента из печени и желчевыводящих путей и проявляется в виде холестатической или гепатоцеллюлярной желтухи. Патологический рост уровня прямого билирубина ведет к появлению этого пигмента в моче. Поскольку непрямой билирубин не выводится мочой, наличие билирубина в моче подчеркивает увеличение в сыворотке крови уровня связанного билирубина.
Сывороточная концентрация неконъюгированного билирубина обусловлена скоростью, с которой вновь синтезированный билирубин проникает в плазму крови и скоростью элиминации билирубина печенью (печеночный клиренс билирубина).
Непрямой билирубин вычисляется расчетным способом:
непрямой билирубин = общий билирубин — прямой билирубин.
— ускоренное разрушение эритроцитов (гемолитическая желтуха),
— гепатоцеллюлярное заболевание (печеночное и внепеченочное происхождение).
Хилез может обусловить ложно завышенную величину содержания билирубина, что следует учитывать, если высокий уровень билирубина определяется у пациента в отсутствии желтухи. «Хилезная» сыворотка крови приобретает белый цвет, что связано с повышенной концентрацией хиломикронов и\или липопротеинов очень низкой плотности. Чаще всего хилез является результатом недавнего приема пищи, однако у собак ее могут вызывать такие заболевания как сахарный диабет, панкреатит, гипотиреоз.
Клинического значение не имеет.
Собака – 2.0-13.5 мкмоль/л
Кошка – 2.0-10.0 мкмоль/л
Собака – 0-5.5 мкмоль/л
Кошка – 0-5.5 мкмоль/л
Аланинаминотрансфераза (АЛТ)
АЛТ – эндогенный фермент из группы трансфераз, широко используемый в медицинской и ветеринарной практике для лабораторной диагностики повреждений печени. Синтезируется внутриклеточно, и в норме лишь небольшая часть этого фермента попадает в кровь. Если энергетический метаболизм клеток печени нарушается инфекционными факторами (например, вирусный гепатит) или токсическими, то это приводит к увеличению проницаемости клеточных мембран с прохождением в сыворотку компонентов цитоплазмы (цитолиз). АЛТ является показателем цитолиза, самым изученным и самым показательным даже для обнаружения минимальных поражений печени. АЛТ является более специфичным для нарушений печени, чем АСТ. Абсолютные значения AЛT все же не коррелируют напрямую с тяжестью повреждений печени и с прогнозированием развития патологического процесса, и поэтому наиболее целесообразным являются серийные определения АЛТ в динамике.
— применение гепатотоксичных препаратов
— иногда при беременности
Аспартатаминотрансфераза (АСТ)
Аспартатаминотрансфераза (АСТ) — эндогенный фермент из группы трансфераз. В отличие от АЛТ, который встречается, главным образом, в печени, АСТ присутствует во многих тканях: миокарде, печени, скелетных мышцах, почках, поджелудочной железе, ткани мозга, селезенке, являясь менее характерным показателем функции печени. На уровне клеток печени изоферменты АСТ находятся как в цитозоле, так и в митохондриях.
— Токсический и вирусный гепатит
— Некроз ткани печени
— Острый инфаркт миокарда
— Введение опиоидов пациентам с заболеваниями желчных путей
Увеличение и быстрое снижение предполагает обструкцию желчных внепеченочных путей.
Повышение АЛТ, превышающее повышение АСТ, характерно для повреждения печени; если же показатель АСТ повышается больше, чем повышается АЛТ, то это, как правило, свидетельствует о проблемах клеток миокарда (сердечной мышцы).
γ — глутамилтрансфераза (ГГТ)
ГГТ – это фермент, локализованный на мембране клеток различных тканей, катализирующий реакцию трансаминирования или переаминирования аминокислот в процессе их катаболизма и биосинтеза. Фермент переносит γ- глутамил с аминокислот, пептидов и других веществ на акцепторные молекулы. Эта реакция обратима. Таким образом, ГГТ участвует в транспорте аминокислот через клеточную мембрану. Поэтому наибольшее содержание фермента отмечается в мембране клеток с высокой секреторной и абсорбционной способностью: печеночные канальцы, эпителий желчных путей, канальцы нефрона, эпителий ворсинок тонкой кишки, панкреатические экзокринные клетки.
Так как ГГТ ассоциирована с эпителиальными клетками системы желчных протоков, она имеет диагностическое значение при нарушении функции печени.
— у собак при повышении концентрации глюкортикостероидов
— гепатиты вне- или внутрипеченочного происхождения, неоплазии печени,
— острый панкреатит, рак поджелудочной железы
— обострение хронического гломерулонефрита и пиелонефрита,
Клинического значения не имеет.
В отличие от АЛТ, которая содержится в цитозоле гепатоцитов и поэтому является чувствительным маркером нарушения целостности клеток, ГГТ обнаруживается исключительно в митохондриях и высвобождается только при значительном повреждении ткани. В отличие от человека, противосудорожные препараты, применяемые у собак, не взывают повышение активности ГГТ или оно минимально. У кошек при липидозе печени активность ЩФ повышается в большей степени, чем ГГТ. Молозиво и грудное молоко в ранние сроки кормления содержат высокую активность ГГТ, поэтому у новорожденных уровень ГГТ повышен.
Щелочная фосфатаза.
Этот фермент обнаруживается главным образом в печени (желчные канальцы и эпителий желчных протоков), канальцах почек, тонком кишечнике, костях и плаценте. Это связанный с мембраной клеток фермент, катализирующий щелочной гидролиз самых разнообразных веществ, в ходе которого происходит отщепление остатка фосфорной кислоты от ее органических соединений.
Общая активность ЩФ в циркулирующей крови здоровых животных складывается из активности печеночных и костных изоферментов. Доля активности костных изоферментов наиболее велика у растущих животных, в то время как у взрослых их активность может увеличиваться при опухолях костей.
— нарушение тока желчи (холестатическое гепатобилиарное заболевание),
— нодулярная гиперплазия печени (развивается при старении),
— повышение активности остеобластов (в молодом возрасте),
— заболевания костной системы (опухоли костей, остеомаляция др.)
— беременность (повышение ЩФ во время беременности происходит за счет плацентарного изофермента).
— У кошек может быть связано с печеночным липидозом.
Альфа – амилаза
Амилаза — гидролитический фермент, участвующий в расщеплении углеводов. Амилаза образуется в слюнных железах и поджелудочной железе, затем поступает в полость рта или просвет двенадцатиперстной кишки соответственно. Значительно более низкой амилазной активностью обладают также такие органы как яичники, фаллопиевы трубы, тонкий и толстый кишечник, печень. В сыворотке крови выделяют панкреатический и слюнной изоферменты амилазы. Выводится фермент почками. Следовательно, увеличение сывороточной активности амилазы приводит к повышению активности амилазы в моче. Амилаза может образовывать крупные по размеру комплексы с иммуноглобулинами и другими белками плазмы, что не позволяет ей проходить через почечные клубочки, в результате чего содержание её в сыворотке возрастает, а в моче активность амилазы наблюдается нормальная.
— Панкреатит (острый, хронический, реактивный).
— Новообразования поджелудочной железы.
— Закупорка протока поджелудочной железы (опухолью, камнем, спайками).
— Сахарный диабет (кетоацидоз).
— Заболевания желчных путей (холелитиаз, холецистит).
— Травматические поражения брюшной полости.
— Острый и хронический гепатит.
Собака – 300-1500 ед./л
Кошка – 500-1200 ед./л
Панкреатическая амилаза.
Амилаза – фермент катализирующий расщепление (гидролиз) сложных углеводов (крахмала, гликогена и некоторых других) до дисахаридов и олигосахаридов (мальтоза, глюкоза). У животных значительная часть амилазной активности обусловлена слизистой тонкого кишечника и другими внепанкреатическими источниками. С участием амилазы в тонком кишечнике завершается процесс переваривания углеводов. Разнообразные нарушения процессов в ацинозных клетках экзокринной части поджелудочной железы, повышение проницаемости протока поджелудочной железы и преждевременная активация ферментов приводят к «утечке» ферментов внутри органа.
— тяжелые воспалительные заболевания кишечника (прободение тонкого кишечника, завороты),
— продолжительное лечение глюкокортикостероидами.
— некроз или опухоль поджелудочной железы.
Собака 243,6-866,2 ед/л
Кошка 150,0-503,5 ед/л
Глюкоза.
Глюкоза – основной источник энергии в организме. В составе углеводов глюкоза поступает в организм с пищей и всасывается в кровь из тощей кишки. Так же она может синтезироваться организмом в основном в печени и почках из неуглеводных компонентов. Потребность в глюкозе имеют все органы, но особенно много глюкозы используется тканями мозга и эритроцитами. Печень регулирует уровень глюкозы в крови посредством гликогенеза, гликолиза и глюконеогенеза. В печени и мышцах глюкоза запасается в виде гликогена, который используется для поддержания физиологической концентрации глюкозы в крови, прежде всего в промежутках между приемами пищи. Глюкоза является единственным источником энергии для работы скелетной мышцы в анаэробных условиях. Основными гормонами, влияющими на гомеостаз глюкозы, являются инсулин и дерегулирующие гормоны – глюкагон, катехоламины и кортизол.
— недостаточность инсулина или резистентность тканей к инсулину,
— физическая нагрузка и стресс (особенно у кошек),
— опухоли гипофиза (встречается у кошек),
— прием некоторых лекарственных средств (глюкокортикостероиды, тиазидные диуретики, внутривенное введение жидкостей, содержащих глюкозу, прогестины и др.),
Кратковременная гипергликемия возможна при травмах головы и поражениях ЦНС.
— опухоль поджелудочной железы (инсулинома),
— гипофункция эндокринных органов (гипокортицизм);
— продолжительное голодание и анорексия;
— врожденные портосистемные шунты;
— идиопатическая ювенильная гипогликемия у собак мелких и охотничьих пород,
При продолжительном контакте сыворотки крови с эритроцитами возможно падение глюкозы, так как эритроциты активно ее потребляют, поэтому кровь желательно как можно быстрее отцентрифугировать. Содержание глюкозы в неотцентрифугированной крови снижается приблизительно на 10 % в час.
Собака 4,3-7,3 ммоль/л
Креатинин
Креатин синтезируется в печени, и после высвобождения поступает в мышечную ткань на 98%, где происходит его фосфорилирование. Образованный фосфокреатин играет важную роль в запасании мышечной энергии. Когда данная мышечная энергия необходима для осуществления метаболических процессов, фосфокреатин расщепляется до креатинина. Креатинин является стойким азотистым составляющим крови, не зависящим от большинства пищевых продуктов, нагрузок или других биологических констант, и связан с метаболизмом мышц.
Нарушения функции почек снижает экскрецию креатинина, обуславливая повышение уровня сывороточного креатинина. Таким образом, концентрации креатинина приблизительно характеризуют уровень клубочковой фильтрации. Главная ценность определения сывороточного креатинина — это диагностика почечной недостаточности.
Сывороточный креатинин является более специфичным и более чувствительным показателем функции почек, в отличие от мочевины.
— острая или хроническая почечная недостаточность.
Обусловлено преренальными причинами вызывающими снижение скорости клубочковой фильтрации (обезвоживание, сердечно-сосудистые заболевания, септический и травматический шок, гиповолемия и др.), ренальными связанными с тяжелыми заболеваниями паренхимы почек (пиелонефрит, лептоспироз, отравления, неоплазии, врожденные расстройства, травмы, ишемия) и постренальными — обструктивными расстройствами, препятствующими выделению креатинина с мочой (обструкция мочеиспускательного канала, мочеточника или разрыв мочевыводящих путей).
— возрастное снижение мышечной массы.
Собака 26-130 мкмоль/л
Кошка 70-165 мкмоль/л
Мочевина
Мочевина образуется в результате катаболизма аминокислот из аммиака. Аммиак, образующийся из аминокислот токсичен и превращается с помощью ферментов печени в нетоксичную мочевину. Основная часть мочевины поступающая после этого в кровеносную систему легко фильтруется и экскретируется почками. Мочевина может так же пассивно диффундировать в интерстициальную ткань почек и возвращаться в кровоток. Пассивная диффузия мочевины зависит от скорости фильтрации мочи – чем она выше (например, после внутривенного введения диуретиков), тем ниже уровень мочевины в крови.
— почечная недостаточность (может быть обусловлена преренальными, ренальными и постренальными расстройствами).
— низкое поступление белка в организм,
Собака 3.5-9.2 ммоль/л
Кошка 5.4-12.1 ммоль/л
Мочевая кислота
Мочевая кислота – конечный продукт катаболизма пуринов.
Мочевая кислота всасывается в кишечнике, циркулирует в крови в виде ионизированного урата и выделяется с мочой. У большинства млекопитающих элиминация осуществляется печенью. Гепатоциты с помощью уреазы окисляют мочевую кислоту с образованием водорастворимого аллантоина, который экскретируется почками. Снижение метаболизма мочевой кислоты в сочетании с ослаблением метаболизма аммиака при портосистемном шунтировании ведет к образованию кристаллов урата с возникновением уратных камней (уролитиаз).
При портосистемном шунтировании (ПСШ) мочевая кислота, образованная в результате метаболизма пурина, практические не проходит через печень, так как ПСШ представляют собой прямую сосудистую связь воротной вены с системной циркуляцией в обход печени.
Предрасположенность собак с ПСШ к уратному уролитиазу связана с сопутствующей гиперурикемией, гипераммониемией, гиперурикурией и гипераммониурией. Так как мочевая кислота при ПСШ не попадает в печень, она не полностью конвертируется в аллантоин, что приводит к патологическому повышению сывороточной концентрации мочевой кислоты. При этом мочевая кислота свободно фильтруется клубочками, реабсорбируется в проксимальных канальцах и секретируется в канальцевый просвет проксимальных нефронов. Таким образом, концентрация мочевой кислоты в моче частично определяется ее концентрацией в сыворотке.
Далматинские доги предрасположены к образованию уратных кристаллов вследствие особенного метаболического нарушения печени, приводящего к неполному окислению мочевой кислоты.
— анемия, вызванная дефицитом витамина В12
— некоторые острые инфекции (пневмония, туберкулез)
Энтеропатии с потерей белка у соба
Ветер Д.С. – руководитель терапевтического отделения ИВЦ МВА, ветеринарный врач, специалист визуальной диагностики.
Бобровский М.А. – ветеринарный врач-терапевт ИВЦ МВА соискатель кафедры ветеринарной хирургии.
Авторы статьи не выявили достоверной корреляции PLE с определенным полом и возрастом животных. Однако в одном исследовании сообщалось, что в 61% случаев PLE у йоркширских терьеров, это были самки; средний возраст животных составлял 7.7 ± 3.0 лет.
Как правило, данный синдром может развиться на фоне первичных воспалительных заболеваний кишечника (лифоцитарно-плазмоцитарного, эозинофильного энтерита и д.р.), лимфангиэктазии, лимфомы кишечника, грибкового поражения (гистоплазмоза), острого бактериального или вирусного энтеритов, аутоиммунных заболеваний кишечника и некоторых других патологических процессах. При этом клиническая картина может выглядеть несколько вариабельно, в зависимости от этиологии заболевания. Среди общих клинических признаков, отражающих наличие PLE, можно выделить следующее:
Во всех случаях гипоальбуминемии, с характерными для PLE клиническими признаками, проводимая диагностика должна быть достаточно агрессивной т.к. этиология синдрома разнообразна, а детальная проработка и исключение каждого заболевания по отдельности, а также оценка результативности эмпирически-назначенной терапии может занять достаточно много времени. Первой диагностической задачей, является установление причины потери белка. Исследование кожи необходимо для исключения поражений, способных привести к потере белка. Как правило, поражения кожи способные вызвать гипоальбуминемию, достаточно очевидны при первичном осмотре (например ожоги большой площади). Быстрый осмотр позволяет выяснить, действительно ли кожа является причиной гипоальбуминемии.
Концентрация аминотрансфераз зачастую возрастает при разрушении гепатоцитов, однако интерпретация значений активности АЛТ, АСТ, ГГТ и ЩФ, должны проводиться с осторожностью, так как у некоторых собак с тяжелыми, хроническими заболеваниями печени, не отмечается высокого уровня гепатоцеллюлярных ферментов. Уровень глобулинов может сохранятся на нормальном уровне или быть незначительно повышен например в случае гистоплазмоза. Абсолютная гипопротеинэмия встречается реже, в основном на поздних стадиях заболевания.
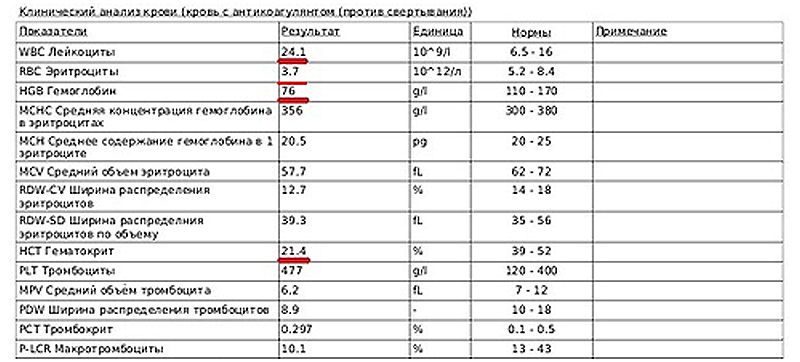
Гиперхолестеринемия в сочетании с гипоальбуминемией, более характерна для PLE (вторично к хронической мальабсорбции) или печеночной недостаточности. В тоже время гиперхолестеринемия в в сочетании с гипоальбуминемией, наводит на мысли о потери белка вследствие нефропатии. Снижение уровня сывороточного кальция (общего и ионизированного) имеет многофакторную этиологию, ассоциированную со снижением альбумина как основного транспортного белка, снижением усвоения витамина D и нарушением усвоения магния. В клиническом анализе крови может наблюдаться лимфопения, особенно в случаях лимфангиэктазии; достаточно часто можно встретить признаки регенераторной, анемии, вследствие снижения усвоения железа и цианокобаламина.
Рис 1. Биохимический анализ крови
Рис 2. Клинический анализ крови
После исключения нарушений функций печени или заболеваний почек, при концентрации альбумина 15-25≤ г/л, PLE является разумным первичным диагнозом. Измерение ингибитора α1-антитрипсина (α1-протеазы) в образцах кала, может использоваться для дальнейшего подтверждения PLE. α1-антитрипсин имеет молекулярный вес, сходный с альбумином. Этот белок находиться в сосудистом и интерстициальном пространстве, в лимфе. В отличие от альбумина и других белков плазмы, α1-антитрипсин способен противостоять разложению кишечными и бактериальными протеазами. При PLE, могут наблюдаться потери α1-антитрипсина в просвет кишечника и выведение его с калом, что может быть определено методом иммуноферментного анализа. Данный тест достаточно трудоемок в плане соблюдения точной методологии забора, хранения и транспортировки образцов. Определение α1-антитрипсина в кале, является полезным исследованием как для непосредственной диагностики PLE, так и для уточнения диагноза в случае сочетанного течения PLE с печеночной недостаточностью или нефропатией. Однако интерпретация результатов данного исследования может вызвать определенные сложности. В целом этот тест редко используется в клинической практике. На территории РФ, данное исследование не проводится.
“Золотым стандартом” PLE, является определение количества меченого изотопом хром-51 альбумина в кале, после его внутривенного введения. Практическое применений данного теста, также ограничено.
Последующая диагностика должна быть направлена на выявление этиологии текущей энтеропатии. Проведение рентгенологических исследований, в том числе рентгеноконтрастных исследований ЖКТ, как правило являются мало информативными. Ультразвуковая диагностика является полезным исследованием для обнаружения специфических изменения кишечной стенки. Например утолщение стенки кишечника и наличие гиперэхогенных полос в подслизистом слое может свидетельствовать о наличии лимфангиэктазии. Еще более выражено эти признаки наблюдаются в случае приема жирной пищи накануне исследования, что приводит к большему расширению лимфатических сосудов стенки кишечника. Ультразвуковая диагностика может выявить очаговые изменения, не доступные для эндоскопической визуализации.
Окончательный диагноз устанавливается после забора биоптатов для проведения гистологического исследования. Биопсия может быть выполнена посредством ЭГДС, лапаротомии или эндоскопически-ассистированной лапаротомии. Выбор того или иного метода забора биопсии зависит от многих факторов,таких как наличие эндоскопических навыков, наличие данных о вероятной локализации патологического очага, наличия необходимого эндоскопического оборудования и д.р.. Из преимуществ проведения лапаротомии, можно выделить возможность полнослойного забора биоптата а также возможность забора материала из нескольких сегментов кишечника, недоступных в случае применения гибкой эндоскопии. Однако понятие “полнослойный материал” не является синонимом “диагностически значимый”. Большое внимание должно быть уделено наложению серозно-мышечных швов, которые в случае PLE, могут представлять угрозу из-за длительной регенерации, и угрозы несостоятельности шва.
Стратегия лечения PLE основывается на выборе адекватной нутрицептивной терапии и контроле уровня воспаления. В случае постановки диагноза на ранних стадиях диагностики, при выявлении очевидных патогенетических факторов (наличие в образцах кала простейших, яиц гельминтов или выявление возбудителей парво/ коронавирусного энтеритов в ректальных смывах), необходимо сосредоточить внимание на лечении выявленной патологий согласно действующим рекомендациям.
Животные поступившие с нестабильными показателями гемодинамики, в состоянии шока, нуждаются в проведении интенсивной терапии. Классический подход к проведению интенсивной терапии животным с гиповолемическим шоком (особенно в случае наличия выпота в анатомические полости или периферическими отеками мягких тканей, свидетельствующих о возможном низком онкотическом давлении), будет отличаться тем, что быстрое введение больших объемов кристаллоидов до введения коллоидов может быть необоснованным из-за низкого онкотического давления и неспособности вследствие этого удержать вводимый объем жидкости.
Болюсное введение кристаллоидов, в начале терапии, должно быть скорректировано в сторону уменьшения объемов и увеличения времени введения или должно проводиться максимально аккуратно при наличии лабораторно подтвержденных сведений о концентрации альбумина. Коллоидным раствором выбора, может являться волювен в дозировке 3мл/кг или альбумин 0.5-1г/кг в/в. В последующей терапии, также может потребоваться дополнительное введение альбумина, для поддержания онкотического давления крови. Многие пациенты поступают в состоянии от умеренной до выраженной дегидратации вследствие острой/хронической диареи и/или рвоты, и поэтому им, параллельно со стабилизацией гемодинамики, должна быть проведена адекватная инфузионная терапиия, направленная на регидратацию.