алло тгск что это
Алло тгск что это
В течение многих лет отмечался значительный рост числа трансплантаций гемопоэтических стволовых клеток. За последние годы общее количество трансплантаций гемопоэтических стволовых клеток в мире не увеличивается и находится на плато на уровне 15 000 для алло-трансплантации гемопоэтических стволовых клеток с тенденцией к снижению до 25 000—30 000 для ауто-трансплантации гемопоэтических стволовых клеток в год.
Эти данные не связаны с уменьшением общей потребности в трансплантации гемопоэтических стволовых клеток, а являются отражением сложившейся в мире ситуации. Высокоиндустриальные страны достигли порога интенсивности в применении метода: количество трансплантаций гемопоэтических стволовых клеток в год колеблется от 200 до 500 на 10 млн населения.
В других странах внедрение трансплантации гемопоэтических стволовых клеток сопряжено с внутренними экономическими проблемами. Число ауто-трансплантаций гемопоэтических стволовых клеток имеет тенденцию к снижению также за счет пересмотра при ряде заболеваний показаний к ее проведению (например, острые лейкозы, рак молочной железы).
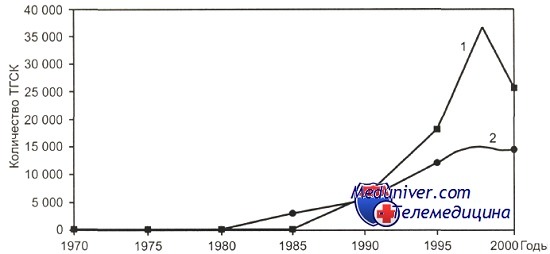
1 — ауто-ТГСК; 2 — алло-ТГСК.
Эти данные в основном отражают общую тенденцию в мире при определении показаний к трансплантации гемопоэтических стволовых клеток у взрослых с учетом результатов стандартной химиотерапии.
Необходимо отметить, что показания к трансплантации гемопоэтических стволовых клеток до сих пор являются предметом дискуссии, что связано с отсутствием в ряде случаев явных преимуществ алло-трансплантации гемопоэтических стволовых клеток и особенно ауто-трансплантации гемопоэтических стволовых клеток по сравнению со стандартными методами цитостатической терапии. До настоящего времени нет однозначного мнения о сроках выполнения трансплантации гемопоэтических стволовых клеток при ОЛЛ, ОМЛ, ХМЛ, некоторых вариантах НХЛ.
Центры, специализирующиеся в области трансплантации гемопоэтических стволовых клеток, проводят лечение как по собственным протоколам с применением новейших цитостатических препаратов и учетом различных прогностических факторов (в первую очередь молекулярно-биологических), так и в рамках многоцентровых исследований.
Показания к алло-трансплантации гемопоэтических стволовых клеток при наличии совместимого донора могут быть определены на одном из этапов лечения больных с любым вариантом лейкоза или лимфомы. Основанием для применения этого метода является анализ следующих факторов: возраст больного, гистологический (морфологический) вариант болезни, стадия, количество лейкоцитов в момент постановки диагноза, характер цитогенетических изменений, ответ на предшествующие курсы химиотерапии, наличие молекулярно-биологических признаков «минимальной остаточной болезни» после первичного и последующих курсов цитостатической терапии.
Алло-трансплантация гемопоэтических стволовых клеток является эффективным методом терапии больных с острым миелобластным лейкозом (ОМЛ); острым лимфобластным лейкозом (ОЛЛ); миелодиспластическими синдромами (МДС); хроническим миелолейкозом (ХМЛ: хроническая стадия, прогрессирующая стадия, бластный криз); неходжкинской лимфомой (НХЛ); множественной миеломой (ММ); хроническим лимфолейкозом (ХЛЛ); лимфомой Ходжкина (ЛХ); хроническим идиопатическим миелофиброзом (ХИМФ).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Трансплантация гемопоэтических стволовых клеток
При проведении различных протоколов терапии острого миелоидного лейкоза (ОМЛ) достичь первой полной ремиссии удается у 60-80% пациентов.
Однако значительное количество пациентов имеет риск развития раннего или позднего рецидива.
В настоящее время трансплантация гемопоэтических стволовых клеток (ТГСК) рассматривается как метод, позволяющий снизить риск рецидива у пациентов с ОМЛ.
Рандомизированные исследования в сравнимых группах больных показали также более высокую общую выживаемость после аллогенной ТГСК (алло-ТГСК) в сравнении результатами химиотерапии при остром миелоидном лейкозе и МДС в группе пациентов промежуточного или неблагоприятного прогноза. Конечно, выполнение ТГСК возможно только у части пациентов этих групп.
Трансплантация представляет серьезный риск и пациент может умереть от различных осложнений. Перед ТГСК необходимо взвесить все за и против, с учетом стадии болезни, возраста, времени от установления диагноза до ТГСК, типа донора и общего состояния пациента.
В качестве вариантов ТГСК рассматривается трансплантация собственных гемопоэтических стволовых клеток (ГСК) пациента (ауто-ТГСК), ГСК родственного совместимого по HLA-системе донора (алло-ТГСК), ГСК неродственного HLA-совместимого донора (алло-ТГСК) и ГСК пуповинной крови.
Каждый из вариантов имеет свои преимущества и недостатки, к которым можно отнести трудности с подбором донора и развитием реакции «трансплантат против хозяина» (РТПХ) тяжелой степени с летальным исходом в 20-30% при алло-ТГСК, возможность контаминации трансплантата лейкозными клетками при ауто-ТГСК и отсутствие при этом реакции «трансплантат против лейкоза». При алло-ТГСК стволовые клетки забирают от родственного HLA-совместимого донора, обычно брата или сестры. Если такого донора нет, выполняется алло-ТГСК от неродственного HLA-совместимого донора.
Преимущество алло-ТГСК состоит в том, что иммунные клетки донора уничтожают клетки опухоли, сохранившиеся после высокодозной химиотерапии (эффект «трансплантат против лейкоза»). Алло-ТГСК помогает излечению от лейкоза не только простым замещением стволовых клеток. Клетки донора находят и уничтожают клетки опухоли лучше, чем иммунная система больного.
Возможно также получение любого количества стволовых клеток; при этом стволовые клетки здорового донора не содержат клеток опухоли. Недостатком алло-ТГСК является угроза гибели клеток донора в организме пациента до их заселения в костном мозге. Кроме того, иммунные клетки донора могут быть направлены против здоровых клеток пациента (РТПХ). Также сохраняется возможность переноса инфекции от донора к пациенту.
Сингенная ТГСК (стволовые клетки получены от идентичного близнеца из двойни или тройни) как вариант алло-ТГСК выполняется только при наличии идентичного сиблинга при наличии HLA-совместимости. Преимуществом ее является отсутствие РТПХ и отсутствие клеток опухоли в трансплантате. Недостатком является то, что иммунные системы донора и реципиента тождественны, а это приводит к отсутствию эффекта «трансплантат против лейкоза». Поэтому необходимо уничтожение всех лейкозных клеток перед ТГСК, что предотвращает риск развития рецидива.
Преимущество ауто-ТГСК состоит в том, что пациент получает свои собственные стволовые клетки. При этом нет РТПХ и пациент не получает дополнительное инфицирование, как это может быть при алло-ТГСК. Но при этом нет эффекта «трансплантат против лейкоза», и опухолевые клетки могут сохраняться и вызывать рецидив.
Поэтому разрабатываются методы уменьшения количества опухолевых клеток перед ауто-ТГСК («очистка»). Однако точно не установлено, насколько это реально помогает снизить риск наступления рецидива. При этом в процессе очистки теряется некоторое количество стволовых клеток, что приводит к удлинению времени нормализации показателей крови, повышению риска инфекций и кровотечений.
Одним из методов ТГСК является отсутствие проведения предтрансплантационной терапии консолидации; такая терапия проводится после ауто-ТГСК. С этой целью применяются ритуксимаб и другие моноклональные антитела.
Выполнение двух ауто-ТГСК называется тандемной или двойной ауто-ТГСК. При этом варианте ТГСК пациент получает два курса высокодозной химиотерапии, после каждого из них выполняется ауто-ТГСК. Все стволовые клетки забираются перед первым курсом высокодозной химиотерапии, и при каждой ауто-ТГСК используется половина собранных клеток.
Наиболее часто проведение обоих курсов занимает срок до 6 месяцев, так как второй курс проводится после восстановления гематологических показателей пациента. Поскольку выполняются две ТГСК, риск серьезных осложнений значительно выше, чем при одиночной ауто-ТГСК. Иногда ауто-ТГСК дополняется алло-ТГСК, что также явлется тандемной трансплантацией.
В табл. 36 приводятся расчеты стоимости разных вариантов ТГСК.
Таблица 36. Стоимость разных вариантов ТГСК (в евро)
Однако шанс выполнить ТГСК от родственного донора имеют не более 30% больных ОМЛ. При ТГСК от неродственного донора необходимо выполнение аллельного типирования (типирование «высокого разрешения») с определением совместимости по локусам HLA-A, HLA-B, HLA-C и HLA-DRB1; при этом условии результаты ТГСК примерно соответствуют результатам при ТГСК от родственного донора.
При условии частичного совпадения результаты алло-ТГСК значительно хуже; при этом несовпадение по локусам В или С дает лучший результат, чем несовпадение по локусам А или DRB1. Имеются данные, что расхождение результатов при выполнении алло-ТГСК от родственного и неродственного HLA-совместимого донора связано с наличием нераспознанных дополнительных антигенов гистосовместимости.
Комплекс HLA содержит дополнительные гены низкой плотности, наиболее значимыми из которых являются гены HLA-DQ (DQB1 и DQA1), гены HLA-DP (DPA1 и DPB1), гены HLA-DRB3, HLA-DRB4 и HLA-DRB5. Несовместимость между донором и реципиентом по одному из этих генов оказывает небольшой эффект, но сочетание с другими генами вызывает снижение общей выживаемости.
S.R. Spellman et al., (2012) предложили следующий алгоритм выполнения ТГСК от неродственного донора с учетом полной или частичной HLA-совместимости (схема 4).

Схема 4. Алгоритм выполнения алло-ТГСК от неродственного донора
Трансплантация гемопоэтических стволовых клеток пуповинной крови
Новым источником стволовых клеток является кровь, полученная из плаценты или пуповины новорожденного. При малом объеме, пуповинная кровь содержит большое количество стволовых клеток; однако их общее количество явно недостаточно для ТГСК у взрослых пациентов.
Поэтому выполнение ТГСК пуповинной крови у взрослых затруднено тем, что не всегда возможно получить достаточное количество стволовых клеток (необходимое количество должно составлять не менее 2,5-3,0х107 ядросодержащих клеток на 1 кг веса пациента). В связи с этим при таком варианте ТГСК приходится использовать пуповинную кровь от двух или более доноров.
Хотя пуповинная кровь содержит общее небольшое количество стволовых клеток, однако каждая стволовая клетка пуповинной крови может образовывать значительно большее количество клеток крови, чем стволовая клетка костного мозга взрослого человека. В основном ТГСК пуповинной крови применяется у детей или подростков, однако рассматривается вопрос об ее применении у взрослых.
Одним из методов является увеличение их количества в лаборатории перед ТГСК. Другим методом является применение стволовых клеток пуповинной крови от двух новорожденных (двойная ТГСК). Третьим вариантом является использование стволовых клеток пуповинной крови в качестве мини-трансплантации. Этот метод не требует поиска донора и может снизить риск развития РТПХ.
Давно известно, что контакт плода с чужеродными антигенами (при наличии близнеца мужского пола) или с антигенами матери может обусловить пожизненную толерантность. Эта толерантность более выражена по отношению к антигенам матери, а именно к высоко иммунногенным ненаследуемым материнским антигенам (NIMA).
Установлено, что ТГСК пуповинной крови HLA-несовместимому реципиенту, HLA-несовместимые антигены которого были идентичны материнскому антигену NIMA стволовых клеток пуповинной крови, приводят к хорошему результату. ТГСК пуповинной крови HLA-несовместимому реципиенту, экспрессирующему антиген NIMA, оказывают лучший результат в сравнении с реципиентами, которые антиген NIMA не экспрессируют.
Другим важным аспектом иммунной системы плода является присутствие в его крови материнских микрохимерических клеток. Эти материнские клетки чувствительны к антигенам отцовского происхождения, т. наз. наследственным отцовским антигенам (IPAs).
Данные антигены при трансплантации реципиенту с микрохимерическими материнскими клетками могут воспринимать их как клетки-мишени. Реципиенты, у которых тип HLA стволовых клеток пуповинной крови включает IPAs, имеют меньшую частоту рецидивов, чем реципиенты, тип HLA которых IPAs не содержит.
Этот принцип материнской сенсибилизации и эффект «трансплантат против лейкоза» применим к результатам гаплоидентичной трансплантации от родственного донора, поскольку ТГСК пуповинной крови от матери более эффективна, чем ТГСК от отца.
Исследования выявили, что пуповинная кровь не может быть полностью HLA-совместима, в отличие от клеток костного мозга или периферической крови. Однако при ее применении РТПХ развивается реже, чем при применении стволовых клеток взрослого человека; поэтому допустимо частичная HLA-несовместимость по локусу HLA-C.
Исследования CIBMTR показали, что несовместимость по HLA-C ассоциирована с повышением обусловленной терапией летальности, но не с повышенным риском РТПХ. ТГСК пуповинной крови вызывает более легкую степень РТПХ в сравнении с алло-ТГСК взрослого человека, поэтому по стандартам допустимо ее частичное несовмещение по HLA-антигенам, в частности, по HLA-С.
По данным Eurocord, при ТГСК пуповинной крови в сравнении с результатами при ТГСК от неродственного HLA-совместимого донора выявлена более высокая связанная с терапией летальность, повышенная частота отторжения трансплантата, более медленное его приживление, повышенная частота ранних инфекционных осложнений и кровотечений, так как стволовые клетки пуповинной крови приживаются более длительно.
Некоторые родители размещают пуповинную кровь своих новорожденных в банке пуповинной крови с целью ее возможного использования в будущем. Стоимость забора пуповинной крови в США и помещения ее в банк составляет от 1,500 до 2,400 долларов плюс оплата за хранение составляет 150 долларов в год, причем эта сумма оплаты со временем увеличивается. Считается, что в будущем эти дети, их братья или сестры выиграют от применения стволовых клеток данной крови.
Однако есть некоторые проблемы, которые надо учитывать:
Гаплоидентичная трансплантация гемопоэтических стволовых клеток
В некоторых исследовательских центрах выполняется гаплоидентичная (полу-совместимая) ТГСК у пациентов, не имеющих HLA-совместимых родственных доноров. Более часто она применяется у детей, при этом донорами являются родители; однако дети тоже могут являться донорами для родителей.
Поскольку при этом выявляется возможная совместимость только по половине HLA-локусов и несовместимость по другой половине, необходимо предотвращение РТПХ проведением цитостатической терапии после ТГСК. Такая ТГСК является экспериментальным вариантом терапии и применяется при высоком риске рецидива и в поздних стадиях заболевания.
При ее проведении рекомендуется выполнение немиелоаблативного кондиционирования и применение высоких доз циклофосфамида после ТГСК. В процессе изучения находится гаплоидентичная трансплантация с применением деплеции Т-лимфоцитов костного мозга и высокой дозы циклофосфамида после трансплантации или деплеции Т-лимфоцитов периферической крови или костного мозга, содержащих большое количество CD34+ клеток.
Поскольку зрелые Т-лимфоциты в основном ответственны за развитие хронической РТПХ, необходимо их удаление перед алло-ТГСК. В меньшей степени они ответственны за развитие острой РТПХ, что обусловлено более быстрым восстановлением гемопоэза.
В исследовании J.E. Wagner et al., (2005) показано, что при алло-ТГСК от неродственного донора получены сходные результаты после деплеции Т-лимфоцитов костного мозга in vitro с применением циклоспорина до трансплантации с применением после трансплантации циклоспорина и метотрексата.
В целом деплеция Т-лимфоцитов in vitro достоверно не отражается на количестве рецидивов или общей выживаемости у пациентов с остром миелоидном лейкозе и МДС, но снижает количество случаев хронической и острой РТПХ.
Другим вариантом деплеции Т-лимфоцитов является применение антител, направленных против Т-лимфоцитов. Для этой цели применяется алемтузумаб (антитела против CD52+) или любая форма антитимоцитарного глобулина (АТГ). Ретроспективное изучение результатов применения АТГ показало, что иммуносупрессия снижает частоту острой и хронической РТПХ, но повышает риск оппортунистических инфекций.
Показания для трансплантации гемопоэтических стволовых клеток
Для большинства пациентов с ОМЛ наиболее приемлемым остается выполнение алло-ТГСК, что иногда является единственным шансом для излечения.
При этом необходимо решить следующие вопросы:
— кто из пациентов с острым миелоидным лейкозом является кандидатом для алло-ТГСК;
— в какой прогностической группе необходимо выполнение ТГСК;
— когда необходимо выполнять алло-ТГСК;
— какой вариант ТГСК необходимо выбрать;
— какого донора целесообразнее выбрать для ТГСК;
— имеет ли проведение алло-ТГСК преимущества у данного конкретного пациента в сравнении с проведением химиотерапии.
По данным, приведенным в обзоре S.Couban (2013), установлены четкие показания для выполнения алло-ТГСК при ОМЛ:
— вторая полная ремиссия,
— первая полная ремиссия для пациентов групп промежуточного и высокого риска (преимущество в безрецидивной и общей выживаемости).
Относительные показания для выполнения алло-ТГСК:
— часть пациентов с рецидивирующим/рефрактерным течением заболевания,
— группа с выполнением RIC.
Ауто-ТГСК при остром миелоидном лейкозе в первой полной ремиссии улучшает безрецидивную, но не общую выживаемость.
В настоящее время показания для алло-ТГСК более четко определены для пациентов при наличии HLA-совместимого родственного донора. Остается неясной роль алло-ТГСК у пациентов с ОМЛ группы промежуточного риска и у пожилых пациентов, находящихся в полной первой ремиссии. Данные, приведенные в обзоре F.R. Appelbaum et al. (2008), указывают, что выполнение алло-ТГСК в первой полной ремиссии имеет преимущества в выживаемости пациентов не только в неблагоприятной прогностической группе, но и в группе промежуточного прогноза.
Однако необходимо выделение двух подгрупп в группе промежуточного риска, основываясь на мутантном статусе NPM1 и FLT3. При наличии мутации NPM1 без FLT3-ITD у пациентов этой прогностической группы алло-ТГСК не имеет преимуществ перед проведением стандартной химиотерапии, такой же, как и в группе благоприятного прогноза. В то же время любая другая комбинация мутаций генов является по исходу такой же, как и в группе неблагоприятного прогноза.
Авторы рекомендуют выполнение алло-ТГСК от HLA-совместимого сиблинга в первой полной ремиссии у пациентов моложе 60 лет в группе неблагоприятного или промежуточного прогноза за исключением подгруппы с мутацией NPM1/FLT3-ITD, и в группе благоприятного прогноза при наличии мутации c-KIT. В то же время необходимо учитывать наличие осложнений типа РТПХ тяжелой степени, повышения летальности и наличия поздних осложнений, снижающих качество жизни после выполнения алло-ТГСК.
Ретроспективный анализ Fred Hutchinson Cancer Research Center при выполнении алло-ТГСК в первой полной ремиссии от HLA-совместимого сиблинга и HLA-совместимого неродственного донора при совпадении по 10 из 10 антигенов не выявил разницы в пятилетней выживаемости (63% и 61% соответственно).
В этом же обзоре произведено сравнение результатов при применении стволовых клеток костного мозга и периферической крови. При алло-ТГСК периферической крови выявлены более быстрое приживление трансплантата, повышенный риск хронической РТПХ, уменьшение риска рецидива и тенденция к улучшению обшей выживаемости.
Согласно рекомендациям международной группы экспертов (2010), выполнение ауто-ТГСК является альтернативным методом постремиссионной терапии у молодых пациентов острый миелоидный лейкоз группы благоприятного и промежуточного цитогенетического риска, но не рекомендуется для пациентов группы высокого риска.
Исходы после ауто-ТГСК менее благоприятны, чем в случае проведения постремиссионной химиотерапии, и поэтому ее возможно применять в отдельных подгруппах пациентов. Выполнение алло-ТГСК ассоциировано с меньшей частотой рецидивов, что обусловлено как проведением высокодозной химиотерапии при стандартных режимах кондиционирования, так и эффектом «трансплантат против лейкоза».
В некоторых исследованиях не выявлено преимуществ в общей выживаемости у пациентов при алло-ТГСК в первой полной ремиссии, хотя при мета-анализе выявлено, что алло-ТГСК в первой полной ремиссии значительно улучшает общую продолжительность жизни у пациентов групп промежуточного и высокого риска.
Такие расхождения можно объяснить различным учетом мутационного статуса ведущих генов, так как относящиеся к ОМЛ генетические изменения глубоко влияют на прогноз. Кроме того, не всегда учитывался источник трансплантата (ГСК костного мозга или периферической крови), а также тип донора и вариант кондиционирования. К тому же данные по трансплантационной летальности в разных исследовательских группах колеблются от 15% до 50%.
Поэтому при принятии решения об алло-ТГСК необходимо учитывать как риск, обусловленный особенностями цитогенетического и молекулярного-генетического профиля, так и риск, обусловленный коморбидностью и осложнениями самой трансплантации.
Согласно этим же рекомендациям, при выполнении алло-ТГСК у пациентов в возрасте 60-75 лет применение режимов редуцированного кондиционирования (RIC) снижает обусловленную трансплантацией летальность.
Данные Cooperative German Transplantat Study Group показали, что при проведении алло-ТГСК от неродственного HLA-совместимого донора и совместимого сиблинга (с использованием RIC у 72% пациентов) результаты по выживаемости в этих группах пациентов существенно не различаются.
Обследование пациента перед ТГСК. Алгоритм выполнения ТГСК практически идентичен при всех ее вариантах.
Перед ТГСК необходимо не позднее чем за 3 недели до ТГСК выполнить обследование пациента, которое включает:
— осмотр, измерение роста и массы тела;
— общий анализ крови;
— определение групп крови по системам АВО и резус;
— биохимическое исследование крови: билирубин, АсАТ, АлАТ, мочевина, креатинин, глюкоза, общий белок, лактатдегидрогеназа (ЛДГ), С-реактивный белок, калий, натрий, хлор;
— иммуноглобулины крови;
— обязательные исследования на наличие: антител к вирусам иммунодефицита человека (HIV); гепатита С (анти-HCV); цитомегаловируса (CMV); вируса Эпштейна-Барр (EBV); вируса простого герпеса (HSV); антигена вируса гепатита В (HBsAg);
— исследования по особым показаниям: количественное или качественное определение ДНК/РНК вирусов гепатита А, В, С, D, G; ДНК цитомегаловируса; вируса Эпштейн-Барр;
антител к вирусам гепатита В (анти-HBsAg) и к другим вирусам или бактериям;
— комплекс серологических реакций на сифилис (микрореакция преципитации с сывороткой крови или тест быстрых плазменных реагинов);
— электрокардиография;
— компьютерная томография черепа, органов грудной полости и брюшной полости (по показаниям);
— ультразвуковое исследование органов брюшной полости и почек;
— неврологический статус;
— осмотр врачом-офтальмологом;
— осмотр врачом-стоматологом с обязательной санацией ротовой полости;
— консультации у врача-невролога, врача-кардиолога, врача-офтальмолога, врача акушера-гинеколога по показаниям.
Трансплантация гемопоэтических стволовых клеток
Трансплантация гемопоэтических стволовых клеток
Трансплантация гемопоэтических стволовых клеток (ТГСК) – метод лечения, широко применяющийся при многих гематологических, онкологических и генетических заболеваниях.
Существуют два основных типа ТГСК.
I. При аутологичной трансплантации (аутотрансплантация, ауто-ТГСК) больному вводят его собственные ГСК, взятые у него заранее и хранившиеся в замороженном виде до момента трансплантации. Ауто-ТГСК чаще всего применяется при лечении злокачественных солидных опухолей. Смысл этой процедуры заключается в том, что она позволяет проводить лечение очень высокими дозами химиопрепаратов. Такие дозы нельзя использовать при обычной химиотерапии. так как они приводят к необратимому повреждению костного мозга. Но если у больного заранее взято достаточное количество ГСК, то можно провести высокодозную терапию, после чего ввести больному его собственные сохраненные клетки. В случае успеха они приживаются в костном мозге и восстанавливают кроветворение. Так как используются собственные клетки, при ауто-ТГСК отсутствуют иммунные осложнения, такие как реакция «трансплантат против хозяина». К сожалению, ауто-ТГСК эффективна далеко не при всех болезнях.
Смысл проведения алло-ТГСК заключается в том, чтобы собственное кроветворение больного было полностью заменено донорским. В случае успеха алло-ТГСК приводит к излечению целого ряда заболеваний кроветворной системы – как врожденных, так и приобретенных. Аллогенные трансплантации широко применяются для лечения острых и хронических лейкозов, апластической анемии. миелодиспластических синдромов и многих наследственных заболеваний (таких как анемия Фанкони. анемия Блэкфана-Даймонда. синдром Вискотта-Олдрича. тяжелые комбинированные иммунодефициты и т.п.).
Трансплантации ГСК уже позволили спасти многие десятки тысяч жизней по всему миру. Однако сама процедура ТГСК связана со значительными рисками. Состояние панцитопении в ранний период после трансплантации влечет за собой угрозу инфекций и кровотечений. В результате химиотерапии могут повреждаться различные органы – в частности, печень, легкие, сердце и кровеносные сосуды. Серьезным осложнением аллогенной трансплантации является реакция «трансплантат против хозяина». Поэтому ТГСК проводится только в случаях жизненной необходимости, и врачи каждый раз взвешивают соотношение всех рисков и возможного положительного эффекта.
Проведение ауто-ТГСК: 1) подготовительная терапия для снижения числа опухолевых клеток, 2) взятие ГСК из костного мозга или крови, 3) замораживание их суспензии для последующего использования, 4) ввод размороженной суспензии после кондиционирования пациента.
Проведение алло-ТГСК: 1) взятие донорских клеток, 2) при необходимости — дополнительная обработка трансплантата, 3) ввод клеток реципиенту, получившему кондиционирование.
Пересадка гемопоэтических стволовых клеток
ЛЕЙКОЗ — leucosis.ru — 2007
До совсем недавнего времени трансплантация (пересадка) гемопоэтических стволовых клеток (ТГСК) упоминалась только в контексте трансплантации костного мозга (ТКМ), поскольку костный мозг был единственным источником гемопоэтических стволовых клеток, используемых при лечении пациентов. Стволовые клетки это невызревшие клетки — предшественницы кроветворения, впоследствии развивающиеся в лейкоциты, эритроциты и тромбоциты. В настоящее время стволовые клетки получают из костного мозга, пуповинной крови или из периферической крови донора. Какой бы источник не использовался, стволовые клетки вводятся в организм пациента после проведения высокодозной химиотерапии или лучевой терапии, призванной полностью уничтожить лейкозные клетки больного. Предтрансплантационная химиотерапия уничтожает также иммунную систему пациента, которую вводимые клетки должны восстановить.
Существует две вида ТГСК: аутологичная и аллогенная. Первый включает в себя предварительный этап забора гемопоэтических стволовых клеток пациента, хранение их в замороженном виде, специальную обработку и вливание пациенту после проведения высокодозной химио- или лучевой терапии. Обычно стволовые клетки забираются в период хронической фазы болезни и вводятся при наступлении фазы ускорения. При этом можно рассчитывать на восстановление хронической фазы, а значит, и на продление жизни, облегчение симптомов. Недостаток аутологичной трансплантации заключается в более высокой вероятности рецидива болезни, чем при аллогенной трансплантации. Однако пациенты, прошедшие аутотрансплантацию, свободны от реакции отторжения «трансплантат против хозяина», которая является очень серьезным возможным осложнением после проведения аллогенной трансплантации.
Аллогенная трансплантация требует наличия родственного или неродственного донора, гистосовместимого (тканесовместимого) с пациентом по HLA-системе. В качестве родственного донора обычно выступает родной брат или сестра, но донор может быть найден и среди родителей или других кровных родственников (дяди, тети, двоюродные братья). В любом случае лечащий врач начинает поиск совместимого донора с ближайших родственников и часто проводит типирование и более дальних родственников пациента. Если подходящего донора не найдено, врач проводит поиск в базе данных российской (например, СПбГМУ) или зарубежной. Независимо от того, родственный или неродственный донор найден, процедура трансплантации одна и та же: производится забор стволовых клеток донора, которые затем внутривенно вводятся пациенту. В отличие от аутологичной трансплантации, донорские клетки замораживаются редко, поскольку их вливание происходит, как правило, в течение 24 часов после забора.
У некоторых пациентов после трансплантации развивается потенциально смертельно-опасная реакция отторжения «трансплантат против хозяина», когда новая иммунная система пациента, воссозданная донорскими клетками, атакует клетки организма реципиента. Трансплантологи различают два типа этой реакции: острую, когда симптомы проявляются вскоре после трансплантации, и хроническую, когда симптомы проявляются слабо и могут возникнуть через месяцы или годы после трансплантации. К счастью, существуют лекарства, способные успешно бороться с этим серьезным осложнением.
ОФОРМИТЬ ЗАЯВКУ на ЛЕЧЕНИЕ
Заготовка трансплантата для аутологичной трансплантации гемопоэтических стволовых клеток онкогематологическим больным: частота и причины неудачных сборов
Грицаев С.В. Кузяева А.А. Волошин С.В. Чубукина Ж.В. Балашова В.А. Тиранова С.А. Запреева И.М. Сельцер А.В. Абдулкадыров К.М.
Реферат. Аутологичная трансплантация гемопоэтических стволовых клеток (АутоТГСК) повышает эффективность лечения онкогематологических больных. Успех АутоТГСК зависит от количества заготовленных CD34+ клеток. число которых должно быть не ниже 2,0×106/кг. Частота неудачных аферезов ГСК достигает 40%. Причинами неэффективных мобилизаций могут быть различные факторы.
Материалы и методы. Проведен ретроспективный анализ 100 заготовок аутотрансплантата у больных разными онкогематологическими заболеваниями. Использовали 2 режима мобилизации: Г-КСФ в монорежиме и комбинация Г-КСФ с цитостатиками. Определение CD34+ клеток проводили в четырехцветном анализе на лазерном проточном цитофлуориметре «Cytomics FC 500» в международном протоколе ISHAGE. Колониеобразующую способность заготовленных клеток изучали in vitro в полной среде MethoCult H4435.
Результаты. Из 100 аферезов неудачными были 32 (32,0%). Наибольшее число неудачных заготовок было у больных неходжкинскими лимфомами (НХЛ): у 10 из 17 (58,8%), а наименьшее – у больных множественной миеломой (ММ): у 10 из 44 (22,7%). Неудача при заготовке аутотрансплантата была ассоциирована с отсутствием циклофосфамида в режиме мобилизации (р=0,000) и редукцией его дозы (р=0,019), возрастом больных (р=0,033) и видом болезни (р=0,027). По разным причинам. связанным со статусом больного, доза циклофосфамида в режиме мобилизации была ниже трансплантате которых содержание CD34+ клеток было
Заключение. Неэффективность аферезов гемопоэтических стволовых клеток (ГСК) у онкогематологических больных зависит от множества факторов. Несмотря на принципиальную роль циклофосфамида в режиме мобилизации, в ряде случаев возникает необходимость редукции его дозы. Условием снижения частоты неэффективных заготовок ГСК может быть внедрение в клиническую практику новых режимов кондиционирования.
Ключевые слова: больные онкогематологическими болезнями, аутологичная трансплантация гемопоэтических стволовых клеток, режимы мобилизации, CD34+ клетки, плериксафор.
Использование цитостатических препаратов в дозах, во много раз превышающих стандартные, является общепризнанной практикой лечения больных онкогематологическими заболеваниями [1]. Назначение высокодозной химиотерапии (ХТ) позволяет преодолеть резистентность опухолевых клеток к химиопрепаратам, значительно уменьшить объем патологического клона и, как следствие, улучшить безрецидивную выживаемость. Вместе с тем интенсификация ХТ нередко приводит к глубокому повреждению внутренних органов. Другое негативное проявление агрессивной цитостатической терапии – выраженный миелоаблативный эффект с тяжелыми инфекционными и геморрагическими осложнениями. В итоге высокодозная ХТ может привести к инвалидизации и/или смерти больного.
Одним из способов предупреждения неблагоприятных последствий агрессивной ХТ является укорочение периода постцитостатической цитопении посредством инфузии гемопоэтических стволовых клеток (ГСК), т.е. проведение трансплантации ГСК (ТГСК). Восстановление за короткий промежуток времени нейтрофилов и тромбоцитов до уровня, ассоциированного с низкой вероятностью инфекционных и геморрагических осложнений, снижает частоту нежелательных событий, что в совокупности с противоопухолевым эффектом ХТ обеспечивает высокий показатель общей выживаемости.
Циторедуктивное действие режима предтрансплантационной подготовки и иммунная реакция «трансплантат против опухоли» – факторы, обусловливающие несомненный клинический приоритет аллогенной ТГСК над другими видами высокодозной ХТ. Вместе с тем по ряду таких причин. как отсутствие родственного HLA-совместимого донора, возраст и соматический статус, аллогенная ТГСК не может быть выполнена большей части онкогематологических больных. В то же время каждый больной может рассматриваться как потенциальный донор собственных (аутологичных) ГСК и, следовательно, быть кандидатом на аутологичную ТГСК (АутоТГСК).
Проведение АутоТГСК осуществляется в несколько этапов: заготовка. замораживание, хранение, размораживание и переливание клеточной взвеси больному. Несмотря на важность сохранения репопуляционного потенциала ГСК от момента их получения до инфузии, ключевым условием эффективности АутоТГСК является объем заготовленных кроветворных клеток. Количество ГСК принято оценивать по числу клеток, на поверхности которых экспрессирован антиген CD34. Чем выше количество CD34+ клеток в аутотрансплантате, тем быстрее восстановление нейтрофилов и тромбоцитов, меньше потребность в трансфузиях эритроцитной массы и тромбоцитного концентрата, короче период профилактического назначения антибактериальных препаратов, реже эпизоды фебрильной нейтропении и инфекционных осложнений, ниже стоимость лечения [2].
Для одиночной АутоТГСК оптимальным считается содержание в трансплантате 4,0–6,0×106 CD34+ клеток/кг веса больного. Вместе с тем у 5–46% онкогематологических больных не удается заготовить минимального количества CD34+ клеток, необходимого для успешной АутоТГСК, которое составляет 2,0–2,5×106/кг [3, 4].
Причины неудачной заготовки трансплантата могут быть обусловлены статусом больного (возраст, пол), состоянием болезни (активность, вовлечение костного мозга в патологический процесс) и/или степенью повреждения костномозгового кроветворения (характер и объем предшествующей ХТ, указание в анамнезе на лучевую терапию, ранее проводимые мобилизации ГСК) [2–7].
Попытки повысить эффективность сборов посредством интенсификации доз цитостатиков и/или ростовых факторов, входящих в состав режимов мобилизации, представляются неоправданными. В этом случае существует высокая вероятность развития тяжелых токсических осложнений, время купирования которых может совпадать с периодом, благоприятным для проведения аферезов [8].
Более привлекательной представляется идея непосредственного воздействия на биологические механизмы, удерживающие ГСК в костномозговой нише, в частности, лиганд-рецепторное взаимодействие SDF1-CXCR4. Фактор стромальных клеток (stromal cell-derived factor1, известный также как CXCL12) – хемокин, который экспрессирован преимущественно на поверхности стромальных клеток и опосредует феномен локализации ГСК в костном мозге. Аналогичный G-протеиновый рецептор (CXCR4) экспрессирован на поверхности кроветворных клеток. Нарушение экспрессии отдельных молекул адгезии с повреждением сигнального пути SDF1-CXCR4 приводит к быстрой мобилизации ГСК в периферическую кровь [9].
Препаратом, который обладает свойством антагониста CXCR4, является плериксафор. В декабре 2008 г. US Food and Drug Administration зарегистрировало плериксафор для мобилизации ГСК в периферическую кровь с последующей их заготовкой для АутоТГСК у больных множественной миеломой (ММ) и неходжкинскими лимфомами (НХЛ).
Плериксафор используется в комбинации с гранулоцитарным колониестимулирующим фактором (Г–КСФ) [10]. В исследованиях по изучению клинической эффективности плериксафора были продемонстрированы безопасность, значимое увеличение числа успешных заготовок ГСК, отсутствие риска контаминации трансплантата опухолевыми клетками, укорочение периода от проведения аферезов до выполнения АутоТГСК, снижение частоты инфекционных осложнений [10–13].
Ожидается, что в 2013 г. плериксафор будет зарегистрирован на территории Российской Федерации. В связи с этим был инициирован ретроспективный анализ результатов заготовок аутотрансплантатов. Цель исследования – определить клиническую потребность в новых режимах мобилизации. Для этого были поставлены две задачи:
1) выявить частоту неудачных сборов у онкогематологических больных;
2) установить факторы, ассоциированные с неэффективной заготовкой ГСК. Дополнительно были проанализированы результаты АутоТГСК, выполненных больным ММ и НХЛ, у которых число заготовленных CD34+ клеток было менее 2,0×106/кг.
Материалы и методы
До начала сбора данных были сформулированы условия включения в исследование и исключения из него. Критерии включения были следующие: возраст больных от 16 лет и старше, заготовка ГСК из периферической крови, оценка состояния болезни до мобилизации и кондиционирования по международным шкалам, доступность информации о количестве (общем и в пересчете на вес больного) заготовленных CD34+ клеток, наличие результатов культуральных исследований.
Из-за небольшого числа наблюдений в исследование не включены данные сборов клеточной взвеси с использованием пегилированного филграстима.
Для мобилизации ГСК были использованы 2 режима. Первый включал введение только Г-КСФ. Во втором режиме Г-КСФ вводился после высокодозной цитостатической терапии. В обоих режимах Г-КСФ (ленограстим или филграстим) назначался по 10 мкг/кг/сут. подкожно однократно или дважды в равных дозах с интервалом в 12 ч. Введение Г-КСФ планировалось сроком на 4–5 дней в случае монотерапии и 10–13 дней при комбинированном режиме. В последнем случае инъекции Г-КСФ начинали на следующий день после введения химиопрепаратов, в среднем через 24 ч. Независимо от режима мобилизации инъекции Г-КСФ продолжали и в период проведения аферезов, включая последний день.
Для комбинированного режима мобилизации были использованы разные схемы ХТ или циклофосфамид. Циклофосфамид назначался из расчета 1,0–5,0 г/м2 и вводился внутривенно однократно или дважды в течение 2 последовательных дней, если доза была ≥3,0 г/м2. Одновременно больные получали месну согласно инструкции.
Аферезы планировали на день, когда концентрация лейкоцитов в периферической крови достигала уровня >5,0×109/л и/или содержание CD34+ клеток было не менее 10 в 1 мкл. Для этого в случае комбинированного режима мобилизации, после достижения лейкоцитами концентрации ≥1,0×109/л осуществляли ежедневный мониторинг количества CD34+ клеток в периферической крови.
Гемопоэтические CD34+ клетки в периферической крови и аферезном продукте определяли с помощью набора реагентов Stem-Kit Reagents в 4-цветном анализе на лазерном проточном цитометре Cytomics FC 500 с использованием программного обеспечения stemCXP Software, основанном на международном протоколе ISHAGE.
Аферезы осуществляли на сепараторах клеток крови Dideco, Hemonetics MCS 9000 и COBE Spectra (version 6.1, Gambro). В процессе каждого афереза обрабатывали 2,5 объема циркулирующей крови. Неудачными считали сборы. когда количество CD34+ клеток в аферезном продукте было менее 2,0×106/кг. Колониеобразующую способность заготовленных клеток оценивали по результатам 14-дневного культивирования 1,0×105 миелокариоцитов в 1,0 мл полной среды MethoCult H4435.
В качестве криопротектора был использован 20,0% раствор диметилсульфоксида, приготовленного ex tempore с применением аутологичной плазмы. Клеточную взвесь смешивали с криопротектором в соотношении 1:1 (конечная концентрация диметилсульфоксида – 10,0%).
Замораживание осуществляли в аппарате программного замораживания Cryo 560-16 Planer RLC (United Kingdom) по 4-этапной схеме: 1-й этап – с –4оС до –20оС со скоростью 1оС/мин. 2-й этап – с –20оС до –40оС со скоростью 2оС/мин. 3-й этап – с –40оС до –80oС со скоростью 4oС/мин. и 4-й этап – с –80oС до –140oС со скоростью 20oС/мин. После этого контейнеры с клеточной взвесью погружали в жидкий азот. Размораживание клеточной взвеси осуществляли на водяной бане при температуре 39oС в течение 30 с.
Статистическую обработку данных проводили с помощью программ Excel и Statisticа. Различие между отдельными показателями принимали достоверным при значении р
Согласно критериям включения из базы данных гематологической клиники были отобраны результаты 100 аферезов, из которых 3 – повторные. Учитывая, что при ремобилизации период между сборами превышал 1 мес. за который 2 больных стали старше на 1 год, результаты всех мобилизаций рассматриваются как отдельные случаи.
Возраст больных на момент заготовки аутотрансплантата был от 16 до 63 лет. Распределение по возрастным группам было следующим: 20 лет и менее – 12%, 21–30 лет – 15%, 31–40 лет – 17%, 51–60 лет – 25% и старше 60 лет – 10%.
От общего количества больные ММ, острым миелоидным лейкозом (ОМЛ), НХЛ, острым лимфобластным лейкозом (ОЛЛ) и лимфогранулематозом (ЛГМ) составили 44, 19, 17, 12 и 8% соответственно.
Полная ремиссия (ПР) была констатирована у 78% больных: у всех 19 больных ОМЛ и 12 больных ОЛЛ, у 15 из 17 больных НХЛ (88,3%), у 5 из 8 больных ЛГМ (62,5%) и у 27 из 44 больных ММ (61,4%). При исследовании морфологических и гистологических препаратов у больных, не достигших ПР, поражения костного мозга выявлено не было (табл. 1).
Для мобилизации кроветворных клеток у 14 больных была использована монотерапия Г-КСФ. У одного больного ОМЛ введению Г-КСФ предшествовал курс терапии «НАМ». В остальных случаях был назначен циклофосфамид с последующими инъекциями Г-КСФ.
У 30 больных доза циклофосфамида была ≥3,0 г/м2 и у 55 больных – менее 3,0 г/м2. Основанием для снижения дозы ниже 3,0 г/м2 были 2 и более из следующих показателей: фракция выброса левого желудочка менее 55%, снижение клиренса креатинина, рассчитанного по формуле Cockcroft-Gault, указание в анамнезе на цистит, ассоциированный с цитомегаловирусной инфекцией, предшествующие 3 и более линии иммуно- и/или ХТ, возраст старше 60 лет. Так, несмотря на отсутствие значимой разницы, циклофосфамид по ≥3,0 г/м2 вводился преимущественно более молодым больным, чем меньшая доза: 36,5 и 47,0 лет (медиана) соответственно; р=0,07. Число аферезов варьировало от 1 до 3. Было заготовлено 0,1–12,2×106 CD34+ клеток/кг. Неудачных сборов было 32 (32,0%). Их число у больных НХЛ, ЛГМ, ОЛЛ, ОМЛ и ММ составило 58,8, 37,5, 33,3, 26,3 и 22,7% соответственно (табл. 1).
Выявлено, что неудача при заготовке аутотрансплантата ассоциирована с:
1) отсутствием циклофосфамида в режиме мобилизации (r=0,372; p=0,000);
2) дозой циклофосфамида (r=0,279; p=0,019);
3) возрастом (r=-0,212; p=0,033);
4) дозой циклофосфамида менее 3,0 г/м2 у больных моложе 45 лет (r=-0,199; p=0,047);
5) видом заболевания (r=0,265; p=0,027).
Отдельному анализу были подвергнуты результаты неудачных сборов у 9 больных ММ и 9 больных НХЛ. Это вызвано тем, что плериксафор как препарат, увеличивающий количество заготавливаемых CD34+ клеток, зарегистрирован FDA только для этих категорий онкогематологических больных. Двум больным была проведена ремобилизация, которая так же, как и первая заготовка, оказалась неудачной. Таким образом, количество неудачных сборов составило 20.
Среди больных НХЛ у 4 был В-клеточный лимфолейкоз, у 2 – диффузная В-клеточная крупноклеточная лимфома, у 1 – лимфома из клеток мантии, у 1 – лимфома из клеток маргинальной зоны и у 1 – пре-Т-клеточная лимфома.
Медиана возраста больных составила 54,5 года. Значимого различия между возрастом больных ММ и возрастом больных НХЛ не обнаружено.
Перед заготовкой больные получили от 1 до 4 линий иммуно- и/или ХТ. Необходимо отметить, что никто из больных ММ не получал курсы, содержащие мелфалан или леналидомид, а из больных НХЛ – алемтузумаб или лучевую терапию.
У больных ММ мобилизация ГСК была осуществлена в период ПР (2 больных), очень хорошего частичного (5) или частичного ответов (3). У больных НХЛ заготовка проводилась во время полного (9) или неполного (1) ответов. Циклофосфамид был включен в режим мобилизации у 13 больных.
В день первого афереза уровень лейкоцитов в периферической крови был от 3,5 до 46,5×109/л, а содержание CD34+ клеток в 1 мкл крови – от 3 до 44. Количество заготовленных CD34+ клеток было в диапазоне от 1,0 до 1,9×106/кг.
Несмотря на низкое содержание CD34+ клеток в аутотрансплантате, больным была выполнена АутоТГСК. Основания для этого были следующие:
– неблагоприятный прогноз с высоким риском прогрессии преимущественно у больных НХЛ, получивших 2 и более линий иммуно- и/или ХТ и не имевших родственных HLA-совместимых доноров;
– вероятность повторного развития осложнений, имевших место во время первого сбора;
– результаты культурального исследования, свидетельствующие о достаточной сохранности пролиферативного потенциала клеточной взвеси in vitro.
Количество мононуклеарных клеток в аутотрансплантате было 1,0–1,8×108/кг (медиана 1,6×108/кг). Колониеобразующие клетки обнаружены во всех образцах клеточной взвеси. Их суммарное число было от 50 до 1031, медиана – 245.
В качестве режима кондиционирования больные НХЛ получили курс ВЕАМ, а больные ММ – мелфалан по 200 мг/м2 внутривенно.
Приживление трансплантата наступило у всех больных. Восстановление лейкоцитов до уровня ≥1,0×109/л было зафиксировано на 9–30 дни (медиана – 12,5 дня), нейтрофилов ≥0,5×109/л – на 9–32 дни (медиана – 14,5 дня) и тромбоцитов ≥50×109/л в течение 3 последовательных дней без переливаний тромбоцитного концентрата – на 10–90 дни (медиана – 18 дней).
Течение постцитостатического периода осложнилось развитием фебрильной нейтропении (9 больных), цитомегаловирусной инфекции (4), сепсиса (3), пневмонии (1) и острой почечной недостаточности (1). За это время больным было перелито от 0 до 6 доз эритроцитной массы (медиана – 1 доза) и от 0 до 8 доз тромбоцитного концентрата (медиана – 4 дозы).
У 1 больной диффузной В-клеточной крупноклеточной лимфомой с частичным ответом, а также у 3 больных ММ с частичным ответом накануне инициации режима кондиционирования были констатированы начальные признаки прогрессии болезни. После восстановления показателей периферической крови у всех 4 больных была констатирована дальнейшая прогрессия болезни.
Период наблюдения за больными составил 94 мес. За это время медиана выживаемости без болезни была одинаковой у больных НХЛ и ММ – 12 мес. Медиана общей выживаемости больных НХЛ составила 18 мес. и не была достигнута у больных ММ.
Интенсивная ХТ широко используется в лечении онкогематологических больных для улучшения качества ответа, предупреждения рецидива, повышения выживаемости. Сокращение периода постцитостатической цитопении посредством вливания аллогенных или аутологичных ГСК позволяет существенно снизить стоимость лечения, а также предоставляет возможность достаточно рано инициировать лечебное пособие по предупреждению прогрессии болезни.
Аллогенная ТГСК выполняется преимущественно больным острыми лейкозами и миелодиспластическим синдромом. Напротив, основным показанием для проведения АутоТГСК являются ММ и НХЛ.
Несомненная эффективность высокодозной ХТ с поддержкой кроветворными клетками делает практически всех больных ММ потенциальными кандидатами для проведения данного вида лечения. Этим объясняется тенденция к постоянному повышению верхней границы возраста больных, которым проводится АутоТГСК.
В большинстве случаев планирование АутоТГСК происходит уже при верификации диагноза. Такой подход позволяет на этапе индукционной терапии предпринять попытки для исключения факторов, сопряженных с неудачной мобилизацией. В первую очередь это сведение к минимуму повреждающего воздействия лекарственных препаратов: исключение мелфалана, сокращение сроков приема леналидомида, укорочение интервала до заготовки [14–16]. Немаловажным условием является максимальная эрадикация клеток патологического клона. Вместе с тем следует заметить, что, несмотря на предпринимаемые усилия, нередко для достижения ответа приходится наращивать интенсивность терапии, итогом которой чаще всего является достижение частичного ответа. То есть к началу заготовки аутотрансплантата к такому неблагоприятному параметру, как возраст больного, может присоединиться еще целый ряд факторов, оказывающих негативное влияние на качество сбора ГСК.
Вышесказанное в полной мере относится и к больным НХЛ. Выраженная биологическая гетерогенность в рамках одного нозологического варианта, включение в состав стандартных схем терапии антрациклиновых антибиотиков и флударабина, планирование АутоТГСК в случае неэффективности нескольких линий терапии или рецидива болезни могут оказать неблагоприятное влияние на качественный состав аутотрансплантата.
Несмотря на предпринимаемые усилия, неудачные сборы могут составлять значительную часть от общего числа заготовок [2–5]. В собственном исследовании 32% сборов были неудачными. Невозможность заготовить CD34+ клетки в объеме ≥2,0×106/кг была ассоциирована с возрастом больного, видом заболевания и интенсивностью режима мобилизации.
Гетерогенный состав больных, чьи данные были проанализированы, не позволяет в полной мере охарактеризовать причины неудачных заготовок при отдельных онкогематологических заболеваниях. Следует предположить, что у больных острыми лейкозами основным негативным фактором была интенсивность индукционной и консолидирующей терапии, а у больных ММ – возраст. В свою очередь совокупность этих 2 факторов, вероятно, объясняет причину высокой частоты неудовлетворительных сборов у больных НХЛ – 60%.
Принято считать, что выбор режима мобилизации во многом зависит от традиций, сложившихся в клинике, и не оказывает существенного влияния на контаминацию заготовленной взвеси опухолевыми клетками и на отдаленные результаты АутоТГСК [17]. Нередко при выборе варианта режима мобилизации рекомендуется учитывать вероятность прогрессии болезни в период проведения сбора ГСК. Если существует риск активации заболевания, то предпочтение следует отдать комбинированному режиму мобилизации, в то время как при благоприятном прогнозе – ростовым факторам в режиме монотерапии [18].
Собственные данные являются основанием рекомендовать в качестве режима мобилизации использовать сочетание Г-КСФ и циклофосфамида, доза которого должна быть не менее 3,0 г/м2. Другой довод в пользу данного положения – возможность дополнительной санации костного мозга независимо от качества ответа на предшествующее лечение.
Вместе с тем необходимо подчеркнуть, что во всех случаях неудачных сборов редукция дозы циклофосфамида была вынужденной мерой из-за изменения отдельных параметров в статусе больного. Данный фактор, а также вероятность присоединения инфекционных и геморрагических осложнений в период цитопении, развивающейся после введения циклофосфамида [6], обосновывают потребность в новых режимах мобилизации, лишенных недостатков существующих. Привлекательным представляется воздействие на молекулы адгезии, которые экспрессированы на поверхности ГСК. Развивающийся при этом ускоренный выход кроветворных клеток в кровь не сопровождается токсическим и миелосупрессивным эффектами.
Плериксафор зарегистрирован FDA для мобилизации ГСК у больных ММ и НХЛ [10]. Рассматривая перспективы применения плериксафора для заготовки аутотрансплантата, следует обратить внимание на следующие факты.
Во-первых, на худшую эффективность сборов у больных НХЛ: несмотря на увеличение сеансов афереза, общий объем заготавливаемых CD34+ клеток у них меньше, чем у больных ММ [19–21]. Во-вторых, использование для АутоТГСК клеточной взвеси, содержащей менее 2,0×106 CD34+ клеток/кг, нередко увеличивает стоимость АутоТГСК в 1,5 раза за счет более длительного периода восстановления [22].
Собственное исследование – не исключение. Если неудачные сборы были зафиксированы у 23% больных ММ, то у больных НХЛ данный показатель составил 60%. При этом между группами больных не было значимой разницы в возрасте. Более того, число ПР у больных НХЛ было выше, чем у больных ММ – 88% против 61%. Эти данные свидетельствуют о том, что эффективность заготовки аутотрансплантата – интегральный показатель, который отражает влияние множества факторов на мобилизацию ГСК, в частности, выбора режима мобилизации. Так, неудачи возможны и при назначении плериксафора, особенно в случаях, когда принципиальными оказываются другие, нежели SDF1-CXCR4, сигнальные пути [20, 23].
Количество клеток, экспрессирующих на своей поверхности CD34+ антиген, является суррогатным маркером, по которому можно косвенно оценить гемопоэтический потенциал трансплантата. Несмотря на отсутствие единого мнения, предполагается, что для быстрого и надежного восстановления показателей крови после АутоТГСК достаточно заготовить не менее 2,0×106 CD34+ клеток/кг [24]. Дальнейшее увеличение числа клеток ассоциируется с ускорением темпа приживления трансплантата [20, 25, 26], хотя и не является обязательным условием. Так, P. Stiff et al. [27] не обнаружили значимого сокращения сроков восстановления нейтрофилов и тромбоцитов у больных ММ и НХЛ после трансфузии >2,0×106 CD34+ клеток/кг.
Помимо числа CD34+ клеток качество трансплантата оценивают по количеству мононуклеарных и колониеобразующих клеток, а также жизнеспособности заготовленных клеток. Комплексный анализ указанных показателей в совокупности с оценкой процесса кристаллизации при замораживании позволяет в отдельных случаях трансплантировать больному взвесь, содержащую менее 2,0×106 CD34+ клеток. Речь идет о ситуациях, когда имеются противопоказания к ремобилизации или существует угроза прогрессии болезни из-за увеличения интервала между курсами специфической терапии [28].
Как свидетельствуют клинические результаты 18 АутоТГСК, при которых было заготовлено 0,5×109/л на 10–14 дни и уровень тромбоцитов ≥50,0×109/л на 15–30 дни. Интерпретация удлинения сроков приживления не может быть однозначной и рассматриваться только как следствие малого количества CD34+ клеток. Возможно, что длительный период восстановления показателей крови мог быть результатом тяжелых инфекционных осложнений, имевших место у большинства больных. Другая вероятная причина – начинающийся во время режима кондиционирования рецидив заболевания. С другой стороны, нельзя исключить, что увеличение сроков приживления трансплантата могло спровоцировать активацию болезни из-за невозможности своевременно инициировать противорецидивную терапию.
Многообразие механизмов, способных спровоцировать удлинение периода постцитостатической аплазии костного мозга, заставляет искать пути их преодоления. Это определение показаний к АутоТГСК на ранних этапах лечения по результатам молекулярно-генетической стратификации больных на группы риска, более тщательный отбор кандидатов на высокодозную терапию, совершенствование методов по определению оптимальных сроков сбора ГСК, внедрение в клиническую практику новых высокоэффективных режимов мобилизации, в частности, с применением ингибитора CXCR4 (плериксафора).
Таким образом, полученные данные свидетельствуют о том, что, несмотря на кажущуюся простоту из-за отсутствия иммунного конфликта, присущего аллогенной ТГСК, успех АутоТГСК складывается из множества факторов и не в последнюю очередь зависит от качества трансплантата. Одним из принципиальных условий заготовки достаточного количества CD34+ клеток является включение в состав режима мобилизации циклофосфамида в дозе не менее 3,0 г/м2. Неудачные сборы, когда содержание CD34+ клеток в аутотрансплантате не достигает уровня 2,0×106/кг, могут иметь место при разных вариантах онкогематологических заболеваний, но с большей частотой встречаются у больных НХЛ. Применение для клинических целей аутотрансплантата, при заготовке которого было собрано менее 2,0×106 CD34+ клеток/кг, допустимо после коллегиальной оценки разными специалистами общесоматического статуса больного и активности болезни, количественного и качественного состава клеточной взвеси, отдельных параметров процесса кристаллизации и результатов размораживания, пробных образцов. Возможным условием повышения качества аутотрансплантата у больных НХЛ и ММ может быть включение плериксафора в режим мобилизации.
1. Волкова М.А. Клиническая онкогматология. М. Медицина, 2007. 1120 с.
2. Bensinger W. DiPersio J.F. McCarty J.M. Improving stem cell mobilization strategies: future directions // Bone Marrow Transplant. 2009. Vol. 43 (3). Р. 181–195.
3. Lemoli R.M. D’Addio A. Hematopoietic stem cell mobilization // Haematologica. 2008. Vol. 93 (3). Р. 321–324.
4. Perseghin P. Terruzzi E. Dassi M. Baldini V. Parma M. Coluccia P. et al. Management of poor peripheral blood stem cell mobilization: incidence, predictive factors, alternative strategies and outcome. A retrospective analysis on 2177 patients from three major Italian institutions // Transfus Apher Sci. 2009. Vol. 41 (1). Р. 33–37.
5. Yang S.M. Chen H. Chen Y.H. Zhu H.H. Zhao T. Liu K.Y. The more, the less: age and chemotherapy load are predictive of poor stem cell mobilization in patients with hematologic malignancies // Chin Med J. 2012. Vol. 125 (4). Р. 593–598.
6. Ameen R.M. Alshemmari S.H. Alqallaf D. Factors associated with successful mobilization of progenitor hematopoietic stem cells among patients with lymphoid malignancies // Clin Lymphoma Myeloma. 2008. Vol. 8 (2). Р. 106–110.
7. Mazumder A. Kaufman J. Niesvizky R. Lonial S. Vesole D. Jagannath S. Effect of lenalidomide therapy on mobilization of peripheral blood stem cells in previously untreated multiple myeloma patients // Leukemia. 2008. Vol. 22 (6). Р. 1280–1281.
8. Meldgaard K.L. Jensen L. Gaarsdal E. Nikolaisen K. Johnson H.E. A comparative study of sequential priming and mobilization of progenitor cells with rhG-CSF alone and high-dose cyclophosphamide plus rhG-CSF // Bone Marrow Transplant. 2000. Vol. 26 (7). Р. 717–722.
9. Покровская О.С. Механизм действия и клиническая эффективность антагониста хемокинового рецептора CXCR4 плериксафора при мобилизации гемопоэтических стволовых клеток // Клиническая онкогематология. 2012. № 4. С. 371–379.
10. DiPersio J.F. Uy G.L. Yasothan U. Kirkpatrick P. Plerixafor // Nat Rev Drug Discov. 2009. Vol. 8 (2). Р. 105–106.
11. Fruehauf S. Ehninger G. Hubel K. Topaly J. Goldschmidt H. Ho A.D. et al. Mobilization of peripheral blood stem cells for autologous transplant in non-Hodgkin’s lymphoma and multiple myeloma patients by plerixafor and G-CSF and detection of tumor cell mobilization by PCR in multiple myeloma patients // Bone Marrow Transplant. 2010. Vol. 45 (2). Р. 269–275.
12. Costa L.J. Miller A.N. Alexander E.T. Hogan K.R. Shabbir M. Schaub C. Stuart R.K. Growth factor and patient-adapted use of plerixafor is superior to CY and growth factor for autologous hematopoietic stem cells mobilization // Bone Marrow Transplant. Vol. 2011. Р. 46 (4). Р. 523–528.
13. D’Addio A. Curti A. Worel N. Douglas K. Motta M.R. Rizzi S. et al. The addition of plerixafor is safe and allows adequate PBSC collection in multiple myeloma and lymphoma patients poor mobilizers after chemotherapy and G-CSF // Bone Marrow Transplant. 2011. Vol. 46 (3). Р. 356–363.
14. Popat U. Saliba R. Thandi R. Hosing C. Qazilbash M. Anderlini P. et al. Impairment of filgrastim-induced stem cell mobilization after prior lenalidomide in patients with multiple myeloma // Biol Blood Marrow Transplant. 2009. Vol. 15 (6). Р. 718–723.
15. Auner H.W. Mazzarella L. Cook L. Szydlo R. Saltarelli F. Pavlu J. et al. High rate of stem cell mobilization failure after thalidomide and oral cyclophosphamide induction therapy for multiple myeloma // Bone Marrow Transplant. 2011. Vol. 46 (3). Р. 364–367.
16. Boccadoro M. Palumbo A. Bringhen S. Merletti F. Ciccone G. Richiardi L. et al. Oral melphalan at diagnosis hampers adequate collection of peripheral blood progenitor cells in multiple myeloma // Haematologica. 2002. Vol. 87 (8). Vol. 846–850.
17. Meldgaard K.L. Jensen L. Gaarsdal E. Nikolaisen K. Johnson H.E. A comparative study of sequential priming and mobilization of progenitor cells with rhG-CSF alone and high-dose cyclophosphamide plus rhG-CSF // Bone Marrow Transplant. 2000. Vol. 26 (7). Р. 717–722.
18. Kumar S. Giralt S. Stadtmauer E.A. Harousseau J.L. Palumbo A. Bensinger W. et al. Mobilization in myeloma revisited: IMWG consensus perspectives on stem cell collection following initial therapy with thalidomide-, lenalidomide-, or borezomib-containing regimens // Blood. 2009. Vol. 114 (9). Р. 1729–1735.
19. Uy G.L. Rettig M.P. Cashen A.F. Plerixafor, a CXCR4 antagonist for the mobilization of hematopoietic stem cells // Expert Opin Biol Ther. 2008. Vol. 8 (11). Р. 1797–1804.
20. Pusic I. Fiang S.Y. Landua S. Uy G.L. Rettig M.P. Cashen A.F. et al. Impact of mobilization and remobilization strategies on achieving sufficient stem cell yields for autologous transplantation // Biol Blood Marrow Transplant. 2008. Vol. 14 (9). Р. 1045–1056.
21. Jagasia M.H. Savani B.N. Neff A. Dixon S. Chen H. Pickard A.S. Outcome, toxicity profile and cost analysis of autologous stem cell mobilization // Bone Marrow Transplant. 2011. Vol. 46 (8). Р. 1084–1088.
22. Stockerl-Goldstein K.E. Reddy S.A. Horning S.F. Blume K.G. Chao N.F. Hu W.W. et al. Favorable treatment outcome in non-Hodgkin’s lymphoma patients with “poor” mobilization of peripheral blood progenitor cells // Biol Blood Marrow Transplant. 2000. Vol. 6 (5). Р. 506–512.
23. Calandra G. McCarty J. McGuirk J. Tricot G. Crocker S.A. Badel K. et al. AMD3100 plus G-CSF can successfully mobilize CD34+ cells from non-Hodgkin’s lymphoma, Hodgkin’s disease and multiple myeloma patients previously failing mobilization with chemotherapy and/or cytokine treatment: compassionate use data // Bone Marrow Transplant. 2008. Vol. 41 (4). Р. 331–338.
24. Bensinger W. Appelbaum F. Rowley S. Storb R. Sanders J. Lilleby K. et al. Factors that influence collection and engraftment of autologous peripheral-blood stem cells. J Clin Oncol 1995; 13(10): 2547-2555.
25. Sola C. Maroto P. Salazar R. Mesía R. Mendoza L. Brunet J. et al. Bone marrow transplantation: prognostic factors of peripheral blood stem cell mobilization with cyclophosphamide and filgrastim (r-metHuGCSF): the CD34+ cell dose positively affects the time to hematopoietic recovery and supportive requirements after high-dose chemotherapy // Hematology. 1999. Vol. 4 (3). Р. 195–209.
