аллопластика кости что это
Аллопластика кости что это
По данным литературы, доля заболеваний коленного сустава среди всех случаев дегенеративно-дистрофических заболеваний суставов конечностей составляет от 21,9 до 29%, причем в 86% случаев страдают лица трудоспособного возраста, у которых прогрессирование заболевания в течение 10-15 лет приводит к инвалидности в 6,2-14,6% случаев [1]. Зачастую методом выбора при лечении пациентов с дегенеративно-дистрофическими заболеваниями суставов становится тотальное эндопротезирование. Одной из проблем, которую нужно решить в процессе тотального эндопротезирования сустава, это замещение костных дефектов в ложе эндопротеза. Их доля при заболеваниях коленного сустава составляет от 25 до 31% [2].
Причинами формирования дефектов и, как следствие, грубых деформаций являются:
— асептический некроз мыщелков, который, по данным различных авторов, составляет от 8 до 22% всех дегенеративно-дистрофических заболеваний коленного сустава,
— кистовидная перестройка эпифизов бедренной и большеберцовой костей,
— посттравматическая импрессия суставной поверхности 6.
Существует достаточное количество классификаций костных дефектов при первичном и ревизионном эндопротезировании коленного сустава [7]. Мы используем наиболее удобную, нашедшую широкое клиническое и научное применение классификацию AORI, разработанную G.A. Engh в Anderson Ortopaedic Research Institute (AORI США, 1997) [8]. Классификация основана на дооперационной рентгенологической оценке состояния костей, с помощью предварительно заданных критериев. В соответствии с этой классификацией выделяют четыре типа состояния бедренной или большеберцовой костей:
1 тип – интактная кость;
2А тип – повреждённая губчатая кость, кость противоположного мыщелка остается неизменной;
2В тип – симметричная потеря костной массы с вовлечением обоих мыщелков или плато;
3 тип – повреждение губчатой и кортикальной кости.
Классификация AORI достаточно четко показывает корреляцию наличия и размеров костных дефектов с ростом потребности использовать металлические блоки, клинья и/или структурированные трансплантаты. У данной методики существует лишь один минус. По современным данным, в группах I и IIA дефекты кости до 5 мм в 46% случаев посредством дооперационных рентгенограмм диагностированы не были [9].
При выполнении тотального эндопротезирования коленного сустава (ТЭКС) преследуется основная цель – создание долговременной надежной опоры для компонента эндопротеза. В случае имеющегося костного дефекта она может достигаться такими способами, как:
— резекция по дну дефекта,
— цементная пластика с армированием или без армирования,
— замещение металлическим блоком,
— костная аллопластика 12.
При детальном рассмотрении у каждого метода отмечаются свои преимущества и недостатки. Преимуществом замещения костного дефекта путем выполнения резекции по дну дефекта является простота и быстрота выполнения. Недостатком становится снижение количества ткани большеберцовой кости в дистальном направлении. Не исключена ситуация, что на максимальном вкладыше стабильность сустава не будет достигнута. Кроме того, при возникновении необходимости выполнения реэндопротезирования у этой группы пациентов хирург может столкнуться с такой проблемой, как обширный дефект большеберцовой кости. Таким образом, этот вариант замещения костного дефекта не является методом выбора. Его применение допустимо при неглубоких дефектах [12]. По нашим данным, резекция по дну дефекта выполнена у 5% пациентов с имеющимся костным дефектом.
Замещение костного дефекта путем цементной пластики с армированием или без армирования винтами также отличается простотой и дешевизной. Недостатки метода заключаются в том, что непросто добиться адекватной прессуризации цемента при нарушении целостности кортикальной кости. Изменение объема цемента во время полимеризации может достигать 2%. Неравномерное распределение нагрузки на подлежащую кость при эксцентрически действующих силах может приводить к нарушению прочности фиксации. Этот метод используется для замещения достаточно глубоких дефектов, при условии соблюдения правил прессуризации цемента и планирования вектора нагрузки [12]. По нашим данным, такое замещение выполнено у 82% пациентов с имеющимся костным дефектом.
Преимущество метода замещения костного дефекта путем костной аутопластики заключается в максимальном сохранении костной ткани метаэпифиза. К недостаткам метода относятся: существенные ограничения в выборе размера трансплантата, риск коллапса, если структура трансплантата повреждена патологическим процессом, и риск несращения. Метод применяется при наличии трансплантата с соответствующими характеристиками (размер, плотность). По нашим данным, такое замещение выполнено у 7% пациентов с имеющимся костным дефектом.
Достоинством замещения костного дефекта металлическим блоком или клином следует считать быстрое создание надежной опоры для имплантата, даже в условиях обширных дефектов. К недостаткам метода относятся ограничения по размеру и форме трансплантата, необходимость специальных инструментов и компонентов эндопротеза. Увеличивается общая стоимость имплантата. При наличии специального инструментария и соблюдении правил имплантации метод применим для замещения любых дефектов [12; 13]. По нашим данным, замещение костного дефекта этим методом выполнено у 6% пациентов.
Цель исследования: улучшить результаты первичного эндопротезирования коленного сустава у пациентов, имеющих костный дефект большеберцовой кости до 2А по AORI.
Материал и методы. В Новосибирском НИИТО за 2012-2015 годы выполнено 7096 операций первичного эндопротезирования коленных суставов. В 2157 (30,4%) случаях был диагностирован требующий замещения костный дефект как бедренной, так и большеберцовой кости [14].
С целью восстановления биомеханики коленного сустава и создания долговременной надежной опоры для компонентов эндопротеза у пациентов, имеющих костный дефект большеберцовой кости до 2А по AORI, нами разработан и внедрен в клиническую практику способ аутопластики большеберцовой кости при первичном эндопротезировании коленного сустава.
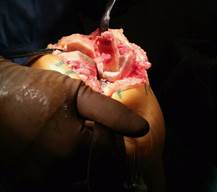
Данная методика выполняется соответственно стандартным этапам эндопротезирования, но имеет некоторые особенности: после выполнения резекции суставной поверхности большеберцовой кости определяется остаточный костный дефицит мыщелка большеберцовой кости. По классификации AORI для аутопластики допускается дефицит не больше T2А. При формирования межмыщелкового бокса бедренной кости производится одновременный забор аутокости. Производится обработка костного аутотрансплантата до придания ему правильной геометрической формы (рис. 1).
Рис. 1. Забор аутотрансплантата, придание ему правильной геометрической формы
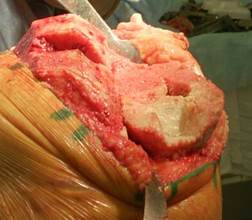
Далее обрабатывается дефект большеберцовой кости до «кровяной росы», после чего в дефекте формируется опорная площадка по размеру трансплантата для плотной посадки аутотрансплантата (рис. 2).
Рис. 2. Обработанный дефект большеберцовой кости со
сформированной опорной площадкой
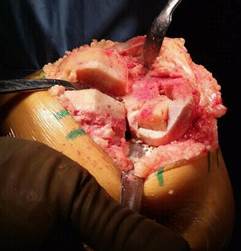
В последующем аутотрансплантат устанавливается в сформированное ложе и производится импакция до фиксации (рис. 3).
Рис. 3. Импакция аутотрансплантата в сформированном ложе
Дальнейший ход операции соответствует стандартным этапам при первичном эндопротезировании коленного сустава. Восстановительный период не имеет каких-либо особенностей по сравнению со стандартным течением [15].
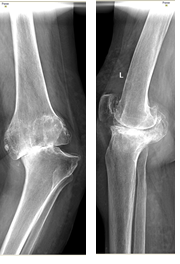
Клинический пример. Пациент С., 65 лет. Диагноз: левосторонний посттравматический гонартроз 3 степени. Дефект медиального мыщелка левой большеберцовой кости. Варусная деформация левой нижней конечности. Комбинированная контрактура левого коленного сустава. Синдром левосторонней гоналгии (рис. 4).
Рис. 4. Рентгенограмма коленного сустава в прямой и боковой проекциях
Пациенту проведено оперативное лечение: эндопротезирование левого коленного сустава с аутопластикой медиального мыщелка большеберцовой кости. Послеоперационный период протекал без особенностей, пациенту была проведена стандартная реабилитация.
На контрольных осмотрах через 6 месяцев, 1 и 2 года после проведенного хирургического лечения пациент отметил хороший результат проведенного лечения, выражающийся в увеличении объема движений в коленном суставе, повышении его стабильности и восстановлении нормальной оси конечности. На контрольной рентгенограмме коленного сустава через 2 года после операции аутотрансплантат состоятелен (рис. 5).
Рис. 5. Контрольная рентгенограмма коленного сустава в прямой и
боковой проекциях через 2 года после операции
Таким образом, у пациентов, имеющих костный дефект большеберцовой кости 2А по AORI, при первичном эндопротезировании коленного сустава выполнение аутопластики по разработанной методике приводит к хорошим результатам, выражающимся в создании долговременной надежной опоры для компонентов эндопротеза, что увеличивает срок его службы за счет нормализации распределения нагрузок в прооперированном коленном суставе.
1. При первичном эндопротезировании коленного сустава максимальное сохранение костной ткани облегчает хирургическую тактику при последующих хирургических вмешательствах, что очень важно у молодых пациентов.
2. Метод аутопластики является «золотым стандартом» для сохранения костной массы.
3. Аутопластика должна выполняться при отсутствии противопоказаний.
Остеопластические материалы в хирургической стоматологии
Использование костного материала в стоматологии широко распространено. С его помощью удается выполнять остеопластику – восстанавливать утраченный объем альвеолярного гребня. Это позволяет избежать дальнейшее разрушение костной ткани и появления ряда негативных последствий, которые возникают на фоне изменения внешнего вида и ухудшения здоровья человека. Часто к процедуре прибегают перед установкой имплантатов, когда костной ткани пациента не хватает. Рассмотрим подробнее специфику материалов, позволяющих провести данные мероприятия.
Характеристика костнопластического материала в стоматологии
Остеопластические материалы в хирургической стоматологии должны быть высокого качества, обладать следующими характеристиками:
В настоящее время на рынке представлено множество видов остеопластических материалов. При выборе наиболее подходящего материала надо учитывать все вышеуказанные характеристики. Кроме того, он должен быть готов к незамедлительному использованию, иметь высокие показатели адгезии, чтобы имплантат с его помощью максимально прилегал к кости.
Классификация остеопластических материалов
Остеопластические материалы представляют собой имплантаты, способствующие формированию кости. При этом они обеспечивают локальную остеокондуктивную, остеоиндуктивную или остеогенную активность. В соответствии с происхождением все остеопластические материалы разделяют на четыре основные группы:
Рассмотрим подробнее особенности каждой группы в отдельности.
Аутогенные
Аутогенный костнозамещающий материал в стоматологии используют чаще остальных. Аутокость получают путем забора с донорского внутриротового или внеротового участка с последующей пересадкой в принимающий участок. В ходе ряда клинических исследований было доказано, что он способствует ускоренному замещению послеоперационных и других костных дефектов новообразованной тканью. Он характеризуется пластичностью, не обладает свойствами иммунной несовместимости. При этом финансовые затраты, связанные с его забором, небольшие.
В соответствии с происхождением различают два вида – эндохондрального (хрящевого) и эктомезенхимального (мебранного) происхождения. Среди недостатков можно отметить вероятность инфицирования, травматичность получения аутоматериала и долгую продолжительность самого оперативного вмешательства. Зачастую аутокость применяют в сочетании с иными материалами, к примеру, аллокостью или ксенокостью. Это позволяет избежать усадки аутокости
Аллогенные
Аллогенный костный материал для синус лифтинга в РФ в соответствии с законодательством не применяют. Аллогенные имплантаты представляют собой костнопластические материалы, которые получают из человеческих трупов, в последствие, подвергая специальной обработке. Это может быть кортикальная и губчатая часть подвздошной кости или аллоимплантат деминерализованной лиофилизированной кости. К основным достоинствам данной группы в сравнении с аутоматериалами относятся:
Помимо этических проблем к недостаткам применения данных материалов относят вероятность возможного инфицирования реципиентов ВИЧ-инфекцией и гепатитом.
Ксеногенные
В крайне редких случаях специалисты прибегают к использованию ксеногенного костного материала для имплантации. Он обладают остеокондуктивными свойствами, сохраняет исходную минеральную структуру кости. Ксенокость (природный гидроксиапатит) получают из костной ткани млекопитающих. Структура костей животных идентична кости человека, что позволяет их использовать в стоматологической практике. Ксенокость предварительно подвергают специальной обработке и деантигенизации. Это позволяет устранить из ее состава все факторы, провоцирующие развитие иммунологической и аллергической реакции.
В зависимости от типа обработки различают ксеноматериалы с низкотемпературной обработкой, ксеноматериалы с высокотемпературной обработкой и ксеноматериалы на основе энзимных технологий. Различают два основных метода деантигенизации. Самый эффективный и популярный – термическая обработка при повышенной температуре (около 700-1000 С°), после которой все органические вещества испаряются. Ксенокость не дает усадку. За счет синхронности процессов разрушения и восстановления костной возникает физиологическое замещение искусственных костных гранул натуральной костью, без утраты объема.
Синтетические
Синтетический костный материал выполнен на основе солей кальция. В особо сложных клинических случаях, когда требуется наращивать большие объемы кости в горизонтальном или вертикальном направлении, ксеногенная костная ткань сочетают с аутогенной костью в равных соотношениях. Синтетика является достойной альтернативой ауто-, алло- и ксеноматериалам. По некоторым признакам они превосходят остеопластические материалы натурального происхождения (к примеру, отсутствует необходимость забора костной ткани, исключена вероятность заражения инфекционными патологиями).
Главным недостатком большинства синтетических материалов в сравнении с ауто-, алло- и ксеноматериалами, является отсутствие свойств остеоиндукции (способности вызывать эктопическое формирование костной ткани). В том случае, если в их состав добавить компоненты, которые будут стимулировать регенерацию костной ткани (к примеру, коллагена), они способны приобрести остеоиндуктивные свойства.
Необходимые процедуры перед увеличением костной ткани
После устранения моляра или премоляра на кость больше не оказывается регулярная нагрузка, что со временем приводит к ее атрофии и утрате объема. Наряду с этим появляются воспалительные процессы в пародонтальной ткани. В результате, чем больше дней проходит после утраты моляра или премоляра, тем сильнее кость начинает испытывать дефицит. На этом фоне становится намного сложнее провести имплантацию.
Методика, к которой прибегают для увеличения объема костной ткани, в каждом клиническом случае подбирают в индивидуальном порядке. Для этого врач-стоматолог предварительно оценивает ротовую полость и при необходимости назначает инструментальную диагностику. Зачастую случается, что необходимость в применении другой методики возникает только в период проведения оперативного вмешательства. За счет этого специалист должен быть осведомлен обо всех разновидностях остеопластики и уметь применять их на практике.
Разновидность остеопластики
Ниже представлены основные виды остеопластики, чтобы разобраться, для каких оперативных вмешательств применяют конкретный тип материала:
Увеличить объем костной ткани удается за счет применения материалов синтетического происхождения. К помощи барьерных мембран прибегают с целью фиксации пересаженных костных тканей или предохранении костной ткани человека после того, как ему устранили моляр или премоляр. Для восстановления костной ткани используют аллотрансплантаты. Наиболее распространенными являются аутотрансплантаты.
Операция с остеопластическим материалом в «А-Медик»
Остеопластические операции признаны одними из самых сложных (с технической точки зрения) в области стоматологической хирургии. Чтобы избежать ряда негативных последствий после оперативного вмешательства, выполнять их следует только в проверенных клиниках. Высококвалифицированные специалисты стоматологии «А-Медик» долгие годы специализируются на проведении данных операций. Клиника оснащена современными инструментами, модернизированным оборудованием и необходимым освещением, что гарантирует положительный результат терапии.
Врачи качественно проводят оперативное вмешательство любой сложности с использованием различных остеопластических материалов. Стоимость процедуры значительно ниже, чем в других частных клиниках Москвы. На официальном сайте можно подробнее ознакомиться с прайсом. Чтобы записаться на первичный прием к врачу-стоматологу достаточно позвонить в клинику по указанным номерам или оставить заявку в онлайн режиме (с указанием имени и контактного номера).
Аутопластика
Наши специалисты свяжутся с вами в ближайшее время
Термин аутопластика объединяет целую группу хирургических пластических операций. Основная особенность – использование собственных тканей организма для ее проведения. Это могут быть органы или кожа пациента. Пересаженные ткани могут быть лишены питания или получать полноценное соединение с кровеносной системой. Во втором случае применяется микрохирургия. В основном процедура проводится с целью устранения крупных дефектов, последствия травм, ожогов, ран.
В каких случаях выполняется
Целью такой пластической операции является восстановление целостности тканей организма после повреждений, происхождение которых не играет роли. Это могут быть органы, части тела, суставы, чаще кожные покровы.
Проведение операции
Рассмотрим проведение артроскопической аутопластики связок коленного сустава. Необходимо заменить связки после их сильного повреждения. Это происходит путем аутопластики коленного сустава – максимально щадящего метода восстановления полноценной функции колена. Поврежденные волокна заменяются собственными тканями или искусственными заменителями.
Второй вариант предполагает использование не менее прочных протезирующих элементов. Замена происходит с использованием нескольких проколов, травматизация минимальна. Ход операции:
Процедура имеет минимум противопоказаний, не оставляет следов на коже. Связки для пересадки берутся из области бедра.
Реабилитация после аутопластики
Пациент направляется в палату сразу после операции. До четырех первых недель реабилитация проходит с фиксацией сустава. Проводится физиотерапевтическое лечение, которое ускоряет процесс восстановления. После этого пациенту необходимо носить ортез. Это нужно для защиты сустава, контроля состояния мышц, постепенного восстановления подвижности.
Полноценная ходьба разрешается примерно через месяц. Среди обязательных процедур в процессе восстановления:
Где сделать операцию?
Узнать больше о проведении аутопластики в ЦКБ РАН у врача-хирурга можно по телефону. Чтобы пройти осмотр и узнать больше, стоит записаться на прием к хирургу. Успех проводимых нами операций не зависит от степени повреждения и неизменно дает положительный результат.
Аллопластика кости что это

Поиск
Костно-пластические вмешательства при лечении доброкачественных опухолей костей
А.Н. ТАРАСОВ
Астраханский государственный медицинский университет МЗ РФ
Контактная информация:
Тарасов Алексей Николаевич – доктор медицинских наук, профессор кафедры травматологии и ортопедии
Адрес: 414000, г. Астрахань, ул. Бакинская, д. 121, e—mail: [email protected]
Цель – изучить эффективность пластического замещения резекционных дефектов после удаления доброкачественных опухолей и опухолеподобных поражений костей.
Материал и методы. В исследование вошло 1755 пациентов с доброкачественными опухолями и опухолеподобными поражениями, которым проведены различные виды резекций кости: плоскостная (427), краевая (705), внутриочаговая (521) и сегментарная (102). 653 больным выполнено замещение резекционного дефекта.
Результаты. Клинико-рентгенологическое обследование пациентов в сроки от 1 года до 15 лет после операции показало, что перестройка кортикальных костных аллотрансплантатов продолжается в зависимости от возраста от 2 до 3 лет и завершается органотипически с нормализацией структуры кости и формированием костномозговой полости. Перестройка губчатых аллотрансплантатов завершается к году после вмешательства с аналогичной рентгенологической картиной.
Выводы. Костная аллопластика остается перспективным и приоритетным направлением при хирургическом лечении больных с доброкачественными опухолями и опухолеподобными поражениями костей.
Ключевые слова: доброкачественные опухоли костей, опухолеподобные поражения костей, резекция костей, аллопластика, аутопластика, осложнения.
A.N. TARASOV
Astrakhan State Medical University of the Ministry of Health of the Russian Federation
Osteoplastic interventions in the treatment of benign bone tumors
Contact details:
Tarasov A.N. – D.Sc. (medicine), Professor of the Department of Traumatology and Orthopedics
Address: 121 Bakinskaya St., Astrakhan, Russian Federation, 414000, e-mail: [email protected]
The aim of the work is to study the effectiveness of plastic replacement of resection defects after removal of benign tumors and tumor-like bone lesions.
Material and methods. The study included 1755 patients with benign tumors and tumor-like lesions, who underwent various types of bone resections: planar (427), marginal (705), intrafocal (521) and segmental (102). 653 patients completed replacement of the resection defect.
Results. Clinical and radiological examination of patients from 1 to 15 years after surgery showed that the restructuring of cortical bone allografts continues depending on the age from 2 to 3 years and ends organotypically with normalization of the bone structure and formation of the bone marrow cavity. The restructuring of spongy allografts is completed by the year after the intervention with a similar x-ray picture.
Conclusion. Bone alloplasty remains a promising and priority area in the surgical treatment of patients with benign tumors and tumor-like bone lesions.
Key words: benign bone tumors, tumor-like bone lesions, bone resection, alloplasty, autoplasty, complications.
Хирургическое вмешательство по поводу доброкачественных новообразований костей многогранно, включает несколько этапов – адекватный оперативный доступ, резекцию кости в пределах здоровых тканей с целью полного удаления новообразования, адьювантное воздействие на резекционный дефект для повышения радикальности вмешательства и полноценное восполнение резекционного дефекта пластическим материалом. Следовательно, для эффективного лечения доброкачественных опухолей и опухолеподобных поражений костей требуется проведение костно-пластических вмешательств. Костная пластика в данном случае необходима для восполнения костной массы для направленной регенерации пораженного сегмента [1].
Несмотря на то, что в многочисленных публикациях аутопластику называют «золотым стандартом» костной трансплантации [2, 3, 4, 5, 6, 7, 8, 9], она зачастую не позволяет достичь удовлетворительного результата реконструкции кости в результате костно-пластического вмешательства. Поэтому предпочтения отдаются аллопластическим материалам [9, 10, 11], которые ряд авторов на сегодняшний день называют «золотым стандартом» в замещении костных дефектов [12].
Цель – на основании клинико-рентгенологических данных изучить эффективность пластического замещения резекционных дефектов после удаления доброкачественных опухолей и опухолеподобных поражений костей.
Материал и методы. В клинике травматологии и ортопедии ФГБОУ ВО «Астраханской государственный медицинский университет» МЗ РФ на базе ГБУЗ АО «Александро-Мариинская областная клиническая больница» и ГБУЗ АО «Областная детская клиническая больница им. Н.Н. Силищевой» с 1970 по 2017 гг. находилось на лечении 1755 больных в возрасте от 1 до 71 года, которым были выполнены различные резекции костей по поводу доброкачественных опухолей и опухолеподобных поражений. По гендерному признаку преобладали мужчины – 992 и 763 соответственно. В зависимости от нозологии были представлены: остеохондрома (костно-хрящевой экзостоз) – 900 (51,3%), хондрома – 184 (10,5%), солитарная киста – 134 (7,6%), метафизарный фиброзный дефект (неоссифицирующая фиброма) – 98 (5,6%), гигантоклеточная опухоль – 90 (5,1%), фиброзная дисплазия – 89 (5,1%), остеома – 71 (4,0%), остеоидная остеома – 61 (3,5%), аневризмальная киста – 59 (3,4%), юкстаартикулярная киста (внутрикостный ганглий) – 23 (1,3%), хондробластома – 8, хондромиксоидная фиброма – 8, эозинофильная гранулема – 7, оссифицирующий миозит – 7 и прочие – 16. (табл. 1). Больным проведены различные виды резекций кости (табл. 1): плоскостная (427), краевая (705), внутриочаговая (521), сегментарная (72), резекция суставного конца (17) и резекция проксимального отдела малоберцовой кости (13). После проведения плоскостной резекции (427 больных), сегментарной резекции ребра (23), лонной (1) и седалищной (1) костей и резекции проксимального отдела малоберцовой кости (13) костная пластика не требуется. 653 больным выполнено замещение резекционного дефекта, из которых у 586 проводилась аллопластика, 45 – аутопластика и 22 – пластика с использованием материала «ЛитАр» (ООО НПП «Сердолик», Россия).
Таблица 1.
Виды резекции кости в зависимости от нозологической принадлежности
Tab. 1
Types of bone resection depending on the nosological affiliation
| Нозологическая форма | Вид резекции кости | Кол-во | |||
| внутриочаговая | краевая | плоскостная | сегментарная | ||
| остеохондрома | – | 485 | 401 | 14 | 900 |
| хондрома | 134 | 29 | 8 | 13 | 184 |
| солитарная киста | 114 | 4 | – | 16 | 134 |
| метафизарный фиброзный дефект | 57 | 37 | – | 4 | 98 |
| гигантоклеточная опухоль | 61 | 4 | – | 25 | 90 |
| фиброзная дисплазия | 34 | 39 | – | 16 | 89 |
| остеома | – | 59 | 10 | 2 | 71 |
| остеоидная остеома | 18 | 38 | 1 | 4 | 61 |
| аневризмальная киста | 55 | – | – | 4 | 59 |
| юкстаартикулярная киста | 22 | 1 | – | – | 23 |
| хондробластома | 7 | – | – | 1 | 8 |
| хондромиксоидная фиброма | 6 | – | – | 2 | 8 |
| эозинофильная гранулема | 5 | 2 | – | – | 7 |
| оссифицирующий миозит | – | – | 7 | – | 7 |
| прочие | 8 | 7 | – | 1 | 16 |
| Итого | 521 | 705 | 427 | 102 | 1755 |
Результаты.
Внутриочаговая резекция кости показана при вовлечении в процесс более половины или всего диаметра кости с равномерным истончением кортикального слоя и веретенообразным вздутием диафиза или метадиафиза кости: энхондрома – 134 (25,7%), солитарная киста – 114 (21,9%), гигантоклеточная опухоль – 61 (11,7%), метафизарный фиброзный дефект – 57 (10,9%), аневризмальная киста – 55 (10,6%), фиброзная дисплазия – 35 (6,7%), юкстаартикулярная киста – 22 (4,2%), остеоидная остеома – 18 (3,5%), хондробластома – 7 (1,3%), хондромиксоидная фиброма – 6 (1,2%), эозинофильная гранулема – 5 (1%) и прочие – 8 (1,3%). Патологический очаг вскрывают, обрабатывают внутреннюю стенку кости, сначала очищая острыми ложечками от патологических тканей, затем фрезами до появления кровоточащей кости. Сохранение истонченной собственной костной стенки желательно, во-первых, как источника регенерации, а во-вторых, как опорного каркаса. Операция в 91,9% случаев завершается заполнением резекционного дефекта преимущественно короткими губчатыми или тонкими кортикальными трансплантатами. При внутриочаговой резекции применялись аллотрансплантаты – 432 (90%), аутотрансплантаты – 33 (6,9%) и ЛитАр – 15 (3,1%). Внутриочаговая резекция соответствует принципу сохранности, но не исключает инфекционных осложнений – нагноение послеоперационной раны отмечено в 0,8% и развитие остеомиелита – 1,9%. Кроме того, у двух пациентов был криз отторжения аллотрансплантатов (0,4%).
Наиболее востребованным видом резекции кости является краевая. Спектр нозологических форм, при которых она была применена, широк. Краевая резекция кости выполняется обычно при поражении патологическим процессом не более половины диаметра кости, когда часть ее стенки интактна с сохранением нормального кортикального слоя: остеохондрома (485 – 68,8%), остеома (59 – 8,4%), фиброзная дисплазия (39 – 5,4%), остеоидная остеома (38 – 5,4%), метафизарный фиброзный дефект (37 – 5,3%), периостеальная хондрома (29 – 4,3%) и прочие (18 – 2,4%). Границы очага деструкции определяются рентгенологически и визуально во время операции. Костная ткань вместе с очагом поражения удаляется на половину или на треть окружности. Образовавшийся дефект обрабатывается шаровидной фрезой. При краевой резекции пластическое замещение резекционного дефекта потребовалось в 16,5% случаев, который заполнялся преимущественно тонкими кортикальными трансплантатами. Нами применялись аллотрансплантаты – 102 (87,9%), аутотрансплантаты – 8 (6,9%) и ЛитАр – 15 (5,2%). После краевой резекции отмечено нагноение послеоперационной раны и развитие остеомиелита в 2,6% случаев.
Сегментарная резекция кости осуществляется при значительном очаге деструкции на протяжении диафиза кости с отсутствием четких границ и остеолизисе кортикальной пластинки, когда ни одну из ее стенок сохранить не представляется возможным. Во время операции резецируемый отдел кости широко обнажается поднадкостнично. Ее пораженный сегмент иссекают в пределах здоровых тканей. При локализации процесса на протяжении диафиза с целью восстановления оси сегмента конечности в его проксимальный и дистальный отдел плотно вводят массивный кортикальный аллотрансплантат, выполняющий роль внутрикостного фиксатора и соответствующий размерам костного канала. Этим достигается увеличение прочности кости на этапах перестройки трансплантатов и замедление темпов их рассасывания. Вокруг этого центрального трансплантата укладывают несколько тонких кортикальных аллотрансплантатов, восполняя дефект по типу «вязанки хвороста» М.В. Волкова. При сегментарной резекции малоберцовой кости 10 больным выполнена костная пластика: аллотрансплантатами у 9 больных и ЛитАром у одного; осложнений не отмечено. Сегментарные резекции ребра, лонной и седалищной кости не требуют костной пластики. При сегментарных резекциях других локализаций 30 пациентам выполнена костная пластика: аллотрансплантатами в 29 случаях и одному – аутопластическим материалом. После данных вмешательств отмечен хронический остеомиелит у 3 больных (10%) и у одного – нагноение послеоперационной раны (3,3%).
При агрессивной литической форме гигантоклеточной опухоли с внутрисуставным переломом и значительным повреждением суставного конца проведена резекция суставного конца кости с последующим костнопластическим артродезированием аутотрансплантатами у 3 и аллотрансплантатами – у 14 больных. Эта операция отличается травматичностью, длительным реабилитационным периодом и значительным снижением двигательной активности, но в то же время способствует восстановлению опорной функции конечности. У двух больных отмечено развитие хронического остеомиелита (11,8%) и у одного – криза отторжения массивного аллотрансплантата по типу «суставной конец».
Отмечено, что риск развития осложнения воспалительного характера увеличивается в зависимости от объема и вида выполненной резекции кости, т. е. травматичности хирургического вмешательства, длительности операции, способа костной пластики и количества пластического материала (табл. 2). Так, благоприятные результаты отмечены у больных после внутриочаговой резекции, где общий процент осложнений воспалительного характера составил 3,1%. После краевой резекции данный показатель увеличился до 5,2%, а при сегментарной резекции и резекции суставного конца достиг 13,3% и 17,7% соответственно.
Таблица 2.
Осложнения
Tab. 2
Complications
| Вид резекции кости | Кол-во резекций кости | Кол-во костно-пластических операций | Осложнения, связанные с костной пластикой | Общее количество и процент осложнений | ||||||
| нагноение раны | остеомиелит | криз отторжения | ||||||||
| абс | % | абс | % | абс | % | абс | % | |||
| Внутриочаговая | 521 | 480 | 4 | 0,8 | 9 | 1,9 | 2 | 0,4 | 15 | 3,1 |
| Краевая | 705 | 116 | 3 | 2,6 | 3 | 2,6 | – | 6 | 5,2 | |
| Сегментарная резекция | 30 | 30 | 1 | 3,3 | 3 | 10 | – | 4 | 13,3 | |
| Резекция суставного конца | 17 | 17 | – | 2 | 11,8 | 1 | 5,9 | 3 | 17,7 | |
| Итого | 1273* | 643** | 8 | 1,2 | 17 | 2,6 | 3 | 0,5 | 28 | 4,4 |
* Из расчета исключены больные, которым не требовалась костная пластика
** При учете осложнений не учитывались больные после сегментарной резекции малоберцовой кости (10), которым выполнена костная пластика и осложнений не отмечено.
Клинико-рентгенологическое обследование пациентов в сроки от 1 года до 15 лет показало, что перестройка кортикальных костных аллотрансплантатов продолжается в зависимости от возраста больных от 2 до 3 лет и завершается органотипической перестройкой с нормализацией структуры кости и формированием костномозговой полости (рис. 1). Перестройка губчатых аллотрансплантатов завершается к году после вмешательства с аналогичной рентгенологической картиной. Значительно медленнее перестраиваются костные аллогенные штифты, введенные интрамедуллярно. Вместе с тем, хотя трансплантаты еще не полностью перестроены, они находятся в интимной связи с восстанавливающейся костной структурой, прослеживаясь в течение 5 лет. Аллогенные трансплантаты в виде суставного конца перестраиваются крайне медленно.
Рисунок 1. Рентгенограммы больной Б., 12 лет с фиброзной дисплазией большеберцовой кости:
а – до операции; б – после краевой резекции и аллопластики;
в – через 1 год после операции; г – через 3 года после операции
Fig. 1
Radiographs of patient B., 12 years old, with fibrous dysplasia of the tibia:
a – before surgery; b — after marginal resection and alloplasty;
b – a year after surgery; d — 3 years after surgery
Выводы.
Бесспорно, что «золотым стандартом» костной пластики является аутопластика, но существенные недостатки в виде дополнительной инвазии для забора донорской кости, невозможности забора костной ткани в необходимом объеме, а иногда и нужной формы, не могут решить проблему полноценного замещения резекционного дефекта в ортопедической онкологии. Костная аллопластика остается перспективным и приоритетным направлением при хирургическом лечении больных с доброкачественными опухолями и опухолеподобными поражениями костей.