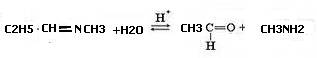аммиачно буферная смесь для чего
Аммиачная буферная система состоит из двух составных частей
Классифицируйте её по составу и природе компонентов.
Укажите интервал значений рН, внутри которого эта система обладает буферной емкостью.
Напишите уравнения реакций, отражающих механизм её действия (ионная форма).
Объясните, почему аммиачная буферная система не входит в состав крови
1.Состав и природа компонентов:
А)NН4ОН (NН3 х Н2О)-гидроксид аммония, слабый электролит
Б) NН4С1 – соль, хлорид аммония, сильный электролит.
При добавлении к раствору гидроксида аммония хлорида аммония, соль как сильный электролит практически полностью диссоциирует на ионы:
и подавляет диссоциацию основания, равновесие которого смещается в сторону обратной реакции.
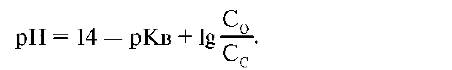
рН=14-4,74+lg(C0/Cc)=9,26+lg(C0/Cc). В зависимости от соотношения C0/Cc интервал значений рН составляет 8,26-10,26.
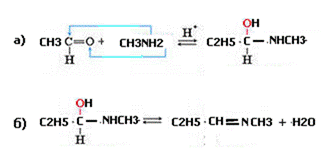
1. 3) Напишите схему реакции взаимодействия этаналя с метиламином.
Опишите механизм этой реакции.
Обоснуйте роль кислотного катализатора.
Объясните возможность протекания реакции гидролиза полученного имина в кислой и щелочной среде.
2.Механизм этой реакции –нуклеофильное присоединение с последующим отщеплением молекулы воды
3. Роль кислотного катализатора – протонирование на стадии а)
4. В присутствии разбавленных кислот иминыгидролизуются водой с образованием карбонильных соединений и аминов, эта реакция обратна реакции синтеза иминов:
В присутствии щелочи гидролиз не идет
Билет 4.
Классификация термодинамических систем
3. Открытые обмениваются с ОС как веществом, так и энергией(организм, открытый сосуд с кипящей водой)
4. Закрытый–обменивается с ОС только энергией в форме теплоты или работы (газ в закрытом балоне)
5. Изолированные— не обмениваются ни в-вом, ни энергии. В природа абсолютно изолированных нет.
По наличию поверхности раздела внутри ТС
1.Гомогенные – поверхность раздела отсутствует, все компоненты находятся водой фазе, все физические и химическиесв-ва в любой части объема одинаковы (смесь газов)
2. Гетерогенные-содержится поверхность раздела, отделяющие части системы(фазы) различны по св-вам (кровь)
Параметры–величины, определяющие состояния ТС
По возможности непосредственного измерения
Основные параметры-параметры, которые можно измерить с помощью соотв-х приборов (m, V, C,плотность, объем)
Можно определить изменение значений функции состояния
Термодинамическое состояние-совокупность значений некоторого числа физ. величин, характеризующих все физ и хм св-ва системы
Неравновесное- параметры меняются самопроизвольно(стакан с горячей водой)
Равновесное-параметры не меняются без внешних воздействий
Стационарное=постоянство параметров за счет внешних параметров (присуще жив организмам)
Процесс-переход системы из одного состояния я в другое, сопровождается изменениями термодинамических параметров.
Классификация-
по постоянству параметров:
B)Изобарные (давление- const)
C)изотермические( температура =const)
По знаку тепловому эффекта:экзотермические и эндотермические
По затрате Энергии: самопроизвольные, несамопроизвольные
По хар-ку протекания:-обратимые – протекают в прямом и обратном направлениях через одни и те же стадии, без изменений в окруж. среде.
-необратимые – все процессы не могут протекать в прямом и обратном направлениях через 1 и те же стадии.
Дата добавления: 2018-02-28 ; просмотров: 4044 ; Мы поможем в написании вашей работы!
Аммиачно буферный раствор зачем он нужен. Буферные системы, их классификация и механизм действия
В лабораторной практике часто приходится работать с растворами, которые имеют определенное значение рН. Такие растворы называют буферными.
Буферные растворы – растворы, рН которых практически не изменяется при добавлении к ним небольших количеств кислот и оснований или при их разбавлении.
Буферные растворы могут быть четырех типов:
1. Слабая кислота и её соль. Например, ацетатный буферный раствор СН 3 СООН + СН 3 СООNа (рН=4,7).
2. Слабое основание и его соль. Например, аммиачный буферный раствор NH 4 OH + NH 4 Cl (рН=9,2).
3. Раствор двух кислых солей. Например, фосфатный буферный раствор NaH 2 PO 4 + Na 2 HPO 4 (рН=8). В этом случае соль играет роль слабой кислоты.
Аминокислотные и белковые буферные растворы.
СН 3 СООNа + НСl = СН 3 СООН + NаСl
При добавлении к ацетатному буферному раствору щелочи (например, NaОН) происходит реакция:
СН 3 СООН + NaОН = СН 3 СООNа + Н 2 О
Буферная емкость – то предельное количество (моль) сильной кислоты или щелочи, которое можно добавить к 1 л буферного раствора, чтобы рН его изменился не более чем на единицу.
Буферные свойства проявляются очень слабо, если концентрация одного компонента в 10 раз и более отличается от концентрации другого. Поэтому буферные растворы часто готовят смешением растворов равной концентрации обоих компонентов либо прибавлением к раствору одного компонента соответствующего количества реагента, приводящего к образованию равной концентрации сопряженной формы.
Для приготовления аммиачной буферной смеси смешивают 100 мл раствора NH 4 Cl с массовой долей его 10% и 100 мл раствора NH 4 OH с массовой долей 10% и разбавляют полученную смесь дистиллированной водой до 1 л.
Буферные растворы широко применяются в химическом анализе, биохимическом анализе для создания и поддержания определенного значения рН среды при проведении реакций.
Например, ионы Ва 2+ отделяют от ионов Са 2+ осаждением дихромат-ионами Сr 2 О 7 2- в присутствии ацетатного буферного раствора; при определении многих катионов металлов с помощью трилона Б методом комплексонометрии используют аммиачный буферный раствор.
Глава 6. ПРОТОЛИТИЧЕСКИЕ БУФЕРНЫЕ СИСТЕМЫ
Глава 6. ПРОТОЛИТИЧЕСКИЕ БУФЕРНЫЕ СИСТЕМЫ
Изменение любого фактора, могущего влиять на состояние химического равновесия системы веществ, вызывает в ней реакцию, стремящуюся противодействовать производимому изменению.
6.1. БУФЕРНЫЕ СИСТЕМЫ. ОПРЕДЕЛЕНИЕ И ОБЩИЕ ПОЛОЖЕНИЯ ТЕОРИИ БУФЕРНЫХ СИСТЕМ. КЛАССИФИКАЦИЯ БУФЕРНЫХ СИСТЕМ
Системы, поддерживающие протолитический гомеостаз, включают в себя не только физиологические механизмы (легочная и почечная компенсация), но и физико-химическое буферное действие, ионный обмен, диффузию. Поддержание на заданном уровне кислотно-основного равновесия обеспечивается на молекулярном уровне действием буферных систем.
Протолитическими буферными системами называются растворы, сохраняющие постоянное значение pH как при добавлении кислот и щелочей, так и при разведении.
По принадлежности слабого электролита буферной системы к классу кислот или оснований и по типу заряженной частицы они делятся на три типа: кислотный, основной и амфолитный. Раствор, содержащий одну или несколько буферных систем, называется буферным раствором. Буферные растворы можно приготовить двумя способами:
Частичной нейтрализацией слабого электролита сильным электролитом:
Смешиванием растворов слабых электролитов с их солями (или двух солей): CH 3 COOH и CH 3 COONa; NH 3 и NH 4 Cl; NaH 2 PO 4
При совмещении двух изолированных равновесий (ионизации кислоты и гидролиза по аниону) оказывается, что процессы, которые в них будут протекать при воздействии одних и тех же внешних факторов (добавлении ионов гидроксония и гидроксид-ионов), разнонаправле-ны. Кроме того, концентрация одного из продуктов каждой из совмещенных реакций влияет на положение равновесия другой реакции.
Протолитическая буферная система представляет собой совмещенное равновесие процессов ионизации и гидролиза.
Уравнение буферной системы выражает зависимость pH буферного раствора от состава буферной системы:
Анализ уравнения показывает, что величина pH буферного раствора зависит от природы веществ, образующих буферную систему, соотношения концентрации компонентов и температуры (так как от нее зависит величина pKa).
Согласно протолитической теории, кислоты, основания и амфоли-ты являются протолитами.
6.2. ТИПЫ БУФЕРНЫХ СИСТЕМ
Буферные системы кислотного типа
Буферные системы амфолитного типа
6.3. МЕХАНИЗМ ДЕЙСТВИЯ БУФЕРНЫХ РАСТВОРОВ И ОПРЕДЕЛЕНИЕ PH В ЭТИХ РАСТВОРАХ. УРАВНЕНИЕ ГЕНДЕРСОНА-ХАССЕЛЬБАХА
Уравнение показывает, что концентрация ионов водорода находится в прямой зависимости от К И, α, концентрации кислоты С к и в обратной зависимости от С с и соотношения С к /С с. Логарифмируя обе части уравнения и взяв логарифм со знаком минус, получим уравнение в логарифмической форме:
Уравнение Гендерсона-Хассельбаха для буферных систем основного и амфолитного типов выводится на примере вывода уравнения для буферных систем кислотного типа.
Для буферной системы основного типа, например аммиачной, концентрацию катионов водорода в растворе можно рассчитать, исходя из константы кислотно-основного равновесия сопряженной кислоты
Уравнение Гендерсона-Хассельбаха для буферных систем основного типа:
Данное уравнение можно представить в виде:
6.4. ЕМКОСТЬ БУФЕРНЫХ РАСТВОРОВ И ОПРЕДЕЛЯЮЩИЕ ЕЕ ФАКТОРЫ
Способность растворов поддерживать постоянное значение pH небезгранична. Буферные смеси можно различить по силе оказываемого ими сопротивления по отношению к действию кислот и оснований, вводимых в буферный раствор.
Количество кислоты или щелочи, которое нужно добавить к 1 л буферного раствора, чтобы значение его pH изменилось на единицу, называют буферной емкостью.
Таким образом, буферная емкость является количественной мерой буферного действия раствора. Буферный раствор имеет максимальную буферную емкость при pH = pK кислоты или основания, образующей смесь при соотношении ее компонентов, равном единице. Чем выше исходная концентрация буферной смеси, тем выше ее буферная емкость. Буферная емкость зависит от состава буферного раствора, концентрации и соотношения компонентов.
Нужно уметь правильно выбрать буферную систему. Выбор определяется необходимым интервалом pH. Зона буферного действия определяется силовым показателем кислоты (основания) ±1 ед.
При выборе буферной смеси необходимо учитывать химическую природу ее компонентов, так как вещества раствора, к которым добав-
ляется буферная система, могут образовывать нерастворимые соединения, взаимодействовать с компонентами буферной системы.
6.5. БУФЕРНЫЕ СИСТЕМЫ КРОВИ
Кровь содержит 4 основные буферные системы.
2.Белковая. На ее долю приходится 7% емкости.
3.Гемоглобиновая, на нее приходится 35% емкости. Она представлена гемоглобином и оксигемоглобином.
Гидратация и дегидратация СО 2 катализируется ферментом карбо-ангидразой, которая имеется в эритроцитах.
Основания также связываются буферным раствором крови и выделяются с мочой, главным образом в виде одно- и двузамещенных фосфатов.
В клиниках всегда определяют резервную щелочность крови.
6.6. ВОПРОСЫ И УПРАЖНЕНИЯ ДЛЯ САМОПРОВЕРКИ ПОДГОТОВЛЕННОСТИ К ЗАНЯТИЯМ И ЭКЗАМЕНАМ
1.При совмещении каких протолитических равновесий растворы будут обладать буферными свойствами?
2.Дать понятие о буферных системах и буферном действии. Каков химизм буферного действия?
3.Основные типы буферных растворов. Механизм их буферного действия и уравнение Гендерсона-Хассельбаха, определяющее pH в буферных системах.
4.Основные буферные системы организма и их взаимосвязь. От чего зависит pH буферных систем?
5.Что называют буферной емкостью буферной системы? Какая из буферных систем крови обладает наибольшей емкостью?
6.Способы получения буферных растворов.
7.Выбор буферных растворов для медико-биологических исследований.
6.7. ТЕСТОВЫЕ ЗАДАНИЯ
1. Какая из предложенных систем является буферной?
б)H 2 SO 4 и NaHSO 4 ;
в)H 2 CO 3 и NaHCO 3 ;
2. Для какой из предложенных буферных систем соответствует расчетная формула pH = рК?
а)0,1 М р-р NaH 2 PO 4 и 0,1 М р-р Na 2 HPO 4 ;
б)0,2 М р-р H 2 CO 3 и 0,3 М р-р NaHCO 3 ;
в)0,4 М р-р NH 4 OH и 0,3 М р-р NH 4 Cl;
г)0,5 М р-р СН 3 СООН и 0,8 М р-р CH 3 COONa;
3. Какая из предложенных буферных систем является бикарбонатной буферной системой?
а) NH 4 OH и NH 4 Cl;
б)Н 2 СО 3 и КНСО 3 ;
в)NaH 2 PO 4 и Na 2 HPO 4 ;
г)СН 3 СOOН и СН 3 СООК;
4. При каких условиях pH буферной системы равна рК к?
а)когда равны концентрация кислоты и ее соли;
б)когда не равны концентрация кислоты и ее соли;
в)когда соотношение объемов кислоты и ее соли равно 0,5;
г)когда соотношение объемов кислоты и ее соли при одинаковых концентрациях не равно;
д)когда концентрация кислоты больше концентрации соли в 2 раза.
5. Какая из предложенных формул подойдет для расчета [Н+], для системы СН 3 СООН и СН 3 СOOК?
6. Какая из ниже перечисленных смесей входит в состав буферной системы организма?
в)NH 4 OH и NH 4 Cl;
г)H 2 CO 3 и NaНСО 3 ;
7. К какому типу кислотно-основных буферных систем относится белковый буфер?
а)слабая кислота и ее анион;
в)анионы 2 кислых солей;
д)ионы и молекулы амфолитов.
8. К какому типу кислотно-основных буферных систем относится аммиачный буфер?
а)слабая кислота и ее анион;
б)анионы кислой и средней соли;
в)анионы 2 кислых солей;
г)слабое основание и его катион;
д)ионы и молекулы амфолитов.
9. К какому типу кислотно-основных буферных систем относится фосфатный буфер?
а)слабая кислота и ее анион;
б)анионы кислой и средней соли;
в)анионы 2 кислых солей;
г)слабое основание и его катион;
д)ионы и молекулы амфолитов.
10. Когда белковая буферная система не является буфером?
а)в изоэлектрической точке;
б)при добавлении щелочи;
в)при добавлении кислоты;
г)в нейтральной среде.
Классификация буферных растворов
Различают естественные и искусственные буферные растворы. Естественным буферным раствором является кровь, содержащая гидрокарбонатную, фосфатную, белковую, гемоглобиновую и кислотную буферные системы. Искусственным буферным раствором может быть ацетатный буфер, состоящий из СН3СООН.
Буферные системы могут быть четырех типов:
1) Слабая кислота и ее анион:
Например: ацетатная буферная система
2) Слабое основание и его катион:
Например: аммиачная буферная система
3) Анионы кислой и средней соли:
Например: карбонатная буферная система
4) Смесь двух кислых солей:
Например: фосфатная буферная система
Механизм действия буферных растворов
Разберемся, на чем основаны свойства буферных растворов, на примере буферной смеси уксусной кислоты и ацетата натрия.
1) Разбавление водой
Предположим, что рассматриваемый раствор разбавляют водой в 10 или в 20 раз. Казалось бы, вследствие сильного уменьшения концентрации уксусной кислоты концентрация ионов Н + должна уменьшиться, но этого не происходит, потому что с разбавлением увеличивается степень диссоциации уксусной кислоты, так как уменьшается концентрация ацетата натрия, подавляющего диссоциацию уксусной кислоты этого раствора. Следовательно, при разбавлении водой рН практически не изменится.
2) Прибавление сильной кислоты
При добавлении к буферной смеси небольшого количества сильной кислоты, например, соляной, происходит реакция:
CH 3 COONa + НСl = NaCl + СН 3 СООН.
3) Прибавление небольшого количества щелочи
Прибавленная в буферную смесь щелочь вступает в реакцию с уксусной кислотой:
СН 3 СООН + NaOH = CH 3 COONa + Н 2 O.
Буферные системы (смеси или растворы) по составу бывают двух основных типов :
а) из слабой кислоты и ее соли, образованной сильным основанием;
б) из слабого основания и его соли, образованной сильной кислотой.
, образующиеся при диссоциации этой соли, будут оказывать некоторое Угнетающее действие на диссоциацию уксусной кислоты.
Буферные растворы в зависимости от своего состава делятся на 2 основных типа: кислотные и основные.
31.Емкость буферных растворов и факторы, определяющие её. Буферные системы крови. Водородкарбонатный буфер. Фосфатный буфер.
Способность растворов поддерживать постоянное значение pH небезгранична. Буферные смеси можно различить по силе оказываемого ими сопротивления по отношению к действию кислот и оснований, вводимых в буферный раствор.
Количество кислоты или щелочи, которое нужно добавить к 1 л буферного раствора, чтобы значение его pH изменилось на единицу, называют буферной емкостью.
Таким образом, буферная емкость является количественной мерой буферного действия раствора. Буферный раствор имеет максимальную буферную емкость при pH = pK кислоты или основания, образующей смесь при соотношении ее компонентов, равном единице. Чем выше исходная концентрация буферной смеси, тем выше ее буферная емкость. Буферная емкость зависит от состава буферного раствора, концентрации и соотношения компонентов.
Нужно уметь правильно выбрать буферную систему. Выбор определяется необходимым интервалом pH. Зона буферного действия определяется силовым показателем кислоты (основания) ±1 ед.
При выборе буферной смеси необходимо учитывать химическую природу ее компонентов, так как вещества раствора, к которым добав-
ляется буферная система, могут образовывать нерастворимые соединения, взаимодействовать с компонентами буферной системы.
Классифицируйте её по составу и природе компонентов.
Укажите интервал значений рН, внутри которого эта система обладает буферной емкостью.
Напишите уравнения реакций, отражающих механизм её действия (ионная форма).
1.Состав и природа компонентов:
А)NН 4 ОН (NН 3 х Н 2 О)-гидроксид аммония, слабый электролит
Б) NН 4 С1 – соль, хлорид аммония, сильный электролит.
При добавлении к раствору гидроксида аммония хлорида аммония, соль как сильный электролит практически полностью диссоциирует на ионы:
NН 4 С1 > NН 4 + + С1-
и подавляет диссоциацию основания, равновесие которого смещается в сторону обратной реакции.
рН=14-4,74+lg(C 0 /Cc)=9,26+lg(C 0 /Cc). В зависимости от соотношения C 0 /Cc интервал значений рН составляет 8,26-10,26.
NH 4 OH+H + =NH 4 + +H 2 O
1. 3) Напишите схему реакции взаимодействия этаналя с метиламином.
Опишите механизм этой реакции.
Обоснуйте роль кислотного катализатора.
Объясните возможность протекания реакции гидролиза полученного имина в кислой и щелочной среде.
2.Механизм этой реакции –нуклеофильное присоединение с последующим отщеплением молекулы воды
3. Роль кислотного катализатора – протонирование на стадии а)
4. В присутствии разбавленных кислот иминыгидролизуются водой с образованием карбонильных соединений и аминов, эта реакция обратна реакции синтеза иминов:
В присутствии щелочи гидролиз не идет
Классификация термодинамических систем
3. Открытые обмениваются с ОС как веществом, так и энергией(организм, открытый сосуд с кипящей водой)
4. Закрытый –обменивается с ОС только энергией в форме теплоты или работы (газ в закрытом балоне)
По наличию поверхности раздела внутри ТС
1.Гомогенные – поверхность раздела отсутствует, все компоненты находятся водой фазе, все физические и химическиесв-ва в любой части объема одинаковы (смесь газов)
Параметры –величины, определяющие состояния ТС
По возможности непосредственного измерения
Основные параметры-параметры, которые можно измерить с помощью соотв-х приборов (m, V, C,плотность, объем)
Можно определить изменение значений функции состояния
Неравновесное- параметры меняются самопроизвольно(стакан с горячей водой)
Равновесное-параметры не меняются без внешних воздействий
Стационарное=постоянство параметров за счет внешних параметров (присуще жив организмам)
по постоянству параметров:
B)Изобарные (давление- const)
По знаку тепловому эффекта: экзотермические и эндотермические
По затрате Энергии : самопроизвольные, несамопроизвольные
Необратимые – все процессы не могут протекать в прямом и обратном направлениях через 1 и те же стадии.
Буферные растворы (ОФС.1.3.0003.15). Приготовление
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Буферные растворы (ОФС.1.3.0003.15)
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
ОФС.1.3.0003.15 Буферные растворы
Взамен ГФ XII, ч.1, ОФС 42-0072-07
Успешное выполнение многих фармакопейных испытаний и методик количественного и качественного анализа требует регулирования или поддержания на определённом уровне величины рН с помощью буферных растворов.
Буферные растворы – растворы с определённой концентрацией водородных ионов (pH), содержащие сопряжённую кислотно-основную пару, обеспечивающую устойчивость величины их водородного показателя при незначительном изменении концентрации, либо при добавлении небольшого количества кислоты или основания.
Забуференные растворы ‒ это системы, в которых конкретный ион находится в равновесии с веществами, способными связывать или высвобождать этот ион. Забуференные растворы способны сохранять активность определенного иона при добавлении веществ, которые, как ожидается, могут изменять активность этого иона.
В фармакопейном анализе применяют кислотные буферные системы (раствор слабой кислоты и ее соли) и основные буферные системы (раствор слабого основания и его соли). рН таких смесей мало меняется при разбавлении в довольно широких пределах (1:100), а также при добавлении небольших количеств сильных кислот или оснований.
Буферный раствор характеризуется значением создаваемого рН и буферной емкостью. Буферная емкость системы определяется количеством моль кислоты или основания (в грамм-эквивалентах на 1 л), добавление которых изменяет рН 1 л (дм 3 ) буферного раствора на 1 единицу рН. Емкость буферного раствора регулируется концентрацией буферных веществ.
Буферные растворы используются для установления и поддержания активности иона в узком диапазоне рН.
Буферные растворы используются в основном:
Компоненты буферной системы для целей химического анализа должны сочетаться с определяемым веществом и используемыми реактивами. Буферные и забуференные растворы готовят на воде очищенной. Также можно использовать воду дистиллированную и воду для хроматографии. Буферные и забуференные растворы после приготовления следует тщательно перемешать.
Забуференный ацетоновый раствор
8,15 г натрия ацетата и 42,0 г натрия хлорида растворяют в воде, прибавляют 68,0 мл 0,1 М раствора хлористоводородной кислоты, 150 мл ацетона и доводят объём раствора водой до 500,0 мл.
Буферный раствор рН 2,0
6,57 г калия хлорида растворяют в воде, прибавляют 119,0 мл 0,1 М раствора хлористоводородной кислоты и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 2,0
8,95 г динатрия гидрофосфата и 3,40 г калия дигидрофосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл. Доводят рН до 2,0 потенциометрически с помощью фосфорной кислоты концентрированной.
Сульфатный буферный раствор рН 2,0
132,1 г аммония сульфата растворяют в воде, доводят объём раствора водой до 500,0 мл (раствор I).
Осторожно при постоянном охлаждении и перемешивании прибавляют 14 мл серной кислоты концентрированной к 400,0 мл воды; охлаждают и доводят объём раствора водой до 500,0 мл (раствор II).
Смешивают равные объёмы растворов I и II; если необходимо, доводят рН до 2,0 потенциометрически раствором I или II.
Буферный раствор рН 2,5
100,0 г калия дигидрофосфата растворяют в 800 мл воды, доводят рН до 2,5 потенциометрически с помощью хлористоводородной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
Буферный раствор рН 2,5 (1)
4,9 г фосфорной кислоты разведённой 10 % смешивают с 250 мл воды, доводят рН до 2,5 потенциометрически с помощью раствора натрия гидроксида разведённого 8,5 % и доводят объём раствора водой до 500,0 мл.
Буферный раствор рН 3,0
21,0 г лимонной кислоты растворяют в 200,0 мл 1 М раствора натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
40,3 мл полученного раствора доводят 0,1 М раствором хлористоводородной кислоты до 100,0 мл.
0,25 М цитратный буферный раствор рН 3,0
4,8 г лимонной кислоты растворяют в 80,0 мл воды. Доводят рН до 3,0 потенциометрически с помощью 1 М раствора натрия гидроксида и доводят объём раствора водой до 100,0 мл.
0,1 М фосфатный буферный раствор рН 3,0
12,0 г натрия дигидрофосфата безводного растворяют в воде. Доводят рН до 3,0 потенциометрически с помощью фосфорной кислоты разведённой 10 % и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 3,0
0,7 мл фосфорной кислоты концентрированной смешивают с 100 мл воды и доводят объём раствора водой до 900,0 мл. Доводят рН до 3,0 с помощью раствора натрия гидроксида концентрированного и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 3,0 (1)
3,40 г калия дигидрофосфата растворяют в 900 мл воды. Доводят рН до 3,0 потенциометрически с помощью фосфорной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 3,2
900,0 мл 4 г/л раствора натрия дигидрофосфата смешивают с 100 мл 2,5 г/л раствора фосфорной кислоты концентрированной. Если необходимо, доводят рН до 3,2 потенциометрически раствором натрия дигидрофосфата или фосфорной кислоты концентрированной.
Фосфатный буферный раствор рН 3,2 (1)
Доводят рН до 3,2 потенциометрически для 35,8 г/л раствора динатрия гидрофосфата c помощью фосфорной кислоты разведённой 10 %.
100,0 мл полученного раствор доводят водой до объема 2000,0 мл.
Буферный раствор рН 3,5
25,0 г аммония ацетата растворяют в 25,0 мл воды, прибавляют 38,0 мл 25 % хлористоводородной кислоты. Если необходимо, доводят рН до 3,5 потенциометрически с помощью хлористоводородной кислоты разведённой 7,3 % или 10% раствора аммиака и доводят объём раствора водой до 100,0 мл.
Фосфатный буферный раствор рН 3,5
68,0 г калия дигидрофосфата растворяют в воде, доводят рН до 3,5 потенциометрически с помощью фосфорной кислоты концентрированной. Доводят объём раствора водой до 1000,0 мл.
Буферный раствор рН 3,6
250,0 мл 0,2 М раствора калия гидрофталата смешивают с 11,94 мл 0,2 М рас-твора хлористоводородной кислоты и доводят объём раствора водой до 1000,0 мл.
Буферный раствор рН 3,7
15,0 мл уксусной кислоты разведенной 30 % смешивают с 60,0 мл спирта 96 % и 20,0 мл воды. Доводят рН до 3,7 потенциометрически с помощью раствора аммиака и доводят объём раствора водой до 100,0 мл.
Забуференный раствор меди сульфата рН 4,0
0,25 г меди (II) сульфата и 4,5 г аммония ацетата растворяют в уксусной кислоте разведённой 12 % и доводят объём раствора тем же растворителем до 100,0 мл.
Ацетатный буферный раствор рН 4,4
136,0 г натрия ацетата и 77,0 г аммония ацетата растворяют в воде и доводят объём раствора водой до 1000,0 мл; прибавляют 250,0 мл уксусной кислоты ледяной и перемешивают.
Фталатный буферный раствор рН 4,4
2,042 г калия гидрофталата растворяют в 50,0 мл воды, прибавляют 7,5 мл
0,2 М раствора натрия гидроксида и доводят водой до объёма 200,0 мл.
0,05 М фосфатный буферный раствор рН 4,5
6,80 г калия дигидрофосфата растворяют в 1000,0 мл воды.
Ацетатный буферный раствор рН 4,5
77,1 г аммония ацетата растворяют в воде, прибавляют 70,0 мл уксусной кислоты ледяной и доводят объём раствора водой до 1000,0 мл.
Натрия ацетатный буферный раствор рН 4,5
63,0 г натрия ацетата безводного растворяют в воде, прибавляют 90,0 мл уксусной кислоты разведенной 30 %. Доводят рН до 4,5 потенциометрически уксусной кислотой разведённой 30% и доводят объём раствора водой до 1000,0 мл.
Ацетатный буферный раствор рН 4,6
5,4 г натрия ацетата растворяют в 50,0 мл воды, прибавляют 2,4 г уксусной кислоты ледяной и доводят объём раствора водой до 100,0 мл; если необходимо, доводят рН до 4,6 потенциометрически уксусной кислотой ледяной.
Сукцинатный буферный раствор рН 4,6
11,8 г янтарной кислоты растворяют в смеси 600,0 мл воды и 82,0 мл 1 М раствора натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Ацетатный буферный раствор рН 4,7
136,1 г натрия ацетата растворяют в 500,0 мл воды. 250,0 мл полученного раствора смешивают с 250,0 мл уксусной кислоты разведённой 12 %. Встряхивают дважды со свежеприготовленным отфильтрованным 0,1 г/л раствором дитизона в хлороформе. Встряхивают с углерода тетрахлоридом до обесцвечивания экстракта. Водный слой фильтруют для удаления следов углерода тетрахлорида.
Ацетатный буферный раствор рН 5,0
К 120,0 мл 6,0 г/л раствора уксусной кислоты ледяной прибавляют 100,0 мл 0,1 М раствора калия гидроксида и 250,0 мл воды, перемешивают. Доводят рН до 5,0 потенциометрически с помощью 6 г/л раствора уксусной кислоты ледяной или 0,1 М раствора калия гидроксида и доводят объём раствора водой до 1000,0 мл.
Цитратный буферный раствор рН 5,0
20,1 г лимонной кислоты и 8,0 г натрия гидроксида растворяют в воде и доводят объём раствора водой до 1000,0 мл. Доводят рН до 5,0 потенциометрически с помощью хлористоводородной кислоты разведённой 7,3 %.
Фосфатный буферный раствор рН 5,0
2,72 г калия дигидрофосфата растворяют в 800,0 мл воды. Доводят рН до 5,0 потенциометрически с помощью 1 М раствора калия гидроксида и доводят объём раствора водой до 1000,0 мл.
Буферный раствор рН 5,2
1,02 г калия гидрофталата растворяют в 30,0 мл 0,1 М раствора натрия гидроксида и доводят объём раствора водой до 100,0 мл.
0,067 М фосфатный буферный раствор рН 5,4
Смешивают необходимые объёмы 23,99 г/л раствора динатрия гидрофосфата и 9,12 г/л раствора натрия дигидрофосфата моногидрата, чтобы получить рН 5,4. Доводят рН до 5,4 потенциометрически.
Буферный раствор рН 5,5
54,4 г натрия ацетата растворяют в 50,0 мл воды, если необходимо, нагревают до температуры 35 С. После охлаждения полученного раствора к нему медленно приливают 10,0 мл уксусной кислоты безводной, перемешивают и доводят объём раствора водой до 100,0 мл.
Ацетатно-эдетатный буферный раствор рН 5,5
250,0 г аммония ацетата и 15,0 г натрия эдетата растворяют в 400,0 мл воды и прибавляют 125,0 мл уксусной кислоты ледяной.
Фосфатный буферный раствор рН 5,5
Раствор I. 13,61 г калия дигидрофосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Раствор II. 35,81 г динатрия гидрофосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Смешивают 96,4 мл раствора I и 3,6 мл раствора II.
Фосфатно-цитратный буферный раствор рН 5,5
56,85 мл 28,4 г/л раствора динатрия гидрофосфата безводного смешивают с 43,15 мл 21,0 г/л раствора лимонной кислоты.
Фосфатный буферный раствор рН 5,8
1,19 г динатрия гидрофосфата дигидрата и 8,25 г калия дигидрофосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Ацетатный буферный раствор рН 6,0
100,0 г аммония ацетата растворяют в 300,0 мл воды, приливают 4,1 мл уксусной кислоты ледяной. Если необходимо, доводят рН до 6,0 с помощью раствора аммиака или уксусной кислоты разведенной 30 % и доводят объём раствора водой до 500,0 мл.
Диэтиламмония фосфата буферный раствор рН 6,0
68,0 мл фосфорной кислоты концентрированной осторожно разбавляют водой до 500,0 мл. 25,0 мл полученного раствора смешивают с 450,0 мл воды и 6,0 мл диэтиламина. Если необходимо, доводят рН до (6 0,05) потенциометрически с помощью диэтиламина или кислоты фосфорной концентрированной и доводят объём раствора водой до 500,0 мл.
Фосфатный буферный раствор рН 6,0
63,2 мл 71,5 г/л раствора динатрия гидрофосфата смешивают с 36,8 мл 21 г/л раствора лимонной кислоты.
Фосфатный буферный раствор рН 6,0 (1)
6,8 г натрия дигидрофосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл. Доводят рН до 6,0 потенциометрически с помощью раствора натрия гидроксида концентрированного.
Фосфатный буферный раствор рН 6,0 (2)
250,0 мл 0,2 М раствора калия дигидрофосфата смешивают с 28,5 мл 0,2 М раствора натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 6,4
2,5 г динатрия гидрофосфата, 2,5 г натрия дигидрофосфата и 8,2 г натрия хлорида растворяют в 950,0 мл воды. Если необходимо, доводят рН до 6,4 потенциометрически с помощью 1 М раствора натрия гидроксида или 1 М раствора хлористоводородной кислоты и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 6,4 (1)
1,79 г динатрия гидрофосфата, 1,36 г калия дигидрофосфата и 7,02 г натрия хлорида растворяют в воде и доводят объём раствора водой до 1000,0 мл.
0,5 М фталатный буферный раствор рН 6,4
100,0 г калия гидрофталата растворяют в воде и доводят объём раствора водой до 1000,0 мл. Доводят рН до 6,4 потенциометрически с помощью раствора натрия гидроксида концентрированного.
Буферный раствор рН 6,5
60,5 г динатрия гидрофосфата и 46,0 г калия дигидрофосфата растворяют в воде, прибавляют 100,0 мл 0,02 М раствора натрия эдетата, 20 мг ртути (II) хлорида и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 6,5
2,75 г натрия дигидрофосфата и 4,5 г натрия хлорида растворяют в 500 мл воды. Доводят рН до 6,5 потенциометрически с помощью фосфатного буферного раствора рН 8,5.
0,1 М фосфатный буферный раствор рН 6,5
13,80 г натрия дигидрофосфата моногидрата растворяют в 900,0 мл воды. Доводят рН до 6,5 потенциометрически с помощью раствора натрия гидроксида концентрированного и доводят объём раствора водой до 1000,0 мл.
Имидазольный буферный раствор рН 6,5
6,81 г имидазола, 1,23 г магния сульфата и 0,73 г кальция сульфата растворяют в 752 мл 0,1 М раствора хлористоводородной кислоты. Если необходимо, доводят рН до 6,5 потенциометрически 0,1 М раствором хлористоводородной кислоты и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 6,6
250,0 мл 0,2 М раствора калия дигидрофосфата смешивают с 89,0 мл 0,2 М раствора натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Фосфатный забуференный физиологический раствор рН 6,8
1,0 г калия дигидрофосфата, 2,0 г дикалия гидрофосфата и 8,5 г натрия хлорида растворяют в 900 мл воды. Если необходимо, доводят рН до 6,8 потенциометрически 0,1 М раствором хлористоводородной кислоты или 0,1 М раствором натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 6,8
77,3 мл 71,5 г/л раствора динатрия гидрофосфата смешивают с 22,7 мл 21 г/л раствора лимонной кислоты.
Фосфатный буферный раствор рН 6,8 (1)
51,0 мл 27,2 г/л раствора калия дигидрофосфата смешивают с 49,0 мл 71,6 г/л раствора динатрия гидрофосфата. Если необходимо, доводят рН до 6,8 потенциометрически исходным раствором калия дигидрофосфата или динатрия гидрофосфата.
Хранят при температуре от 2 до 8 ºС.
1 М трис-гидрохлорида буферный раствор рН 6,8
60,6 г трис(гидроксиметил)аминометана растворяют в 400 мл воды, доводят рН до 6,8 потенциометрически с помощью хлористоводородной кислоты концентрированной и доводят объём раствора водой до 500,0 мл.
Малеатный буферный раствор рН 7,0
10,0 г натрия хлорида, 6,06 г трис(гидроксиметил)аминометана и 4,90 г малеинового ангидрида растворяют в 900,0 мл воды. Доводят рН до 7,0 потенциометрически с помощью 170 г/л раствора натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Хранят при температуре от 2 до 8 ºС.
Фосфатный буферный раствор рН 7,0
82,4 мл 71,5 г/л раствора динатрия гидрофосфата смешивают с 17,6 мл 21 г/л раствора лимонной кислоты.
Фосфатный буферный раствор рН 7,0 (1)
250,0 мл 0,2 М раствора калия дигидрофосфата смешивают со 148,2 мл 8 г/л раствора натрия гидроксида. Если необходимо, доводят рН до 7,0 потенциометрически исходным раствором калия дигидрофосфата или натрия гидроксида и доводят объём раствора водой до 1000,0мл.
Фосфатный буферный раствор рН 7,0 (2)
50,0 мл 136 г/л раствора калия дигидрофосфата смешивают с 29,5 мл 1 М раствора натрия гидроксида, доводят объём раствора водой до 100,0 мл. Доводят рН до 7,0 потенциометрически исходным раствором калия дигидрофосфата или натрия гидроксида.
Фосфатный буферный раствор рН 7,0 (3)
5,0 г калия дигидрофосфата и 11,0 г дикалия гидрофосфата растворяют в 900,0 мл воды. Доводят рН до 7,0 потенциометрически с помощью фосфорной кислоты разведённой 10 % или раствора натрия гидроксида разведённого 8,5 % и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 7,0 (4)
28,4 г динатрия гидрофосфата безводного и 18,2 г калия дигидрофосфата растворяют в воде и доводят объём раствора водой до 500,0 мл.
Фосфатный буферный раствор рН 7,0 (5)
28,4 г динатрия гидрофосфата безводного растворяют в 800,0 мл воды. Доводят рН до 7,0 потенциометрически с помощью 30 % раствора фосфорной кислоты и доводят объём раствора водой до 1000,0 мл.
0,025 М фосфатный буферный раствор рН 7,0
1 объём 0,063 М фосфатного буфера рН 7,0 смешивают с 1,5 объёмами воды.
0,03 М фосфатный буферный раствор рН 7,0
5,2 г дикалия гидрофосфата растворяют в 900,0 мл воды. Доводят рН до 7,0 с помощью фосфорной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
0,063 М фосфатный буферный раствор рН 7,0
5,18 г динатрия гидрофосфата безводного и 3,65 г натрия дигидрофосфата моногидрата растворяют в 950,0 мл воды. Доводят рН до 7,0 потенциометрически с помощью фосфорной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
0,067 фосфатный буферный раствор рН 7,0
Раствор I. 0,908 г калия дигидрофосфата растворяют в воде и доводят объём раствора водой до 100,0 мл.
Раствор II. 2,38 г динатрия гидрофосфата растворяют в воде и доводят объём раствора водой до 100,0 мл.
38,9 мл раствора I смешивают с 61,1 мл раствора II; если необходимо, доводят рН до 7,0 потенциометрически раствором I или II.
0,1 М фосфатный буферный раствор рН 7,0
1,361 г калия дигидрофосфата растворяют в воде и доводят объём раствора водой до 100,0 мл. Доводят рН до 7,0 потенциометрически с помощью 35 г/л раствора динатрия гидрофосфата
Тетрабутиламмония буферный раствор рН 7,0
6,16 г аммония ацетата растворяют в смеси 15,0 мл 400 г/л раствора тетрабутиламмония гидроксида и 185,0 мл воды. Если необходимо, доводят рН до 7,0 потенциометрически с помощью азотной кислоты концентрированной.
Буферный раствор рН 7,2
250,0 мл 0,2 М раствора калия дигидрофосфата смешивают с 175,0 мл 0,2 М раствора натрия гидроксида. Доводят рН до 7,2 потенциометрически 0,2 М раствором калия дигидрофосфата или 0,2 М раствором натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 7,2
87,0 мл 71,5 г/л раствора динатрия гидрофосфата смешивают с 13,0 мл 21 г/л раствора лимонной кислоты.
Забуференный солевой раствор рН 7,2
8,0 г натрия хлорида, 0,2 г калия хлорида, 0,1 г кальция хлорида безводного, 0,1 г магния хлорида, 3,18 г динатрия гидрофосфата и 0,2 г калия дигидрофосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Фосфатно-альбуминовый забуференный физиологический раствор рН 7,2
10,75 г динатрия гидрофосфата, 7,6 г натрия хлорида и 10,0 г альбумина бычьего растворяют в воде и доводят объём раствора водой до 1000,0 мл. Непосредственно перед использованием доводят рН до 7,2 потенциометрически с помощью раствора натрия гидроксида разведённого 8,5 % или фосфорной кислоты разведённой 10 %.
Фосфатно–альбуминовый забуференный физиологический раствор рН 7,2 (1)
10,75 г динатрия гидрофосфата, 7,6 г натрия хлорида, 1,0 г альбумина бычьего растворяют в воде и доводят объём раствора водой до 1000,0 мл. Непосредственно перед использованием доводят рН до 7,2 потенциометрически с помощью раствора натрия гидроксида разведённого 8,5 % или фосфорной кислоты разведённой 10 %.
Имидазольный буферный раствор рН 7,3
3,4 г имидазола и 5,8 г натрия хлорида растворяют в воде, приливают 18,6 мл 1 М раствора хлористоводородной кислоты и доводят объём раствора водой до 1000,0 мл; если необходимо, доводят рН до 7,3 потенциометрически 1 М раствором хлористоводородной кислоты.
Буферный раствор рН 7,4
0,6 г калия дигидрофосфата, 6,4 г динатрия гидрофосфата и 5,85 г натрия хлорида растворяют в воде, если необходимо, доводят рН до 7,4 потенциометрически 0,1 М раствором хлористоводородной кислоты или 0,1 М раствором натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Барбитал-буферный раствор рН 7,4
50,0 мл раствора, содержащего 19,44 г/л натрия ацетата и 29,46 г/л барбитал-натрия, смешивают с 50,5 мл 0,1 М раствора хлористоводородной кислоты, прибавляют 20,0 мл 85 г/л раствора натрия хлорида и доводят объём раствора водой до 250,0 мл.
Фосфатный буферный раствор рН 7,4
393,4 мл 0,1 М раствора натрия гидроксида смешивают с 250,0 мл 0,2 М раствора калия дигидрофосфата.
Трис(гидроксиметил)аминометана – натрия хлорида буферный раствор рН 7,4
6,08 г трис(гидроксиметил)аминометана и 8,77 г натрия хлорида растворяют в 500 мл воды, прибавляют 10,0 г альбумина бычьего. Доводят рН до 7,4 потенциометрически с помощью хлористоводородной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
Трис – натрия ацетата буферный раствор рН 7,4
6,3 г трис(гидроксиметил)аминометана и 4,9 г натрия ацетата безводного растворяют в 900,0 мл воды. Доводят рН до 7,4 с помощью серной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
Трис – натрия ацетата – натрия хлорида буферный раствор рН 7,4
30,0 г трис(гидроксиметил)аминометана, 14,5 г натрия ацетата безводного, 14,6 г натрия хлорида растворяют в 900,0 мл воды и прибавляют 0,50 г альбумина бычьего. Доводят рН до 7,4 потенциометрически с помощью серной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
Фосфатный забуференный физиологический раствор рН 7,4
2,38 г динатрия гидрофосфата, 0,19 г калия дигидрофосфата и 8,0 г натрия хлорида растворяют в воде, если необходимо, доводят рН до 7,4 потенциометрически 0,1 М раствором хлористоводородной кислоты или 0,1 М раствором натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Боратный буферный раствор рН 7,5
2,5 г натрия хлорида, 2,85 г натрия тетрабората и 10,5 г борной кислоты растворяют в воде, если необходимо, доводят рН до 7,5 потенциометрически 0,1 М раствором хлористоводородной кислоты или 0,1 М раствором натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Хранят при температуре от 2 до 8 ºС.
Буферный (HEPES) раствор рН 7,5
2,38 г 2-[4-(2-гидроксиэтил)пиперазин-1-ил]этансульфоновой кислоты растворяют в 90 мл воды. Доводят рН до 7,5 потенциометрически с помощью 20 % раствора натрия гидроксида и доводят объём раствора водой до 100,0 мл.
0,2 М фосфатный буферный раствор рН 7,5
27,22 г калия дигидрофосфата растворяют в 930,0 мл воды. Доводят рН до 7,5 потенциометрически с помощью 300 г/л раствора калия гидроксида и доводят объём раствора водой до 1000,0 мл.
0,33 М фосфатный буферный раствор рН 7,5
Раствор I. 119,31 г динатрия гидрофосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Раствор II. 45,36 г калия дигидрофосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
85,0 мл раствора I смешивают с 15,0 мл раствора II; если необходимо, доводят рН до 7,5 потенциометрически раствором I или раствором II.
Трис(гидроксиметил)аминометана буферный раствор рН 7,5
7,27 г трис(гидроксиметил)аминометана и 5,27 г натрия хлорида растворяют в воде. Если необходимо, доводят рН до 7,5 потенциометрически исходным раствором трис(гидроксиметил)аминометана или 0,1 М раствором хлористоводородной кислоты и доводят объём раствора водой до 1000,0 мл.
0,05 М трис – гидрохлорида буферный раствор рН 7,5
6,057 г трис(гидроксиметил)аминометана растворяют в воде. Если необходимо, доводят рН до 7,5 потенциометрически с помощью хлористоводородной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
Натрия цитрата буферный раствор рН 7,8 (0,034 М натрия цитрата и 0,101 М натрия хлорида раствор)
10,0 г натрия цитрата и 5,90 г натрия хлорида растворяют в 900,0 мл воды. Доводят рН до 7,8 потенциометрически с помощью хлористоводородной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
Буферный раствор рН 8,0
50,0 мл 0,2 М раствора калия дигидрофосфата смешивают с 46,8 мл 0,2 М раствора натрия гидроксида и доводят объём раствора водой до 200,0 мл.
Буферный раствор рН 8,0 (1)
20,0 г дикалия гидрофосфата растворяют в 900,0 мл воды. Доводят рН до 8,0 потенциометрически с помощью фосфорной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
0,0015 М боратный буферный раствор рН 8,0
0,572 г натрия тетрабората и 2,94 г кальция хлорида растворяют в 800,0 мл воды. Доводят рН до 8,0 с помощью 1 М раствора хлористоводородной кислоты и доводят объём раствора водой до 1000,0 мл.
0,02 М фосфатный буферный раствор рН 8,0
50,0 мл 0,2 М раствора калия дигидрофосфата смешивают с 46,8 мл 0,2 М раствора натрия гидроксида и доводят объём раствора водой до 500,0 мл.
0,1 М фосфатный буферный раствор рН 8,0
0,523 г калия дигидрофосфата и 16,73 г дикалия гидрофосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
1 М фосфатный буферный раствор рН 8,0
136,1 г калия дигидрофосфата растворяют в воде. Доводят рН до 8,0 потенциометрически с помощью 1 М раствора натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Трис – натрия ацетатный буферный раствор рН 8,0
6,3 г трис(гидроксиметил)аминометана и 4,9 г натрия ацетата безводного растворяют в 900,0 мл воды. Доводят рН до 8,0 потенциометрически с помощью серной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
1 М трис – гидрохлоридный буферный раствор рН 8,0
121,1 г трис (гидроксиметил)аминометана и 1,47 г кальция хлорида растворяют в 900,0 мл воды. Доводят рН до 8,0 потенциометрически с помощью хлористоводородной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
Трис – гидрохлоридный буферный раствор рН 8,0
1,21 г трис (гидроксиметил)аминометана и 29,4 мг кальция хлорида растворяют в воде. Доводят рН до 8,0 потенциометрически с помощью 1 М раствора хлористоводородной кислоты и доводят объём раствора водой до 100,0 мл.
Трис (гидроксиметил)аминометана буферный раствор рН 8,1
0,294 г кальция хлорида растворяют в 40,0 мл раствора трис(гидрокси-метил)аминометана 24,22 г/л. Доводят рН до 8,1 потенциометрически с помощью 1 М раствора хлористоводородной кислоты и доводят объём раствора водой до 100,0 мл.
Трис – глицина буферный раствор рН 8,3
6,0 г трис(гидроксиметил)аминометана и 28,8 г глицина растворяют в 500,0 мл воды и доводят объём раствора водой до 1000,0 мл. Непосредственно перед использованием 1 объём приготовленного раствора доводят водой до 10 объёмов.
Барбитала буферный раствор рН 8,4
8,142 г барбитал-натрия и 0,287 г натрия ацетата растворяют в воде, добавляют 90,0 мл 0,1 M хлористоводородной кислоты и доводят объём раствора водой до 1000,0 мл.
Трис – EDTA – BSA буферный раствор рН 8,4
6,1 г трис(гидроксиметил)аминометана, 2,8 г натрия эдетата, 10,2 г натрия хлорида и 10,0 г альбумина бычьего растворяют в воде. Доводят рН до 8,4 потенциометрически с помощью 1 М раствора хлористоводородной кислоты и доводят объём раствора водой до 1000,0 мл.
Трис(гидроксиметил)аминометана – EDTA буферный раствор рН 8,4
5,12 г натрия хлорида, 3,03 г трис(гидроксиметил)аминометана и 1,40 г натрия эдетата растворяют в 250,0 мл воды. Доводят рН до 8,4 потенциометрически с помощью хлористоводородной кислоты концентрированной и доводят объём раствора водой до 500,0 мл.
Фосфатный буферный раствор рН 8,5
3,5 г дикалия гидрофосфата и 4,5 г натрия хлорида растворяют в 500,0 мл воды. Доводят рН до 8,5 потенциометрически с помощью смеси равных объёмов фосфорной кислоты разведённой 10 % и воды.
Трис – ацетатный буферный раствор рН 8,5
0,294 г кальция хлорида и 12,11 г трис(гидроксиметил)аминометана растворяют в воде. Доводят рН до 8,5 потенциометрически с помощью уксусной кислоты разведенной 30 % и доводят объём раствора водой до 1000,0 мл.
Трис – боратный буферный раствор с трилоном Б рН 8,6 – 8,8
60,5 г трис(гидроксиметил)аминометана, 6,0 г трилона Б, 19,0 г борной кислоты последовательно растворяют в воде в мерном цилиндре вместимостью 1000,0 мл, доводят объём раствора водой до метки и перемешивают. При необходимости раствор фильтруют через бумажный фильтр. Раствор хранят при температуре 2 – 8 °С не более 3 мес.
1,5 М трис – гидрохлоридный буферный раствор рН 8,8
90,8 г трис(гидроксиметил)аминометана растворяют в 400 мл воды. Доводят рН до 8,8 потенциометрически с помощью хлористоводородной кислоты концентрированной и доводят объём раствора водой до 500,0 мл.
Буферный (фосфатный) раствор рН 9,0
1,74 г калия дигидрофосфата растворяют в 80 мл воды. Доводят рН до 9,0 потенциометрически с помощью 1 М раствора калия гидроксида и доводят объём раствора водой до 100,0 мл.
Буферный раствор рН 9,0
Раствор I. 6,18 г борной кислоты растворяют в 0,1 М растворе калия хлорида и доводят объём раствора тем же растворителем до 1000,0 мл.
Раствор II. 0,1 М раствор натрия гидроксида.
1000,0 мл раствора I смешивают с 420,0 мл раствора II.
Буферный раствор рН 9,0 (1)
6,20 г борной кислоты растворяют в 500,0 мл воды. Доводят рН до 9,0 потенциометрически с помощью 1 М раствора натрия гидроксида (около 41,5 мл) и доводят объём раствора водой до 1000,0 мл.
Аммония хлорида буферный раствор рН 9,5
33,5 г аммония хлорида растворяют в 150,0 мл воды, прибавляют 42,0 мл раствора аммиака концентрированного 25% и доводят объём раствора водой до 250,0 мл. Хранят в полиэтиленовой упаковке.
Аммония хлорида буферный раствор рН 10,0
5,4 г аммония хлорида растворяют в 20,0 мл воды, приливают 35,0 мл раствора аммиака и доводят объём раствора водой до 100,0 мл.
Диэтаноламина буферный раствор рН 10,0
96,4 г диэтаноламина растворяют в воде, доводят объём раствора водой до 400,0 мл, прибавляют 0,5 мл 186 г/л раствора магния хлорида. Доводят рН до 10,0 потенциометрически с помощью 1 М раствора хлористоводородной кислоты и доводят объём раствора водой до 500,0 мл.
0,1 М аммония карбоната буферный раствор рН 10,3
7,91 г аммония карбоната растворяют в 800,0 мл воды. Доводят рН до 10,3 потенциометрически с помощью раствора натрия гидроксида разведённого 8,5 % и доводят объём раствора водой до 1000,0 мл.
Аммония хлорида буферный раствор рН 10,4
70,0 г аммония хлорида растворяют в 200,0 мл воды, прибавляют 330,0 мл раствора аммиака концентрированного 25% и доводят объём раствора водой до 1000,0 мл. Если необходимо, доводят рН до 10,4 потенциометрически с помощью раствора аммиака 17%.
Боратный буферный раствор 10,4
24,64 г борной кислоты растворяют в 900,0 мл воды. Доводят рН до 10,4 потенциометрически с помощью 400 г/л раствора натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Буферный раствор рН 10,9
6,75 г аммония хлорида растворяют в растворе аммиака (см. ОФС «Реактивы. Индикаторы») и доводят объём раствора тем же растворителем до 100,0 мл.
Буфер для регулирования ионной силы
58,5 г натрия хлорида, 57,0 мл уксусной кислоты ледяной, 61,5 г натрия ацетата и 5,0 г циклогексилендинитрилтетрауксусной кислоты растворяют в воде и доводят объём раствора водой до 500,0 мл. Доводят рН до 5,0 – 5,5 с помощью 335 г/л раствора натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Буфер для регулирования ионной силы (1)
Раствор (а). 210,0 г лимонной кислоты растворяют в 400,0 мл воды. Доводят рН до 7,0 потенциометрически с помощью раствора аммиака концентрированного 25 % и доводят объём раствора водой до 1000,0 мл.
Раствор (б). 132 г аммония фосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Раствор (в). К суспензии 292,0 г (этилендинитрил)тетрауксусной кислоты в 500,0 мл воды прибавляют 200,0 мл раствора аммиака концентрированного 25%. Доводят рН до 6,0-7,0 потенциометрически с помощью раствора аммиака концентрированного 25% и доводят объём раствора водой до 1000,0 мл.
Смешивают равные объёмы растворов (a), (б), (в) и доводят рН до 7,5 с помощью раствора аммиака концентрированного 25 %.