анеуплоидия что это такое
Преимплантационный генетический анализ эмбрионов
Каждая из 100 триллионов клеток в организме человека (за исключением красных кровяных клеток) содержит весь человеческий геном. Хромосомы – это струноподобные элементы внутри ядра (в центре) каждой клетки вашего тела. Они содержат генетическую информацию, ДНК. Ген занимает определенное место на хромосоме. В норме, есть 23 идентичных пары хромосом (2 метра ДНК) в каждой клетке, в общей сложности 46 хромосом. Каждый партнер во время оплодотворения обычно предоставляет 23 хромосомы. Если яйцеклетка или сперматозоид имеют аномальную упаковку хромосом, эмбрион, который они создают, также будет иметь хромосомные аномалии. Иногда это связано с перестройкой хромосом, или недостатком части хромосомы. В некоторых случаях есть отсутствующие хромосомы, или дополнительная хромосома (анеуплоидии), ведущие к наследственным заболеваниям. Любой эмбрион, в котором отсутствует хромосома (моносомия) перестанет расти до имплантации (фатальная аномалия). Если анеуплоидии включают хромосомы 13, 18, 21, Х или Y, беременность может дойти до родов. Наиболее распространенной из этих несмертельных аномалий является трисомия 21, или синдром Дауна, при которой присутствует дополнительная 21-я хромосома. Другие включают синдром Тернера у женщин и синдром Клайнфельтера у мужчин.
История преимплантационной генетической диагностики (ПГД)
Первые живорождения после ПГД были зарегистрированы в Лондоне в 1989 году. Две двойни девочек-близнецов родились от пяти пар с риском передачи связанного с Х-хромосомой заболевания. В настоящее время с помощью методов генетического анализа или ПГД могут быть обнаружены около 90% аномальных эмбрионов. Не все хромосомные или генетические заболевания могут быть определены этими процедурами, так как в ходе одной процедуры может быть диагностировано только ограниченное число хромосом. Многочисленные исследования на животных и некоторые исследования на человеке показывают, что микрохирургия эмбриона (биопсия), необходимая для удаления клеток, не влияет на нормальное развитие ребенка. Эта процедура, однако, была выполнена относительно небольшому числу пациентов во всем мире, поэтому точные негативные последствия, если таковые имеются, неизвестны. Несмотря на то, что после генетического анализа для выявления анеуплоидии всем мире на сегодняшний день было рождено уже много детей, эта процедура все еще относительно нова. В исследованиях на животных не было обнаружено никаких очевидных проблем и предварительные данные с эмбрионами человека позволяют предположить справедливость этого вывода. В исследовании, проведенном в Университетском колледже Лондона, исследователи недавно рассмотрели 12 преимплантационных эмбрионов с новой техникой, которая сочетает в себе амплификацию всего генома (WGA) и сравнительную гибридизацию генома (CGH). В результате в 8 из 12 изученных эмбрионов были обнаружены значительные хромосомные аномалии. Это может объяснить, почему люди имеют в лучшем случае 25% шансов на достижение жизнеспособной беременности в месяц при естественном зачатии.
Как передаются по наследству генетические заболевания
В диаграммах ниже, D или d представляет дефектный ген, а N или n представляет нормальный ген. Мутации не всегда приводят к болезни.
Доминантные заболевания:
Один из родителей имеет один дефектный ген, который доминирует над своей нормальной парой. Так как потомки наследуют половину своего генетического материала от каждого из родителей, есть 50% риск наследования дефектного гена, и, следовательно, заболевания.
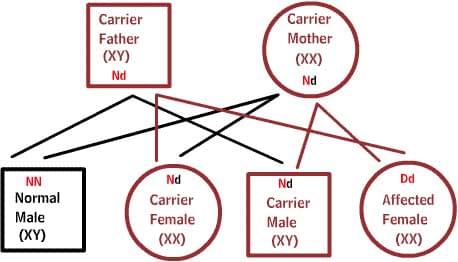
Рецессивные заболевания:
Оба родителя являются носителями одного дефектного гена, но при этом имеют нормальную пару гена. Для наследования заболевания необходимы две дефектных копии гена. Каждый потомок имеет 50% шанс быть носителем, и 25% шанс унаследовать заболевание.
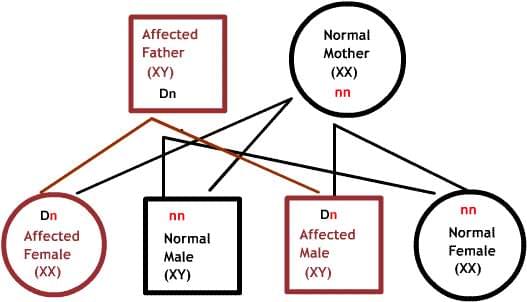
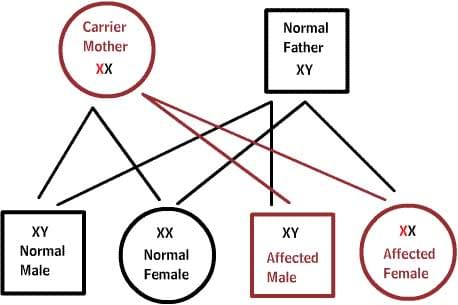
X-сцепленные заболевания:
Нормальные женщины имеют XX хромосомы, а нормальные мужчины XY. Женщины, которые имеют нормальный ген на одной из Х-хромосом, защищены от дефектного гена на их другой Х-хромосоме. Однако, у мужчины отсутствует такая защита в связи с наличием только одной Х-хромосомы. Каждый мужской потомок от матери, которая несет в себе дефект, имеет 50% шанс унаследовать дефектный ген и заболевание. Каждый женский потомок имеет 50% шанс быть носителем, как и ее мать. (на рисунке ниже X представляет нормальный ген а X представляет дефектный ген)
Возможные преимущества генетического анализа
Преимплантационная генетическая диагностика позволяет отобрать и перенести не измененные (хромосомно нормальные) эмбрионы, которые могут привести к большей частоте имплантации на эмбрион, сокращению потерь беременности и рождению большего числа здоровых детей. Генетическая диагностика предлагает парам альтернативу мучительному выбору по поводу того, чтобы прервать пострадавшую беременность после пренатальной диагностики, производимой путем амниоцентеза или биопсии ворсин хориона (CVS) на более поздних стадиях беременности. Почти все генетически связанные заболевания, которые могут быть диагностированы в перинатальном периоде либо амниоцентезом или CVS, могут быть обнаружены и ПГД. Процедура должна уменьшить психологическую травму для пар, которые несут повышенный риск генетических заболеваний для потомства.
Преимущества преимплантационной генетической диагностики (ПГД) могут включать в себя:
Возможные риски генетического анализа
Кандидаты для биопсии эмбриона и ПГД
Кандидаты для биопсии эмбриона и ПГД включают в себя:
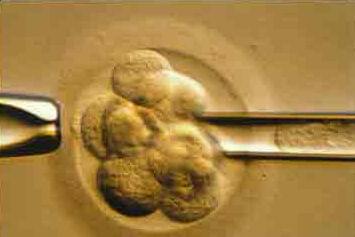
Пары с повторными неудачами ЭКО.
Используемые методы
Для анализа на наличие генетических дефектов эмбриона, из него необходимо удалить либо первое полярное тельце из неоплодотворенной яйцеклетки и/или 1 или 2 клетки от каждого эмбриона. Это называется биопсией яйцеклетки или эмбриона и обычно делается перед тем, как происходит оплодотворение, или через 3 дня после оплодотворения. Биопсия на 6-10 клеточной стадии не оказывает отрицательного влияния на преимплантационное развитие. На этом этапе каждая клетка имеет полный набор хромосом. Обычно из эмбриона удаляется только одна клетка, так как ожидается, что будут одинаковыми со всеми другими клетками в эмбрионе. Иногда необходимо удалить вторую клетку из эмбриона, например, если сигнал в первой не обнаружен. Для диагноза предрасположенности с помощью первого и второго полярных телец, как показателей генетического статуса яйцеклетки, используется анализ методом FISH. Недостатком анализа полярных телец заключается в том, что он не принимает во внимание отцовские анеуплоидии.
Анализ биопсированной клетки использует один из двух методов:
Вся информация носит ознакомительный характер. Если у вас возникли проблемы со здоровьем, то необходима консультация специалиста.
ПГТ хромосомных анеуплоидий
Что такое анеуплоидия?
Анеуплоидия — нарушение числа хромосом в диплоидном наборе, когда в одной из пар гомологичных хромосом (а иногда и в нескольких) появляется лишняя хромосома, либо одна из хромосом исчезает. Эта аномалия известна как наиболее часто встречающаяся у доимплантационных эмбрионов.
Типы анеуплоидий – трисомии (лишняя хромосома), моносомии (отсутствие одной из парных хромосом). Эмбрионы с дефицитом (моносомия) или избытком (трисомия) отдельных хромосом возникают, главным образом, вследствие оплодотворения яйцеклетки с хромосомным дисбалансом.
Анеуплоидии всегда клинически значимы, то есть, так или иначе патологически проявляются. Их проявления могут выражаться в отсутствии имплантации, прерывании беременности, нарушениями эмбриогенеза и рождению ребенка с хромосомной патологией.
При этом:
С возрастом риск возникновения анеуплоидной патологии у женщины существенно возрастает. Так, риск трисомий после 40-ленего возраста женщин имеется у каждой из 63-х, а в 45 лет – уже у каждой из 20.
Таргетные (целевые) исследования всего лишь нескольких хромосом из полного набора у эмбриона не оправдывают себя лишь в том, что они не охватывают остальные хромосомы, не дают полной картины по всем возможным анеуплоидиям.
В нашем центре мы предложим молекулярное кариотипирование эмбриона (исследование набора хромосом эмбриона), включающее исследование на анеуплоидии полного набора хромосом по доступной цене. Это оправдано не только с клинической точки зрения, но и с экономической.
Предимплантационный скрининг и хромосомные нарушения
Предимплантационный генетический скрининг (ПГС) представляет собой метод диагностики ЭКО-эмбрионов с целью обнаружения у них хромосомной патологии. Возможны сбои как в количестве хромосом эмбриона, так и в их распределении. Необходимо помнить, что ПГС не предназначен для выявления носительства конкретных генетических болезней, в отличие от ПГД.
В последнее время активно применяется новейший метод исследования хромосомных нарушений плода – неинвазивная пренатальная диагностика (НПД / NIPT). Данный метод позволяет выявить анеуплодии у плода лишь с использованием венозной крови матери, т.е. без какого-либо воздействия на плод. Эффективность НПД очень высока, составляя 90-99%, и его применение возможно уже с 10 недели беременности.
Что такое анеуплоидии?
Человеческая яйцеклетка в большинстве случаев является носителем хромосомного набора с патологией, и процент таких ненормальных яйцеклеток увеличивается с возрастом женщины. В общей сложности, порядка 50% человеческих эмбрионов имеют тот или иной тип хромосомной аномалии, говоря медицинским языком – анеуплоидии.
Анеуплоидия переводится с греческого языка как «не полностью кратный вид», т.е. это явление, при котором изменяется число хромосом в клетках организма. В норме каждый человек является носителем диплоидного (двойного) набора хромосом, состоящего из аутосом – 22 пары и половых хромосом – 2 штуки, в соматических клетках. В половых клетках (гаметах) человека содержится гаплоидный (одинарный) набор хромосом, который в момент оплодотворения превращается в диплоидный набор.
Анеуплоидии в сторону уменьшения количества хромосом, т.е. отсутствие 1 хромосомы в любой из хромосомных пар, называются моносомией. В большинстве случаев из-за отсутствия аутосомы у плода развиваются пороки не совместимые с жизнью, приводящие либо к его внутриутробной гибели, либо к спонтанному выкидышу.
Вследствие анеуплоидии хромосомный набор может также увеличиваться, приводя к явлению полисомии (полиплоидии) в виде трисомии – добавляется одна хромосома, тетрасомии – добавляются две хромосомы и пентасомии – добавляются три хромосомы. Данная патология, как правило, так же не совместима с жизнью, но есть некоторые виды этих нарушений, с которыми рождаются детки.
Показания к предимплантационной генетической диагностике
В настоящее время сфера предимплантационной генетической диагностики и скрининга является одной из самых динамично развивающихся областей репродуктивной медицины.
Данное исследование может быть рекомендовано для выявления анеуплоидии в следующих случаях:
В заключение хочу сказать, что даже в ситуации неблагоприятной наследственности Вы можете стать родителями малыша, который будет здоров с высокой долей вероятности. Помогут Вам в этом предимплантационный генетический скрининг ЭКО-эмбрионов и неинвазивная пренатальная диагностика материнской крови.
Невынашивание беременности
Если вы посетили эту нашу страницу, значит вы в поиске ответов на болезненный сегодня для вас вопрос — почему внутриутробно погиб ваш не родившийся малыш, почему это происходит не впервые, кто виноват и, главное, что делать?
Возможно, вы уже прошли дорогостоящие длительные дополнительные медицинские обследования, но так и не получили ответ на ваш вопрос. Возможно, вы в настоящий момент готовитесь к выскабливанию. В любом случае, мы готовы помочь вам и вашему врачу в решении проблемы.
Мы поможем вам не только установить причины случившегося, но и ответить совместно с вашим персональным врачом на следующие вопросы:
— может ли это повториться в будущем?
— а что же действительно делать, чтобы этого избежать?
— каков путь лечения и будет ли результат?
— каков путь в планировании и ведении следующей беременности?
К сожалению, 90% наступающих беременностей — это спонтанные беременности, и, несмотря на убеждение пары, что беременность якобы спланирована, необходимый объем предшествующего планового обследования пары зачастую не проходят. А ведь многих проблем можно было избежать. Среди многообразия причин «первую скрипку» в неудачах зачатия и вынашивания беременности играют именно генетические, а зачастую – наследственные факторы.
Несмотря на стремительное развитие клинической генетики, расширения информационного поля этой сферы, все ещё ни пациенты, ни врачи не готовы воспользоваться, да и попросту не знают о современных и уже абсолютно доступных молекулярных лабораторных методах постановки диагноза.
Не всегда абортивный материал подвергается хотя бы классическому цитогенетическому анализу, а если это и происходит, то сам метод несет в себе множество безрезультативных неудач.
Что необходимо знать парам, столкнувшимся с невынашиванием беременности?
Что же в сущности стоит за такой статистикой? Принято считать, что даже при очень хороших условиях для зачатия максимальная вероятность наступления беременности в менструальном цикле не превышает 40%. 60 же процентов приходятся на доклинические потери (то есть, еще до наступления беременности). После того, как произошел это первичный фильтр, шансы на удачную беременность резко возрастают и 80% наступивших беременностей прогрессируют, а 20% — завершаются самопроизвольным прерыванием развития беременности. Беременность либо замирает, либо происходит самопроизвольный выкидыш. Большая часть прервавшихся беременностей — до 80% — приходится на I триместр гестации. И самая частая причина для этого — патологический генетический статус эмбриона, присутствие того или иного не совместимого с развитием и жизнью дефекта в его генетическом материале.
Невынашиванием беременности принято считать самопроизвольное её прерывание на любых сроках от момента зачатия до полных 37 недель беременности. Невынашивание беременности может идти по двум сценариям: самопроизвольный выкидыш и неразвивающаяся (замершая) беременность. Отличает неразвивающуюся беременность от самопроизвольного выкидыша лишь факт отсутствия самостоятельного опорожнения полости матки в первом случае, и тогда пациентка направляется на медицинский аборт.
Риск невынашивания беременности увеличивается с возрастом женщины: от около 5% в возрасте 20 лет и до практически 50% для возрастных групп женщин за пределами 35-40 лет.
Наиболее достоверно доказана связь ранней потери беременности с двумя факторами — старший и поздний репродуктивный возраст матери; большое число предыдущих выкидышей. И чем больше эпизодов невынашивания беременности, тем хуже прогноз для последующего зачатия: риск очередной потери после двух предшествующих потерь достигает 29%, после трёх — 33%.
Какие генетические причины приводят к замершим беременностям и самопроизвольным выкидышам?
Одна из основных причин невынашивания беременности — это хромосомный дисбаланс у плода. В большинстве случаев такой хромосомный дисбаланс — событие случайное и от него никто не застрахован. Однако частота возникновения хромосомных нарушений прямо пропорциональна возрасту беременной, воздействию вредных внешних факторов, зависит от присутствия какой либо генетической патологии у близкого окружения родства и ряда других факторов.
Не стоит забывать и о том, что следствием некоторых форм такого хромосомного дисбаланса в дальнейшем могут стать также тяжелые заболевания у самой женщины, потерявшей беременность, в том числе онкологические.
Количественные аномалии:
Трисомия аутосомных хромосом — наличие в хромосомном наборе трех гомологичных хромосом вместо двух. Большинство трисомий аутосомных хромосом летальны для плода. А примерами жизнеспособных трисомий являются синдромы Дауна, Эдвардса, Патау.
Моносомия аутосомных или половых хромосом — отсутствие в хромосомном наборе одной из парных хромосом. При моносомии по любой из аутосом нормальное развитие эмбриона невозможно. Единственная совместимая с жизнью моносомия у человека — это моносомия по половой хромосоме X — приводит к развитию синдрома Шерешевского—Тернера (45,Х0).
Триплоидия — наличие в хромосомном наборе дополнительного гаплоидного набора хромосом. Триплоидии — летальны для плода.
Полисомия половых хромосом — наличие в хромосомном наборе дополнительных половых хромосом вместо двух. Пример — синдром Клайнфельтера — наличие одной или нескольких дополнительных Х- или У-хромосом у мужчин.
Делеция — утрата фрагмента ДНК в пределах определенного локуса, гена хромосомы.
Дупликация — напротив, увеличение хромосомного материала, удвоение участка хромосом.
Размеры делеций и дупликаций могут быть разными — от крупных, доступных современным микроскопам, до микроделеций и микродупликаций, которые можно обнаружить только современными молекулярными методами с высоким разрешением.
Транслокации — обмен участками между двумя парами гомологичных или не гомологичных хромосом.
Инсерции — вставки генетического материала в хромосому.
Инверсии — поворот участка хромосом на 180 градусов в пределах одной хромосмы.
Наиболее частыми причинами потери беременности из числа количественных нарушений в наборе хромосом являются:
— полные аутосомные трисомии (как по одной паре хромосом, так и двойные, тройные трисомии). На их долю приходится около 60% всех известных генетических причин гибели плода
— полиплоидия (до 15-20%%), чаще всего — триплоидия
— моносомия Х хромосомы ( до15%).
Реже причиной замершей беременности могут стать нарушения в структуре хромосом, сочетание различных таких аберраций:
— Транслокации. Несбалансированная хромосомная перестройка (непропорциональный обмен участками между хромосомами с нарушение количественного и качественного баланса хромосомного материала) у плода может закончиться самопроизвольным абортом или привести к появлению ребенка с врожденными дефектами и/или умственной отсталостью. Этот вид перестройки возникает тогда, когда родители являются носителем сбалансированной хромосомной перестройки (без изменения количества хромосомного материала). И тогда вслед за исследованием ДНК плода потребуется дополнительное обследование хромосомного материала родителей, для того, чтобы избежать потери беременности в следующий раз.
Как диагностировать генетический дефект в случае регресса беременности?
Для этого, прежде всего, необходимо исследовать абортивный материал в условиях генетической лаборатории.
К сожалению, не всегда супружеская пара, столкнувшаяся с необъяснимой причиной прервавшейся беременности, оказывается в кабинете генетика, чтобы получить профессиональную «направляющую» в последующем обследовании и попытаться установить эти причины и получить рекомендации в отношении следующей беременности.
Тем не менее, если вы столкнулись с проблемой невынашивания, обсудите с вашим врачом возможность генетического обследования. И сделать это вы можете в нашем центре, где мы не только быстро и точно проведем сам лабораторный анализ, но сопроводим вас и вашего врача консультированием до его проведения и после полученных результатов.
Показания для исследования абортивного материала
— в анамнезе уже имеются два и более эпизода самопроизвольного аборта или замершей беременности
— если при предыдущем выкидыше или медицинском аборте уже выявлялась хромосомная патология у плода
— у одного из супругов ранее было выявлено носительство хромосомного дисбаланса или наследственных заболеваний
— если в семье уже имеется ребенок с хромосомной патологией или врожденными пороками развития
И даже в случае первой неудачной беременности вы можете узнать больше о причинах гибели плода.
Какой бы из известных методов лабораторного анализа абортивного материала вам не будет назначен, суть его заключается в оценке кариотипа погибшего плода на предмет отклонений в его хромосомном материале. В ходе последующей оценки карты кариотипа устанавливается тип хромосомного дефекта, место его локализации и ассоциация этого дефекта с патологическим эффектом потери беременности.
Какой лабораторный метод выбрать?
Мы оптимально подберем вам метод исследования, исходя из вашего конкретного клинического случая. Нам неважно, на каком отдалении от нашей лаборатории вы находитесь, в каком регионе России вы проживаете. Наши логистические возможности позволят доставить ваш биологический материал из любого города и в том преаналитическом состоянии, которое нам необходимо для осуществления исследования.
В настоящее время существуют различные методы анализа кариотипа: от появившихся в лабораторной практике давно и ставших стандартным рутинным анализом, до инновационных молекулярных современных генетических тестов, обладающих невероятно высокой точностью и скоростью производства.
Возможности нашей лаборатории — методы последних поколений, которые исключают недостатки и неточности стандартизованных рутинных методов. В одном клиническом случае можно ограничиться таргетным (целевым) исследованием отдельных хромосом, дефекты в которых встречаются с наибольшей частотой. В другом случае мы порекомендуем вам полногеномный метод молекулярного кариотипирования (то есть, исследующий полностью все хромосомы и на все известные своей клинической значимостью дефекты, даже самые мельчайшие, недоступные современным микроскопам).
Почему мы не исследуем абортивный материал стандартным цитогенетическим методом?
Стандартный цитогенетический анализ кариотипа — метод, давно использующийся в отечественных цитогенетических лабораториях. Однако с появлением и бурным развитием более современных методов генетической диагностики — молекулярно-цитогенетических, молекулярно-генетических, которые превосходят по своей точности и диагностической значимости в 100-1000 раз, стандартное кариотипирование можно считать устаревшим по отношению к более современным и востребованным технологиям. Тем более, что стоимость молекулярных методов не намного превышает классический цитогенетический.
Цитогенетический анализ кариотипа осуществляется методом микроскопии, то есть с использованием различных модификаций микроскопов, различных алгоритмов обработки и подготовки препаратов абортивного материала для обеспечения визуализации хромосомного материала, различной степени подготовки и профессионализма цитогенетиков, оценивающих полученный результат. То есть так или иначе присутствует определенный эффект субъективизма в оценке и трактовке, а значит и не исключен процент ложных результатов.
Недостатки
Данный метод кариотипирования возможен только при условии доставки в лабораторию «живых» клеток материала, способных к делению. Отсюда — сложности в транспортировке с соблюдением особых условий, затруднения при доставке из отделенных регионов, удорожание транспортной услуги из-за особых преаналитических требований, длительное время для деления клеток (период исследования составит от 15 до 26 дней).
Другой вопрос — возможные и отнюдь не редкие случаи ложных результатов из-за невозможности данным методом исключить контаминацию материнским генетическим материалом исследуемый образец. Зачастую кариотип матери выдается за кариотип плода. А поскольку кариотип матери не отклонен от нормы, причина не будет установлена.
Образец может быть загрязнен и другим биологическим материалом, всё зависит от условий, в которых отбирался образец абортивного материала.
При неблагоприятном стечении перечисленного выше — шанс установить причину упущен, абортивный материал просто утилизирован.
И наконец, ограничения диагностической ценности метода из-за его низкой разрешающей способности (что может, а что не может выявить метод). Метод в 100% выявит анеуплоидии (численные отклонения в наборе хромосом), установит пол плода ( при наличии в кариотипе Y хромосомы — мужской пол), и может увидеть, что потерян крупный фрагмент/участок хромосомы, либо появился такой же большой дополнительный фрагмент. Огромное количество микроперестроек, которые также могут привести к серьезным последствиям — потеря беременности, рождение ребенка с тяжелым хромосомным заболеванием, остаются за пределами возможности данного метода.
Наша альтернатива — молекулярное кариотипирование на микроматрицах — шанс за одно исследование быстро, достоверно, без «осечек» либо найти причину, либо исключить.
КРЕДО — тест первой линии в диагностике причин невынашивания беременности — ускорен, автоматизирован, точен, достоверен, удобен, доступен по цене.
Тест, который устранил недостатки иных методов.
Тест, который объединил в себе требуемые диагностические цели.
Тест, который прошел многолетнюю практику после первой клинической апробации и набрал достоверную статистику.
Тест, который исключит лишние затраты на диагностику и подчас безрезультативное лечение, а стало быть оптимален с точки зрения экономии средств.
Тест, который не заставит вас волноваться по поводу возможной «лабораторной неудачи» или «лабораторной ошибки»
Тест, который доступен из любого региона.
Тест, который устроит вашего врача своими диагностическими и полезными возможностями, реально поможет вам в борьбе с невынашиванием.
КРЕДО — тест первой линии в диагностике причин невынашивания беременности.
Неоспоримые преимущества
О технологии молекулярного кариотипирования
Мы осуществляем молекулярный анализ хромосомного материала на основе технологии aCGH- сравнительной геномной гибридизации на микроматрицах. Использование нескольких форматов таких однонуклеотидных микроматриц позволяет нам обеспечить полногеномное покрытие (одновременно исследуются все хромосомы) и добиться определенных поставленных целей исследования с фокусированием на наиболее значимых синдромных областях и около 1000 функционально значимых генах.
В основе метода — автоматизированный анализ CNVs / SNPs после гибридизации проб ДНК пациента и референсной ДНК на микрочипе. Микрочип — это изготовленная промышленным способом микроматрица с иммобилизованной ДНК, содержащая геномные фрагменты, с известными нуклеотидными последовательностями. Каждый фрагмент — это зонд/маркер/различны по длине и специфичности. Определенный тип микрочипа используют под определенные задачи в зависимости от присутствующих на платформе маркеров.
Что можно выявить с помощью тестов КРЕДО:
В 100% все анеуплоидии по всем хромосомам
Все клинически значимые известные делеции/ дупликации в пределах разрешающих характеристик микроматрицы, включая субмикроскопические дефекты.
Контаминацию материнскими клетками
Тесты имеют ограничения
— Нельзя выявить сбалансированные структурные перестройки
— Точечные мутации генов
— Мозаицизм низкого уровня Перейти к выбору исследований