антиген инактивированного вируса что это такое простыми
Антиген инактивированного вируса что это такое простыми
Для профилактики вирусных заболеваний широко применяют инактивированные вакцины, которые имеют ряд преимуществ перед живыми вакцинами. Важным условием эффективности вакцин является количество и качество вирусного антигена, выбор инактиватора и оптимальных условий инактивации, позволяющих полностью лишить вирус инфекционности при максимальном сохранении антигенности. Понятие «инактивированный» относится к жизнеспособности вирусов, входящих в состав вакцины.
Инактивированные вирусные вакцины обычно готовят из вирулентных вирусов, разрушая вирулентность химическими или физическими методами при сохранении иммуногенности. Такие вакцины должны быть безопасны и содержать большое количество вирусного антигена, чтобы вызвать иммунный ответ и образование антител. Нормальный курс первичной вакцинации включает 2 или 3 инъекции вакцины; в дальнейшем, может потребоваться бустеризация для поддержания иммунитета.
Среди первых инактивированных вирусных вакцин были вакцины против бешенства, желтой лихорадки, ящура, классической чумы свиней, чумы плотоядных, ньюкаслской болезни и оспы животных. Поскольку не все из созданных вакцин оказались эффективными, а некоторые из них таили угрозу инфицирования из-за недостаточной полноты инактивации вируса, многие исследователи стали отдавать предпочтение живым вакцинам, приготовленным на основе аттенуированных штаммов. Лучшим примером живых вакцин служит вакцина против оспы людей.
Следствием недостаточной инактивации вируса явились случаи возникновения болезни, которые имели место при изготовлении инактивированной вакцины против полиомиелита. Недостаточная инактивация вируса ящура вызывала вспышки болезни у вакцинированных животных в Западной Европе. Подобные явления отмечали после применения формолвакцины против венесуэльского ЭМЛ.
Однако в последние годы тенденция использовать инактивированные вакцины вновь стала возрождаться. Этому способствовало совершенствование методов получения, концентрирования и очистки вирусных антигенов, инактивации вирусов и методов контроля, обеспечивающих полную безопасность и выраженную эффективность препаратов. С другой стороны, попытки получить безопасную эффективную живую вакцину не всегда оканчивались успешно. Так было, например, с многочисленными попытками получить живую вакцину против ящура.
Кроме того, живые вакцины против ряда вирусных заболеваний (грипп, инфекционный бронхит кур, трансмиссивный гастроэнтерит свиней и др.) зачастую не обладают гарантированной безопасностью и достаточной эффективностью.
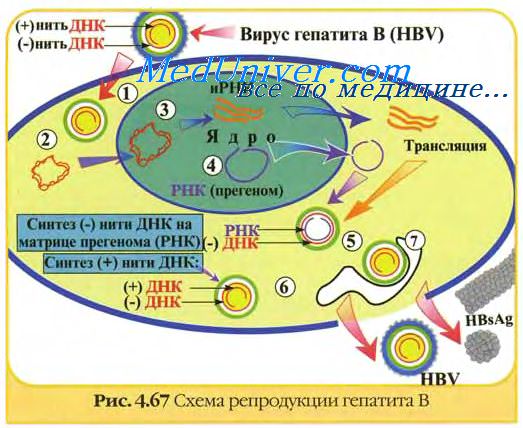
В производстве инактивированных вакцин против вирусных инфекций имеется три критических этапа: производство антигена, инактивация, адъювант.
Национальный Фармацевтический журнал
Войти на сайт
ВАКЦИНЫ ПРОТИВ COVID-19 И АДЪЮВАНТЫ, УЛУЧШАЮЩИЕ ИХ СВОЙСТВА.

Новый адъювант для профилактических вакцин компании SEPPIC

• вакцины на основе цельного (полногеномного) ослабленного вируса;
• инактивированные вакцины на основе полностью нежизнеспособного вируса;
• векторные вакцины;
• генетические вакцины (ДНК и РНК вакцины);
• субъединичные вакцины на основе отдельных компонентов патогена, таких как белки, пептиды или генетический материал (например, белковые или рекомбинантные вакцины). Разработчики из различных стран на основании накопленных знаний и имеющихся у них результатов и методов исследований выбирают для разработки тот тип вакцины, который считают наиболее действенным для обеспечения эффективной защиты людей от вируса SARS-CoV-2 (Рис.1).
На настоящий момент среди вакцин-кандидатов против COVID-19, зарегистрированных в списке ВОЗ, можно найти практически все из вышеназванных типов вакцин. Коротко напомним, что представляет собой каждый из них и чем они отличаются друг от друга.

Векторные вакцины – это также вакцины на основе живых вирусов, однако здесь есть небольшой, но очень важный нюанс: это вакцины на основе хорошо изученных и достаточно безобидных для человека вирусов («векторов» или вспомогательных транспортных вирусов) с встроенными в них фрагментами генома «злого вируса» (Рис. 3). В случае векторных вакцин в геном хорошо изученного и, в целом, безобидного вируса, например, аденовируса («вектора»), путём генетических модификаций встраивается небольшой ген – участок генома SARS-CoV-2. При вводе в организм такой векторной вакцины генетически модифицированные вспомогательные вирусы провоцируют такой же сильный иммунный ответ на белки-антигены SARS-CoV-2, как в случае «живой» полногеномной вирусной вакцины.
Преимущество указанных вакцин, по замыслу разработчиков, в той же высокой эффективности, что и у вакцин на основе живых ослабленных вирусов, но в большей управляемости в связи с достаточной изученностью и предсказуемостью «вектора»-носителя. Векторные вакцины начали разрабатываться и изучаться относительно недавно, поэтому к массовому применению вакцин этого типа ученые также подходят с должной и необходимой осторожностью.

Еще два перспективных типа вакцин против COVID-19, разрабатываемые мировым сообществом, – вакцины на основе нуклеиновых кислот, а именно, ДНК- и РНК-вакцины. В случае ДНК-вакцины нуклеотидная последовательность, кодирующая антиген SARS-CoV-2, встраивается в вектор – бактериальную плазмиду – небольшую стабильную кольцевую молекулу ДНК, способную к автономной репликации. Сама по себе плазмида не вызывает нужного специфического иммунного ответа, для этого, собственно, в неё и вшивают гены иммуногенных белков. Указанный модифицированный геном направляется в клетку, встраивается в ее ядро и образует вирусный белок (антиген), индуцирующий иммунный ответ.
Согласно замыслу разработчиков, ДНК-вакцины не могут вызвать заражение SARS-Cov-2, однако иммунитет, который они обусловливают, должен оказаться таким же сильным, как в случае «живых» вакцин. Тем не менее, влияние ДНК-вакцин на живые организмы изучено еще в меньшей степени, чем влияние векторных вакцин, поэтому вряд ли в ближайшее время ДНК-вакцины будут допущены к массовому применению на людях. 
В случае применения РНК-вакцины получается двойной иммунный ответ: с одной стороны, выработку антител вызывают вирусные белки, с другой стороны, сами липидные частицы с мРНК могут стимулировать иммунный ответ, так как «похожи на вирус» и воспринимаются организмом соответственно. Разработчики предполагают, что при вакцинации РНК-вакцинами из-за их «двойного действия» в организме быстро возникнет сильный и стойкий иммунитет.
В случае генетических вакцин преимуществом является их относительно быстрое и экономически выгодное производство: небольшую молекулу мРНК можно довольно быстро воссоздать, наработка нужного антигена обойдется недорого. Это делает вакцину доступной широким массам. Тем не менее иммунологи очень осторожно относятся к РНК-вакцинам, так как из-за малого периода их изучения никто не знает наверняка, как именно мРНК будет вести себя в живом, особенно в репродуктивном, организме.

Одним из самых безопасных типов вакцин в настоящее время считаются субъединичные вакцины, то есть вакцины на основе белков или фрагментов вируса (Рис. 6), не имеющих в своем составе ни ДНК, ни РНК как, например, белковые вакцины.
Попадая в организм при вакцинации, смесь фрагментов вирусных белков-антигенов также способна вызывать иммунный ответ. При этом такая вакцина абсолютно безопасна, здесь невозможны мутации вируса, поэтому вызвать у человека заболевание COVID-19 такая вакцина не может. Недостатком субъединичных вакцин является довольно длительный и сложный процесс наработки и очистки – получить достаточное для вакцинации очищенное количество вирусного белка не так легко. Кроме того, в чистом виде белковые вакцины не вызывают сильный иммунный ответ, поэтому недостаточно эффективны. В связи с этим при разработке белковых вакцин очень важно:
а) усилить иммунный ответ, вводя в состав белковых вакцин соединения, усиливающие их эффективность (эти вещества называют адъюванты),
б) увеличить количество нарабатываемой вакцины также за счет добавления к наработанному вирусному белку существенного количества того же адъюванта.

Наконец, мы подошли к еще одному безопасному и перспективному типу вакцин – инактивированным вакцинам. Здесь так же, как и в случае «живых» вакцин на основе ослабленного вируса используется цельный геном SARS-Cov-2, но в случае инактивированных вакцин вирус полностью деактивирован либо высокой температурой, либо дезинфицирующими составами, либо определенным видом излучения, что делает его совершенно нежизнеспособным. Этот инактивированный вирус никогда не сможет инфицировать клетку. Тем не менее по структуре «неживой» инактивированный вирус остается полным аналогом «живого» вируса и поэтому вызывает в организме иммунный ответ. Проблема в том, что в чистом виде инактивированные вирусы индуцируют существенно более низкий иммунный ответ, нежели живые, пусть даже и ослабленные вирусы. В связи с этим в составах инактивированных вакцин так же, как и в случае субъединичных вакцин используют адъюванты – вещества, которые значительно усиливают иммунный ответ, делая эти вакцины схожими по эффективности с живыми.
Основываясь на вышесказанном, мы склоняемся к выводу, что наиболее безопасными для человека являются субъединичные и инактивированные вакцины. Для повышения эффективности указанных безопасных вакцин до уровня более иммуногенных «живых», векторных или генетических вакцин необходимо применение в их составах современных адъювантов. Что же такое адъюванты и какова их роль в вакцинах?

Адъювант (от лат. adjuvans – «помогающий, поддерживающий») – соединение или комплекс веществ, используемых для усиления иммунного ответа при введении одновременно с антигеном.
Адъюванты на протяжении десятилетий применяются для улучшения иммунного ответа на вакцинные антигены. Включение адъювантов в состав вакцин направлено на усиление, ускорение и продление специфического иммунного ответа до желаемого уровня. Таким образом, адъюванты играют ключевую роль в получении эффективного и длительного иммунитета.
Использование адъювантов в вакцинах позволяет:
• Усилить краткосрочный иммунный ответ;
• Увеличить продолжительность иммунитета, то есть сократить частоту требуемых бустерных иммунизаций;
• Направить иммунный ответ (гуморальный или клеточный иммунитет);
• Уменьшить антигенную нагрузку при сохранении эффективности вакцины;
• Улучшить иммунный ответ у ослабленных или иммунокомпроментированных вакцинируемых лиц;
• Снизить себестоимость вакцины;
• Повысить стабильность вакцины.
Интерес к адъювантам для вакцин резко возрос в 2000-е годы. Ведущие фармацевтические компании-производители путем применения адъювантов разработали более эффективные и безопасные вакцины против гриппа.
В последние годы появляется все больше и больше новых вакцин-кандидатов как для профилактики инфекционных заболеваний, так и для терапии самых тяжелых заболеваний человечества. В связи с низкой иммуногенностью таких вакцин во многих случаях требуется введение в их состав адъювантов. Новые достижения в области аналитической биохимии, очистке макромолекул, технологии рекомбинантной ДНК, улучшенное понимание иммунологических механизмов и патогенеза заболевания позволили улучшить техническую основу разработки и применения адъювантов.
В настоящее время известно довольно много эффективных адъювантов, которые классифицируются по природе происхождения, механизму действия и физическим или химическим свойствам.
Так, в современных вакцинах широко применяются гели гидроксида алюминия, фосфаты алюминия или кальция, препараты на основе масляных эмульсий и ПАВ, дисперсные адъюванты, например, виросомы, структурные комплексы сапонинов и липидов и многие другие типы адъювантов.
Как уже упоминалось выше, наиболее эффективно и поэтому чаще всего адъюванты используются в следующих категориях вакцин:
• вакцины на основе белков (рекомбинантные субъединичные);
• инактивированные;
• векторные вакцины (для уменьшения дозы).
Для каждой вакцины адъювант подбирается таким образом, чтобы получить оптимальное соотношение эффективности указанной вакцины (получение сильного и продолжительного иммунного ответа) и ее безопасности для человека (минимальная реактогенность и отсутствие побочных эффектов).
К сожалению, немаловажным аспектом уже зарегистрированных в настоящее время адъювантов является их недоступность широкому кругу разработчиков. Практически все имеющиеся на настоящий момент современные адъюванты, применяемые в профилактических вакцинах, за исключением соединений алюминия, являются собственностью крупнейших фармацевтических компаний (см. табл. 2). В первую очередь, к ним относятся адъюванты для приготовления эмульсионных вакцин. Эти адъюванты на настоящий момент считаются наиболее перспективными в профилактических вакцинах, но остаются при этом и наименее доступными, так как были специально разработаны крупными биофармацевтическими компаниями исключительно для вакцин собственного производства.
Эти недоступные широкому кругу разработчиков адъюванты ведущих фармацевтических компаний отлично зарекомендовали себя в составах готовых вакцин указанных производителей. К примеру, эмульсионные адъюванты масло-в-воде MF59, AS03 и AF03 продемонстрировали высокую эффективность в вакцинах против гриппа. Сегодня вакцинами на их основе провакцинировано >120 миллионов человек, их профиль безопасности и иммуногенности тщательно и глубоко изучен и подтвержден на значительном количестве клинических испытаний (см. табл. 3).

Франсуа Бертран, руководитель направления разработки и производства адъювантов компании Seppic, в своем выступлении по поводу выпуска адъюванта SEPIVAC TM SWE на мировой рынок сказал: «Указанная разработка иллюстрирует наше общее стремление привнести готовый эффективный и общедоступный адъювант в мировое сообщество разработчиков вакцин. Мы твердо верим, что SEPIVAC TM SWE ускорит разработку новых профилактических вакцин для людей и будет способствовать более здоровому будущему человечества во всем мире».
Вакцины, антитела, антигены. Гид по иммунологии для чайников
Андрей Смирнов
Антитела, антигены, титры, тесты, вакцины — сейчас все это буквально из каждого утюга. «СПИД.ЦЕНТР» объясняет, какими бывают антитела, откуда они берутся и как все это связано с вакцинами и иммунитетом.
Что такое антитела?
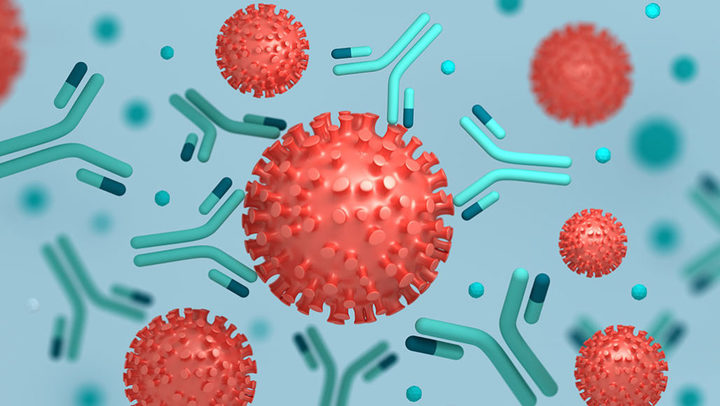
Антитела (они же иммуноглобулины) — это специальные белки, которые вырабатывают клетки нашей иммунной системы для борьбы с «чужеродным вторжением» — проникновением в организм практически чего угодно, что наша иммунная система посчитает потенциально опасным. Это могут быть бактерии, вирусы, их токсины — так наш организм защищается от инфекции, или даже безобидная пыльца растений и лекарства — и в этом случае развивается аллергия.
Вещество, в ответ на которое начали вырабатываться антитела, называют антигеном. И да, антиген — это именно вещество, так как антитела вырабатываются не против вируса или бактерии «целиком», а против тех или иных конкретных вирусных или бактериальных белков. Например, если говорят об антителах против вируса гриппа, подразумевают антитела против двух белков из оболочки этого вируса — гемагглютинина и нейраминидазы. В случае SARS-CoV-2 речь чаще всего идет о шиповидном белке оболочки вируса (он же S-белок или спайк-белок).
Антитела обладают высокой специфичностью, то есть работают строго против определенного антигена или небольшой группы антигенов, очень сходных по своей структуре. Суть работы антител довольно простая — они химически связываются с антигеном и блокируют его взаимодействие с другими молекулами. Например, антитела против шиповидного белка оболочки коронавируса будут «прилипать» к этому белку, обволакивая вирусную частицу, — и такой вирус уже не сможет «прилипнуть» к клетке и проникнуть в нее. Кроме того, частицы с «налипшими» на них антителами гораздо «аппетитнее» выглядят для клеток нашей иммунной системы и будут быстрее поглощаться и перевариваться макрофагами — этот эффект называется «опсонизация».
Как организм понимает, какие антитела вырабатывать?
Выработка антител — довольно сложный и многостадийный процесс. Если очень коротко, то специальные клетки иммунной системы поглощают и переваривают потенциально опасную частицу (например, бактерию или вирус), буквально разбирают ее на кусочки. И затем показывают эти кусочки другим клеткам, которые подбирают подходящую структуру антитела так, чтобы это антитело могло химически связаться с одним из «кусочков» переваренной бактерии. Когда нужная структура найдена — запускается массовое производство антител. На этот процесс требуется немало времени, поэтому после первого контакта с антигеном накопление антител начинается примерно через 2 недели. Выработанные антитела циркулируют в крови около 4 недель, после чего разрушаются, при этом выработка новых антител может продолжаться.
Хорошая новость в том, что иммунная система умеет «запоминать» антигены, и при следующем контакте организму уже не нужно тратить 2 недели на поиск нужной структуры антитела — выработка начинается практически сразу. Именно так работает приобретенный иммунитет.
Иммунологическая память хранится разное время. Для некоторых инфекций, например для клещевого энцефалита, это 3–5 лет. Для других, например гепатита B или кори, — от десятков лет до пожизненной «гарантии». Именно от времени хранения иммунологической памяти, а не от текущей концентрации антител в крови зависит стойкость иммунитета и риск повторной инфекции.
Как антитела вырабатываются при вакцинации?
Для начала синтеза антител организму не обязательно сталкиваться с живой опасной бактерией или вирусом. Достаточно будет «убитого» или ослабленного микроба, кусочка его оболочки или даже отдельного белка — это тоже запустит иммунную реакцию и выработку антител. Эти антитела будут совершенно нормально работать и против живого опасного возбудителя инфекции. В этом и заключается смысл вакцинации — знакомим иммунную систему с ослабленным или убитым микробом, чтобы она научилась убивать живых и опасных.
Продолжительность вакцинного иммунитета тоже зависит от иммунологической памяти и может отличаться от естественного иммунитета, возникшего после болезни. Когда иммунитет угасает, нужно вакцинироваться снова. Для вакцин от разных инфекций есть свои графики повторной вакцинации, их частота зависит от времени хранения иммунологической памяти.
Вакцины, полученные по различной технологии, могут отличаться по времени действия вакцинного иммунитета. Обычно эти различия не слишком велики, так как продолжительность иммунитета в гораздо большей степени зависит от вида самого возбудителя, чем от конкретной вакцины.
На формирование защитного иммунитета также влияет состояние самого организма. Например, при тяжелых заболеваниях иммунной системы (наследственные иммунодефициты, злокачественные новообразования) иммунный ответ на вакцину может быть снижен или не формироваться вообще. Как показывает многолетний опыт использования разных вакцин, в случае ВИЧ-инфекции иммунный ответ на вакцины, как правило, ничем не отличается от иммунного ответа у ВИЧ-негативных людей. Поэтому графики вакцинации и дозы вакцины для ВИЧ-позитивных пациентов не будут иметь никаких особенностей.
по теме
Лечение
Безумно дорогое лекарство, которое спасет мир от пандемии
Некоторые лекарства, например глюкокортикоиды и иммунодепрессанты, могут подавлять формирование вакцинного иммунитета. В таких случаях тактику вакцинации нужно обсудить с врачом.
Для вакцин от новой коронавирусной инфекции время действия вакцинного иммунитета остается одним из главных вопросов. Предсказать продолжительность защиты той или иной вакцины очень трудно. Обычно это выясняют на практике, регистрируя частоту инфекций у привитых во время массовой вакцинации людей спустя разное количество времени, а также измеряя титр защитных антител.
Титр? Какой еще титр?
Как мы уже выяснили, антитела — это белки, которые циркулируют в крови. Для того чтобы обеспечивать эффективную защиту, эти белки должны быть в крови в определенной концентрации — ее и называют титром. Выражают титр в виде чисел, разделенных двоеточием, например 1:50 или 1:100 (читается как «один к пятидесяти» или «один к ста»).
Так как антитела — это сложные белки, определять их химическими методами крайне трудно. Поэтому для определения антител используют иммунологические реакции. Конкретных методов очень много, но в самом общем виде суть этих реакций очень простая. Мы берем раствор нужного антигена (например, того самого шиповидного белка коронавируса) и смешиваем его с сывороткой, в которой ищем антитела. Если антитела в сыворотке есть, то они связываются с антигеном и их соединение выпадает в виде осадка или раствор мутнеет. На практике проведение такой реакции выглядит сложнее, часто используют специальные гелевые среды и разные способы детектирования, но суть от этого не меняется.
Проблема в том, что такой подход отвечает нам только на вопрос, есть антитела в сыворотке или их нет, но ничего не говорит о количестве самих антител. Как в таком случае сравнить между собой две разные сыворотки? По количеству выпавшего осадка — не вариант, слишком большая погрешность. Но есть другой способ — можно разводить исследуемую сыворотку до тех пор, пока реакция (осадок) все еще будет обнаруживаться. И вот последнее, самое сильное разведение, при котором мы еще можем наблюдать реакцию сыворотки с раствором антигена, и называют титром этой сыворотки. То есть титр 1:50 говорит нам о том, что эту сыворотку можно развести в 50 раз и она еще будет давать реакцию с антигеном. Соответственно, чем больше вторая цифра в обозначении титра, тем выше концентрация антител в сыворотке.
Недостаток титра в том, что он указывает на относительное содержание антител. Если у нас есть две сыворотки с титрами 1:50 и 1:100, мы можем с уверенностью сказать, что во второй сыворотке антител в 2 раза больше, чем в первой. Но какая именно концентрация антител в каждой из этих сывороток, мы не знаем. На практике это часто бывает и не нужно: нам достаточно знать, с каким титром антител человек еще защищен от инфекции, а с каким — уже нет. Это легко выяснить, измеряя титр антител у вакцинированных людей, которые все же заразились.
В результатах лабораторных анализов обычно указывают концентрацию антител в международных единицах (МЕ) или относительных единицах (ОЕ). Результаты, полученные в МЕ, можно сравнивать между собой — значение не будет зависеть от лаборатории, тест-системы и условий анализа (для коронавируса таких пока нет). Результаты, выраженные в ОЕ, можно сравнивать между собой только для тестов одной марки, при этом сама лаборатория и время анализа роли не играют, то есть можно отслеживать динамику изменения уровня антител у одного человека.
Чтобы понять, нужна ли вакцина и подействовала ли она, достаточно измерить уровень антител? Какой нужен для ковида?
К сожалению, все немного сложнее. Антитела отвечают за гуморальный иммунитет — и это только лишь часть нашей иммунной системы. Помимо гуморального, есть еще клеточный иммунитет, работа которого не зависит от уровня антител. При защите от разных инфекций разные звенья иммунитета играют неодинаковые роли. В каких-то случаях ведущую роль имеет гуморальный иммунитет и антитела (например, в случае гепатита В, гриппа, столбняка и многих других инфекций). В других случаях — ведущая роль у клеточного иммунитета, например, при туберкулезе. По новой коронавирусной инфекции пока слишком мало данных, чтобы делать выводы о важности каждого из звеньев иммунитета и необходимом уровне антител. То есть даже если вы сделаете тест на антитела, эта информация практически ничего не даст по ряду причин.
Если вы еще не вакцинировались и тест на антитела будет положительным, что говорит о перенесенной инфекции в бессимптомной форме, это все равно не является противопоказанием к вакцинации. Мы не знаем, какова продолжительность естественного иммунитета, так что вакцина может продлить или усилить защиту.
Если вы делаете тест на антитела после вакцинации, сейчас нет надежных данных, с которыми можно было бы соотнести полученные результаты и сделать вывод о том, подействовала ли вакцина. Другими словами, пока никто не знает, сколько должно быть антител после вакцинации, чтобы гарантировать надежный уровень защиты. Плюс уровень антител ничего не говорит о состоянии клеточного иммунитета, а он тоже может быть очень важен для защиты.
Если вы наблюдаете за динамикой концентрации антител после вакцинации и видите ее снижение, это еще не говорит о снижении уровня защиты. Как мы выяснили выше, падение концентрации антител в крови с течением времени — это нормальное явление, а долговременную защиту обеспечивает иммунологическая память, которая с концентрацией антител не связана.
Не все антитела одинаково полезны
Для характеристики антител важно понимать их класс, тип и с каким антигеном они связываются.
Антитела бывают разных классов (A, M, G, E и др.). Основной класс защитных антител — G, в лабораторных исследованиях и тестах их обычно обозначают IgG. Наличие этих антител в крови говорит о наличие иммунитета после вакцинации или перенесенного заболевания. IgM — тоже защитные антитела, которые начинают вырабатываться первыми, раньше, чем IgG. Обычно IgM менее эффективны, чем IgG, и почти полностью исчезают к концу заболевания. Наличие этих антител обычно указывает на еще протекающее, или совсем недавно перенесенное заболевание, или на хроническую инфекцию. То есть, если нас интересует устойчивый иммунитет, в тестах ищем IgG.
Если антитело связывается с каким-то белком на поверхности вируса или бактерии, это далеко не всегда означает, что бактерия и вирус становятся после этого полностью безвредными. Например, вирус может использовать другой участок поверхностного белка для проникновения в клетку, не тот, с которым связалось антитело. Антитела, которые связываются с патогенами, но не подавляют их опасность, называют связывающими. Если же связывание антитела полностью «обезвреживает» микроб, «нейтрализует» его опасное влияние, такое антитело называют нейтрализующим. Связывающие антитела нельзя назвать полностью бесполезными — прикрепляясь к вирусу или бактерии, такие антитела делают их более заметными для клеток иммунной системы и ускоряют реакцию иммунитета. Но именно нейтрализующие антитела, которые могут самостоятельно обезвреживать опасные микробы, обеспечивают основную защиту, и именно их уровень важен при оценке вакцинного или естественного иммунитета. То есть в анализах нам нужно искать нейтрализующие IgG.
И, наконец, антиген. Как мы разбирали выше, антитела обладают очень высокой специфичностью и связываются только с определенными белками. Когда иммунная система, столкнувшись с инфекцией, подбирает нужное антитело, она чаще всего начинает синтезировать сразу несколько разных видов, нацеленных на разные белки возбудителя. Ведь клетки, синтезирующие антитела, получают для анализа разные кусочки полупереваренного микроба — и поверхностные, и внутренние белки — и для каждого из них ищут антитело. Для эффективной защиты важны именно те антитела, которые связываются с белками на поверхности вируса или бактерии. Ведь антитела — это крупные молекулы, которые не могут поникать внутрь вирусных частиц или бактерий, для них доступны только поверхностные белки. Именно поэтому защитный иммунитет в первую очередь обеспечивают антитела к поверхностным антигенам. Например, в случае коронавирусной инфекции вырабатывается как минимум 2 вида антител — к S-белку (который на поверхности вирусной частицы) и к N-белку (он же нуклеокапсидный белок, который находится внутри вирусной частицы). Так как до N-белка антитела добраться не могут, защиту будут обеспечивать именно антитела к S-белку. То есть, если вы все же хотите определить уровень защитных антител после прививки от ковида, нужно искать тест на нейтрализующие IgG к S-белку.