антиконвульсанты что это такое список
Традиционные и новые антиконвульсанты в эпилептологии
В настоящее время «золотым стандартом» оценки эффективности и переносимости противоэпилептических препаратов (ПЭП) являются двойные слепые плацебо-контролируемые исследования. Тем не менее эти исследования не лишены ряда недостатков и основной
В настоящее время «золотым стандартом» оценки эффективности и переносимости противоэпилептических препаратов (ПЭП) являются двойные слепые плацебо-контролируемые исследования. Тем не менее эти исследования не лишены ряда недостатков и основной из них — ограниченная продолжительность исследования по сравнению с многолетним, во многих случаях пожизненным течением эпилепсии. Известно, что препарат, ранее эффективный, может быть заменен на другой из-за развития толерантности к нему [1] или появления непереносимых или неприемлемых для пациента побочных действий. Снижение эффективности ПЭП может быть связано и с эволюцией самого заболевания, например медиальной височной эпилепсии, но и при этом врачи, как правило, увеличивают дозы ПЭП, заменяют препарат на другой, добавляют еще один.
Показателем, позволяющим оценить успешность долгосрочного применения ПЭП, является уровень удержания на препарате (% пациентов, продолжающих лечение через определенный промежуток времени, обычно 6 или 12 мес от начала исследования). Уровень удержания на препарате (Retention rate) — интегрированный показатель, отражающий, с одной стороны, его переносимость, с другой — развитие толерантности к нему.
В нашем обзоре отражены результаты долгосрочных (6 мес и более) исследований, посвященных как традиционным (вальпроат, карбамазепин), так и новым (ламотриджин, топирамат, леветирацетам, окскарбазепин) ПЭП.
Вальпроат и карбамазепин. Вальпроат (соль вальпроевой кислоты) (Депакин® и карбамазепин (Тегретол®, Финлепсин®) относятся к традиционным ПЭП и считаются «золотым стандартом» лечения эпилепсии [2]. Оба препарата применяются для лечения эпилепсии с 60-х годов XX в. Вальпроат — препарат широкого спектра действия, карбамазепин применяется главным образом при симптоматических и предположительно фокальных эпилепсиях, он противопоказан при большинстве идиопатических генерализованных эпилепсий. В США при применении карбамазепина и вальпроата добавляется фенитоин. За прошедшие годы был проведен целый ряд исследований, касающихся эффективности и переносимости этих препаратов.
В исследовании, проведенном M. Kuncikova и др. [3], показана высокая эффективность и хорошая переносимость вальпроата натрия в лечении парциальной эпилепсии у детей и взрослых. Показатель ремиссий достигал 84 % у детей и 73 % у взрослых, при этом отмечен высокий уровень удержания на препарате (90 % через 6 мес лечения). Только 2 % пациентов прекратили участие в исследовании из-за появления побочных эффектов.
Мультицентровое сравнительное исследование эффективности вальпроата натрия и карбамазепина (группа EPITEG) в лечении взрослых [4] и детей [5] проведено в Великобритании.
В исследование EPITEG по применению у взрослых были включены пациенты с вновь диагностированной эпилепсией с первично-генерализованными, парциальными или вторично-генерализованными приступами. Больные были разделены на группы: получавших вальпроат натрия (200 мг 2 раза, n = 149) и принимавших карбамазепин (100 мг 2 раза, n = 151). При необходимости доза увеличивалась либо до прекращения приступов, либо до появления токсических эффектов.
Вальпроат натрия и карбамазепин показали одинаковую эффективность, однако через 6 мес в группе, леченных вальпроатом осталоcь достоверно больше пациентов, чем в другой (90 % против 75 %, p = 0,001). Отмена из-за побочных действий чаще проводилась при приеме карбамазепина, чем вальпроата (15 % против 5 % в первые 6 мес терапии). К концу трехлетнего периода наблюдения свыше 70 % исследуемых пациентов либо оставались на назначенной терапии, либо прекратили прием препарата после достижения длительной ремиссии. В целом исследование показало хорошую переносимость традиционных ПЭП в терапии эпилепсии у взрослых.
В исследование EPITEG по применению ПЭР в педиатрической практике были включены 260 детей с вновь диагностированной первично-генерализованной или парциальной эпилепсией, перенесших два и более генерализованных тонико-клонических или парциальных приступа за предшествующие 6 мес. Дети были разделены на две группы: в одной принимали вальпроат натрия (n = 130), в другой — карбамазепин (n = 130). И те и другие наблюдались амбулаторно в течение 3 лет. При необходимости доза ПЭП увеличивалась либо до прекращения приступов, либо до проявления токсических эффектов. Оба препарата показали эквивалентную эффективность, побочные действия были незначительными и редко требовали отмены.
Сравнительная эффективность монотерапии фенобарбиталом, фенитоином, карбамазепином и вальпроатом натрия при впервые диагностированной эпилепсии у детей изучалась M. de Silva и соавторами [6]. В открытое рандомизированное исследование были включены 167 детей в возрасте от 3 до 16 лет, перенесших как минимум два парциальных или генерализованных тонико-клонических приступа. Дети распределились по группам в зависимости от назначенного препарата — одного из четырех ПЭП. Протокол исследования был приближен к обычной клинической практике. Эффективность оценивалась по времени до первого приступа после начала терапии и времени достижения годовой ремиссии. Результаты применения всех четырех препаратов были благоприятными. В течение 3 лет наблюдения годовая ремиссия была достигнута у 73 % детей. Между препаратами не было установлено достоверных различий по эффективности. Наиболее высокий уровень проявления побочных действий, требующих отмены приема, отмечен при применении фенобарбитала (6 из первых 10 пациентов в группе, получавших этот препарат), в связи с чем в дальнейшем фенобарбитал не назначался. Среди оставшихся трех ПЭП чаще отменялся фенитоин (9 %), чем карбамазепин или вальпроат (по 4 %).
Аналогичное по дизайну сравнительное исследование было проведено A. J. Heller и соавторами [7] при впервые диагностированной эпилепсии у взрослых. 243 пациента в возрасте 16 лет и старше, перенесшие как минимум два парциальных или генерализованных тонико-клонических приступа, были распределены по группам для получения фенобарбитала, фенитоина, карбамазепина и вальпроата натрия. 75 % пациентов достигли годовой ремиссии в течение трехлетнего периода наблюдения. Препараты продемонстрировали эквивалентную эффективность, но отличались по переносимости. Отмена терапии из-за побочных эффектов была необходима в целом у 10 % пациентов, при этом в группе пациентов, принимавших фенобарбитал, эта доля составила 22 %, принимавших фенитоин, карбамазепин и вальпроат — 3, 11 и 5 % соответственно. Авторы считают, что при выборе препарата следует оценивать уровень токсичности и стоимость.
Новые антиконвульсанты. В России на сегодняшний день зарегистрированы и реализуются в аптеках пять новых ПЭП. Три из них: ламотриджин (Ламиктал®), леветирацетам (Кеппра®), топирамат (Топамакс®), относятся к препаратам широкого спектра действия. Окcкарбазепин (Трилептал®) и габапентин (Нейронтин®) показаны для лечения симптоматических и предположительно симптоматических фокальных эпилепсий. Несмотря на то что, по некоторым данным, новые ПЭП аналогичны по эффективности традиционным, но лучше переносятся, результаты исследований и клиническая практика показывают, что они заметно различаются как по эффективности, так и по уровню удержания на препарате. Так, габапентин оказался препаратом с невысокой противоэпилептической активностью и зарегистрирован для лечения нейропатической боли; ламотриджин сочетает относительно низкую эффективность с хорошей переносимостью; у топирамата высокая эффективность сочетается с относительно низким уровнем удержания.
Был проведен ряд исследований по оценке эффективности и переносимости новых ПЭП: открытые проспективные и ретроспективные исследования новых препаратов, сравнительные исследования, метаанализы (обзоры, основанные на математической обработке результатов двойных слепых плацебо-контролируемых исследований сравниваемых ПЭП).
В исследовании H. P. Bootsma и соавторов [8], посвященном изучению эффективности топирамата, уровень удержания на препарате составил 53 % через год, 45 % через 2 года, 38 % через 3 года и 30 % через 4 года после назначения препарата. Таким образом, через 4 года 70 % пациентов прекратили принимать топирамат, в 65 % случаев это было связано с побочными действиями препарата.
К. Ю. Мухин и соавторы [9] применяли топирамат в качестве дополнительной терапии у 45 пациентов с различными формами эпилепсии. Положительный эффект был достигнут в 69 % случаев, однако в 19 % случаев через 1–3 мес частота приступов достигла прежнего уровня. Отмена препарата из-за побочных действий была необходима в 11 % случаев.
Исследование эффективности и переносимости леветирацетама у детей и подростков с рефрактерной эпилепсией проведено С. von Stuelpnagel и соавторами [10]. В исследование были включены 129 пациентов со средним возрастом 10,6 года, страдающие тяжелой формой эпилепсии, часто — с задержкой умственного развития. Пациенты получали леветирацетам в средней дозе 39,8 мг/кг в сутки (6–70 мг/кг). Лечение дало результаты у 35 пациентов (27,1 %), из них у 5 приступы прекратились. Уровень удержания на препарате среди больных с успешным лечением через 3 года составил 22,5 %.
Ретроспективное мультицентровое исследование эффективности, переносимости и оценки уровня удержания при терапии леветирацетамом проведено D. Peake и соавторами [11]. В исследование включили 200 детей от 0,3 до 19 лет с рефрактерной эпилепсией. Доза леветирацетама варьировала от 8 до 100 мг/кг в сутки (в среднем 39 мг/кг). Препарат переносился хорошо. Уровень удержания на препарате через 1 год после начала исследования составил 49 %. В 2, 6 и 12 мес снижение приступов более чем на 50 % отмечено у 60, 40 и 32 % соответственно, включая отсутствие приступов соответственно у 14, 14 и 5 % пациентов. Авторы оценивают уровни эффективности терапии и удержания на препарате в данной группе детей с резистентной эпилепсией как хорошие.
В британском исследовании R. J. Simister и соавторов [12] сравнивались уровни удержания на нескольких новых ПЭП у взрослых пациентов с хронической эпилепсией и задержкой умственного развития. Через 2 года после начала лечения уровень удержания составил 85 % для окскарбазепина, 57 % — для ламотриджина, 56 % — для леветирацетама и 45 % — для топирамата. Для тиагабина и габапентина этот уровень составил 24 и 15 % соответственно. Наибольшая частота проявления побочных действий зарегистрирована при применении топирамата (60 %), наименьшая — леветирацетама (16 %).
S. Chung и соавторами [13] изучены показатели удержания на пяти новых ПЭП: леветирацетаме, ламотриджине, окскарбамазепине, топирамате и зонизамиде. Оценку проводили на 4, 12, 24, 52 и 104-й неделях. Всего проанализированы 828 назначений ПЭП. Уровень удержания был наиболее высоким для ламотриджина (74,1 %), за ним следовали зонизамид (60,2 %), окскарбазепин (58,8 %), леветирацетам (53,6 %) и топирамат (44,2 %). Отмена препаратов чаще всего была связана с неэффективностью (29,5 %) и седативными побочными эффектами (20,5 %). Как правило, препарат отменялся в первые 6 мес терапии. Некоторые причины отмены были специфичны для конкретных ПЭП: нарушение поведения и возбудимость при применении леветирацетама; сыпь в связи с приемом карбамазепина и ламотриджина; окскарбазепин вызывал гипонатриемию; топирамат и зонизамид отменялись из-за камней в почках.
Метаанализ позволяет проводить непрямое сравнение эффективности и переносимости препаратов. Результаты одного из метаанализов [14] представлены на рисунке. Уровень ответа (по вертикальной оси) отражает эффективность препарата (чем выше, тем эффективнее), уровень отмены (по горизонтали) — переносимость (чем ближе к нулю, тем реже препарат отменяется).
Для большинства новых ПЭП за исключением леветирацетама прослеживается закономерность: чем эффективнее препарат, тем ниже уровень удержания.
Сравнение традиционных и новых антиконвульсантов. Эффективность и переносимость вальпроата, ламотриджина и топирамата у пациентов с генерализованными или неклассифицируемыми приступами изучалась в британском открытом, рандомизированном, контролируемом исследовании SANAD [15]. В исследование были включены 716 пациентов, для которых вальпроат считался стандартной терапией. Пациенты распределялись по группам в зависимости от применяемого препарата: вальпроата, топирамата и ламотриджина. В качестве первичных исходов оценивались время до достижения терапевтической неудачи и время достижения годовой ремиссии. Исследование показало превосходство вальпроата над топираматом по переносимости и над ламотриджином по эффективности. Показатели удержания на препарате при сроке наблюдения до 6 лет представлены в таблице.
Как видно из таблицы, вальпроат продемонстрировал более благоприятные и устойчивые показатели удержания на препарате по сравнению с ламотриджином и топираматом.
Основная цель противоэпилептической терапии — достижение стойкой ремиссии при приемлемой переносимости ПЭП. Однако эта цель не всегда достижима. M. Brodie (2005) в течение 20 лет наблюдал 780 пациентов (г. Глазго) с впервые диагностированной эпилепсией [16]. Из них у 56,1 % ремиссия была достигнута при применении первого или второго ПЭП (вне зависимости от препарата), у 8,5 % положительный результат отмечен в начале терапии, но в дальнейшем развилась резистентность, 3,4 % больных оказались резистентными с самого начала заболевания. Пациенты первой группы способны достичь ремиссии при приеме низких и средних доз соответствующего ПЭП, и переносимость, а следовательно, и уровень удержания на препарате у них хорошие. Однако, согласно J. H. French [17], в группе резистентных пациентов с целью достижения результата применяются более высокие дозы препаратов. Для всех новых ПЭП, за исключением, возможно, леветирацетама, существует связь между дозой и уровнем отмены, что подтверждается и результатами других метаанализов [14].
Можно сделать вывод о том, что в группе традиционных ПЭП вальпроат натрия имеет наилучшие показатели удержания на препарате. Что касается новых ПЭП, этот показатель выше у ламотриджина и леветирацетама. Убедительных доказательств превосходства новых ПЭП над традиционными по уровню удержания на препарате на сегодняшний день нет. При выборе ПЭП, помимо традиционных показаний к применению, следует учитывать и уровень удержания на препарате как один из предикторов его успешного применения без замены в течение длительного срока лечения эпилепсии.
По вопросам литературы обращайтесь в редакцию.
А. Ю. Ермаков, кандидат медицинских наук
С. Р. Болдырева
Московский НИИ педиатрии и детской хирургии Росздрава, Москва
ДГБ № 1, Санкт-Петербург
Противосудорожные средства
7. Противосудорожные средства (антиконвульсанты) и терапия припадков. Антиконвульсанты (лат. convellere – потрясать, колотить) – препараты, предупреждающие наступление эпилептических припадков, купирующие их и используемые при лечении эпилепсии и эпилептических синдромов экзогенно-органической этиологии. Механизмы действия антиконвульсантов связывают с их способностью подавлять активность эпилептического очага (группы нейронов, которые спонтанно и периодически приходят в состояние неконтролируемого возбуждения), блокировать исходящие от него нервные импульсы и снижать чувствительность нервных структур головного мозга к импульсам из эпилептического очага.
К числу основных противоэпилептических средств в настоящее время относятся следующие.
1) Карбамазепины. Это карбамазепин, финлепсин-форте, окскарбазепин. При всех простых и сложных парциальных припадках, а также при вторично генерализованных припадках карбамазепины – препараты первого выбора, они составляют от 16% (Япония) до 55% (Германия) объема всех назначаемых антиконвульсантов. Установлено, кроме того, что они оказывают положительный эффект в отношении психических функций пациентов с эпилепсией. Терапевтическая концентрация в плазме – 3–12 мг/л. Терапевтическая доза у детей – до 30 мг/кг массы тела/сут, у взрослых – до 20 мг/кг массы тела/сут.
Основные механизмы действия карбамазепина:
Место карбамазепина в терапии эпилепсии и эпилептических припадков:
При лечении парциальных форм эпилепсии предпочтительны пролонгированные или дюрантные формы карбамазепина. Это позволяет избегать рецидивов припадков к концу интервала между приемами препарата и предупреждать дозозависимые побочные эффекты, которые возникают вскоре после приема его внутрь. С целью снизить вероятность развития побочных эффектов рекомендуется распределять суточную дозу на 2–3 приема.
Рекомендуется избегать политерапии, т. е. комбинации с производными фенобарбитала и другими препаратами, вызывающими индукцию энзимов печени. Эффективность монотерапии парциальных припадков карбамазепином оценивается в 60–85%;
2) Вальпроаты. Это ацедипрол, вигабатрин, вальпромид, тиагабин. Высокая эффективность вальпроевой кислоты и ее солей при всех типах припадков превратила их в основной антиэпилептический препарат. Доля пациентов, принимающих вальпроаты, в настоящее время колеблется от 16% (Германия) до 57% (Япония). Терапевтическая концентрация вальпроатов в плазме составляет от 30 до 120 мг/л. Терапевтическая доза у детей – 20–30 мг/кг массы тела/сут, у взрослых – 15–20 мг/кг массы тела/сут.
Основные механизмы действия вальпроатов:
Место вальпроатов в терапии эпилепсии и эпилептических припадков:
Кроме того, вальпроаты оказывают:
3) Топирамат. Благодаря своим уникальным свойствам препарат получил распространение в 95 странах мира. В качестве монотерапии и в комбинации с другими антиконвульсантами топирамат используется в лечении эпилепсии у детей с 2-летнего возраста (топирамат практически не взаимодействует с другими антиконвульсантами, исключая фенитоин, поэтому хорошо переносится в режиме комбинированной терапии). Сочетание с карбамазепином, фенобарбиталом и фенотоином увеличивает скорость выведения топирамата приблизительно на 50%. Механизмы противоэпилептического действия топирамата:
Экспериментальные исследования показывают, что топирамат обладает также церебропротекторным действием, что априорно должно способствовать замедлению темпов нарастания эпилептических изменений личности и мнестико-интеллектуального дефицита.
Место топирамата в лечении эпилепсии, мигрени и психических расстройств:
Топирамат обладает также нормотимическим действием и, предупреждая развитие как маниакальных, так и депрессивных фаз, выгодно отличается от других нормотимиков.
Детям старше 2 лет в первую неделю лечения назначают по 0,5–1 мг/кг массы тела на ночь, после чего дозу каждые 1–2 недели увеличивают на 0,5–1 мг/кг в сутки. В большинстве случаев эффективные дозы у детей составляют 3–6 мг/кг в сутки. Принимают препарат 2 раза в сутки. Средняя терапевтическая доза препарата у взрослых составляет 200–400 мг/сут, лечение начинают с 50–100 мг/сут.
4) Ламотриджин. В настоящее время используется как препарат первого выбора в моно- и политерапии эпилепсии. Ламотриджин обладает уникальными фармакодинамическими свойствами:
Терапевтическая концентрация ламотриджина в плазме крови составляет 1–3 мг/л, уровень препарата в плазме имеет линейную зависимость от дозы, что позволяет подбирать ее без необходимости контроля содержания в плазме.
Место ламотриджина в терапии эпилепсии и аффективных расстройств:
Детям в возрасте от 2 до 12 лет препарат назначают начиная с 0,2 мг/кг 1 раз в сутки в течение 2 недель, в дальнейшем – по 0,5 мг/кг 1 раз в сутки в течение 2 недель, затем подбирают эффективную терапевтическую дозу. Средняя поддерживающая доза – 1–5 мг/кг/сут в 1–2 приема.
Детям старше 12 лет и взрослым монотерапию начинают с дозы 0,025 г (25 мг) 1 раз в сутки в течение 2 недель, затем дозу увеличивают до 0,05 г (50 мг) 1 раз в сутки в течение следующих 2 недель, потом постепенно повышают дозу на 0,05–0,1 г (50–100 мг) каждые 1–2 недели до получения терапевтического эффекта. Средняя поддерживающая доза – 0,2 г (200 мг) в сутки в 2 приема (в некоторых случаях она составляет до 0,5 г, или 500 мг/сут). Сочетание ламотриджина и вальпроатов часто позволяет достичь максимального эффекта терапии.
5) Фенитоин. Один из наиболее распространенных, эффективных и недорогих антиконвульсантов. Механизм его действия связывают с влиянием на вольтажзависимые натриевые каналы, а также с торможением кальциевых каналов. Терапевтическая концентрация в плазме – 5–20 мг/л. Терапевтическая доза у детей – 7 мг/кг массы тела/сут, у взрослых – 5 мг/кг массы тела/сут.
Место финитоина в терапии эпилепсии:
6) Клоназепам. Механизм противосудорожного действия объясняют воздействием на бензодиазепиновые рецепторы (3Н-диазепам-рецепторы), расположенные в ГАМКергической нейротрансмиттерной системе, представленной в разных структурах головного мозга, благодаря чему бензодиазепины стимулируют физиологические механизмы подавления активности большинства нейронов. Терапевтическая концентрация клоназепама в плазме – 0,025–0,075 мг/л. Терапевтическая доза при пероральном приеме – 0,015 мг/кг массы тела/сут.
Место клоназепама в терапии эпилепсии и аффективных расстройств:
7) Этосуксимид. Механизм действия связывают с влиянием на вольтажзависимые кальциевые каналы (Т-каналы) и торможение возбуждающих трансмиттеров в таламусе. Терапевтическая концентрация в плазме – 40–100 мг/л. Терапевтическая доза у взрослых – 20 мг/кг массы тела/сут, поддерживающая доза – 1–1,5–2 г/сут (в 2–4 приема). Детям до 6 лет назначают по 15–20 мг/кг/сут, но не более 0,25 г/сут, детям старше 6 лет – начиная с 0,25 мг/сут, поддерживающая доза – 15–30 мг/кг/сут. Полный эффект обычно достигается через 4–8 недель.
Место препарата в лечении эпилепсии:
8) Фенобарбитал. Механизм действия связывают с влиянием на вольтажзависимые натриевые каналы и рецепторы ГАМК. Терапевтическая концентрация в плазме – 5–20 мг/л. Терапевтическая доза у детей – 7 мг/кг массы тела/сут, у взрослых – 5 мг/кг массы тела/сут.
Место препарата в терапии эпилепсии:
9) Леветирацетам. Относится к высокоселективным антиконвульсантам. К настоящему времени известны следующие механизмы противосудорожного действия препарата:
Терапевтическая доза у детей – 10–30 мг/кг массы тела/сут, у взрослых – 10–40 мг/кг массы тела/сут.
Место препарата в терапии эпилепсии, аффективных и иных расстройств:
10) Прегабалин. Механизм противосудорожного действия препарата:
Место прегабалина в терапии эпилепсии и других патологий:
11) Лакосамид. Механизмы противосудорожного действия препарата не установлены, однако известно, что препарат способствует затуханию активности эпилептического очага. Лакосамид применяют в качестве дополнительной терапии при лечении парциальных и вторично генерализованных припадков у пациентов с фокальной эпилепсией в возрасте 16 лет и старше. Терапевтическая доза: начиная с 50 мг 2 раза в день, затем постепенно увеличивается на 100 мг. Максимальная доза – 400 мг/сут.
Антиконвульсанты: классификация и механизмы действия
По современному определению Международной противоэпилептической лиги и Международного бюро по эпилепсии 2005 г. (ILAE, IBE, 2005), «эпилепсия — это расстройство (заболевание) головного мозга, характеризующееся стойкой предрасположенностью к генерации (развитию) эпилептических припадков, а также нейробиологическими, когнитивными, психологическими и социальными последствиями этого состояния». Эпилепсия является одним из наиболее распространенных заболеваний нервной системы. Во всем мире распространенность эпилепсии составляет 4–10/1000 человек, что соответствует 0,5–1,0 % в популяции. [1]
В Международной классификации эпилептических припадков выделяют два основных вида: генерализованные и парциальные. К генерализованным относятся тонико-клонические, тонические, клонические, миоклонические припадки и абсансы; к парциальным — простые, сложные и вторично-генерализованные. Однако большое разнообразие припадков не всегда позволяет отнести их к одному из этих видов приступов, поэтому выделена еще одна рубрика — «неклассифицированные» припадки, к которым относят 9–15 % припадков. [2] В настоящее время для дифференцирования приступов пользуются классификацией, принятой в 1981 году в Киото, Япония. Умение правильно дифференцировать приступы — необходимый компонент рационального подбора противосудорожной терапии.
Классификация форм эпилепсии весьма обширна, однако глобально можно разделить всю эпилепсию в соответствии с этиологией на:
1. Идиопатическую (генетическая (наследственная) предрасположенность при отсутствии других возможных причин заболевания); [3]
2. Симптоматическую (причиной развития заболевания становится повреждение головного мозга вследствие различных факторов, действующих во время беременности и после родов: пороки развития головного мозга (преимущественно пороки развития коры большого мозга — кортикальные дисплазии); внутриутробные инфекции; хромосомные синдромы; наследственные болезни обмена веществ; гипоксически-ишемическое поражение мозга в перинатальном периоде (во время родов, в последние недели беременности, в первую неделю жизни ребенка); инфекционные заболевания нервной системы (менингиты, менингоэнцефалиты); черепно-мозговая травма; опухоли, дегенеративные заболевания нервной системы); [3]
3. Криптогенную (эпилептические синдромы, этиология которых неизвестна или неясна. Само слово «криптогенный» переводится как тайный, скрытый. Данные синдромы еще не удовлетворяют требованиям идиопатической разновидности, однако они не могут быть причислены и к симптоматической эпилепсии).
Механизм действия противосудорожных препаратов (антиконвульсантов) до конца не изучен. Во многом это объясняется недостаточной изученностью эпилепсии как таковой, поскольку зачастую причину судорожных приступов выяснить не удается.
Важное значение в развитии эпилептогенной активности головного мозга имеет нарушение баланса между тормозными (ГАМК, глицин) и возбуждающими нейромедиаторами (глутамат, аспартат). Для возбуждающих аминокислот имеются специфические рецепторы в головном мозге — NMDA- и АМРА-рецепторы, связанные в нейронах с быстрыми натриевыми каналами. Установлено, что содержание глутамата в тканях мозга в области эпилептогенного очага увеличено. Вместе с тем, содержание ГАМК в тканях мозга больных эпилепсией понижено. [4]
Классифицируют противоэпилептические средства, обычно, исходя из их применения при определенных формах эпилепсии: [4]
I. Генерализованные формы эпилепсии
— Большие судорожные припадки (grand mal; тонико-клонические судороги):
Натрия вальпроат. Ламотриджин, Дифенин, Топирамат,
Карбамазепин, Фенобарбитал, Гексамидин.
— Эпилептический статус:
Диазепам, Клоназепам, Дифенин-натрий,
Лоразепам, Фенобарбитал-натрий, Средства для наркоза.
— Малые приступы эпилепсии (petit mal; absense epilepsia):
Этосуксимид, Клоназепам, Триметин,
Натрия вальпроат, Ламотриджин.
— Миоклонус-эпилепсия:
Клоназепам, Натрия вальпроат, Ламотриджин.
II. Фокальные (парциальные) формы эпилепсии
Карбамазепин, Ламотриджин, Клоназепам, Тиагабин,
Натрия вальпроат, Фенобарбитал, Топирамат, Вигабатрин,
Дифенин, Гексамидин, Габапентин.
Также существует классификация по “поколениям” препаратов:
I — Антиконвульсанты 1-го поколения
Фенобарбитал, Фенитоин, Карбамазепин,
Вальпроевая кислота, Этосуксимид.
II — Антиконвульсанты 2-го поколения
Фелбамат, Габапентин, Ламотриджин, Топирамат, Тиагабин,
Окскарбазепин, Леветирацетам, Зонизамид, Клобазам, Вигабатрин.
III — Антиконвульсанты 3-го поколения (новейшие, многие в стадии клинического исследования)
Бриварацетам, Валроцемид, Ганаксолон, Караберсат, Карисбамат, Лакосамид, Лозигамон, Прегабалин, Ремацемид, Ретигабин, Руфинамид, Сафинамид, Селетрацетам, Соретолид, Стирипентол, Талампанел, Флуорофелбамат, Фосфенитоин, Эсликарбазепин, DP- вальпроевая кислота.
В настоящем посте будут рассматриваться основные препараты I и II поколений.
Кроме того, классифицировать противоэпилептические средства можно исходя из принципов их действия:
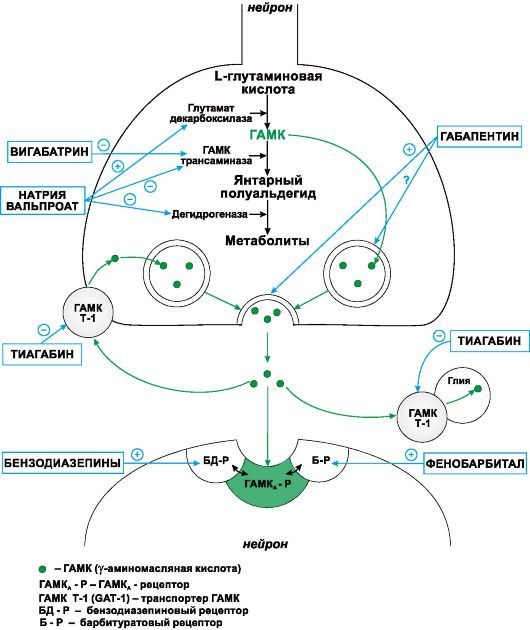
Рисунок 1. | Сайты действия различных препаратов на метаболизм ГАМК
I. Средства, блокирующие натриевые каналы:
Дифенин, Ламотриджин, Топирамат,
Карбамазепин, Натрия вальпроат.
II. Средства, блокирующие кальциевые каналы Т-типа:
Этосуксимид, Триметин, Натрия вальпроат.
III. Средства, активирующие ГАМК-ергическую систему:
1. Средства, повышающие аффинитет ГАМК к ГАМК-А-рецепторам Бензодиазепины, Фенобарбитал, Диазепам, Лоразепам, Клоназепам, Топирамат.
2. Средства, способствующие образованию ГАМК и препятствующие ее инактивации
Натрия вальпроат
3. Средства, препятствующие инактивации ГАМК
Вигабатрин
4. Средства, блокирующие нейрональный и глиальный захват ГАМК
Тиагабин
IV. Средства, понижающие активность глутаматергической системы:
1. Средства, уменьшающие высвобождение глутамата из пресинаптических окончаний
Ламотриджин
2. Средства, блокирующие глутаматные (АМPА) рецепторы
Топирамат
Блокаторы натриевых каналов
Карбамазепин (Тегретол, Финлепсин) является производным иминостильбена. Противосудорожное действие препарата обусловлено тем, что он блокирует натриевые каналы мембран нервных клеток и снижает способность нейронов поддерживать высокочастотную импульсацию, типичную для эпилептогенной активности; блокирует пресинаптические натриевые каналы и препятствует высвобождению медиатора. Препарат метаболизируется в печени, повышает скорость собственного метаболизма за счет индукции микросомальных ферментов печени. Один из метаболитов — карбамазепин-10,11-эпоксид — обладает противосудорожной, антидепрессивной и антиневралгической активностью. Выводится в основном почками (более 70 %). Побочные эффекты: потеря аппетита, тошнота, головная боль, сонливость, атаксия; нарушение аккомодации; диплопия, нарушения сердечного ритма, гипонатриемия, гипокальциемия, гепатит, аллергические реакции, лейкопения, тромбоцитопения, агранулоцитоз (требуется контроль картины крови). Существует риск развития тератогенного действия. Карбамазепин повышает скорость метаболизма, вследствие чего снижает в крови концентрацию некоторых лекарственных веществ, в том числе, противоэпилептических препаратов (клоназепама, ламотриджина, натрия вальпроата, этосуксимида и др.).
Фенитоин (Дифенин) является производным гидантоина. Противосудорожное действие: блокада натриевых каналов; уменьшение вхождения в нейроны ионов натрия; нарушение генерации и распространения высокочастотных разрядов; снижение возбудимости нейронов, препятствие их активации при поступлении к ним импульсов из эпилептогенного очага. Для предупреждения судорожных припадков фенитоин назначают внутрь в виде таблеток. Фенитоин-натрий применяют для купирования эпилептического статуса, вводят внутривенно.
Фенитоин интенсивно связывается с белками плазмы крови (на 90 %). Метаболизируется в печени, основной неактивный метаболит — 5-(п-гидроксифенил)-5-фенилгидантоин — подвергается конъюгации с глюкуроновой кислотой. В основном выводится из организма почками в виде метаболитов. Побочные эффекты: головокружение, возбуждение, тошнота, рвота, тремор, нистагм, атаксия, диплопия, гирсутизм; гиперплазия десен (особенно у молодых людей), снижение уровня фолатов и мегалобластная анемия, остеомаляция (связано с нарушением метаболизма витамина D), аллергические реакции и др. Отмечено тератогенное действие. Вызывает индукцию микросомальных ферментов в печени и таким образом ускоряет метаболизм ряда лекарственных веществ (кортикостероиды, эстрогены, теофиллин), повышает их концентрацию в крови.
Ламотриджин (Ламиктал) блокирует натриевые каналы мембран нейронов, а также уменьшает выделение глутамата из пресинаптических окончаний (что связывают с блокадой натриевых каналов пресинаптических мембран). Побочные эффекты: сонливость, диплопия, головная боль, атаксия, тремор, тошнота, кожные высыпания. [5]
Блокаторы кальциевых каналов Т-типа
Этосуксимид (Суксилеп) относится к химическому классу сукцинимидов, которые являются производными янтарной кислоты. Противосудорожное действие: блокирует кальциевые каналы Т-типа, участвующие в развитии эпилептической активности в таламокортикальной области. Является препаратом выбора для лечения абсансов. Метаболизируется в печени. В основном выводится из организма почками в виде метаболитов и около 20 % от введенной дозы — в неизмененном виде. Побочные эффекты: тошнота, рвота, дискинезия; головная боль, сонливость нарушения сна, снижение психической активности, состояние тревоги, аллергические реакции; редко — лейкопения, агранулоцитоз.
Механизм действия некоторых противоэпилептических средств включает несколько компонентов и не установлено, какой из них является преобладающим, вследствие чего эти препараты трудно отнести к одной из вышеприведенных групп. К таким препаратам можно отнести вальпроевую кислоту, топирамат.
Вальпроевая кислота (Ацедипрол, Апилепсин, Депакин) применяется также в виде вальпроата натрия. Противосудорожное действие: 1) блокирует натриевые каналы нейронов и снижает возбудимость нейронов в эпилептогенном очаге; 2) ингибирует фермент, метаболизирующий ГАМК (ГАМК-трансаминаза) + повышает активность фермента, который участвует в синтезе ГАМК (глутаматдекарбоксилаза); увеличивает содержание ГАМК в тканях головного мозга; 3) блокирует кальциевые каналы. Выводится главным образом почками в виде конъюгатов с глюкуроновой кислотой или в виде продуктов окисления. Побочные эффекты: тошнота, рвота, диарея, боли в желудке, атаксия, тремор, кожные аллергические реакции, диплопия, нистагм, анемия, тромбоцитопения, ухудшение свертываемости крови, сонливость. Препарат противопоказан при нарушении функции печени и поджелудочной железы.
Топирамат (Топамакс) обладает сложным, до конца не выясненным механизмом действия. Он блокирует натриевые каналы, а также увеличивает действие ГАМК на ГАМК-А-рецепторы. Снижает активность рецепторов возбуждающих аминокислот (предположительно, каинатных). Препарат используется для дополнительной терапии парциальных и генерализованных тонико-клонических судорог в сочетании с другими противоэпилептическими средствами. Побочные эффекты: сонливость, заторможенность, снижение аппетита (анорексия), диплопия, атаксия, тремор, тошнота. [5]
Средства, повышающие ГАМК-ергическую активность
Фенобарбитал (Люминал) взаимодействует со специфическими местами связывания (барбитуратными рецепторами), находящимися на ГАМК-А-рецепторном комплексе и, вызывая аллостерическую регуляцию ГАМК-А-рецептора, повышает его чувствительность к ГАМК. При этом увеличивается открытие хлорных каналов, связанных с ГАМК-А-рецептором, — больше ионов хлора поступает через мембрану нейрона в клетку и развивается гиперполяризация мембраны, что приводит к снижению возбудимости нейронов эпилептогенного очага. Кроме того, полагают, что фенобарбитал, взаимодействуя с мембраной нейрона, вызывает изменение ее проницаемости и для других ионов (натрия, калия, кальция), а также проявляет антагонизм в отношении глутамата. Метаболизируется в печени; неактивный метаболит (4-оксифенобарбитал) выделяется почками в виде глюкуронида, около 25 % — в неизмененном виде.
Побочные эффекты: гипотония, аллергические реакции (кожная сыпь), ощущение разбитости, сонливость, депрессия, атаксия, тошнота, рвота. Фенобарбитал вызывает выраженную индукцию микросомальных ферментов печени и поэтому ускоряет метаболизм лекарственных веществ, в том числе ускоряется метаболизм самого фенобарбитала. При повторных применениях вызывает развитие толерантности и лекарственной зависимости.
Бензодиазепины (Клоназепам) стимулируют бензодиазепиновые рецепторы ГАМК-А-рецепторного комплекса; повышается чувствительность ГАМК-А-рецепторов к ГАМК и происходит увеличение частоты открытия хлорных каналов, стимулируется поступление в клетку большего числа отрицательно заряженных ионов хлора, следствием чего является гиперполяризация нейрональной мембраны и усиление тормозных эффектов ГАМК. Побочные эффекты: усталость, головокружение, нарушение координации движений, мышечная слабость, депрессивные состояния, нарушения мышления и поведения, аллергические реакции (кожная сыпь). При длительном применении у детей клоназепам может вызвать нарушения умственного и физического развития. При парентеральном введении возможны угнетение дыхания (вплоть до апноэ), гипотензия, брадикардия. Вигабатрин (Сабрил) является структурным аналогом ГАМК и необратимо ингибирует ГАМК-трансаминазу, разрушающую ГАМК. Увеличивает содержание ГАМК в головном мозге. Вигабатрин обладает широким спектром противосудорожного действия, используется для профилактики больших судорожных припадков, эффективен при парциальных судорогах.
Габапентин (Нейронтин) создавался как липофильный структурный аналог ГАМК для стимуляции ГАМКА-рецепторов в головном мозге. Однако ГАМК-миметической активностью не обладает, но оказывает противосудорожное действие. Механизм действия не ясен, предполагается, что препарат способствует высвобождению ГАМК, не исключена возможность блокады транспортных систем возбуждающих аминокислот. Габапентин применяют как дополнение при лечении парциальных судорог. Препарат эффективен при нейропатических болях. Побочные эффекты: сонливость, головокружение, атаксия, тремор, головная боль. [5]