аргентум таблица менделеева что обозначает
Серебро
Серебро (Ag от лат. Argentum ) — элемент 11 группы (по устаревшей классификации — побочной подгруппы первой группы), пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 47.
Простое вещество серебро — ковкий, пластичный благородный металл серебристо-белого цвета. Кристаллическая решётка — гранецентрированная кубическая. Температура плавления — 962 °C, плотность — 10,5 г/см³.
| Название, символ, номер | Серебро / Argentum (Ag), 47 |
|---|---|
| Атомная масса (молярная масса) | 107,8682(2) [2] а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d 10 5s 1 |
| Радиус атома | 144 пм |
| Ковалентный радиус | 134 пм |
| Радиус иона | (+2e) 89 (+1e) 126 пм |
| Электроотрицательность | 1,93 (шкала Полинга) |
| Электродный потенциал | +0,799 |
| Степени окисления | 2, 1 |
| Энергия ионизации | |
| Плотность (при н. у.) | 10,5 г/см³ |
| Температура плавления | 1235,1 К; 962 °C |
| Температура кипения | 2485 К; 2162°C |
| Уд. теплота плавления | 11,95 кДж/моль |
| Уд. теплота испарения | 254,1 кДж/моль |
| Молярная теплоёмкость | 25,36 [3] Дж/(K·моль) |
| Молярный объём | 10,3 см³/моль |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 4,086 Å |
| Температура Дебая | 225 K |
| Теплопроводность | (300 K) 429 Вт/(м·К) |
| Номер CAS | 7440-22-4 |
Содержание
История
Серебро известно человечеству с древнейших времён. Это связано с тем, что в своё время серебро, равно как и золото, часто встречалось в самородном виде — его не приходилось выплавлять из руд. Это предопределило довольно значительную роль серебра в культурных традициях различных народов. Одним из древнейших центров добычи и обработки серебра была доисторическая Сардиния, где оно было известно с раннего энеолита.
В Ассирии и Вавилоне серебро считалось священным металлом и являлось символом Луны. В Средние века серебро и его соединения были очень популярны среди алхимиков. С середины XIII века серебро становится традиционным материалом для изготовления посуды. Кроме того, серебро и по сей день используется для чеканки юбилейных монет (выход из оборота последних серебряных монет в 1960—1970-е годы примерно совпал с кризисом Бреттон-Вудской валютной системы).
Происхождение названия
Греческое название серебра ἄργυρος, árgyros произошло от индоевропейского корня *H₂erǵó-, *H₂erǵí-, означающего «белый, блистающий». Из того же корня происходит и его латинское название — argentum.
Нахождение в природе
Среднее содержание серебра в земной коре (по Виноградову) — 70 мг/т. Максимальные его концентрации устанавливаются в глинистых сланцах, где достигают 1 г/т. Серебро характеризуется относительно низким энергетическим показателем ионов, что обуславливает незначительное проявление изоморфизма этого элемента и сравнительно трудное его вхождение в решётку других минералов. Наблюдается лишь постоянный изоморфизм ионов серебра и свинца. Ионы серебра входят в решётку самородного золота, количество которого иногда достигает в электруме почти 50 % по массе. В небольшом количестве ион серебра входит в решётку сульфидов и сульфосолей меди, а также в состав теллуридов, развитых в некоторых полиметаллических и особенно, в золото-сульфидных и золото-кварцевых месторождениях.
Определённая часть благородных и цветных металлов встречается в природе в самородной форме. Известны и документально подтверждены факты нахождения не просто больших, а огромных самородков серебра. Так, например, в 1477 году на руднике «Святой Георгий» (месторождение Шнееберг в Рудных горах в 40—45 км от города Фрайберг) был обнаружен самородок серебра весом 20 т. Глыбу серебра размером 1×1×2,2 м выволокли из горной выработки, устроили на ней праздничный обед, а затем раскололи и взвесили. В Дании, в музее Копенгагена, находится самородок весом 254 кг, обнаруженный в 1666 году на норвежском руднике Конгсберг. Крупные самородки обнаруживали и на других континентах. В настоящее время в здании парламента Канады хранится одна из добытых на месторождении Кобальт в Канаде самородных пластин серебра, имеющая вес 612 кг. Другая пластина, найденная на том же месторождении и получившая за свои размеры название «серебряный тротуар», имела длину около 30 м и содержала 20 т серебра. Однако, при всей внушительности когда-либо обнаруженных находок, следует отметить, что серебро химически более активно, чем золото, и по этой причине реже встречается в природе в самородном виде. По этой же причине растворимость серебра выше и его концентрация в морской воде на порядок больше, чем у золота (около 0,04 мкг/л и 0,004 мкг/л соответственно).
Известно более 50 природных минералов серебра, из которых важное промышленное значение имеют лишь 15—20, в том числе:
Как и другим благородным металлам, серебру свойственны два типа проявлений:
Собственно серебряные месторождения играют достаточно существенную роль в мировой добыче серебра, однако следует отметить, что основные разведанные запасы серебра (75 %) приходятся на долю комплексных месторождений.
Содержание серебра в рудах цветных металлов 10-100 г/т, в золото-серебряных рудах 200—1000 г/т, а в рудах серебряных месторождений 900—2000 г/т, иногда десятки килограммов на тонну.
Серебро встречается и в каустоболитах: торфах, нефти, угле, битуминозных сланцах.
Месторождения
Значительные месторождения серебра расположены на территориях следующих стран:
Также месторождения серебра есть на Кипре и на Сардинии.
Физические свойства
Чистое серебро — довольно тяжёлый (легче свинца, но тяжелее меди, плотность — 10,5 г/см³), необычайно пластичный серебристо-белый металл (коэффициент отражения света близок к 100 %). Тонкая серебряная фольга в проходящем свете имеет фиолетовый цвет. С течением времени металл тускнеет, реагируя с содержащимися в воздухе следами сероводорода и образуя налёт сульфида, чья тонкая плёнка придаёт тогда металлу характерную розоватую окраску. Обладает самой высокой теплопроводностью среди металлов. При комнатной температуре имеет самую высокую электропроводность среди всех известных металлов (удельное электрическое сопротивление 1,59⋅10 −8 Ом·м при температуре 20 °C). Относительно тугоплавкий металл, температура плавления 962 °C.
Химические свойства
Серебро, будучи благородным металлом, отличается относительно низкой реакционной способностью, оно не растворяется в соляной и разбавленной серной кислотах. Однако в окислительной среде (в азотной, горячей концентрированной серной кислоте, а также в соляной кислоте в присутствии свободного кислорода) серебро растворяется:
Растворяется оно и в хлорном железе, что применяется для травления:
Серебро также легко растворяется в ртути, образуя амальгаму (жидкий сплав ртути и серебра).
Серебро не окисляется кислородом даже при высоких температурах, однако в виде тонких плёнок может быть окислено кислородной плазмой или озоном при облучении ультрафиолетом. Во влажном воздухе в присутствии даже малейших следов двухвалентной серы (сероводород, тиосульфаты, резина) образуется налёт малорастворимого сульфида серебра, обуславливающего потемнение серебряных изделий:
В отсутствии кислорода:
Свободные галогены легко окисляют серебро до галогенидов:
Однако на свету эта реакция обращается, и галогениды серебра (кроме фторида) постепенно разлагаются. На этом явлении основан принцип чёрно-белой фотографии.
При нагревании с серой серебро даёт сульфид:
Соли серебра (I), за редким исключением (нитрат, перхлорат, фторид), нерастворимы в воде, что часто используется для определения ионов галогенов (хлора, брома, йода) в водном растворе.
Применение
Области применения серебра постоянно расширяются, и его применение — это не только сплавы, но и химические соединения. Определённое количество серебра постоянно расходуется для производства серебряно-цинковых и серебряно-кадмиевых аккумуляторных батарей, обладающих очень высокой энергоплотностью и массовой энергоёмкостью и способных при малом внутреннем сопротивлении выдавать в нагрузку очень большие токи.
Серебро используется в качестве добавки (0,1—0,4 %) к свинцу для отливки токоотводов положительных пластин специальных свинцовых аккумуляторов, имеющих очень большой срок службы (до 10—12 лет) и малое внутреннее сопротивление.
Хлорид серебра используется в хлор-серебряно-цинковых батареях, а также для покрытий некоторых радарных поверхностей. Кроме того, хлорид серебра, прозрачный в инфракрасной области спектра, используется в инфракрасной оптике.
Монокристаллы фторида серебра используются для генерации лазерного излучения с длиной волны 0,193 мкм (ультрафиолетовое излучение).
Серебро используется в качестве катализатора в фильтрах противогазов.
Ацетиленид серебра (карбид) изредка применяется как мощное инициирующее взрывчатое вещество (детонаторы).
Фосфат серебра используется для варки специального стекла, используемого для дозиметрии излучений. Примерный состав такого стекла: фосфат алюминия — 42 %, фосфат бария — 25 %, фосфат калия — 25 %, фосфат серебра — 8 %.
Перманганат серебра, кристаллический тёмно-фиолетовый порошок, растворимый в воде; используется в противогазах. В некоторых специальных случаях серебро также используется в сухих гальванических элементах следующих систем: хлор-серебряный элемент, бром-серебряный элемент, йод-серебряный элемент.
Серебро зарегистрировано в качестве пищевой добавки E174.
В медицине
До середины ХХ века нитрат серебра использовался в качестве наружного антисептика под названием ляпис. На свету он разлагается на свободное серебро, диоксид азота и молекулярный кислород. Однако в настоящее время во всех сферах применяется множество значительно более эффективных антисептиков.
Начиная с 1990 года, в нетрадиционной медицине наблюдается возрождение использования коллоидного серебра в качестве средства для лечения многочисленных болезней. В лабораторных исследованиях получены разные результаты: в одних исследований показано, что антимикробное воздействие серебра весьма незначительно, в то время как другие показали, что раствор 5—30 ppm является эффективным против стафилококка и кишечной палочки. Данное противоречие связано с размерами коллоидных наночастиц серебра — чем меньше их размер, тем более выражен антимикробный эффект. Следует отметить, что подобные свойства наночастиц характерны для большинства переходных металлов и связаны с разрушением клеточной мембраны бактерий при сорбции наночастицы. Это, однако, проявляется только в очень чистых растворах.
Серебро — это тяжёлый металл, содержание которого в питьевой воде регламентировано СанПиН 2.1.4.1074-01 «Вода питьевая» — серебру присвоен класс опасности 2, «высокоопасное вещество». Госсанэпидемнадзор официально утвердил гигиенические нормативы содержания вредных веществ в питьевой воде, в этих нормативах содержание серебра в питьевой воде ограничено концентрацией 0,05 мг/л.
В США и Австралии препараты на основе коллоидного серебра не признаны лекарствами и предлагаются в продовольственных магазинах. Также в изобилии их можно встретить в Интернет-магазинах по всему миру в качестве БАД (биологически активных добавок), более простое название — пищевые добавки. Законом США и Австралии было запрещено маркетологам приписывать медицинскую эффективность коллоидному серебру. Но некоторые сайты, в том числе на их территории, по-прежнему указывают на благотворное воздействие препарата при профилактике простуды и гриппа, а также на лечебное воздействие при более серьёзных заболеваниях, таких, как диабет, рак, синдром хронической усталости, ВИЧ/СПИД, туберкулёз, и другие заболевания. Нет никаких медицинских исследований, свидетельствующих о том, что коллоидное серебро эффективно для какого-либо из этих заявленных симптомов.
До эпохи доказательной медицины растворы солей серебра широко применяли в качестве антисептических и вяжущих средств. На этом свойстве серебра основано действие таких лекарственных препаратов, как протаргол, колларгол и др., представляющих собой коллоидные формы серебра. В настоящее время препараты серебра применяются всё реже в связи с низкой эффективностью.
Физиологическое действие
Следы серебра (порядка 0,02 мг/кг) содержатся в организмах всех млекопитающих, но его биологическая роль недостаточно изучена. Головной мозг человека характеризуется повышенным содержанием серебра (0,03 мг на 1000 г свежей ткани, или 0,002 % по массе в золе). Интересно, что в изолированных ядрах нервных клеток — нейронов — серебра гораздо больше (0,08 % по массе в золе).
С пищевым рационом человек получает в среднем около 0,1 мг Ag в сутки. Относительно много его содержит яичный желток (0,2 мг в 100 г). Выводится серебро из организма главным образом с калом.
Ионы серебра обладают бактериостатическими свойствами. Однако для достижения бактериостатического эффекта концентрацию ионов серебра в воде необходимо повысить настолько, что она становится непригодной для питья. Бактериостатические свойства серебра известны с древности. В VI веке до н. э. персидский царь Кир II Великий в своих военных походах использовал серебряные сосуды для хранения воды. Покрытие поверхностных ран серебряными пластинами практиковалось ещё в древнем Египте. Очистку больших количеств воды, основанную на бактерицидном действии серебра, особенно удобно производить электрохимическим путём.
В начале 1970-х годов нижний предел бактериостатического действия серебра оценивался содержанием его в воде порядка 1 мкг/л. По данным 2009 года — нижний предел действия находится на уровне 50—300 мкг/л, что уже опасно для человека.
Как и все тяжёлые металлы, серебро при избыточном поступлении в организм токсично.
По санитарным нормам США содержание серебра в питьевой воде не должно превышать 0,05 мг/л. Согласно действующим российским санитарным нормам серебро относится к высокоопасным веществам (класс опасности 2 по санитарно-токсикологическому признаку вредности), и предельно допустимая концентрация серебра в питьевой воде составляет те же 0,05 мг/л.
При длительном поступлении в организм избыточных доз серебра развивается аргирия, внешне выражающаяся серой окраской слизистых оболочек и кожи, причём преимущественно на освещённых участках тела, что обусловлено отложением частичек восстановленного серебра. Какие-либо расстройства самочувствия заболевших аргирией наблюдаются далеко не всегда. Вместе с тем, немедицинскими источниками отмечалось, что они не подвержены инфекционным заболеваниям.
Ионы серебра оказывают генотоксичный эффект, разрушая целостность молекул ДНК в клетках, в том числе вызывая перестройки в хромосомах и фрагментацию последних. Кроме того, исследователи выявили повреждения генов в сперматозоидах.
Добыча
Серебро было известно с глубокой древности (4-е тысячелетие до н. э.) в Египте, Персии, Китае.
Значительным источником извлечённого серебра (не в виде самородков) считается территория Анатолии (современная Турция). Добываемое серебро поступало в основном на Ближний Восток, в Крит и Грецию.
Более или менее значительные данные о добыче серебра относятся к периоду после III тысячелетия до н. э., например, известно, что халдеи в 2500 году до н. э. извлекали металл из свинцово-серебряных руд.
После 1200-х годов до н. э. центр производства металла сместился в Грецию, в Лаврион, недалеко от Афин. Шахты были весьма богаты: их добыча с 600 до 300 года до н. э. составляла около 1 млн тройских унций (30 т) в год. В течение почти тысячи лет они оставались самым крупным источником серебра в мире.
С IV по середину I века до н. э. лидером по производству серебра были Испания и Карфаген.
Во II—XIII веках действовало множество рудников по всей Европе, которые постепенно истощались.
По мере расширения торговых связей, требующих денежного обращения, в XII—XIII веках выросла добыча серебра в Гарце, Тироле (главный центр добычи — Швац), Рудных горах, позднее в Силезии, Трансильвании, Карпатах и Швеции. С середины XIII до середины XV веков ежегодная добыча серебра в Европе составляла 25—30 т; во 2-й половине XV века она достигала 45—50 т в год. На германских серебряных рудниках в это время работало около 100 тысяч человек. Крупнейшим из старых месторождений самородного серебра является открытое в 1623 году месторождение Конгсберг в Норвегии.
Освоение Америки привело к открытию богатейших месторождений серебра в Кордильерах. Главным источником становится Мексика, где в 1521—1945 годах было добыто около 205 тыс. т металла — около трети всей добычи за этот период. В крупнейшем месторождении Южной Америки — Потоси — за период с 1556 по 1783 год добыто серебра на 820 513 893 песо и 6 «прочных реалов» (последний в 1732 году равнялся 85 мараведи).
В России первое серебро было выплавлено в июле 1687 года российским рудознатцем Лаврентием Нейгартом из руд Аргунского месторождения (Нерчинский горный округ). В 1701 году в Забайкалье был построен первый сереброплавильный завод, который на постоянной основе стал выплавлять серебро 3 года спустя. Некоторое количество серебра добывалось на Алтае. Лишь в середине XX века освоены многочисленные месторождения на Дальнем Востоке.
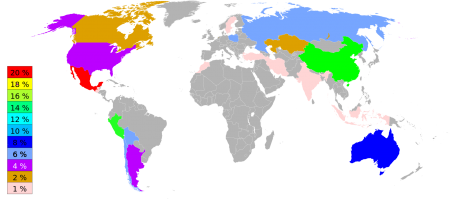
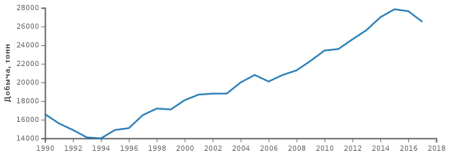
В 2008 году всего добыто 20 900 т серебра. Лидером добычи является Перу (3600 т), далее следуют Мексика (3000 т), Китай (2600 т), Чили (2000 т), Австралия (1800 т), Польша (1300 т), США (1120 т), Канада (800 т).
На 2008 год лидером добычи серебра в России является компания «Полиметалл», добывшая в 2008 году 535 т. В 2009 и 2010 годах «Полиметалл» добыл по 538 т серебра, в 2011 году — 619 т.
Мировые запасы серебра оцениваются в 505 тыс. т (на 1986 год), подтверждённые — 360 тыс. т.
В мифологии
В мифологии многих народов серебру приписываются магические свойства, способность отгонять всяческую нечисть — оборотней, вампиров, злых духов и так далее.
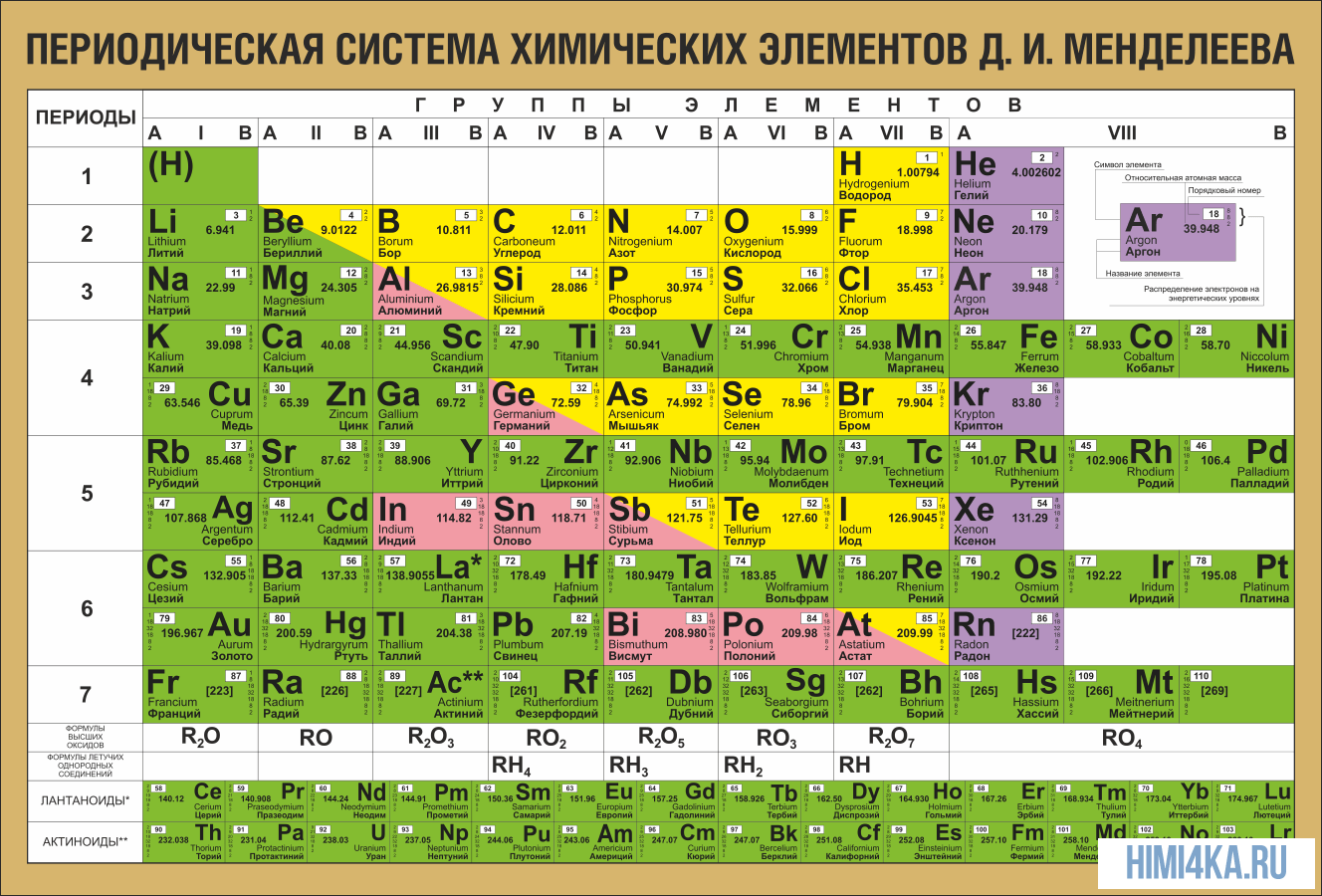
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
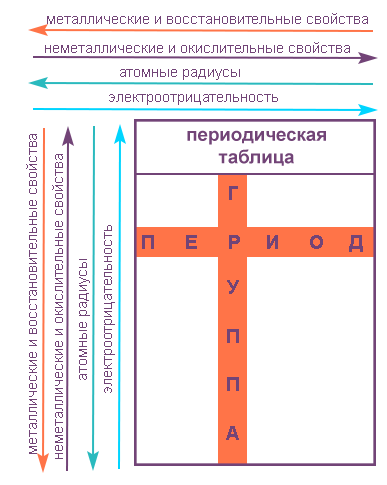
Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.