артифициальный мочевой пузырь что это
Симптомы, лечение и удаление опухолей мочевого пузыря
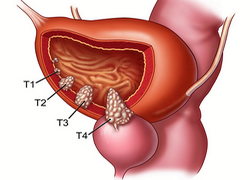
Опухоль мочевого пузыря – новообразование, которое возникает в полости или на стенке органа. Болезнь может протекать как с яркими симптомами, так и без особых признаков, что часто приводит к поздней диагностике. По основной классификации опухоли бывают доброкачественными и злокачественными. Именно тип образования, его размеры и место определяют схему лечения опухоли мочевого пузыря и прогноз выздоровления.
Причины появления опухоли
Механизм развития опухолей заключается в активном делении клеток. Такие процессы могут быть запущены разными факторами, которые провоцируют мутацию генетического клеточного материала. В случае с мочевым пузырем особенно опасны курение, неблагоприятная экология и работа, связанная с химическими веществами. Эти факторы могут вызывать разные виды опухолей мочевого пузыря:
Доброкачественные опухоли часто диагностируются у рабочих, занятых в лакокрасочной, бумажной, химической и резиновой промышленности. Провоцировать заболевание может застой мочи. Чем выше ее концентрация и чем дольше она задерживается в пузыре, тем более сильным оказывается опухолегенное действие веществ в ее составе. У мужчин причинами опухолей выступают заболевания мочеполового тракта:
Ввиду особенностей анатомического строения мужчины больше подвержены риску возникновения новообразований. Злокачественные опухоли мочевого пузыря могут развиваться по тем же причинам:
Симптомы опухолевых заболеваний
Рассматривая симптомы опухоли мочевого пузыря, стоит отметить, что на раннем этапе она никак себя не проявляет. Признаки возникают, когда новообразование достигает таких размеров, при которых оно может раздражать стенки органа. В такой ситуации у человека могут быть следующие жалобы:
Методы диагностики опухоли мочевого пузыря
Поскольку опухоль может носить доброкачественный или злокачественный характер, особое значение приобретает дифференциальная диагностика. Она направлена на то, чтобы определить тип новообразования, поскольку от этого зависит схема лечения. Исходя из этого, в инструментальную и лабораторную диагностику опухоли мочевого пузыря включают:
Гиперактивный мочевой пузырь: как справиться с деликатной проблемой
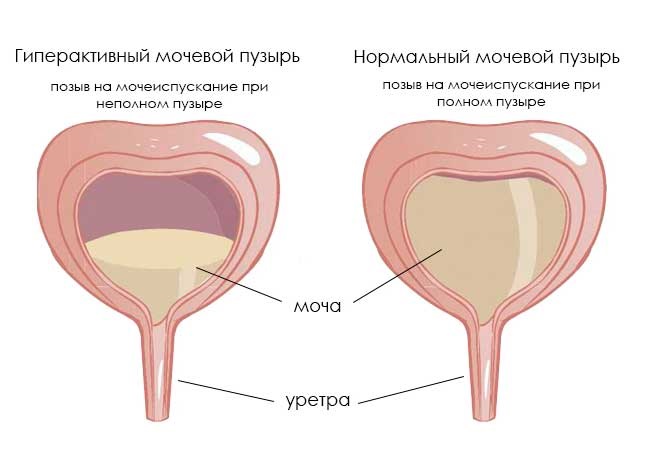
Гиперактивный мочевой пузырь (гиперрефлекторный, ГАМП или ГМП) – форма нейрогенного мочевого пузыря (НМП), при котором у человека появляются проблемы с произвольным сознательным контролем мочеиспускания. Эта форма НМП встречается чаще, чем гипорефлекторная. Основной симптом – частое мочеиспускание, которое может сопровождаться увеличением объема мочи. ГАМП – серьезная проблема, поскольку по распространенности сравним с гипертонией, хроническим бронхитом, астмой и заболеваниями сердца.
Из-за чего может развиться гиперактивный мочевой пузырь
Гиперактивный мочевой пузырь у женщин встречается чаще, чем у мужчин – 60% против 40%. Основной причиной выступают нарушения в работе нервной системы, вызванные:
Еще ГАМП развивается на фоне сахарного диабета, отравления организма алкоголем или химическими веществами. Также расстройство может быть врожденным из-за аномалий в строении мочевыделительного канала.
У мужчин ГАМП может вызывать аденома простаты, из-за которой сужается мочеиспускательный канал. У женщин синдром гиперактивного мочевого пузыря имеет факторы риска, которые увеличивают вероятность столкнуться с таким заболеваниям. В список таких факторов включают:
Еще с ГАМП можно столкнуться в период климакса, когда организму недостает гормонов эстрогенов. Чувствительность детрузора (его сокращение приводит к мочеиспусканию) может повышаться при заместительной гормонотерапии при раке молочной железы. Не меньшее значение в развитии ГАМП имеют стрессовые ситуации и вредные условия труда.
Признаки гиперактивного мочевого пузыря
Нейрогенный гиперактивный мочевой пузырь проявляется в частом мочеиспускании (поллакиурии), причем малыми порциями при незаполненном пузыре. На его фоне может наблюдаться полиурия – увеличенное количество мочи, свыше 1800-2000 мл при норме 1000-1500 мл. В ряде случаев за сутки может выделяться более 3 л мочи. Причем желание помочиться может вызывать звук льющейся воды.
Еще при ГМП возможно недержание мочи, иногда возникающее даже от любого напряжения брюшных мышц. Чаще всего это ургентное недержание, при котором резко появляется желание помочиться, после чего происходит непроизвольное выделение мочи. Другой характерный признак – ноктурия. Это необходимость просыпаться ночью для мочеиспускания более 1-2 раз. Ноктурия, поллакиурия и полиурия могут возникать как одновременно, так и изолировано.
Нередко ГМП сопровождается симптомами, которые указывают на расстройство вегетативной нервной системы. К таким признакам относятся повышение артериального давления и гипергидроз (усиленное потоотделение). Еще ГАМП влияет на социализацию. Человек постоянно боится не успеть в туалет, переживает из-за неприятного запаха. Из-за произвольного выделения мочи может развиваться экзема или мочевой дерматит.
Как лечат ГАМП
Лечение гиперактивного мочевого пузыря у мужчин и женщин производится по одним и тем же принципам. Но терапия не имеет единой схемы. Она носит, в основном, паллиативный характер, т. е. проводится для улучшения качества жизни пациента. Можно сказать одно – лечение гиперактивного мочевого пузыря всегда сложное и комплексное. К основным методам относятся:
В самых сложных случаях, когда не помогают режим и лекарства, прибегают к малоинвазивным операциям. Но решение об их проведении принимает врач. При ГАМП необходимо обратиться к урологу. В Государственном центре урологии вы можете получить квалифицированную медицинскую помощь в рамках ОМС. Для этого вам необходимо записаться на прием к урологу, воспользовавшись формой на сайте или нашим контактным номером.
Нейрогенный мочевой пузырь: деликатная проблема и как ее решить
Нейрогенный мочевой пузырь — отклонение в работе мочевыделительной системы, при котором нарушаются процессы накопления и эвакуации мочи. У здорового человека их регулирует центральная нервная система, что позволяет ему волевым усилием контролировать удержание и испускание мочи. Если есть заболевания, от которых страдает головной или спинной мозг, т. е. ЦНС, то с мочеотделением могут возникнуть проблемы. Одна из них — это и есть нейрогенный мочевой пузырь.
Как проявляется заболевание
Главный симптом — проблемы с мочеиспусканием. Они могут проявляться по-разному. Все зависит от того, как работает детрузор — мышечная оболочка, сокращение которой приводит к мочеиспусканию. Так, у человека может быть гипер- или гипорефлекторный нейрогенный мочевой пузырь.
Гипорефлекторный
«Гипо–» означает сниженную функцию детрузора при выделении, т. е. редкое мочеиспускание. Из-за снижения или отсутствия сократительной активности человек не ощущает нужду даже при полном или уже переполненном мочевом пузыре. Все потому, что из-за сниженной активности детрузора не повышается внутрипузырное давление, которое нужно, чтобы преодолеть сопротивление сфинктеров мочевого пузыря. Это вызывает задержку или вялое мочеотделение, при котором приходится сильно натуживаться.
Другие характерные симптомы и признаки:
Гиперрефлекторный
Гиперрефлекторный нейрогенный мочевой пузырь. «Гипер–» означает повышенную активность детрузора, т. е. у человека наблюдается частое мочеиспускание при накоплении менее 250 мл мочи. Детрузор находится в тонусе, что увеличивает давление внутри мочевого пузыря при небольшом количестве мочи. На фоне слабых сфинктеров человек начинает ощущать частые позывы к мочеиспусканию. Это и ведет к его учащению.
Другие симптомы и признаки:
На УЗИ нейрогенный мочевой пузырь определяют по объему остаточной мочи. Но в первую очередь оценивают состояние самого органа в наполненном состоянии. Дополнительно человеку нужно вести дневник мочеиспускания, УЗИ почек, анализы крови и мочи.
Причины возникновения нарушения
Проблема может возникать при нарушениях на любом из уровней нервной системы, поскольку мочеиспускание регулируется большим количеством нервов. Все причины можно разделить на следующие категории:
Основные принципы лечения
Цель лечения — нормализовать процесс мочеотделения и помочь человеку с такой проблемой социально адаптироваться. Лечение во многом зависит от вида нейрогенного мочевого пузыря. Легче справиться с гиперрефлекторной формой. Пациенту назначают лекарства, которые снижают тонус мышц мочевого пузыря, улучшают кровоснабжение органов. Нередко применяется ботулотоксин, который вводят в мышечный слой мочевого пузыря, что помогает человеку нормально опорожняться.
В лечении нейрогенного мочевого пузыря гипорефлекторного типа очень важно регулярное и полное опорожнение. Его добиваются путем принудительного мочеотделения, наружного давления на мочевой пузырь (прием Креде), с помощью физиотерапии и специальной гимнастики для тренировки мышц тазового дна. Иногда приходится прибегать к периодической или постоянной катетеризации.
Если положение усугубилось, проблему решают хирургическим путем. Чтобы этого избежать, необходимо обратиться к врачу при первых же симптомах. Запишитесь на прием к урологу в клинику урологии имени И.М. Сеченова, позвонив по телефону или воспользовавшись формой онлайн-записи.
Отдаленные функциональные результаты при различных вариантах гетеротопической илеоцистопластики
Васильченко М.И., Погосян Р.Р., Забелин М.В., Семенякин И.В., Самойлов А.С., Сергеев В.П., Кызласов П.С.
C учетом увеличения заболеваемости раком мочевого пузыря во всем мире, а также расширением показаний к выполнению радикальной цистэктомии, остро ставится вопрос выбора метода отведения мочи [1,2]. Достигнутые в последние годы значительные успехи в области хирургического лечения различных заболеваний нижних мочевыводящих путей не исключают проблем, связанных с методом отведения мочи при цистэктомии. Они попрежнему остаются в центре внимания урологов и еще далеки от окончательного решения [3]. Золотым стандартом лечения мышечноинвазивного рака мочевого пузыря, который составляет до 25% от всех форм рака мочевого пузыря, является радикальная цистэктомия [4,5].
Применение сегмента тонкого кишечника за последнее время зарекомендовало себя как оптимальный метод деривации мочи. В некоторых случаях формирование ортотопического неоцистиса не представляется возможным по ряду причин: анатомически короткая брыжейка подвздошного кишечного трансплантата, при которой невозможно низведение сформированного неоцистиса в малый таз; распространенное опухолевое поражение тазового дна или органов малого таза и др. При таких условиях показано отведение мочи путем создания гетеротопического мочевого неоцистиса, либо использование других методов. Формирование удерживающего механизма при гетеротопической пластике мочевого неоцистиса позволяет улучшить качество жизни больных при отсутствии показаний для ортотопического варианта неоцистиса [6,7].
Цель исследования: изучение результатов хирургического лечения больных с органической патологией мочевого пузыря, требующей выполнения цистэктомии и деривации мочи посредством гетеротопической тонкокишечной пластики мочевого пузыря.
МАТЕРИАЛЫ И МЕТОДЫ
Изучены результаты хирургического лечения 105 больных с верифицированным диагнозом рака мочевого пузыря в стадии Т24N02M0х, которым была выполнена цистэктомия и деривация мочи. Пациенты наблюдались на клинической базе ГБУЗ МО «Московского областного онкологического диспансера» г. Балашиха, ГКБ №68 г. Москвы, ГКБ им. С.И. Спасокукоцкого г. Москвы. Мужчин было 93 (88,6%), женщин 12 (11,4%), возраст больных колебался от 65 до 80 лет. Больные были разделены по группам в зависимости от способа отведения мочи: гетеротопическая пластика мочевого пузыря по методу М.И. Васильченко и соавт. 35 (33,3%) больных; гетеротопическая тонкокишечная пластика мочевого неоцистиса по предложенной авторами методике 35 (33,3%) больных; операция илеокондуит по Bricker 35 (33,3%) пациентов.
Во всех случаях с целью создания кишечного неоцистиса (резервуара) использовался терминальный отдел подвздошной кишки, отступив от илеоцекального угла на 25 см, с обязательным сохранением а. ileocolica. Способ определения длины резекции тонкой кишки, предложенный И.В. Семенякиным и соавт. и используемый в данной работе, позволил выполнить экономную и обоснованную резекцию участка подвздошной кишки с целью создания необходимого объема артифициального мочевого пузыря [8].
Оригинальный способ гетеротопической пластики мочевого пузыря, предложенный И.В. Семенякиным, М.И. Васильченко и соавт. был нами модифицирован и применен с целью создания гетеротопического тонкокишечного мочевого неоцистиса. Техника выполнения была следующая: выкроенный сегмент подвздошной кишки на сосудистой ножке длиной до 55 см (обязательное сохранение а. ileocolica) складывают в виде буквы W, делят на участки в проксимальном и дистальном участках по 10 см каждый и между ними два участка по 20 см. Формирование тонкокишечного (артифициального) мочевого пузыря начинают путем сшивания задних стенок рассеченной кишки однорядным узловым швом. В состоянии умеренного натяжения по длине и ширине рассеченные и обращенные друг к другу края обоих двух колен сшивают непрерывным швом, рассасывающейся нитью. Сформированный кишечный лоскут затем складывают в большой резервуар, сшивая края кишечного лоскута создают переднюю стенку мочевого пузыря. Путем сшивания задних стенок рассеченной кишки, а затем сшиванием передней стенки, формируется резервуар для мочи с низким давлением (рис. 1). Мочеточники, после предварительной интубации, имплантируют по антирефлюксной методике. Далее при формировании стомы проксимальный конец недетубуляризированного участка мочевого пузыря выводится через разрез в левой подвздошной области.
Рис. 1. Резервуар для мочи с низким давлением
Вторым этапом после цистэктомии выполнялась резекция сегмента кишечника. В зависимости от планируемого объема мочевого неоцистиса (резервуара) применялся способ определения длины резекции тонкой кишки. По данным различных литературных источников, необходимо выделение протяженного участка мочеточников перед этапом формирования уретерокишечных анастомозов, т.к. в дальнейшем могут происходить трофические нарушения стенки мочеточника, что ведет к некрозу дистального отдела мочеточника, а также к несостоятельности уретерокишечных анастомозов [5]. Применение нами оригинальных методик формирования гетеротопического тонкокишечного мочевого неоцистиса (резервуара) позволяет исключить развитие данных осложнений, поскольку концы резецированного сегмента кишечника подводятся к дистальным отделам мочеточников, выделенных на протяжении не более 1525 мм, что полностью позволяет сформировать уретерокишечный анастомоз, сохранив полное кровоснабжение в культе мочеточника.
Способ создания гетеротопического тонкокишечного мочевого неоцистиса позволяет интраоперационно придать резервуару овоидную форму, которая в последующем приближается к шаровидной. Следующим этапом формируется удерживающий клапан на проксимальном конце мочевого неоцистиса (резервуара) с выведением стомы на переднюю брюшную стенку создание губовидного свища.
Рентгенологические методы диагностики мочевого неоцистиса (резервуара) позволяют оценить его форму, объем, а также состояние уретерокишечных анастомозов, уродинамику верхних мочевыводящих путей и удерживающего механизма стомы. Динамические радиологические методы исследования, выполненные у больных на разных сроках наблюдения в послеоперационном периоде, дают возможность оценить функцию почечной паренхимы, транспортировку радиофармпрепарата по реконструированному уретерокишечному анастомозу. Для изучения качества жизни больных использовали анкетирование с помощью специальных опросников (опросник SF36, опросник стомированного больного) на различных сроках после операции, функция удержания мочи оценивалась на основании терминологии ICS по классификации McGuire, способы опорожнения мочевого пузыря, а также функции удержания мочи по критериям Хаутманна.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Величина средней продолжительности оперативного лечения составила 358,1 (150700) минут. Интраоперационная кровопотеря, обусловленная технической сложностью выполнения цистэктомии, в среднем составила 365,1 (1501100) мл, при этом способ отведения мочи на объем кровопотери не оказывал влияния.
Максимальный срок наблюдения за пациентами составил 10 лет. Оценка результатов хирургического лечения проводилась по данным, полученным в ходе обследования пациентов через 14, 30 суток, 3, 6, 12 месяцев, 2 10 лет.
По результатам выполненной экскреторной урографии в ранние сроки после оперативного лечения (7 30 суток) определялись умеренные ретенционные изменения чашечнолоханочной системы почек у 10 (9,52%) из 105 пациентов (рис. 2). Обострение хронического пиелонефрита наблюдалось у 10 (9,52 %) больных, которым выполнялась деривация мочи путем формирования илеокондуита по Брикеру, после проведения консервативной антибактериальной терапии данный процесс был купирован.
Рис. 2. Экскреторная урография в ранние сроки после оперативного лечения
Сформированные гетеротопические тонкокишечные мочевые резервуары, по данным динамической ангионефросцинтиграфии в комплексе с другими методами исследования, позволили улучшить основные функции почек по сравнению с предоперационным состоянием. Анализ результатов динамической сцинтиграфии у 48 (46%) больных, произведенной через 3, 6, 12 мес. и 15 лет после операции формирования гетеротопического тонкокишечного мочевого резервуара, показал, что транспортировка радиофармпрепарата по реконструированному уретерокишечному сегменту в большинстве случаев не нарушена, функциональное состояние почечной паренхимы не ухудшалось. Также оценивалась функция почек в сопоставлении с состоянием верхних мочевыводящих путей до выполнения операции. У 89% больных в предоперационном периоде на фоне воспаления отмечены выраженные изменения в крови и моче, прогрессирование хронической почечной недостаточности (ХПН), электролитные нарушения. После шечнолоханочной системы у наблюдаемых больных приходили к нормальным значениям, не изменяясь в дальнейшем (рис. 3).
Рис. 3. Экскреторная урография через 1,5 месяца после операции
Таким образом, умеренные ретенционные изменения чашечнолоханочной системы почек, наблюдавшееся у 10 из 105 пациентов в раннем послеоперационном периоде, уже к 3 месяцам после операции были купированы полностью, не выявляясь в дальнейшем (рис. 4).

Рис. 4. Экскреторная урография через 3 месяца после операции
Сформированные гетеротопические тонкокишечные мочевые резервуары, по данным динамической ангионефросцинтиграфии в комплексе с другими методами исследования, позволили улучшить основные функции почек по сравнению с предоперационным состоянием. Анализ результатов динамической сцинтиграфии у 48 (46%) больных, произведенной через 3, 6, 12 мес. и 15 лет после операции формирования гетеротопического тонкокишечного мочевого резервуара, показал, что транспортировка радиофармпрепарата по реконструированному уретерокишечному сегменту в большинстве случаев не нарушена, функциональное состояние почечной паренхимы не ухудшалось. Также оценивалась функция почек в сопоставлении с состоянием верхних мочевыводящих путей до выполнения операции. У 89% больных в предоперационном периоде на фоне воспаления отмечены выраженные изменения в крови и моче, прогрессирование хронической почечной недостаточности (ХПН), электролитные нарушения. После проведенных операций на фоне интенсивной терапии с коррекцией электролитных нарушений, с учетом посевов мочи на флору и определением чувствительности к антибиотикам, явления воспаления купированы, в биохимических анализах крови отмечалась стабилизация или уменьшение показателей креатинина, мочевины, калия. Причем, снижение показателей было отмечено в первые три месяца послеоперационного периода. Исходно до операции уровень креатинина крови у пациентов в среднем составлял 150 ± 15,5 мкмоль/л, спустя 3 месяца после операции средний показатель составил 125± 10 мкмоль/л (рис. 5). Схожие изменения фиксировались и при определении уровня мочевины крови: до операции среднее значение мочевины крови являлось 12,3±3,2 ммоль/л, спустя 3 месяца после операции средний показатель составил 9,4 ± 2,5 мколь/л (рис. 6).
Рис. 5. Динамика изменения уровня креатинина в крови в различные сроки после операции
Рис. 6. Динамика изменения уровня мочевины и калия в крови в различные сроки после операции
В качестве примера улучшения функции почек приводим следующее клиническое наблюдение:
Пациент Н., 68 лет: в период подготовки к операции больному выполнена динамическая ангионефросцинтиграфия с целью определения фильтрационной функции почек и уродинамики верхних мочевыводящих путей. По результатам исследования определялся обтурационный тип кривой на ренограммах,
гемодинамика почек относительно удовлетворительная, фильтрационная функция почек снижена, ренограммы плоского обструктивного типа, выраженное снижение выделительной функции обеих почек. Снижение клиренсовой функции, признаки ХПН (рис. 7).
Рис. 7. Динамическая ангионефросцинтиграфия больного Н. до операции
Через 3 месяца после операции пациенту выполнено повторное исследование, по результатам которого отмечалось положительное влияние выполненной операции на функцию почек, слева паренхиматозный тип кривой, что свидетельствовало о восстановлении уродинанамики левой почки, справа отрицательной динамики не отмечается. Прогрессирования снижения гемодинамики и фильтрационной функции почек не отмечено, также как и нарастания признаков хронической почечной недостаточности (рис. 8).

Рис. 8. Динамическая ангионефросцинтиграфия больного Н. через 3 месяца после операции
Рентгенрезервуарография подтвердила эффективность применяемой атирефлюксной методики создания уретерокишечных анастомозов. Во время тугого наполнения неоцистиса (резервура) у 70 больных, перенесших оригинальные методики формирования гетеротопических неоцистисов, рентгенологически отсутствовали рефлюксы в верхние мочевые пути (рис. 9).
Рис. 9. Рентгенрезервуарография больного Н.
После удаления трубки из стомы у 35 (33,3%) из 105 оперированных больных, проведено исследование герметичности клапана и жома при натуживании и положении больного на животе, при этом оценивалось удержание мочи. Результаты исследований указывали на хорошую герметичность стомы в различные сроки послеоперационного периода (рис. 10).
Рис. 10. Исследование герметичности клапана и жома: А при натуживании; Б в положении больного на животе
Резервуарография гетеротопического тонкокишечного мочевого неоцистиса у 43 больных, выполненная в различные сроки после операции, свидетельствовала, что формирование окончательного объема резервуара происходит в течение первого года после операции (табл. 1).
Таблица 1. Динамика изменения объема гетеротопического тонкокишечного мочевого пузыря (резервуара) по оригинальным методикам в послеоперационном периоде
| Сроки наблюдения | Объем гетеротопического мочевого резервуара с запланированным объемом (мл) | |||||||
|---|---|---|---|---|---|---|---|---|
| Гетеротопическая пластика мочевого резервуара по методу М.И. Васильченко и соавт. 300 мл (n=21) | Гетеротопическая тонкокишечная пластика мочевого неоцистиса (авторская методика) 350 мл (n=22) | |||||||
| 3 месяца | 210±23 | 319±14 | ||||||
| 6 месяцев | 290±12 | 327 ±12 | ||||||
| 1 год | 305±18 | 353±10 | ||||||
| 2 года | 310±7 | 372±7 | ||||||
| 3 года | 307 ±15 | 362±5 | ||||||
| 4 года | 324±19 | 371±10 | ||||||
Для оценки эффективности выполненных гетеротопических илеоцистопластик при обоснованном объеме резекции кишечника на уровень цианокобаламина (витамина В12) в послеоперационном периоде были обследованы две группы пациентов. В группу «А» вошли пациенты, которым выполнена операция илеокондуит по Bricker. В группу «Б» вошли больные, которым выполнена гетеротопическая пластика мочевого пузыря. Динамика изменения уровня Цианокобаламина представлена на рисунке 11. В группе «Б» уровень цианокобаламина практически не изменялся на протяжении всего срока после перенесенного оперативного вмешательства: средний уровень до операции составил 362±51 пг/мл и спустя 5 лет после оперативного лечения 333±28 пг/мл. Прогрессивное снижение уровня цианокобаламина отмечалось в группе «А» на протяжении 5 лет после перенесенного оперативного лечения от 416±29 пг/мл до операции до 179±23 пг/мл. Полученные данные указывают на то, что при необоснованно большой резекции кишечника происходит прогрессивное снижение уровня цианокобаламина в послеоперационном периоде, при этом снижение ниже уровня нормы происходит через 3 года после операции. Обнаружены статистически достоверные различия среднего уровня цианокобаламина в исследованных группах сравнения через 4 и 5 лет после оперативного лечения. Уровень цианокобаламина, при применении предложенного способа расчета длины оптимальной резекции кишечника, остается стабильным на протяжении 5 лет после операции, при этом практически не изменяется по сравнению с предоперационным уровнем, что может свидетельствовать об эффективности применяемого авторского способа.
Рис. 11. Динамика изменения уровня Цианокобаламина (витамин В12)
Показатели электролитных изменений состава крови до и в различные сроки после операции исследованы в тех же группах больных (табл. 2). Полученные данные указывают на то, что прогрессивное снижение уровня натрия в сыворотке крови до 128,3±0,8 ммоль/л происходит через 1 месяц после оперативного лечения у пациентов группы «А». Восстановление уровня натрия до 136,0±1,2 ммоль/л в сыворотке крови отмечается лишь к 18ому месяцу после операции и в дальнейшем соответствует референсным значениям. Увеличение уровня калия в сыворотке крови у больных группы «А» до 4,58± 0,01 ммоль/л достигается через год после оперативного лечения, а в последующие годы не изменяется. Прогрессивное снижение уровня хлора в сыворотке крови до 87,8± 0,3 ммоль/л отмечено через 1 месяц после оперативного лечения, однако уже к 6ому месяцу уровень хлора в сыворотке крови становится выше референсных значений, практически не меняясь в дальнейшем. В группе «Б» уровень изучаемых показателей уже через 6 месяцев после операции соответствовал референсным значениям и не изменялся на протяжении всего срока наблюдения.
Таблица 2. Динамика электролитных изменений состава крови
| Сроки | Группа «А» | Группа «Б» | ||||
|---|---|---|---|---|---|---|
| Na (N=133142) ммоль/л | K (N=3,54,7) ммоль/л | Cl (N=97108) ммоль/л | Na (N=133142) ммоль/л | K (N=3,54,7) ммоль/л | Cl (N=97108) ммоль/л | |
| До операции | 133,8±1 1 | 3,60±0,01** | 100,5±1,2 | 134,2±0,8 | 3,92±0,04** | 100,5±0,9 |
| 1 месяц | 128,3±0,8* | 4,58±0,04** | 87,8±0,3*** | 131,3±1,0* | 3,81 ±0,06** | 95,2 ±1,3*** |
| 6 месяцев | 131,0±1,2 | 4,52±0,04** | 107,0±1,3 | 133,4±0,8 | 3,55±0,03** | 99,2±0,6 |
| 12 месяцев | 132,8±1 1 | 4,58±0,01** | 108,3±0,6 | 135,0±0,9 | 3,72±0,02** | 103,5±0,8 |
| 18 месяцев | 136,0±1,2 | 4,54±0,04** | 106,5±0,5 | 133,1±1,1 | 3,69±0,04** | 98,5±0,6 |
| 24 месяца | 136,3±0,7 | 4,31 ±0,02** | 104,8±0,6 | 135,1±1,2 | 3,71 ±0,02** | 98,2±0,6 |
| 36 месяцев | 137,1 ±0,5 | 3,48±0,02 | 106,1 ±0,4 | 133,0±0,4 | 3,60±0,01 | 100,2±0,2 |
| 48 месяцев | 134,0±1,2 | 3,68±0,01 | 106,2±0,2 | 134,4±0,2 | 3,62±0,02 | 98,6±0,5 |
*p ≤ 0,05 при сравнении уровня Na в группах на исследуемых сроках
** p ≤ 0,05 при сравнении уровня K в группах на исследуемых сроках
*** p ≤ 0,05 при сравнении уровня Cl в группах на исследуемых сроках
Проведенное исследование герметичности клапана и жома неоцистиса при натуживании у 35 больных свидетельствовало о полном удержании мочи последними, что обеспечило улучшение качества жизни пациентов, а также доказало эффективность создаваемого клапанного механизма.
В различные сроки после операции (14, 30 суток, 3, 6, 12 месяцев, 2 10 лет) было оценено качество жизни больных путем анкетирования. Установлено, что за счет сокращения числа аутокатетеризаций вследствие увеличения объема резервуара, достигается улучшение качества жизни пациентов: если в первые три месяца после операции больным приходилось выполнять самокатетеризацию через каждые 1,52 часа, то при увеличении объема «мочевого пузыря» к 4ому месяцу интервал между самокатетеризациями возрастал до 3,5 4 часов (рис. 12).
Рис. 12. Динамика количества самокатетеризаций гетеротопического тонкокишечного мочевого резервуара при увеличении его емкости
Для оценки и сравнения качества жизни больных после цистэктомии с различными видами кишечной деривации мочи было обследовано 105 пациентов. Все пациенты были разделены на группы.
Рис. 12. Динамика количества самокатетеризаций гетеротопического тонкокишечного мочевого резервуара при увеличении его емкости
В группу «А1 » вошли 35 пациентов после гетеротопической пластики мочевого неоцистиса по авторской методике, 35 пациентов (группа «А2») после гетеротопической пластики мочевого резервуара по методу М.И. Васильченко и соавт. и 35 пациентов (группа «А3») после формирования илеокондита по Bricker.
Была сформирована контрольная группа (группа «К»), состоявшая из 35 мужчин (средний возраст 67,5 года), не страдающих онкологическими заболеваниями, прошедших тестирование по шкале IPSS и имеющих балл 56, QоL 02.
В качестве инструмента для оценки качества жизни была выбрана русская версия общего (неспецифического) опросника SF36.
С целью объективизации и стандартизации оценки качества жизни у больных, перенесших реконструктивные оперативные вмешательства на нижних мочевых путях использовался опросник SF36.
При сравнении полученных результатов контрольной группы (К) и группы пациентов, перенесших гетеротопическую пластику
мочевого пузыря (группы А1 и А2) отмечается снижение показателей в группе оперированных больных практически по всем шкалам. Наиболее выражено снижение показателей по шкале роль физических проблем в ограничении жизнедеятельности (RP), общее восприятие здоровья (GH), жизнеспособность (VT), роль эмоциональных проблем (RE) (табл. 3).
Таблица 3. Качество жизни у пациентов, перенесших гетеротопическую пластику мочевого пузыря, и контрольной группы