атерогенный эффект что это
Коэффициент атерогенности: маркер агрессии холестерина
Как холестерин влияет на сосуды сегодня широко известно. И большинство знакомы с анализом крови «на холестерин». Однако не все знают, что только общего анализа недостаточно для выводов о поражении сосудов. Так как же получить полную картину «холестериновой агрессии»? Кому актуален такой анализ? И чем понизить коэффициент атерогенности?
Что покажет коэффициент атерогенности
Коэффициент атерогенности – это отношение «плохого» холестерина к «хорошему». И именно это соотношение и отражает риск развития или степень поражения сосудов.
Но почему для выводов недостаточно оценки только «плохого» холестерина? Ведь, по сложившемуся мнению, именно его повышение – маркер риска сосудистых патологий.
Все дело в том, что деление холестерина на плохой и хороший крайне условно. И обе фракции одинаково необходимы для здоровья.
Липопротеины высокой плотности (ЛПВП)
считаются «хорошими», поскольку:
Здесь холестерин, как вещество ценное, используется для синтеза витамина D и желчи.
А, помимо прочего, холестерин:
Очевидно, что холестерин очень нужен организму, но его избыток в крови вредит и повышает риски сосудистых заболеваний.
Липопротеины низкой и очень низкой плотности (ЛПНП и ЛПОНП)
получили статус «вредных» за способность легко отдавать холестерин тканям.
А тот, в свою очередь:
В сосудах такие «заплатки» снижают возможности растяжения, то есть расширения и снижения давления. И чем больше таких участков и их площадь, тем меньше эластичность сосудистой стенки.
И если повышается и «хороший», и «плохой» холестерин (коэффициент атерогенности 2-3) – организм пока справляется с поражением, площадь пораженных участков не велика, излишки холестерина удаляются вовремя, а само нарушение легко поддается коррекции.
А преобладание «плохих» фракций (значение коэффициента атерогенности больше 3,5) говорит о масштабном нарушении липидного обмена. Что может привести к развитию атеросклероза и высокому риску инфаркта и инсульта.
Кому актуален анализ
Что может исказить результат
Как уже было отмечено, холестерин служит «скелетом» множества соединений и «цементом» всех клеточных стенок. И именно по этой причине повышение холестерина и его отдельных фракций может быть связано не только с патологией сосудов.
Так, повышение коэффициента атерогенности наблюдается при:
Снижение показателя клинического значения не имеет, однако имеет место при:
Как понизить коэффициент атерогености
Способы нормализации показателя полностью определяются его исходным уровнем и причиной повышения. В любом случае улучшить показатели липидного обмена может:
Возможности коррекции нарушений липидного обмена у больных с метаболическим синдромом
Цель обзора. Описать возможности воздействия на атерогенную дислипидемию у больных с метаболическим синдромом.
Последние данные литературы. Метаболический синдром (МС) играет значимую роль в развитии и прогрессировании сердечно-сосудистых заболеваний (ССЗ), смертность от которых занимает лидирующие позиции среди причин смерти людей трудоспособного возраста. Среди больных с МС риск развития ишемической болезни сердца (ИБС) в 3–4 раза выше, смертность от ИБС в 3 раза выше, риск развития ишемического инсульта в 2 раза выше по сравнению с пациентами без метаболических нарушений. Атерогенная дислипидемия представляет собой не только модифицируемый фактор риска развития и прогрессирования атеросклероза, но и одно из основных звеньев «порочного круга» МС. Поэтому главной «мишенью» в комплексе мер, направленных на максимальное снижение риска развития ССЗ и их осложнений у больных с МС представляется дислипидемия. Известно, что только достижение целевых уровней липидов наряду с коррекцией всех компонентов МС может гарантировать снижение сердечно-сосудистого риска. В настоящее время в арсенале врача-интерниста достаточно широкий спектр гиполипидемических средств. В статье рассматриваются немедикаментозные и медикаментозные подходы к лечению нарушений липидного обмена. Перспективным представляется применение комбинированной липидкорригирующей терапии.
Заключение. Своевременное выявление МС имеет большое клиническое и прогностическое значение, поскольку данное состояние при адекватной терапии потенциально обратимо. Одной из важнейших задач в лечении атерогенной дислипидемии в рамках МС служит достижение целевых уровней липидов путём изменения образа жизни и применения гиполипидемической терапии.
Метаболический синдром (МС) в последние годы стал центром дискуссий среди врачей многих специальностей: кардиологов, эндокринологов, гастроэнтерологов, гинекологов и др. Повышенное внимание к данной проблеме обусловлено, прежде всего, нарастающей распространённостью МС. За последние 15 лет было проведено более 20 эпидемиологических исследований, посвященных распространенности МС. Мета-анализ широкомасштабных исследований показал, что в популяции взрослого населения МС выявляется от 10% в Китае до 24% в США. Эксперты ВОЗ назвали МС пандемией XXI века, и в ближайшие 25 лет прогнозируют увеличение темпов роста МС на 50% [1, 2].
Одним из важных аргументов изучения МС служит его атерогенный потенциал. Согласно данным скандинавского исследования KIHD (Kuopio Ischaemic Heart Disease Risk Factor Study) продолжительностью 11 лет, среди больных с МС риск развития ИБС оказался в 3–4 раза выше, смертность от ИБС в 3 раза выше по сравнению с пациентами без метаболических нарушений [3]. В исследовании ARIC (Atherosclerosis Risk in Communities) было показано, что у лиц с МС инциденты развития ишемического инсульта были в 2 раза выше по сравнению с контрольной группой [4]. Таким образом, актуальность проблемы обусловлена, прежде всего, тем, что МС играет значимую роль в развитии и прогрессировании сердечно-сосудистых заболеваний (ССЗ), смертность от которых занимает лидирующие позиции среди причин смерти людей трудоспособного возраста 5. Своевременное выявление МС имеет большое клиническое и прогностическое значение, поскольку данное состояние при адекватной терапии потенциально обратимо.
Нарушения липидного обмена служат важной причиной развития атеросклероза и его клинических осложнений. Дислипидемия в тоже время представляет собой модифицируемый фактор риска и одно из основных звеньев «порочного круга» МС. Поэтому главной «мишенью» в комплексе мер, направленных на максимальное снижение риска развития ССЗ и их осложнений у больных с МС, представляется атерогенная дислипидемия. Целью проводимой терапии должно быть достижение целевых уровней липидов наряду с коррекцией всех компонентов МС, что может гарантировать снижение сердечно-сосудистого риска. Оптимальные значения липидных параметров, которые были приняты секцией атеросклероза ВНОК в соответствии с Европейскими рекомендациями по профилактике ССЗ, представлены в табл. 1 [9].
Современные основы диагностики и коррекции атерогенных дислипопротеидемий
Конец ХХ века ознаменовался крупными достижениями в лечении атеросклероза. Это связано в основном с успешной коррекцией дислипопротеидемий (ДЛП), которые являются патогенетическим звеном атерогенеза и одним из главных факторов риска коронарной (ишемическ
Конец ХХ века ознаменовался крупными достижениями в лечении атеросклероза. Это связано в основном с успешной коррекцией дислипопротеидемий (ДЛП), которые являются патогенетическим звеном атерогенеза и одним из главных факторов риска коронарной (ишемической) болезни сердца (КБС).
В процессе атерогенеза в стенке артерий происходит накопление и отложение холестерина (ХС), что во многом определяет начальные этапы и дальнейшее развитие атеросклероза. Вместе с тем имеются веские основания полагать, что в основе данной патологии лежит не само по себе повышение уровня ХС в сыворотке (плазме) крови, то есть не «гиперхолестеринемия» как таковая. Точнее было бы сказать, что развитие заболевания определяется типом и концентрацией в крови липопротеидных частиц, транспортирующих ХС, и зависит от судьбы этих частиц в кровотоке и артериальной стенке.
Помимо ХС в состав липопротеидов входят другие липидные компоненты и аполипопротеины (апо) разных классов. Холестерин свободный и в виде эфиров и триглицериды (ТГ) являются компонентами как атерогенных, так и неатерогенных липопротеидов. Атерогенные липопротеиды низких плотностей отличаются от антиатерогенных липопротеидов высокой плотности (ЛВП) по белковому составу: основным апобелком липопротеидов низкой и очень низкой плотности (ЛНП и ЛОНП) является апо В, которого нет в ЛВП, а основным белковым компонентом ЛВП — апо А. Определение в сыворотке крови уровня апо А и апо В позволяет с высокой степенью достоверности оценить уровень липопротеидов высокой и низкой плотности; однако на практике проведение количественного измерения этих апобелков для большинства клинических лабораторий пока недоступно.
Содержание каждого класса липопротеидов с достаточной для клинической практики степенью достоверности характеризуется уровнем входящего в их состав холестерина. Известно, что ЛОНП служат основным транспортером триглицеридов, а содержание ХС ЛОНП рассчитывается по формуле
ХС ЛОНП (ммоль/л) = ТГ (ммоль/л)/2,2 или ХС ЛОНП (мг/дл) = ТГ (мг/дл)/5.
Уровень ХС ЛВП определяется в плазме или сыворотке крови после осаждения апо В-содержащих липопротеидов низких плотностей. После измерения уровней общего ХС, ТГ и ХС ЛВП (липидной триады) рассчитывают уровень ХС, входящего в состав наиболее атерогенных ЛНП по формуле Фридвальда:
ХС ЛНП = общий ХС — ТГ/2,2 — ХС ЛВП (при расчете в ммоль/л) или ХС ЛНП = общий ХС — ТГ/5 — ХС ЛВП (при расчете в мг/дл).
Липопротеиды различных классов обладают разным атерогенным потенциалом. В развитии атеросклероза большую роль играет проникновение в артериальную стенку из кровотока ЛНП, липопротеидов промежуточной плотности (ЛПП), подфракции мелких частиц липопротеидов ЛОНП. Чем выше содержание в сыворотке крови этих липопротеидов, тем выше риск атеросклероза и связанных с ним заболеваний. Подфракции крупных частиц ЛОНП и хиломикроны не проникают в артериальную стенку из-за большого размера частиц, поэтому не считаются атерогенными.
В настоящее время твердо установлено, что не только гиперхолестеринемия (повышенный уровень в крови ЛНП), но и гипертриглицеридемия, то есть повышенное содержание липопротеидов, обогащенных триглицеридами, ассоциируется с преждевременным развитием коронарного атеросклероза.
Гиперхолестеринемия и гипертриглицеридемия могут быть вторичными по отношению к ряду заболеваний (сахарный диабет, хроническая почечная недостаточность и нефротический синдром, гипотиреоз, алкоголизм и др.). ДЛП является одним из четырех основных компонентов высокоатерогенного метаболического синдрома. В этих случаях выявление и коррекция ДЛП необходимы для диагностики и лечения этих состояний.
Антиатерогенные ЛВП рассматриваются как показатель сниженного риска атеросклероза: чем ниже содержание в крови ЛВП и холестерина, входящего в их состав (ХС ЛВП), тем выше риск развития КБС. ЛВП обладают несколькими механизмами защиты от атеросклероза. В первую очередь, это участие их в обратном транспорте холестерина, когда частицы ЛВП захватывают ХС с мембран клеток, в том числе и артериальных, и транспортируют его в печень, где он превращается в желчные кислоты и выводится из организма. Эта способность ЛВП считается их основным физиологическим свойством. Кроме того, ЛВП препятствуют развитию атеросклероза благодаря своим антиоксидантным, антивоспалительным, антиагрегаторным и профибринолитическим свойствам. Низкий уровень ЛВП ассоциируется с «атерогенным» образом жизни, так как ХС ЛВП снижается при курении, ожирении, гиподинамии.
Среди практикующих врачей общепринятым стало мнение, что прогноз развития атеросклеротических заболеваний для пациента, у которого значительная доля ХС входит в состав ЛВП, отличается от прогноза для больного с таким же уровнем общего ХС, который, однако, распределен преимущественно в ЛНП, а доля ХС ЛВП низка.
В настоящее время появляется все больше информации о практических достижениях в области коррекции липидных нарушений. Это в значительной мере обусловлено созданием новых мощных гиполипидемических лекарственных препаратов, к разработке которых подталкивает понимание того, что современный крайне неблагоприятный образ жизни способствует повышению риска развития сердечно-сосудистых заболеваний (ССЗ), включая КБС. Независимо от уровня ХС увеличение массы тела способно изменять процессы метаболизма липопротеидов и приводить к потенциально атерогенным отклонениям в спектре липопротеидов. Иными словами, диагностика и коррекция ДЛП, которая основывается на понимании роли липопротеидов в атерогенезе и влияния образа жизни на их метаболизм, представляют собой намного более адекватный подход к профилактике атеросклероза, нежели лечение, нацеленное только на коррекцию уровня ХС.
Немаловажным в патогенезе атеросклероза является тот факт, что характер ДЛП оказывает мощное влияние на состояние сосудистого эндотелия: повышенное содержание ХС в ЛНП и ЛОНП вызывает нарушение ответа эндотелия на действие эндотелий-зависимых вазодилятаторов, тогда как ЛВП обладают противоположным действием. Более того, оказалось, что, если животным отменить питание, индуцирующее гиперхолестеринемию, функция эндотелия восстанавливается. Можно полагать, что и у людей гипохолестеринемическая диета будет сопровождаться коррекцией эндотелиальной дисфункции.
Каковы же механизмы, обусловливающие нарушение нормального функционирования эндотелия кровеносных сосудов при ДЛП? Для комбинированной ДЛП, то есть при увеличении концентрации как ЛНП, так и ЛОНП (общего ХС и ТГ), характерно накопление в крови мелких, плотных, модифицированных, чаще всего окисленных частиц ЛНП. Такие частицы вызывают дисфункцию эндотелия. Попадая в субэндотелиальное пространство, мелкие ЛНП подвергаются дальнейшему окислению, захватываются макрофагами и таким образом участвуют в образовании пенистых клеток, которые являются неотъемлемым компонентом атероматозной бляшки.
Химически модифицированные липопротеиды (окисленные, гликозилированные и др.) способны запускать аутоиммунный ответ. Это сопровождается формированием ЛНП-содержащих аутоиммунных комплексов, которые, в свою очередь, активируют макрофаги и повреждают эндотелиальные клетки. Кроме того, модифицированные ЛНП (и содержащие их иммунные комплексы) эффективно стимулируют выброс или секрецию моноцитами или образовавшимися из них макрофагами повышенного количества цитокинов, таких, как фактор некроза опухоли-альфа (TNF-α) и интерлейкин 1-бета (IL-1β). Патогенетический потенциал такой стимуляции в ускоренном атерогенезе огромен. Цитокины индуцируют адгезию лейкоцитов к эндотелиальным клеткам, способствуют синтезу и секреции эндотелием соединений, обладающих прокоагулянтными свойствами, а также факторов роста, способствующих пролиферации гладкомышечных клеток (ГМК).
Пролиферация ГМК считается одной из наиболее ярких характеристик развития атеросклеротического поражения. Было показано, что в условиях in vitro промежуточные продукты, образующиеся при синтезе ХС (изопреноиды), стимулируют рост и миграцию в интиму этих клеток. Поэтому лекарственные препараты, блокирующие синтез ХС на этапе образования мевалоната (ингибиторы ГМГ-КоА редуктазы), угнетают пролиферацию ГМК и таким образом могут независимо от действия на липопротеиды влиять на развитие атеросклероза и ИБС.
Модифицированные ЛНП оказывают хемотаксический эффект на моноциты, способствуя их прилипанию к эндотелию. Модифицированные ЛНП тормозят пролиферацию эндотелиальных клеток, которая представляет собой механизм восстановления поврежденного эндотелия. В противоположность этому ЛВП, наоборот, стимулируют пролиферацию эндотелия и способствуют нормализации его функций.
Имеются данные о том, что модифицированные ЛНП усиливают секрецию эндотелина-1, тормозят активность NO-синтазы и тем самым провоцируют спазмирование артерий. При повышенном уровне ХС ЛНП нарушается продукция простациклина — мощного вазодилятатора и ингибитора агрегации тромбоцитов; в то же время ЛВП усиливают его синтез и секрецию. Модифицированные ЛНП снижают активность фибринолиза, ингибируя секрецию эндотелиальными клетками тканевого активатора плазминогена (ТАП), стимулируя продукцию этими же клетками ингибитора ТАП (ИТАП-1) и усиливая таким образом тромбообразование.
Особенно атерогенной формой ЛНП является липопротеид (а) [ЛП (а)], состоящий из ЛНП и специфического апопротеина (а). Апо (а) по своей структуре в значительной мере подобен плазминогену. Предполагается, что ЛП (а), связываясь с рецепторами для плазминогена на поверхности эндотелия, конкурентно ингибирует превращение плазминогена в плазмин, что также способствует тромбообразованию.
Нарушением метаболизма липопротеидов можно объяснить ряд изменений в системе гемостаза, усугубляющих атеротромбоз. Процесс свертывания крови вызывается происходящей на клеточной поверхности активацией фактора VII, что имеет место при пищевой липидемии и усиливается при увеличении в плазме концентрации насыщенных жирных кислот. В результате активации фактора VII усиливается синтез фибриногена, индуцирующего агрегацию тромбоцитов и образование фибринового сгустка.
Таким образом, накопленные к настоящему времени фундаментальные знания о метаболизме липопротеидов служат основой как для проведения более дифференцированной диагностики атерогенных ДЛП, так и для разработки эффективных схем коррекции липидных нарушений, что позволяет достичь поставленных задач при лечении различных категорий пациентов, относящихся к группе высокого риска.
Исходя из этого, группа экспертов трех Европейских научных обществ, объединяющих специалистов в области сердечно-сосудистых заболеваний (по изучению гипертонии, атеросклероза и общества кардиологов), разработала методику коррекции факторов риска, прежде всего ГЛП и артериальной гипертонии, с использованием данных по оценке суммарного риска развития острых эпизодов (осложнений) КБС в ближайшие 10 лет.
Суммарный риск рассчитывается по прогностическим программам, составленным на основании данных проспективного наблюдения за заболеваемостью и смертностью в больших выборках населения, обследованных первично на наличие и уровень возможных факторов риска КБС. Суммарный риск рассчитывается либо по таблицам, опубликованным в зарубежной и отечественной литературе, так называемым специальным «счетчикам риска», выпускаемым рядом фармацевтических компаний, либо с помощью компьютерных программ, например подготовленной немецкими исследователями программы, созданной на основании эпидемиологического проспективного исследования программы PROCAM.
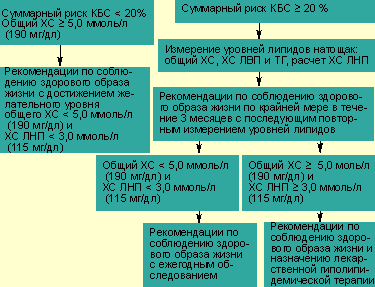 |
| Схема показаний к лечению гиперхолестеринемии с учетом уровня общего холестерина и суммарного коронарного риска (риска КБС) |
Тактика коррекции ДЛП строится исходя из уровня липидов (в основном общего ХС и ХС ЛНП) и из значений суммарного риска КБС каждого пациента (см. схему). При суммарном риске менее 20% предпочтительна немедикаментозная коррекция ДЛП, то есть оздоровление образа жизни по трем направлениям: гиполипидемическая диета, отказ от курения, физическая активация. При суммарном риске более 20% наряду с методами коррекции образа жизни решается вопрос о медикаментозном лечении ДЛП.
Дислипидемии: липиды и липопротеины, метаболизм и участие в атерогенезе
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Центр атеросклероза НИИ физико-химической медицины Минздрава РФ, Москва
Русский Медицинский Журнал начинает серию публикаций по проблеме атеросклероза и связанных с ним осложнений
Среди множества факторов, ассоциирующихся с ИБС, наиболее строго с риском коронарных событий связаны следующие: нарушение липидного обмена, артериальная гипертония, курение и сахарный диабет. Многочисленные экспериментальные, клинические и эпидемиологические данные убедительно свидетельствуют о ключевой роли дислипидемии в патогенезе атеросклероза и его клинических проявлений. В популяциях с относительно низким уровнем общего холестерина (ХС) и ХС липопротеинов низкой плотности (ХС ЛПНП), таких как Китай и Япония, распространенность ИБС остается низкой, несмотря на высокое распространение курения и артериальной гипертонии. В Фремингемском исследовании длительное наблюдение за лицами без ИБС и новообразований показало, что уровень общего ХС прямо связан с общей и сердечно-сосудистой смертностью у мужчин и женщин моложе 50 лет [1].
Стратегия первичной и вторичной профилактики ИБС основывается на результатах крупных клинических исследований, которые показали, что снижение общего ХС и ХС ЛПНП приводит к достоверному снижению риска возникновения ИБС и общей смертности [2]. Знание метаболизма липидов и липопротеинов в норме позволяет лучше представлять механизмы тех нарушений, которые лежат в основе наиболее часто встречающихся дислипидемий, и более целенаправленно проводить коррекцию этих нарушений.
Что такое липиды и липопротеины?
К липидам (жироподобным веществам) крови относятся ХС, триглицериды и фосфолипиды. Около 700–1000 мг ХС синтезируется в организме и примерно 300–500 мг поступает с пищей [3]. Синтез ХС осуществляется в клетках почти всех органов и тканей, однако в значительных количествах он образуется в печени – 80%, в стенке тонкой кишки – 10% и коже – 5%. ХС – обязательная составная часть мембран клеток человека, используется для образования кортикоидных и половых гормонов, желчных кислот и витамина D.
В крови липиды циркулируют в составе липопротеинов – липидно-белковых комплексов. Все липопротеины имеют одинаковую структуру: состоят из гидрофобного ядра, в котором находятся эфиры ХС и триглицериды, и гидрофильной поверхностной части, представленной фосфолипидами, свободным ХС и специфическими белками – апопротеинами (табл. 1). Липопротеины различаются по содержанию липидов, плотностью при ультрацентрифугировании, подвижностью при электрофорезе и апопротеинами. Липопротеины делятся на классы в зависимости от плотности. Основные липопротеины плазмы: хиломикроны, липопротеины очень низкой, промежуточной, низкой и высокой плотности.
Хиломикроны – самые крупные липопротеиновые частицы. Хиломикроны богаты триглицеридами, содержат апопротеин В-48 в качестве главного структурного белка и транспортируют экзогенные (пищевые) жиры и ХС из кишечника в печень и периферические ткани. Они образуются в эндоплазматическом ретикулуме кишечника, секретируются в лимфу и затем через грудной проток попадают в кровь. Период полужизни хиломикронов составляет 5–20 мин. Плазма крови здоровых людей, при взятии крови натощак, практически не содержит хиломикронов.
После секреции хиломикроны получают апопротеины Е, С-I, C-II и C-III от липопротеинов высокой плотности (ЛПВП). В кровотоке под действием фермента липопротеинлипазы, связанной с протеогликанами эндотелиальных клеток и активируемой с помощью апопротеина C-II, происходит гидролиз триглицеридов в составе хиломикронов. При этом хиломикроны подвергаются ремоделированию с образованием остатков (ремнант), которые имеют плотность липопротеинов очень низкой плотности (ЛПОНП), и затем – липопротеинов промежуточной плотности [4]. Ремнанты хиломикронов, содержащие апопротеин В-48 и обогащенные апопротеином Е, захватываются гепатоцитами с помощью рецепторов, имеющих высокое сродство с апопротеином Е.
Параллельно печень секретирует богатые триглицеридами ЛПОНП, содержащие на поверхности молекулу апопротеина В-100 [5]. В пробах крови, взятых натощак, на долю ЛПОНП приходится около 10–15% общего ХС и практические все триглицериды крови. Апопротеин В-100, синтезируемый в печени, является составной частью не только ЛПОНП, но и липопротеинов промежуточной плотности и ЛПНП, поэтому их относят к содержащим апопротеин В липопротеинам крови.
ЛПОНП являются транспортной формой эндогенных триглицеридов, на долю которых приходится около 50–70% массы частицы [3]. Если апопротеин В-100 – интегральная часть ЛПОНП, то апопротеины Е, С-I, C-II и C-III поступают к частицам ЛПОНП уже в кровотоке от ЛПВП. Печень может секретировать как крупные, так и мелкие ЛП, богатые триглицеридами, с плотностью от липопротеинов промежуточной плотности до ЛПОНП [4].
Примерно половина секретированных ЛПОНП обратно захватывается печенью [6]. Другая половина ЛПОНП после гидролиза триглицеридов в составе этих частиц под действием фермента липопротеинлипазы преобразуется в липопротеины промежуточной плотности. Липопротеины промежуточной плотности, содержащие апопротеин Е, так же как и частицы ЛПОНП, имеют два пути метаболизма [6]. Одна их часть удаляется из кровотока печенью с помощью рецепторов к ЛПНП. Другая же часть липопротеинов промежуточной плотности подвергается воздействию печеночной липазы, что ведет к гидролизу оставшихся триглицеридов с образованием ЛПНП. В процессе образования ЛПНП большая часть апопротеинов Е, С-I, C-II и C-III покидает ремнанты ЛПОНП и вновь ассоциируются с ЛПВП.
Конечный продукт этого метаболического каскада – ЛПНП, основной переносчик эндогенного ХС в крови (транспортирует около 70% общего ХС плазмы). Его липидное ядро почти полностью состоит из эфиров ХС. Одна молекула апопротеина В-100 на поверхности ЛПНП обеспечивает распознавание, связывание и удаление около 75% частиц ЛПНП из циркуляции с помощью апо В/Е-рецепторов печени и периферических клеток. Около 3/4 ЛПНП удаляется печенью, а остальная часть – внепеченочными тканями [6].
Период полужизни ЛПНП в крови – 2,5 дня. ЛПНП имеют два потенциальных метаболических исхода. Первый путь метаболизма – связывание с апо В/Е-рецепторами печени, клеток надпочечников и периферических клеток, включая гладкомышечные клетки и фибробласты. В норме рецептор-опосредованным путем удаляется около 75% ЛПНП из циркуляции. После проникновения в клетку частицы ЛПНП подвергаются деградации с высвобождением свободного ХС, который выполняет регуляторную роль в метаболизме ХС – при избытке внутриклеточного ХС, через взаимодействие с геном рецептора ЛПНП, подавляет синтез рецепторов к ЛПНП [5]. И наоборот, при низком уровне внутриклеточного ХС синтез рецепторов к ЛПНП возрастает.
Замедление удаления ЛПНП из кровотока, отмечаемое у больных с семейной гиперхолестеринемией и сопровождаемое резким увеличением концентрации общего ХС и ХС ЛПНП, вызвано дефицитом специфичных рецепторов, которые распознают апопротеин В в составе ЛПНП. За это открытие ученые J.L. Goldstein и M.S. Brown в 1985 г. были удостоены Нобелевской премии в области физиологии и медицины.
ЛПВП – самые мелкие липопротеиновые частицы. На их долю приходится 20–30% общего ХС крови, но из всех липопротеинов именно эти частицы содержат наибольшее количество фосфолипидов и белка. ЛПВП образуются в печени и кишечнике в виде незрелых дисковидных частиц, состоящих из фосфолипидов, апопротеинов семейства А (А-I и А-II) и ХС. Еще один источник ЛПВП – это преобразование липопротеинов и апопротеинов в процессе метаболизма и ремоделирование богатых триглицеридами частиц – хиломикронов и ЛПОНП.
Основная функция ЛПВП в обмене липопротеинов – обеспечение обратного транспорта ХС. Обратный транспорт ХС – позитивный процесс, с помощью которого ХС возвращается из периферических тканей в печень для дальнейшего катаболизма. По современным представлениям, незрелые частицы ЛПВП – хорошие акцепторы свободного ХС [4]. Свободный ХС на поверхности ЛПВП эстерифицируется с образованием эфиров ХС. В роли катализатора эстерификации свободного ХС выступает фермент лецитин-холестерин-ацетилтрансфераза, а в качестве кофактора – апопротеин А-1, структурный белок ЛПВП. Образованные эфиры ХС перемещаются с поверхности частиц ЛПВП в гидрофобное ядро, освобождая таким образом дополнительную поверхность для свободного ХС. По мере накопления в ядре эфиров ХС, дисковидные частицы ЛПВП преобразуются в сферические, богатые холестерином ЛПВП. Эфиры ХС из ЛПВП и содержащих апопротеин В липопротеинов захватываются гепатоцитами через рецептор-опосредованный эндоцитоз или с помощью скэвенджер-рецепторов [4].
За сутки в организме человека окисляется около 500 мг ХС в желчные кислоты, примерно такое же количество выделяется с фекалиями и около 100 г – с кожным жиром. Свободный, неэстерифицированный ХС содержится в мембранах клеток. Мозг, желчь и эритроциты содержат только свободный ХС, скелетная мышца и надпочечники – и свободный, и эстерифицированный ХС [3].
Атерогенные и неатерогенные липопротеины
Липопротеины различаются и по участию в атерогенезе. Атерогенность липопротеинов частично зависит от размера частиц. Самые мелкие липопротеины, такие как ЛПВП, легко проникают в стенку сосуда, но также легко ее покидают, не вызывая атеросклероз. Богатые триглицеридами частицы – хиломикроны и крупные ЛПОНП, как полагают, не атерогенны, но их избыток может вызвать острый панкреатит. Что касается остатков липолиза богатых триглицеридами липопротеинов – ремнант хиломикронов и липопротеинов промежуточной плотности, то они считаются атерогенными. ЛПНП, липопротеины промежуточной плотности и мелкие ЛПОНП достаточно малы, чтобы проникать в стенку сосуда, и в случае химической модификации (вследствие окисления) легко задерживаются в сосудистой стенке.
ЛПНП – наиболее атерогенные липопротеины крови. Строгая, независимая прямая связь между уровнем ХС ЛПНП и риском ИБС четко установлена как у мужчин, так и у женщин, у лиц без признаков ИБС и больных ИБС. По расчетам, увеличение концентрации ХС ЛПНП на 1% может привести к увеличению риска ИБС на 2–3 %.
Наиболее яркий пример связи уровня ХС ЛПНП с атеросклерозом и ИБС – семейная гиперхолестеринемия. Содержание ХС ЛПНП при гетерозиготной семейной гиперхолестеринемии повышено до 7–10 ммоль/л (270– 390 мг/дл), а при гомозиготной семейной гиперхолестеринемии уровень ХС ЛПНП может достигать крайне высоких значений – 12–31 ммоль/л (465–1200 мг/дл). В случае семейной гиперхолестеринемии, особенно гомозиготного характера, преждевременная ИБС возникает даже при отсутствии других факторов риска.
Прямое определение концентрации ЛПНП в крови – дорогостоящая и трудоемкая задача. В большинстве случаев определяют содержание общего ХС, триглицеридов и части ХС, транспортируемой ЛПВП, а концентрацию ХС ЛПНП рассчитывают по формуле Friedwald [7]:
ХС ЛПНП, ммоль/л=Общий ХС – ХС ЛПВП – (0,45 х триглицериды)
ХС ЛПНП, мг/дл=Общий ХС – ХС ЛПВП – (0,2 х триглицериды)
Расчет ХС ЛПНП по формуле Friedwald правомерен в случае, когда концентрация триглицеридов менее 5 ммоль/л (450 мг/дл) [2].
Помимо уровня ХС ЛПНП, на риск возникновения ИБС влияет и размер частиц ЛПНП. Триглицериды из ЛПОНП и хиломикронов могут быть перенесены к ЛПНП под действием белка, переносящего эфиры ХС (липид-переносящий белок). Гидролиз триглицеридов в составе этих частиц под воздействием печеночной липазы приводит к образованию ЛПНП частиц, которые отличаются более высоким содержанием апопротеина В и более низким, чем обычно, содержанием ХС, меньшими размерами и большей плотностью, чем нормальные ЛПНП [4].
По данным проспективных исследований, у людей, у которых в крови преобладают мелкие, плотные частицы ЛПНП (фенотип В), риск ИБС более чем в 3 раза выше, независимо от уровня ХС ЛПНП [8]. Этот тип липидных нарушений часто сочетается с гипертриглицеридемией, сниженным уровнем ХС ЛПВП, повышением артериального давления, абдоминальным ожирением, нарушением чувствительности периферических тканей к инсулину (резистентность к инсулину), нарушенной функцией эндотелия и повышенной склонностью к тромбозу [9,10].
Механизм высокой атерогенности мелких плотных частиц ЛПНП остается до конца не выясненным. По сравнению с крупными и плавучими частицами ЛПНП фенотипа А в мелких плотных частицах ЛПНП содержание сиаловой кислоты снижено, что может увеличить их способность связываться с протеогликанами на поверхности артериальной стенки. Атерогенность частиц ЛПНП фенотипа В связывают с низкой связывающей способностью к B/E-рецепторам, длительным периодом их полужизни в плазме, повышением синтеза тромбоксана. В экспериментах in vitro показано, что мелкие плотные ЛПНП больше подвержены перекисному окислению [11]. Однако установлено, что от 33 до 50% вариабельности размеров и плотности частиц ЛПНП определяется генетическими факторами, что указывает на важность модифицируемых факторов для коррекции этих нарушений [12].
Все липопротеины содержат триглицериды, но в разных количествах. Наиболее богатые триглицеридами хиломикроны, синтезируемые слизистой тонкого кишечника, и ЛПОНП, синтезируемые в печени. ЛПОНП в норме переносят основную часть триглицеридов и очень быстро метаболизируются (период полужизни менее 1 ч) в отличие от ЛПВП, период полужизни которых составляет несколько дней. ЛПОНП и ЛПВП метаболически тесно связаны, и концентрация ХС ЛПВП снижена, когда содержание ЛПОНП повышено. Некоторые исследователи полагают, что ЛПВП-индикатор, отражение того, что происходит с ЛПОНП [2]. Концентрация триглицеридов значительно варьирует в зависимости от приема пищи и алкоголя.
Единое мнение об истинном значении триглицеридов в отношении увеличения риска ИБС пока отсутствует. При одномерном анализе большинства проспективных исследований уровень триглицеридов до 5 ммоль/л (450 мг/дл) предсказывает риск ИБС, особенно у женщин. Так, в Фрамингемском исследовании риск ИБС был тем выше, чем выше была концентрация триглицеридов [13]. Но когда вводится поправка на другие факторы риска, особенно ЛПВП, независимый эффект триглицеридов исчезает или значительно ослабевает. Однако в последнее время стали появляться факты, свидетельствующие о независимой связи концентрации триглицеридов с риском ИБС. Недавно опубликованы данные исследования Copenhagen Male Study, охватывающего 2906 мужчин в возрасте 52–74 года без ИБС [14]. За 8 лет наблюдения первый инфаркт миокарда возник у 229 из них и риск возникновения ИБС возрастал по мере увеличения исходной концентрации триглицеридов. Метаанализ клинических исследований с общим числом обследованных 46 413 мужчин и 10 864 женщин, проведенный Hokanson и Austin, показал, что триглицериды являются независимым фактором риска ИБС даже после поправки на ХС ЛПВП [15].
Одна из главных причин, затрудняющих оценку высокого уровня триглицеридов как независимого фактора ИБС – это гетерогенность липопротеинов, богатых триглицеридами, содержащих апопротеин В. По мнению Brewer (1999), также как существует “хороший и плохой” ХС (ХС ЛПВП и ХС ЛПНП), есть два вида гипертриглицеридемии [4]. Некоторые случаи гипертриглицеридемии ассоциируются с высоким риском ИБС, а другие – нет. Например, выраженная гипертриглицеридемия может быть за счет хиломикронов и крупных частиц ЛПОНП, однако они слишком крупные и не могут проникнуть в стенку сосуда. Синдром семейной хиломикронемии, в основе которого лежит дефицит либо липопротеинлипазы – фермента, ответственного за гидролиз триглицеридов, либо апопротеина С-II (кофактора фермента липопротеинлипазы), ассоциируется с низким риском ИБС, но повышенной вероятностью развития острого панкреатита. Также с низким риском ИБС ассоциируется гипертриглицеридемия, вызванная злоупотреблением алкоголя, приемом эстрогенов и некоторыми семейными формами гипертриглицеридемии. В отличие от крупных частиц ЛПОНП мелкие формы ЛПОНП, так же как и липопротеины промежуточной плотности, – атерогенны, и лица с гипертриглицеридемией за счет высокой концентрации мелких ЛПОНП и липопротеинов промежуточной плотности имеют высокий риск ИБС.
При уровне триглицеридов более 180 мг/дл у пациента следует исключить наличие метаболического синдрома, который ассоциируется с высоким риском развития ИБС. Этот синдром характеризуется инсулиновой резистентностью (нарушением чувствительности периферических тканей, в первую очередь скелетной мускулатуры, к действию инсулина), артериальной гипертонией и гиперкоагуляцией, вызванной повышенным уровнем активности ингибитора тканевого активатора плазминогена I типа, VII фактора и увеличением содержания фибриногена. У пациентов с этим синдромом повышено содержание мочевой кислоты и количество мелких плотных частиц ЛПНП фенотипа В. Еще одним важным составляющим этого синдрома является абдоминальный тип распределения подкожной жировой клетчатки (“абдоминальное ожирение”), о наличии которого указывает величина обхвата талии, превышающая 102 см у мужчин и 88 см у женщин [16].
Недавно были опубликованы результаты исследования, в котором изучали уровень инсулина, размер частиц ЛПНП, а также тип регионального распределения подкожной жировой клетчатки с помощью антропометрии и компьютерной томографии у 165 практически здоровых мужчин. Оказалось, что более 80% мужчин с обхватом талии более 90 см и уровнем триглицеридов более 2 ммоль/л – 180 мг/дл имеют метаболическую триаду: гиперинсулинемию, увеличение концентрации апопротеина В и преобладание мелких плотных частиц ЛПНП [17]. Авторы полагают, что сочетание гипертриглицеридемии (триглицериды более 2 ммоль/л – 180 мг/дл) и абдоминального типа распределения подкожной жировой клетчатки (обхват талии более 90 см) – так называемая гипертриглицеридемическая талия является маркером метаболического синдрома со всеми характерными для этого состояния проявлениями.
Тесная обратная связь между уровнем ХС ЛПВП и риском ИБС обнаружена у мужчин и женщин, у лиц без клинических проявлений атеросклероза и больных ИБС.
ЛПВП препятствуют развитию ИБС, способствуя обратному переносу избытка ХС из периферических клеток в печень для дальнейшей экскреции. В экспериментах с животными было показано, что рост концентрации ЛПВП с помощью увеличения синтеза апопротеина А-1 предотвращает развитие индуцированного диетой атеросклероза. По популяционным данным, увеличение концентрации ХС ЛПВП на 1 мг/дл ассоциируется со снижением относительного риска ИБС на 2–3% [18]. В то же время при редкой наследственной патологии – болезни Танжера – крайне низкий уровень ХС ЛПВП не сопровождается увеличенной вероятностью ИБС, а очень высокий уровень ХС ЛПВП при дефиците белка, переносящего эфиры ХС, ассоциируется с высоким риском возникновения ИБС.
Механизм обратной взаимосвязи между ХС ЛПВП и ИБС не вполне ясен. ХС ЛПВП обычно снижен, когда уровень триглицеридов высок, и допускается вероятность того, что концентрация ХС ЛПВП – это лишь реципроктное отражение уровня атерогенных ЛП, таких как ЛПОНП. Не исключается, однако, возможность и прямого защитного действия ЛПВП на артериальную стенку с помощью транспорта ХС из артериальной стенки в печень или ингибирования окисления ЛПНП. Еще одна гипотеза заключается в том, что низкий ХС ЛПВП лишь идентифицирует лиц с атерогенным образом жизни, поскольку ХС ЛПВП снижен при курении, ожирении и низкой физической активности.
Отрицательный совокупный эффект различных липидов и липопротеинов плазмы очень важен, так как сочетание гипертриглицеридемии с низким ХС ЛПВП и отношением общий ХС/ХС ЛПВП>5 связан особенно с высоким риском ИБС. Так, например, группа мужчин и женщин – участников Фрамингемского исследования с уровнем триглицеридов >150 мг/дл и уровнем ХС ЛПВП Первичные и вторичные дислипидемии
При дислипидемии концентрация липидов и липопротеинов крови выходит за пределы нормы вследствие наследственных или приобретенных состояний, при которых нарушается их образование, разрушение или удаление из циркуляции. Дислипидемии классифицируются в зависимости от того, уровень каких именно липидов и липопротеинов выходит за пределы нормы.
Одна из первых классификаций гиперлипидемий принадлежит Фредриксону (1967) [20], который, скомбинировав результаты нескольких методов разделения липопротеинов: электрофореза на бумаге, преципитации с гепаринсульфатом и препаративного ультрацентрифугирования, предложил выделять 5 фенотипов гиперлипидемий (табл. 2). К ее недостаткам следует отнести то, что она не разделяет первичные и вторичные дислипидемии, не учитывает уровень ХС ЛПВП и генетические дефекты, лежащие в основе многих нарушений липидного обмена.
Первичные дислипидемии, характеризующиеся гиперхолестеринемией
Многие фенотипы гиперлипидемий генетически детерминированы. Вклад наследственных факторов в вариабельность ЛПНП составляет около 50%. Причиной высокого уровня общего ХС часто является семейная гиперхолестеринемия – моногенное нарушение, вызванное мутацией гена ЛПНП-рецепторов. Частота гетерозиготных форм этого нарушения в большинстве популяций составляет 1 на 500. Обычно от каждого родителя наследуется один ген рецептора ЛПНП. При гетерозиготной форме семейной гиперхолестеринемии у больного имеется только один нормальный ген рецептора ЛПНП, уровень ХС ЛПНП превышает 200 мг/дл, общего ХС плазмы – 300 мг/дл, встречаются ксантомы сухожилий, липоидная дуга роговицы и преждевременно развивается ИБС. На долю гетерозиготной семейной гиперхолестеринемии приходится до 2–5% всех случаев ИБС у лиц в возрасте до 60 лет.
Редко, в одном случае на миллион встречаются лица, наследующие оба ненормальных гена рецептора ЛПНП, и они, следовательно, являются гомозиготными по признаку семейной гиперхолестеринемии. Уровень ХС у таких больных колеблется в пределах 15,5– 25,9 ммоль/л (600–1000 мг/дл), у них наблюдаются плоские и эруптивные ксантомы сухожилий. Тяжелая и подчас летальная форма коронарной недостаточности развивается уже к 13-19 годам.
Еще одним примером моногенных дислипидемий является семейный дефект апопротеина В (familial defective apo B), вызванный мутацией гена апопротеина В, встречается с частотой 1:500 и тоже сопровождается увеличением концентрации ХС и ХС ЛПНП и высоким риском развития ИБС. Высокие уровни ХС и ХС ЛПНП у пациента с семейным анамнезом преждевременной ИБС должны насторожить относительно наличия семейной гиперхолестеринемии, они являются показанием для исследования концентрации липидов и липопротеинов у близких родственников (родители, дети, братья и сестры).
Семейная комбинированная гиперлипидемия может проявится в виде IIб или IV типа гиперлипидемии. Ключевым нарушением является увеличение синтеза апопротеина В-100 печенью, что в свою очередь сопровождается увеличением количества богатых триглицеридами липопротеинов в плазме. При IIб типе содержание общего ХС достигает 250–350 мг/дл, при IV типе – отмечается умеренная гипертриглицеридемия, но может быть и существенный рост концентрации триглицеридов. Встречается в популяции с частотой 1 на 100. У больных отсутствуют ксантомы сухожилий, а ИБС возникает в зрелом возрасте.
Первичные дислипидемии с гипертриглицеридемией
Семейная хиломикронемия – редкая наследственная патология, которая характеризуется присутствием хиломикронов в плазме крови, взятой натощак (V тип гиперлипидемии). Содержание триглицеридов в крови резко увеличено, концентрация ХС нормальная или слегка повышена. В основе лежит обусловленное генетическими нарушениями снижение активности фермента липопротеинлипазы или его кофактора апопротеина С-II. Больных беспокоят боли в животе, присутствуют эруптивные ксантомы, развивается сопутствующий панкреатит, но риск ИБС не увеличивается.
Дисбеталипопротеинемия, или III тип гиперлипидемии, характеризуется увеличением количества липопротеинов промежуточной плотности, что проявляется гиперхолестеринемией, гипертриглицеридемией и высокой вероятностью раннего развития ИБС. Встречается с частотой 1 на 5000. В основе дисбеталипопротеинемии лежит полиморфизм гена апопротеина Е. Нормальный фенотип апопротеина Е обозначается как Е-3, а III тип гиперлипидемии вызван наличием изоформы апопротеина Е-2, который эффективно не связывается с апо В/Е-рецепторами клеток и рецепторами к ремнантам, что ведет к нарушению удаления липопротеинов промежуточной плотности и их накапливанию. Липопротеины промежуточной плотности при дисбеталипопротеинемии обладают бета-подвижностью при электрофорезе, обогащены эфирами ХС, захватываются макрофагами, и поскольку этот путь катаболизма не регулируется по механизму обратной связи уровнем внутриклеточного ХС, приводит к превращению макрофагов в пенистые клетки.
Дисбеталипопротеинемия наиболее часто проявляется у гомозигот по апопротеину Е-2. Диагностируется дисбеталипопротеинемия с помощью выявления изоформы апопротеина Е, но величина отношения ХС ЛПОНП/триглицериды плазмы более 0,3 подтверждает диагноз дисбеталипопротеинемии.
Еще одним типом семейной гипертриглицеридемии является семейная эндогенная гипертриглицеридемия (IV тип гиперлипидемии), для которой характерно увеличение содержания в плазме ЛПОНП. Уровень триглицеридов находится в пределах 200-500 мг/дл, концентрация ХС ЛПВП снижена, общего ХС – в норме или умеренно повышена, встречается с частотой 1 на 300 и в ряде случаев приводит к раннему возникновению ИБС.
Наиболее частыми причинами вторичных дислипидемий являются диабет, нефротический синдром, хроническая почечная недостаточность и гипотиреоидные состояния.
Показано, что около 20% больных ИБС страдают сахарным диабетом, но частота ИБС среди диабетиков существенно выше. Атеросклероз – основное осложнение диабета, а ИБС – главная причина заболеваемости и смертности больных с диабетом. Нарушение липидного обмена у больных диабетом, особенно диабетом II типа, характеризуется особым липидным профилем, обозначаемым как “липидная триада” или “диабетическая дислипидемия”:
• низким уровнем ХС ЛПВП;
• увеличением количества мелких частиц ЛПНП фенотипа В. Именно преобладание в крови мелких, плотных частиц ЛПНП, которые больше, чем более крупные частицы ЛПНП, подвержены окислению и гликолизированию и способствуют развитию дисфункции эндотелия, считается одной из причин повышенного риска ИБС у больных диабетом.
При любом уровне отдельных факторов риска и при любых сочетаниях факторов риска общий риск ИБС у больных с диабетом существенно выше, чем у таких же лиц без диабета. Показано, что смертность от сердечно-сосудистых заболеваний у больных диабетом типа II в 3 раза выше, чем в общей популяции. У этой категории больных также хуже исходы хирургических процедур по восстановлению коронарного кровотока. Американская ассоциация диабета больных с диабетом, но без клинических проявлений коронарного атеросклероза по степени риска возникновения сердечно-сосудистых осложнений приравнивает к больным с установленной ИБС, а в качестве целевого предлагает уровень ХС ЛПНП
Литература
1. Anderson KM, Castelly WP and Levy D. Cholesterol and mortality: 30 years of follow-up from the Framingham study. JAMA 1987; 257: 2176.
2. Prevention of Coronary Heart Disease in Clinical Practice. Recommendations of the Second Joint Task Force of the European and other Societies on Coronary Prevention. Eur Heart J 1998; 19: 1434–503.
3. Климов НА, Никульчева НГ. Липиды, липопротеиды и атеросклероз.1995, СПб, “Питер”, 89–199.
4. Brewer HB. Hypertriglyceridemia: changes in the plasma lipoproteins, associated with an increased risk of cardiovascular disease. Am J Cardiol 1999; 83: 3–12.
5. Beisiegel U. Lipoprotein metabolism. Eur Hert J 1998; 19 (Suppl A): A20–A23.
6. Grundy SM and Vega G. Causes of high blood cholesterol. Circulation 1990; 81: 412–27.
7. Friedwald WT, Levy RI, Fredrickson DS. Estimation of the concentration of low-density lipoprotein cholesterol in plasma, without usef the preparative ultracentrifuge. Clin Chem 1972; 18: 499–502.
8. Austin MA, Breslow JL, Hennekens CH et al. Low-density lipoprotein subclass pattern and risk of miocardial infarction. JAMA 1988; 260: 1917.
9. Reaven GM. Chen Y-DL. Jeppesen J et el Insulin resistance and hypertriglyceridemia in an individuals with smal, dense low density lipoprotin particles.J Clin Invest 1993; 92: 141.
10. Chapman MJ, Guerin M and Bruckert E. Atherogenic, dense low-density lipoproteins: pathophisiology and new therapeutic approaches. Eur Heart J 1989; 19 (Suppl A): A24–A30.
11. Dejager S, Bruckert E and Chapman MJ. Dense low density lipoprotein subspecies with diminished oxidative resistance predominate in combined hyperlipidemia. J Lipid Res 1993; 349: 295.
12. Austin M.A.: Genetic epidemiology of low-density lipoprotein subclass phenotypes. Ann. Med., 1992; 24: 477.
13. Castelli WP, Abbott RD, McNamara PM. Summary estimates of cholesterol used to predict coronary heart disease. Circulation 1983; 67: 730–4.
14. Jeppesen J, Hein HO, Suadicany P, Geintellberg F. Triglycerides concentration and ischaemic heart disease: an eight-year follow-up in the Copenhagen Male Study. Circulation 1998; 97: 1029–36.
15. Austin MA, Hokanson JE, Edvards KL. Hypertriglyceridemia as a cardiovascular risk factor. Am J Cardiol 1998; 81: 7B–12B.
16. Grundy S Hypertriglyceridemia, insulin resistance and the metabolic syndrome. Am J Cardiol 1999; 83 (9B): 25F–29F.
17. Lemieux I, Pascot A, Couillard C et al. Hypertriglyceridemic waist: a marker of the atherogenic metabolic triad (hypertriglyceridemia, hyper apo B, small, dense LDL)? 72nd Scientific sessions of American Heart Association. 1999; 4223.
18. Gordon DJ High-density lipoprotein cholesterol and cardiovascular disease. Four prospective American studies. Circulation 1989; 79: 8–15.
19. Castelly W. Cholesterol and lipids in the risk of coronary artery disease: the Framingham Heart Study. Can J Cardol 1988; 4 (Suppl A): 5A–10A.
20. The ILIB Lipid Handbook for clinician Practice: Blood Lipids and Coronary Heart Disease. Houston, International Lipid Information Bureau, 1995; 29.