атрофический эндометрий матки что это
Что такое эндометрит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Делеске И. А., гинеколога со стажем в 8 лет.
Определение болезни. Причины заболевания
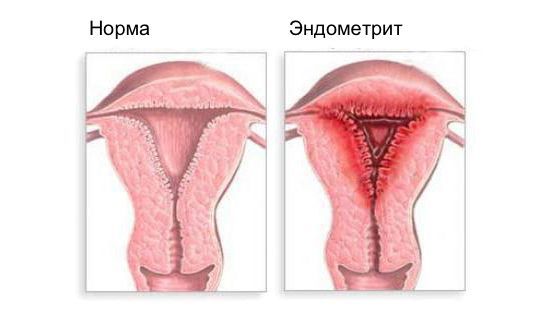
Эндометрит — это воспаление внутреннего слоя матки (эндометрия), которое приводит к изменению его функций. Возникает в результате заражения этой области микробами, вирусами и грибковыми инфекциями.
В женском репродуктивном тракте присутствуют различные микроорганизмы, среди которых преобладают Lactobacillus spp. Эндометрит чаще ассоциирован с чрезмерным размножением бактерий Enterobacter, Enterococcus, Streptococcus, Staphylococcus, Ureaplasma, Mycoplasma.
Эндометрит вызывают также вирусные инфекционные агенты: вирус герпеса, цитомегаловирус, вирус папилломы человека, энтеровирусы и аденовирусы.
Риск развития эндометрита увеличивают:
Симптомы эндометрита
Воспаление может протекать в острой и хронической форме. Чаще всего симптомы эндометрита появляются на четвёртый день после инфицирования. При острой форме эндометрита отмечаются общие симптомы воспаления, такие как слабость, быстрая утомляемость, повышение температуры тела, изменения в общем анализе крови (сдвиг лейкоцитарной формулы влево и повышение СОЭ).
К локальным симптомам острого эндометрита можно отнести:
При отсутствии правильного и своевременного лечения эндометрита в течении 10 дней возможен переход в хронический воспалительный процесс. При этом держится повышенная температура, появляются новые симптомы:
Течение острого послеродового эндометрита более тяжёлое, проявляется в следующих симптомах:
Патогенез эндометрита
На начальном этапе воспаления инфекционный агент (бактерии, вирусы или грибки) внедряется в слизистую оболочку матки. Начинается выработка медиаторов воспаления, которая приводит к нарушению микроциркуляции крови в его очаге. Миграция лейкоцитов в зону повреждения, активация нейтрафилов и макрофагов ведёт к активной выработке цитокинов и перекиси водорода, запуску перекисного окисления липидов с повреждением мембран клеток. В это время на фоне повышенной выработки цитокинов и факторов роста происходит деградация матрикса клеток. Нарушение микроциркуляции крови приводит к развитию локальной ишемии и гипоксии ткани, которые затем активируют процессы склерозирования. При длительной стимуляции иммунной системы происходит её истощение и появление аутоиммунных реакций.
При длительности воспалительного процесса более 2 месяцев можно расценивать его как хронический процесс. Развиваются изменения в структуре и функции ткани, происходит нарушение пролиферации (деления клеток) и физиологической циклической трансформации эндометрия. В связи с этим возможно нарушение нормальной имплантации эмбриона при беременности.
Классификация и стадии развития эндометрита
Эндометрит можно разделить на острую и хроническую форму.
Острый эндометрит возникает при абортах, диагностических манипуляциях, выскабливании, развивается быстро, воспаление сопровождается острыми или ноющими болями и повышением температуры. Наиболее частый путь инфекции при нём — восходящий. Распространение инфекции из влагалища в верхние отделы репродуктивного тракта происходит при несостоятельности барьера шейки матки. Воспаление может локализоваться в эндометрии, а также переходить на миометрий. При несвоевременном и неполноценном лечении возможно развитие пельвиоперитонита (воспаление оболочки брюшины в области малого таза).
Отдельно выделяется острый послеродовый эндометрит — начинается на 2-4 сутки после родов, ему может предшествовать хориоамнионит (инфицирование оболочек плода и жидкости).
При хроническом эндометрите симптоматика сглажена. Характерны периодические обострения и рецидивы после переохлаждения и воспаления другой локализации урогенитального тракта.
По клиническим проявлениям эндометрит подразделяется на клиничеcки выраженную и субклиническую форму.
По характеру воспалительного процесса эндометрит можно разделить на:
По морфологическим признакам:
Осложнения эндометрита
Осложнения у эндометрита могут быть достаточно серьёзными.
Пельвиоперитонит — воспаление выходит за пределы матки, в процесс вовлекаются листки брюшины. Пациентки отмечают резкое повышение температуры, симптомы интоксикации, тошноту, рвоту, интенсивные боли внизу живота (основная локализация ниже пупка), симптом раздражения брюшины ( резкое усиление боли в животе при быстром надавливании и снятии руки).
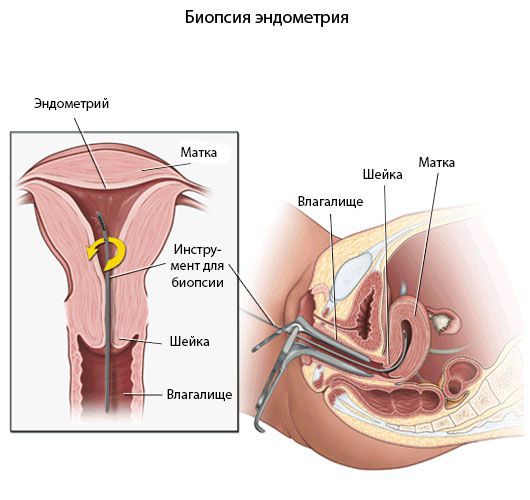
Диагностика эндометрита
Диагностика хронического эндометрита должна быть основана на комплексном подходе анализа жалоб пациентки, анамнеза, симптомов, результатов эхографических исследований, лабораторной диагностики, данных морфологического исследования эндометрия и иммунного статуса.
Критериями хронического эндометрита является наличие очаговых или диффузных лимфоидных инфильтратов, склероз стенок спиральных артерий, фиброз стромы и наличие плазматических клеток. При этом к абсолютным признакам хронического эндометрита относят плазматические клетки.
Микробиологические посевы используются для выявления возбудителя воспалительного процесса.
При эхографии (УЗИ) хронический эндометрит определяют по:
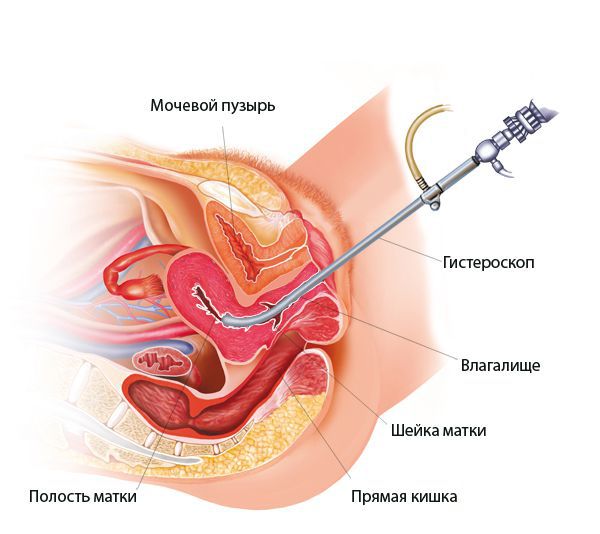
При гистероскопии определяются следующие признаки хронического эндометрита: гиперемия слизистой оболочки матки, неровномерная толщина эндометрия, полипообразные образования, кровоизлияния, очаговая гиперплазия эндометрия.
Лечение эндометрита
Контрольные критерии эффективности терапии хронического эндометрита:
Прогноз. Профилактика
При своевременном и полноценном лечении прогноз благоприятный. Пациентки отмечают улучшение состояния в течении двух суток. При запоздалом лечении эндометрита возможно развитие септического шока.
Для профилактики эндометрита рекомендуется:
Эндометрит матки
Последнее обновление: 11.04.2020
Содержание статьи
Эндометрит (Endometritis) матки – достаточно распространенное заболевание, которое часто встречается у женщин репродуктивного и пожилого возраста, и требует немедленного обращения к врачу. Это состояние имеет свойство очень быстро усугубляться, поэтому только незамедлительное начало лечения позволит обойтись «малой кровью» и избавится от воспалительного процесса без последствий для организма.

Что такое эндометрит матки?
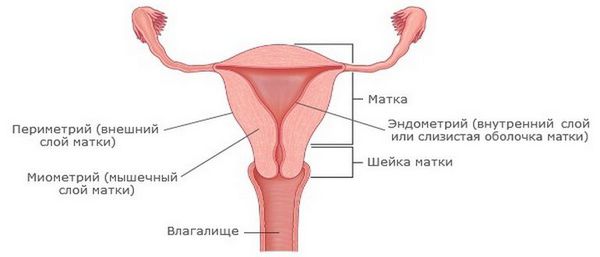
При эндометрите матки воспалительный процесс охватывает верхний слой (слизистую оболочку) эндометрия. Это заболевание следует отличать от эндомиометрита, при котором инфекция поражает более глубокие участки тканей: миометрий и базальный слой эндометрия (Endometrium). Эндометрит, как и любой другой воспалительный процесс, может протекать остро или в хронической форме. Возбудителями этого процесса могут быть:
Симптомы и признаки эндометрита матки
К основным симптомам острого эндометрита относятся сильные боли внизу живота, высокая температура, необычные кровянистые выделения. При заболевании эндометритом в пожилом возрасте, у женщины в матке может скапливаться гной. Это состояние называют пиометрой (Pyometra) и диагностируют простым осмотром: матка при этом имеет шарообразную форму, увеличенные размеры, мягкость.
Хронический эндометрит матки характеризуется меньшей выраженностью симптомов:
Причины эндометрита матки
Основные причины эндометрита – восходящая инфекция, появившаяся вследствие неправильного спринцевания, полового акта на фоне менструации, неправильной установки внутриматочной спирали, вагинального обследования. Также эндометрит может быть следствием повреждений непосредственно стенок матки:
Эндометрит матки и беременность
Присутствие эндометрита в анамнезе женщины, а также наличие его хронической формы может стать причиной проблем с беременностью. Наличие воспаленных участков эндометрия препятствует имплантации оплодотворенной яйцеклетки. Даже если имплантация прошла успешно, воспаленный эндометрий может просто отторгать эмбрион на малых сроках беременности.
Только после этого она получает реальные шансы успешно забеременеть и выносить ребенка. В противном случае ей может грозить бесплодие, привычное невынашивание и даже неэффективность ЭКО (экстракорпорального оплодотворения).
Как диагностируют эндометрит матки?
Диагностика такого состояния, как эндометрит матки, не вызывает сложностей. На приеме у гинеколога женщина с симптомами эндометрита должна пройти ручной осмотр, сдать мазок из влагалища и полости матки на посев (гистология), анализ крови на антитела. Также гинеколог обычно направляет женщину на УЗИ. Все эти диагностические меры помогают не только зафиксировать сам факт заболевания, но и определить причину, которая его вызвала.
Как лечить эндометрит матки
Большинство случаев эндометрита связано с размножением вредоносных бактерий. Именно поэтому острый эндометрит матки лечится исключительно антибиотиками широкого спектра действия, а при выявлении вирусной природы воспаления в схему лечения добавляются противовирусные препараты и иммуномодуляторы, такие как «Масло примулы вечерней». Гинокомфорт. Средство было разработано специалистами фармацевтической компании ВЕРТЕКС. Как и вся продукция Гинокомфорт, Масло примулы вечерней имеет необходимые документы и сертификаты качества.
Хронический эндометрит матки требует более «глубокой» работы. Помимо антибиотиков (в виде свечей или таблеток) и противовирусных препаратов, врачи назначают протеолитики, препараты для улучшения микроциркуляции крови, витаминные комплексы и физиотерапевтические процедуры. Все вспомогательное лечение направлено на улучшение кровоснабжения матки и восстановление защитных свойств внутренней поверхности. Именно поэтому при лечении хронической формы заболевания так важно укрепление иммунитета в целом.
Иногда для лечения эндометрита необходима гормональная терапия. Это относятся к случаям, когда заболевание вызвано нарушением процесса роста и отторжения эндометрия. В этом случае женщина может отмечать постоянное нарушение менструального цикла, поэтому лечение такого состояние чаще всего сводится к назначению противозачаточных таблеток, которые помогают восстановить нормальную менструацию. Лечение длится 3-6 месяцев.
Причины, симптомы и лечение эндометрита, видео
Принципы индивидуальной гормональной подготовки эндометрия у пациенток с неэффективными попытками ЭКО. Е.В. Дюжева, Е.А. Коган, Е.А. Калинина, А.Н. Кузьмичев // Акуш. и гинекол. – 2011. – № 7-2. – С. 39-45.
Cytokines and embrio implantation. C. Simon, C. Moreno, J. Remohi, A. Pellicer // J. Reprod. Immunol. – 1998. – Vol. 39. – С. 117-31.
Молекулярные и морфологические аспекты нарушений рецептивности эндометрия при хроническом эндометрите. Е.А. Коган, Т.А. Демура, В.Я. Водяной, А.В. Шуршалина // Архив патологии. – 2012. – Vol. 74 (3). – С. 15-27.
Хронический эндометрит матки
МКБ-10: N71.1 — Хроническая воспалительная болезнь матки.
Хронический эндометрит — это заболевание, которое характеризуется наличием вялотекущего воспалительного процесса во внутреннем слое матки (эндометрии). Как результат — в эндометрии происходят морфологические и функциональные изменения, нарушается способность ткани реагировать на гормоны и претерпевать циклические изменения.
Стаж работы 11 лет.
Согласно статистическим данным разных авторов, частота заболевания колеблется в очень широких пределах — от 3 до 70%. Такая вариабельность обусловлена отсутствием единых патоморфологических критериев диагноза и существенными различиями в материале, отправляемом на исследование. Чаще всего болеют женщины репродуктивного возраста — на данную категорию приходится около 97% всех больных.
Болезнь всегда является следствием острого воспаления, которое не до конца вылечили. Результатом этого становится затяжной хронический эндометрит. Основная угроза, которую несет хронический воспалительный процесс — бесплодие, поэтому проблема носит не только медицинский, но и социальный характер. Кроме проблем с зачатием, патология резко снижает вероятность успешного экстракорпорального оплодотворения, провоцирует различные осложнения во время беременности, в том числе — преждевременные роды.
Классификация
Классифицируется эндометрит по стадиям:
Среди пациенток, испытывающих проблемы с естественным зачатием, от 12 до 68% страдают хроническим эндометритом. Среди женщин с неудачными попытками применения вспомогательных репродуктивных технологий заболевание встречается примерно у 60%. У 70% больных с привычным невынашиванием присутствует диагноз «хронический эндометрит».
Причины хронического эндометрита матки
Главные причины хронического эндометрита — патогенные и условно-патогенные бактерии. В большинстве случаев они проникают в полость матки восходящим путем — из влагалища.
К факторам, которые способствуют инфицированию слизистой оболочки матки, нужно отнести:
К основным из них относятся:
На фоне всех этих ситуаций может возникнуть хронический эндометрит, симптомы и лечение которого напрямую зависят от степени выраженности проблемы и общего состояния пациентки.
Признаки и симптомы хронического эндометрита матки
Эндометрит проявляется такими симптомами:
При объективном обследовании матка увеличена, пальпация сопровождается болевыми ощущениями. Чаще всего хронический эндометрит является следствием острой формы заболевания. Главная причина хронизации процесса — неправильное подобранное, несвоевременное или преждевременно прекращенное лечение. Внешние проявления болезни при этом уменьшаются, однако воспалительный процесс не устраняется полностью, что вызывает ряд изменений в строении и функционировании эндометрия.
Диагностика хронического эндометрита матки
Диагностика хронического эндометрита затруднена из-за слабой выраженности клинических симптомов. Тем не менее, применяя современные возможности медицины, поставить диагноз вполне возможно.
Дополнительная диагностика хронического эндометрита заключается в проведении ряда лабораторных и инструментальных тестов, в частности:
При необходимости проводят гистероскопию, компьютерную и магнитно-резонансную томографию, консультируются у смежных специалистов. Таким образом, гинеколог может получить максимум информации о состоянии пациентки и подобрать наиболее подходящее лечение.
Лечение хронического эндометрита матки
Параллельно применяется противовоспалительная и симптоматическая терапия. После устранения основных симптомов женщине назначают курс физиотерапевтических процедур и санаторно-курортное лечение хронического эндометрита.
Особенно сильный эффект оказывают такие процедуры:
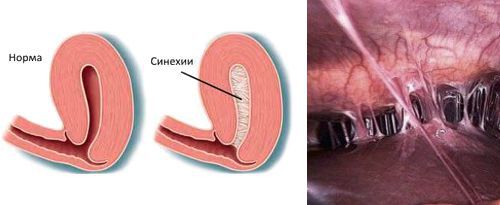
При неправильном или неполноценном лечении развиваются такие осложнения хронического эндометрита:
Если диагностирован хронический эндометрит, можно ли забеременеть — вот что интересует многих женщин, страдающих от соответствующей патологии. Нужно отметить, что небольшой шанс на зачатие существует. Однако из-за воспалительного процесса вероятность имплантации эмбриона в эндометрий значительно уменьшается.
Профилактика хронического эндометрита матки
Профилактика хронического эндометрита это, прежде всего, предупреждение острого воспалительного процесса.
Чтобы предотвратить острый эндометрит, нужно придерживаться таких правил:
Хронический эндометрит и беременность
Можно ли зачать ребенка при хроническом эндометрите — это один из наиболее частых вопросов, которые слышит врач-гинеколог на приеме. Часто именно бесплодие становится причиной обращения женщины к доктору, в то время как других жалоб у неё нет. Хронический эндометрит не во всех случаях провоцирует нарушения фертильности. Многие женщины успешно беременеют и вынашивают ребенка. Но шанс наступления беременности в каждом цикле снижается, потому что затрудняется прикрепление эмбриона в стенку матки. Эндометрий хуже созревает. Кроме того, повышается риск перинатальных потерь.
Здоровый эндометрий — один из решающий факторов при попытке зачать ребенка.
Другой решающий фактор — плодное яйцо, которое должно надежно прикрепиться в полости матки для последующего развития. Оплодотворенная яйцеклетка не может прижиться на пораженной ткани, которая не в состоянии из-за хронического воспалительного процесса создать благоприятные условия для развития бластоцисты.
Иногда женщине с хроническим эндометритом удается забеременеть, но такая беременность практически всегда заканчивается выкидышем. Даже, если плодное яйцо закрепилось на пораженном эндометрии, то угроза выкидыша сохраняется на весь период гестации. Параллельно с риском выкидыша будут постоянно возникать те или иные осложнения беременности. Далее воспаление будет распространяться на зародыш, что закончиться внутриутробной гибелью плода.
Мнение врача
Врач репродуктолог, акушер-гинеколог, к.м.н.

Данная статья не может быть использована для постановки диагноза, назначения лечения и не заменяет прием врача.
Вагинальная атрофия: этиологические аспекты и современные подходы к терапии
Согласно прогнозам, к 2030 г. в мире число женщин в постменопаузе достигнет 1,2 млрд. Эстрогендефицитное состояние в период климактерия у 15–57% женщин приводит к развитию вагинальной атрофии. В обзоре приводятся последние данные, касающиеся вопросов пато
Постменопауза характеризуется эстрогендефицитным состоянием у женщин, обусловленным возрастным снижением, а затем и прекращением функции яичников [1]. Как известно, любые эпителиальные ткани реагируют на изменение окружающей их гормональной среды сходным образом, но ни одна из них не может сравниться с эпителием свода влагалища и шейки матки по скорости и отчетливости реакции на гормоны, в первую очередь на половые стероиды [2]. Таким образом, урогенитальный тракт особенно чувствителен к снижению уровня эстрогенов и около половины всех женщин в постменопаузе испытывают симптомы, связанные с урогенитальной атрофией (УГА), затрагивающие половую функцию и качество жизни [3]. В клинической картине урогенитальных расстройств в климактерическом периоде выделяют симптомы, связанные с атрофией влагалища (вагинальная атрофия (ВА)), и расстройства мочеиспускания (цистоуретральная атрофия). В отличие от вазомоторных симптомов, которые обычно проходят со временем, симптомы вагинальной атрофии, как правило, возникают в пременопаузе и прогрессируют в постменопаузальном периоде, приводя к функциональным и анатомическим изменениям [4]. У 15% женщин в пременопаузе и 40–57% женщин в постменопаузе отмечаются симптомы ВА [5], такие как сухость влагалища 27–55%, жжение и зуд 18%, диспареуния 33–41%, а также повышенная восприимчивость к инфекционным заболеваниям органов малого таза 6–8% [4], что значительно ухудшает состояние здоровья, негативно влияет на общее и сексуальное качество жизни [6]. У 41% женщин в возрасте 50–79 лет есть хотя бы один из симптомов ВА [10].
Стенки влагалища состоят из трех слоев: внутреннего слоя, который выстлан многослойным плоским эпителием; среднего мышечного и наружного соединительнотканного слоев (или волокнистого слоя). Атрофические процессы, захватывающие соединительнотканные и мышечные структуры влагалища, а также мышцы тазового дна, уретры, мочевого пузыря, особенно выражены в слизистой влагалища. Известно, что у женщин слизистая оболочка влагалища состоит из четырех основных слоев эпителиальных клеток: базальный слой; парабазальный слой (или митотически-активный); промежуточный гликогенсодержащий слой; поверхностный (слущивающийся) [11]. Эстрогеновые рецепторы располагаются в основном в базальном и парабазальном слоях влагалища и практически отсутствуют в промежуточном и поверхностном [10]. Дефицит эстрогенов блокирует митотическую активность базального и парабазального слоев эпителия влагалищной стенки, а следовательно, и пролиферацию влагалищного эпителия [12]. Следствием прекращения пролиферативных процессов во влагалищном эпителии является исчезновение гликогена — питательной среды для лактобактерий, таким образом из влагалищного биотопа полностью элиминируется его основной компонент — лактобациллы [3, 12].
Известно, что перекись-продуцирующие лактобациллы, преобладающие в микробиоцинозе влагалища у женщин репродуктивного возраста, играют ключевую роль в предотвращении появления заболеваний урогенитального тракта [10, 11]. Вследствие расщепления гликогена, который образуется в эпителии влагалища при условии наличия достаточного количества эстрогенов, образуется молочная кислота, обеспечивающая кислую среду влагалища (в пределах колебаний рН от 3,8 до 4,4). Подобный защитный механизм приводит к подавлению роста патогенных и условно-патогенных бактерий. В период постменопаузы слизистая оболочка влагалища утрачивает эти защитные свойства, истончается, легко травмируется с последующим инфицированием не только патогенными, но и условно-патогенными микроорганизмами.
Эстрогены являются главными регуляторами физиологических процессов во влагалище. Эстрогеновые рецепторы α присутствует во влагалище в пременопаузе и постменопаузе, в то время как эстрогеновые рецепторы β полностью отсутствуют или имеют низкую экспрессию в вагинальной стенке у женщин в постменопаузе. Наиболее высокая плотность эстрогеновых рецепторов наблюдается во влагалище и уменьшается по направлению от внутренних половых органов к коже. Плотность андрогеновых рецепторов, наоборот, низкая во влагалище и более высокая в области наружных половых органов. Рецепторы прогестерона встречаются только во влагалище и эпителии вульвовагинального перехода [10]. Поскольку в клетках стромы влагалища содержатся рецепторы к эстрогенам, то коллаген, входящий в состав соединительной ткани влагалищной стенки, является эстроген-чувствительной структурой, содержание которого уменьшается по мере прогрессирования эстрогенного дефицита. Так как рецепторы к эстрогенам располагаются не только в эпителии и строме влагалищной стенки, но и в эндотелии сосудов, в постменопаузе отмечается снижение кровообращения во влагалище до уровня различной степени ишемии. К тому же эстрогены являются вазоактивными гормонами, которые увеличивают приток крови, стимулируя высвобождение эндотелиальных медиаторов, таких как оксид азота, простагландины и фактор гиперполяризации эндотелия. Подобное прогрессирующее снижение кровотока в слизистой влагалища приводит к гиалинизации коллагеновых и фрагментации эластических волокон, увеличивая количество соединительной ткани [12].
Эстрогеновые рецепторы были также обнаружены на вегетативных и сенсорных нейронах во влагалище и вульве. В исследовании T. L. Griebling, Z. Liao, P. G. Smith было выявлено уменьшение плотности сенсорных ноцицептивных нейронов во влагалище на фоне лечения эстрогенами. Эта особенность может быть полезна в целях устранения дискомфорта, связанного с ВА, а именно в облегчении симптомов, таких как жжение, зуд и диспареуния, с которыми сталкиваются многие женщины в постменопаузе [5, 10].
Атрофия слизистой вульвы и влагалища характеризуется истончением эпителия, уменьшением вагинальной складчатости, побледнением, наличием петехиальных кровоизлияний, признаков воспаления. Также вследствие инволютивных изменений происходит потеря упругости тканей, подкожно-жировой клетчатки и выпадение лобковых волос, снижение секреторной активности бартолиниевых желез [3, 13, 14]. Как правило, врачи диагностируют атрофию вульвы и влагалища на основании сочетания клинических симптомов и визуального осмотра. Исследователи все чаще настаивают на более объективных и воспроизводимых способах диагностики, не исключая субъективные жалобы пациента [13]. Исторически сложилось, что для диагностики ВА необходимы два основных объективных способа диагностики и оценки эффективности лечения: рН влагалища, а также подсчет вагинального индекса созревания (ВИС, преобладание клеток базального и парабазального слоев) [12, 13]. Интересно, что степень атрофических изменений, измеряемая индексом созревания, не всегда коррелирует с симптомами [15]. В исследовании, проведенном среди 135 менопаузальных женщин-добровольцев, которые прошли оценку симптомов, а затем рейтинг «вагинального здоровья» (оценка цвета влагалища, выделений, целостности и толщины эпителия, рН) и измерение индекса созревания, исследователи обнаружили слабую корреляцию между физическими проявлениями и индексом созревания.
Гормональные изменения, происходящие в течение жизненного цикла, оказывают влияние на вагинальную флору начиная от момента рождения до периода постменопаузы. Снижение эстрогенов в перименопаузе и постменопаузе приводит к уменьшению количества лактобактерий и изменению флоры в целом. Согласно данным S. L. Hillier, R. J. Lau, при детальном анализе микрофлоры влагалища 73 женщин в постменопаузе, не принимавших гормональную терапию, в 49% случаев не было выявлено лактобацилл. А среди тех, у которых они обнаруживались, концентрация последних была в 10–100 раз меньше, чем у женщин в пременопаузе [15]. В постменопаузе наиболее распространенными микроорганизмами являлись анаэробные грамотрицательные палочки и грамположительные кокки.
Несмотря на вышесказанное, у некоторых женщин симптомы атрофии прогрессируют вскоре после наступления менопаузы, а у других они не возникают даже в более поздние годы. Среди факторов, которые могут увеличить риск развития урогенитальной атрофии, курение является одним из наиболее изученных. Курение оказывает прямое воздействие на плоскоклеточный эпителий влагалища, снижает биодоступность эстрогена и уменьшает перфузию крови. Другими гормональными факторами, которые, как правило, имеют значение, являются уровни различных андрогенов, таких как тестостерон и андростендион. Предполагают, что после менопаузы у женщин с более высоким уровнем андрогенов, которые поддерживают сексуальную активность, отмечено меньше изменений, связанных с атрофией [12]. Кроме того, ВА наблюдается чаще у женщин, которые никогда не рожали через естественные половые пути [16].
Принимая во внимание патогенез заболевания, терапия эстрогенами является золотым стандартом лечения. Все клинические рекомендации по лечению УГА сходятся во мнении, что наиболее распространенным и эффективным методом лечения является системная или локальная гормональная терапия эстрогенами в различных формах, так как она достаточно быстро улучшает индекс созревания и толщину слизистой оболочки влагалища, снижает рН влагалища и устраняет симптомы ВА [3, 11–13]. Для лечения УГА, сочетающейся с симптомами климактерия, используют системную гормональную терапию. В остальных случаях отдают предпочтение местному лечению, которое позволяет избежать большинства системных побочных эффектов [12, 13]. Исследования показали, что системная заместительная гормональная терапия устраняет симптомы ВА в 75% случаев, в то время как локальная терапия — в 80–90%.
Эстрогенсодержащие препараты для локального применения, представленные в форме крема, таблеток, пессариев/суппозиториев, вагинального кольца, могут содержать эстриол, конъюгированные эквинэстрогены, эстрадиол или эстрон. Из трех природных эстрогенов человеческого организма эстриол имеет самый короткий период полувыведения и наименьшую биологическую активность. В России имеется многолетний опыт локального применения эстриолсодержащих препаратов, обладающих выраженным кольпотропным эффектом. Учитывая слабое пролиферативное действие на эндометрий при использовании эстриола, дополнительное введение прогестагена не требуется. Многочисленные исследования показали, что ежедневное применение эстриола в дозе 0,5 мг оказывает заметный пролиферативный эффект на эпителий влагалища. Локальное применение эстриолсодержащих препаратов является безопасным и эффективным подходом к предотвращению и лечению ВА, не имеющим ограничений по возрастному аспекту и длительности лечения. В настоящее время в европейских странах отмечается тенденция к локальному использованию низких доз для эстрогенов эстриола и эстрадиола.
В 2006 г. в Кокрановском систематическом обзоре были проанализированы 19 клинических испытаний, в которых приняли участие 4162 женщины в постменопаузе, распределенные по группам, в зависимости от принимаемого вагинально препарата с эстрогенами, а конечной точкой в исследовании была оценка эффективности, безопасности и приемлемости терапии. Четырнадцать исследований сравнивали безопасность различных препаратов, семь акцентировали внимание на побочных эффектах и четыре на безопасности лечения и воздействии на эндометрий. Семь исследований включали плацебо-группы, и во всех показано улучшение состояния пациентов, принимающих гормональную терапию (табл.).
Результаты анализа показывают, что вагинальные таблетки с эстрадиолом более эффективны по сравнению с вагинальным кольцом и что оба варианта лечения превосходят плацебо в устранении диспареунии, сухости и зуда во влагалище. Вагинальный крем с конъюгированными лошадиными эстрогенами (КЛЭ) превосходит увлажняющие кремы в устранении сухости, повышении эластичности и объема кровотока во влагалище. Однако не было обнаружено никаких различий между тремя проанализированными препаратами терапии (крем с КЛЭ, таблетки с эстрадиолом и эстрадиол-рилизинг-кольцо) по отношению к количеству парабазальных клеток, кариопикнотическому индексу, индексу созревания и вагинальному индексу здоровья. К тому же также сообщаются данные об отсутствии значительных различий в толщине эндометрия, гиперплазии и количестве побочных эффектов между вагинальным кольцом, кремом или таблетками. Тем не менее, незначительный риск вагинальных кровотечений был описан во всех исследованиях, в которых применялись различные методы местной терапии эстрогенами, а также возможное увеличение риска развития кандидоза [16].
В результате метаанализа, проведенного Cardozo и соавт., показано, что вагинальный путь введения эстрогенов является эффективным методом лечения ВА. Комбинация местной и системной терапии позволяет достичь результатов в более сжатые сроки. Кроме того, низкие дозы местных эстрогенов: эстрадиола или эстриола так же эффективны, как и при системном введении. Было показано, что трансдермальный пластырь с ежедневной дозой в 14 мкг эстрадиола обладает аналогичным воздействием на рН влагалища и на индекс созревания, как и вагинальное кольцо с 7,5 мкг эстрадиола [17].
Положительный терапевтический эффект местной гормональной терапии был также отмечен в ситуациях, выходящих за рамки лечения ВА, а именно таких, как снижение риска рецидивирующих инфекций мочевыводящих путей и развития гиперактивного мочевого пузыря. С учетом вышеизложенного, эстрадиол-рилизинг-кольцо было одобрено в качестве лечения дизурии и ургентного недержания мочи. В то время как системная гормональная терапия, наоборот, увеличивает процент возникновения стрессового недержания мочи и почечных камней [10].
Таким образом, местная терапия имеет ряд преимуществ по сравнения с системным введением препаратов. Она позволяет избежать первичный метаболизм в печени, минимально воздействует на эндометрий, имеет низкую гормональную нагрузку, минимальные побочные эффекты, не требует добавления прогестагенов, оказывает в основном локальный эффект.
С практической точки зрения и в связи с аналогичной эффективностью и безопасностью всех местных препаратов с эстрогенами, пациентка должна иметь возможность выбрать препарат, который она считает наиболее подходящим для нее. Она должна быть проинформирована о том, что эффект достигается после одного-трех месяцев лечения. Дополнительное назначение прогестагенов не является обязательным при использовании локальных форм эстрогенов [18]. В обзоре за 2009 г., посвященном местной гормональной терапии, говорится, что ни в одном исследовании не наблюдали пролиферацию эндометрия после 6–24 месяцев использования эстрогенов, так что литература, таким образом, дает уверенность относительно безопасности малых доз вагинальных препаратов с эстрогенами и не поддерживает одновременное применение системных прогестагенов для защиты эндометрия [13].
Помимо перечисленных выше методов лечения ВА на сегодняшний момент существуют такие, как терапия с использованием дегидроэпиандростерона, селективных тканевых эстрогеновых комплексов, селективных модуляторов эстрогеновых рецепторов и негормональные методы лечения, а также комбинированные препараты, содержащие ультранизкодозированный эстриол и лактобактерии.
В работе U. Jaisamrarn и соавт. впервые оценивалась эффективность и переносимость ультранизких доз эстриола (0,03 мг) в сочетании с жизнеспособными Lactobacillus acidophilus в краткосрочной и долгосрочной перспективе лечения симптомов ВА. Было выявлено, что комбинация эстриола и лактобактерий в течение 12 недель была достаточна для достижения статистически и клинически значимых результатов, включающих улучшение объективных параметров (ВИС, рН, доля латобактерий в микрофлоре влагалища), а также качество жизни женщин [19].
Среди селективных модуляторов эстрогеновых рецепторов (SERM) оспемифен является наиболее современным лекарственным средством. В 12-недельном трехфазном рандомизированном исследовании с участием 826 женщин в постменопаузе изучали эффективность данного препарата в дозе 30 мг, 60 мг по сравнению с плацебо. К 4-й и 12-й неделям оспемифен в указанных ранее дозах показал статистически значимое увеличение количества поверхностных клеток, снижение парабазальных клеток и рН во влагалище по сравнению с плацебо. Сухость влагалища значительно снизилась как в группах с 30 мг и 60 мг по сравнению с плацебо к 12-й неделе, в то время как диспареуния уменьшилась только в группе, получавшей препарат в дозе 60 мг. В ходе исследования было выявлено, что побочный эффект препарата, проявляющийся в виде приливов, наблюдался у 9,6%, 8,3% и 3,4% участников в группах, получавших оспемифен в дозе 30 мг, 60 мг и плацебо соответственно. Толщина эндометрия от исходного уровня к 12-й неделе в среднем изменилась на 0,42 мм, 0,72 мм и 0,02 мм у участниц выше представленных групп соответственно [21].
Комбинация конъюгированных эстрогенов и базедоксифена — селективного модулятора эстрогеновых рецепторов, известная как тканевой селективный эстрогенный комплекс (TSEC), изучалась в исследовании 3-й фазы, где 601 женщина была распределена по группам в зависимости от ежедневной получаемой терапии: 20 мг базедоксифена плюс конъюгированные эстрогены 0,45 мг (BZA/CE), или базедоксифен 20 мг плюс 0,625 мг конъюгированные эстрогены, или 20 мг базедоксифена и плацебо. В ходе исследования было выявлено увеличение доли поверхностных клеток и уменьшение доли парабазальных от исходного уровня к 12-й неделе в большей степени в группе BZA/CE по сравнению с плацебо и только BZA. РН влагалища существенно не изменился по сравнению с исходным к окончанию исследования в группе BZA или плацебо, но значительно уменьшились в обеих группах BZA/CE. Тем не менее, снижение рН влагалища было значимо ниже в группе BZA/CE 20 мг/0,625 мг, чем в плацебо-группе. Самые «назойливые» симптомы значительно уменьшились к 12-й неделе по сравнению с плацебо в группе BZA/СЕ 20 мг/0,625 мг, но не в группе BZA/СЕ 20 мг/0,45 мг. Не отмечено каких-либо существенных различий в побочных эффектах или случаях прекращения участия в исследовании между группами. Однако была отмечена более высокая заболеваемость вагинитами в группах лечения (BZA/CE) по сравнению с плацебо [22]. Таким образом TSEC, а именно базедоксифен в сочетании с конъюгированными эстрогенами представляет собой альтернативу терапии прогестинами для защиты эндометрия от стимуляции эстрогенами, при сохранении благоприятного воздействия эстрогенов на симптомы, связанные с менопаузой.
Несмотря на перечисленные методы лечения ВА, не стоит забывать о профилактике заболевания. Сохранение регулярной половой жизни рекомендуется, в общем, всем женщинам и, в частности, женщинам в менопаузе. Это связано с тем, что половой акт улучшает циркуляцию крови во влагалище, и семенная жидкость также содержит половые стероиды, простагландины и незаменимые жирные кислоты, которые способствуют сохранению вагинальной ткани [12].
Хотя официальная распространенность атрофии влагалища меняется в зависимости от численности и индивидуальных особенностей изучаемого населения, все большее число женщин страдают от этого состояния по мере старения населения. Одно из исследований, проведенное зарубежными коллегами, показало, что более 60% женщин испытывают симптомы ВА спустя 4 года после наступления постменопаузы. При этом всего лишь 4% женщин в возрасте 55–65 лет связывают вышеуказанные жалобы с атрофией влагалища, 37% знают, что это симптомы обратимы, и 75% женщин считают, что симптомы ВА негативно влияют на их жизнь. Учитывая деликатный характер этих симптомов, пациентки не решаются обратиться за медицинской помощью и, следовательно, страдают от прогрессирующих симптомов [10, 23]. Лишь 25% женщин с симптомами вагинальной атрофии обращаются за медицинской помощью. ВА является хроническим и прогрессирующим состоянием [10]. Значительное число женщин с симптомами ВА даже не представляют, что существует возможность эффективного лечения. Своевременное информирование пациентов о причинах возникновения вышеуказанных симптомов и возможностях их устранения может позволить в короткие сроки улучшить состояние женщин, возвратить им интерес к жизни и ее качество. Таким образом, проблема сохранения здоровья и профилактики заболеваний, обусловленных старением, приобрела в последние годы особое значение. В связи с ее актуальностью в настоящее время проводится разработка и внедрение новых лекарственных препаратов для лечения ВА, что позволит индивидуализировать подход к лечению пациентов.
Литература
ФГБУ НЦ АГиП им. В. И. Кулакова МЗ РФ, Москва
Abstract. According to forecasts to 2030 there will be 1,2 bln women in postmenopause. The state of oestrogen deficit in climacterical period cause vaginal atrophy with 15–57% of women. The latest data on the problem of pathogenesis, clinical manifestations and therapy of this state are provided in review.




_575.gif)