ацетат натрия что можно сделать
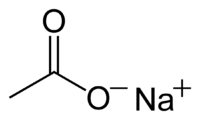
Ацетат натрия
| Ацетат натрия | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | sodium acetate (ИЮПАК) sodium ethanoate (систематическое) ацетат натрия натрия этаноат |
| Химическая формула | CH3COONa |
| Эмпирическая формула | C2H3O2Na |
| Физические свойства | |
| Состояние (ст. усл.) | белый гигроскопичный порошок |
| Молярная масса | 82.03 грамм/моль (безводная форма) 136.08 грамм/моль (тригидрат) г/моль |
| Плотность | 1,45 г/см³ |
| Термические свойства | |
| Температура разложения | 324 °C |
| Удельная теплота плавления | 264—289 к Дж/кг |
| Химические свойства | |
| Растворимость в воде | 76 г/100 мл |
Ацетат натрия CH3COONa, — натриевая соль уксусной кислоты, производится и широко применяется в промышленных масштабах.
Содержание
Область применения
Ацетат натрия используется в текстильном производстве для нейтрализации отработанной серной кислоты в сточных водах и как фоторезист при использовании анилиновых красителей. Также используется при дублении солями хрома (для протравливания), и замедляет процесс вулканизации хлоропрена при производстве синтетических резин.
Ацетат натрия известен как пищевая добавка E262 и применяется как консервант.
В растворе ацетат натрия (будучи солью слабой кислоты) и уксусная кислота могут применяться как буфер, для сохранения относительно постоянного pH. Это особенно полезно в биохимии в pH-зависимых реакциях.
На этом свойстве основан довольно красивый опыт — «горячий лёд»
Способы получения
Ацетат натрия недорог и его легче приобрести в хим. магазинах, чем синтезировать в лабораторных условиях. В лабораторных условиях получается при взаимодействии уксусной кислоты, например, с карбонатом натрия, гидрокарбонатом натрия или гидроксидом натрия.
Это — хорошо известная реакция «гашения» пищевой соды и винного уксуса, происходящая в тесте. 84 грамма гидрокарбоната натрия реагируют с 750 граммами 8 % винного уксуса (или же с 86 граммами 70 % уксусной эссенции) с образованием 82 грамм ацетата натрия в растворе. Выпариванием воды можно получить чистый кристаллический ацетат натрия или его концентрированный раствор.
Характерные реакции
Ацетат натрия может быть использован для образования эфира с алкил галогенидами такими как бромэтан:
При сильном нагревании (более 324 °C) ацетат натрия разлагается на карбонат натрия и ацетон:
Одновременно может проходить разложение до оксида натрия, ацетона и диоксида углерода:
Галерея
Химический обогреватель, содержащий перенасыщенный раствор ацетата натрия, выделяющего тепло при фазовом переходе в кристаллическую форму тригидрата ацетата натрия.
Сайт про изобретения своими руками
МозгоЧины
Сайт про изобретения своими руками
Изготовление горячего льда или ацетата натрия
Изготовление горячего льда или ацетата натрия
Опыт, который я проводил раньше, но наткнулся на него снова. Можно показывать фокусы близким, якобы одним прикосновением замораживая обычную воду. Жидкость кристаллизуется на глазах и очень похожа на воду! Провести опыт достаточно просто каждому мозгочину!
Начнем, пожалуй. Первое, и самое главное, что вам понадобится — это уксус, рекомендуемая концентрация 30% или 70%. Но если есть только 9%, не беда, пойдет и такой. Второй компонент — обычная столовая сода или гидрокарбонат натрия. Ну вот вы затарились кучей уксуса и соды, что же теперь делать дальше? А дальше вам надо вот что: вам нужны весы) Да без весов этот опыт скорее всего не удастся, так как химия — наука точная и не терпит методов «на глаз». Для начала вам необходимо отмерить компоненты — соду и уксус. Я рассчитал сколько нужно граммов соды для 200 мл бутылочки уксуса (именно в таких чаще всего продают уксус, а если нет, то обязательно ищите бутылочку на 200 мл уксуса) различной концентрации, вот мои результаты:
Советую брать соды чуть меньше, так как выход этой реакции не 100%, а около 88-90%. Это потому, что в процессе выделения углекислого газа часть уксуса улетучивается. И для опыта советую брать электронные весы, так как с механическими возни не оберешься. Ну вот, вы отмерили количество соды и уксуса, теперь начинаем реакцию:
CH3COOH + NaHCO3 = CH3COONa + CO2 + H2O
Реакцию лучше проводить сразу в кастрюльке, немного нагревая смесь. Нагревать нужно, так как в ходе реакция температура смеси понижается и реакция замедляется. Только не надо ставить на газовую горелку, а то у вас там все пригорит. Имейте ввиду, что в ходе реакции образуется много пены. Ну вот, после того как реакция завершилась, раствор стал прозрачным испытайте вашу смесь: капните туда чуть-чуть уксуса, если реакция пойдет, это значит, что в растворе осталась лишняя сода. Добавляйте понемногу уксус, пока реакция не завершится. Также, если у вас раствор очень сильно пахнет уксусом, значит, в нем переизбыток уксусной кислоты. Можно немного добавить соды, чтобы при варке у вас не было вонищи по всему дому). Соду лучше добавлять по чуть-чуть, главное, чтобы запах уксуса не был таким сильным. На этом этапе очень важно, чтобы в растворе не было переизбытка соды, а то при следующем этапе у вас ничего не получится. Ну а если все уже нормально, и в растворе нет переизбытка соды и он не сильно воняет уксусом,, то смело ставьте ваш раствор на плиту и начинайте варить. Только не надо сразу забивать и идти смотреть зомбоящик или гамать в комп. Нет, за смесью надо следить!
В процессе варки или выпаривания из раствора улетучивается лишняя вода, поэтому процесс необходимо строго контролировать. Упаривать необходимо для получения перенасыщенного раствора ацетата натрия. Варить надо до появления по краям кастрюльки кристаллизационной корки. Время варки зависит от того, какой концентрации вы брали уксус.
Как только появилась корка, не тормозим и сразу снимаем кастрюльку с огня. И даем смеси чутка поостыть, минут так 5. После небольшого охлаждения кристаллизационная корка должна расшириться, и поверхность раствора должна покрыться как-бы «льдом». После этого кипятим в чайнике или в другой кастрюльке (если нету чайника) воду. Дальше берем в руки чайник и потихонечку, по капелькам добавляем в кастрюльку с нашей поостывшей смесью кипяток. Добавили чутка воды, отставили чайник, помешали раствор ложечкой. И так делаем до тех пор, пока весь «лед» и непонятные куски, плавающие в растворе не растворятся. В итоге должен получится горячий прозрачный, немного такой маслянистый раствор. Маслянистый, не в смысле жирный, а в смысле вязковатый или густоватый. Дальше вам понадобится какая-нибудь емкость типа баночки или кружки, только эта емкость должна быть идеально чистой. Это необходимо для того, чтоб раствор не кристаллизовался, пока охлаждается. Ну вот, взяли вы емкость, и выливаете туда горячий раствор из кастрюльки. Потом ставите емкость с раствором в холодильник. Раствор должен охладится как минимум до комнатной температуры. Ну а после того, как ацетат натрия охладился, то наступает момент истины: ИСПЫТАНИЕ!
Для этого возьмите щепотку столовой соли и сыпаните ее в ваш горячий лед. Если пошла кристаллизация, и ваше настроение улучшилось, то АЛИЛУЯ! Опыт удался! ВЫ сделали первый шаг на пути становления химиком!
А после кристаллизации этот горячий лед можно еще и повторно использовать! Для этого просто поставьте вашу емкость к кристаллизировавшимся ацетатом натрия на водяную баню. Помешивайте смесь ложечкой. Лед, как ему положено, будет таять. А если будет образовываться противная кристаллизационная корка, не злитесь, а по капелькам добавляйте кипяточек в ваш драгоценный горячий лед.
Очень интересный и красивый опыт — горячий лед:
Ацетат натрия используется в текстильном производстве для нейтрализации отработанной серной кислоты в сточных водах и как фоторезист при использовании анилиновых красителей. Также используется при дублении солями хрома (для протравливания), и замедляет процесс вулканизации хлоропрена при производстве синтетических резин.
Ацетат натрия известен как пищевая добавка E262 и применяется как консервант.
В растворе ацетат натрия (будучи солью слабой кислоты) и уксусная кислота могут применяться как буфер, для сохранения относительно постоянного pH. Это особенно полезно в биохимии в pH-зависимых реакциях.
Ацетат натрия также используется в быту как составная химических грелок (англ. heating pad) или химических обогревателей (англ. Hand warmer), применяется как составная часть смеси «горячего льда» (англ. «hot ice»), при кристаллизации ацетата натрия выделяется тепло — это экзотермический процесс). При нагреве тригидрата ацетата натрия (имеющего точку плавления в 58 °C) до 100 °C (обычно ёмкость с ним кладут в кипящую воду), он расплавляется и переходит в водный раствор ацетата натрия. При охлаждении этого раствора ацетата натрия, он образует перенасыщенный раствор ацетата натрия в воде. Этот раствор прекрасно переохлаждается до комнатной температуры без образования твёрдой фазы, затем нажатием на металлический диск в ёмкости образуется центр кристаллизации, который, вырастая, заставляет перенасыщенный раствор переходить назад в твёрдую фазу тригидрата ацетата натрия. Этот процесс сопровождается значительным выделением тепла (экзотермическая реакция). При этом процессе выделяется около 264—289 кДж/кг (Теплота фазового перехода). Также ацетат натрия используется в некоторых моделях космических скафандров, как источник тепла.
Теперь, надеюсь вы без проблем получите ацетат натрия в домашних условиях и впечатлите окружающих своими познаниями и интересными опытами.
Ацетат натрия: свойства, применение, вред
Ацетат натрия (натрия этаноат, натрий уксуснокислый) – это натриевая соль этановой кислоты, вещество, активно производимое и применяемое в пром. масштабах. На вид – твердая рассыпчатая масса белого цвета (возможно, с желтоватым или коричневатым оттенком, зависимо от наличия в составе примесей). Часто используется в пищепроме в качестве добавки к пище, консерванта Е262. Но окрашенный продукт подходит только для промышленных задач.
Получение
Промышленный синтез выглядит как сухая перегонка древесины. На самом же деле, большинство из нас хоть раз в жизни тоже производило данное вещество на собственной кухне. Каким образом? Гася для приготовления теста питьевую соду уксусом! В результате такой реакции формируются этаноат натрия и угольная кислота. Последняя очень нестойкая и почти сразу превращается в воду и углекислый газ. Так что получение водного раствора ацетата натрия – это ничто иное, как реакция между этановой кислотой и хорошо известной каждой хозяйке пищевой содой. Чтобы получить материал в твердой форме, необходимо дополнительно осуществить выпаривание раствора.
Свойства
Это кристаллический продукт без вкуса и запаха (или с легким запахом уксусной кислоты). Хорошему растворению поддается в воде (76 г/100 мл), с образованием раствора, а вот в спиртах и эфирах растворение слабое. Характеризуется гигроскопичностью. К горючим веществам не принадлежит. Степень токсичности – низкая.
К слову, так как данная соль вступает в реакцию с водой, для ее перевозки и хранения необходимо использовать упаковку, дополненную изнутри полиэтиленовой подкладкой, с отметкой «Беречь от влаги». Вообще это могут быть текстильные пищевые мешки, гофрокартонные ящики, пакеты, состоящие из многих слоев бумаги, а также бочки и контейнеры.
Примечательно, что натрия этаноат широко распространен в естественной среде (похвалиться этим могут далеко не все пищевые добавки). Он присутствует в составе растительных и животных клеток. Как и природные кислоты, есть в преимущественном количестве фруктов. Кроме того, формируется в ходе бактериальной ферментации, как результат, является постоянным ингредиентом всей кисломолочки (кефира, простокваши, сливок и др.).
Рассматриваемому продукту свойственно еще одно название – «горячий лед». Объясняется оно тем, что в ходе кристаллизации происходит выделение обильного количества тепла.
Молярная масса – 82,03 и 136,08 г/моль (в безводном состоянии и в форме тригидрата, соответственно), плотность – 1,45 г/см³, t разложения – 324 °C, pH водного раствора – 8-9,5. Количество основного компонента – 98,5 %. Формула: C2H3O2Na.
Применение
Ацетат натрия – доступный и безвредный для людей и окружающей среды материал с большим спектром применения, что объясняется вышеупомянутыми химическими свойствами. Главное из направлений – производство пищевых продуктов.
Значение Е262 для пищепрома. Здесь эту добавку ценят, прежде всего, за способность регулировать уровень кислотности химической среды, выступать отменным консервантом, ароматизатором и стабилизатором. В ее функциональных обязанностях – сохранность вкусо-ароматических характеристик, формы и текстуры, а также улучшение консистенции продуктов. Следовательно, есть ряд продуктов, производство которых на сегодняшний день без нее практически не обходится.
Уксуснокислый натрий наиболее часто вводят в муку с целью предотвращения «картофельной болезни» хлеба (прежде всего пшеничного с низкой кислотностью) и хлебобулочных изделий, которую провоцируют формирующие споры бактерии, очень распространенные в природных условиях. Популярно совместное применение с кальция ацетатом.
В овощных и фруктовых консервах он призван смягчать избыточно острый вкус этановой кислоты, нивелировать резкость запаха. С его участием часто производят чипсы, сухарики и аналогичные продукты, чтобы сделать их вкус и запах более приятными, пикантными, немного уксусными. Также Е262 можно встретить в майонезе, бульонных кубиках и сублимированных продуктах (к примеру, в супах быстрой готовки).
Этаноат натрия разрешен к применению в пищепроме во всей Европе, США и в Украине. В виду низкотоксичности, считается, что данная пищевая добавка может употребляться здоровым человеком вместе с пищей в неограниченных объемах. Поэтому даже максимальные суточные дозы потребления не везде нормированы.
Другие сферы применения:
— химия. Находит место при создании красителей и разноплановых химических соединений (в частности, хлористого ацетила, ангидрида и винилового эфира уксусной кислоты). Также выступает катализатором поликонденсации;
— биохимия. Здесь, а именно в pH-зависимых реакциях, очень важна способность данного реактива выступать буфером, сохраняющим сравнительно постоянный pH;
— медицина. Эту субстанцию можно встретить в составе некоторых мочегонных препаратов, заживляющих раны, антисептических мазей и лекарств иного назначения. Кроме того, оно служит ощелачивателем при метаболическом ацидозе и низком уровне натрия в крови. А способность легкого растворения объясняет ее использование в качестве ингредиента инъекционных составов против воспалений и для обезболивания;
— изготовление гигиенических средств, прежде всего мыла;
— текстильная и кожевенная отрасли. Служит фоторезистом (полимерным светочувствительным материалом) при задействовании анилиновых красителей. В качестве протравы принимает участие в покраске текстиля и кожедублении хромовыми солями;
— резиновое и каучуковое направление. Тормозит вулканизацию хлорбутадиена при изготовлении искусственной резины;
— аграрный комплекс. Задействуется в роли добавки-консерванта, призванной сохранять фуражное зерно и зеленые корма. Также повышает количество удоев и привес рогатого скота. А у птиц увеличивает яйценоскость;
— строительство. Создает антиморозный эффект для бетона (любой вид бетона, благодаря ему, становится более устойчивым к пониженным температурам). Применяется при сооружении конструкций-монолитов, бетонных и ЖБ зданий из легких и мелкозернистых бетонов. Отлично зарекомендовал себя при реализации кладки из камня тогда, когда работы проводятся при низкой t окружающей среды. А еще ему под силу препятствовать промерзанию бетоносмесей при перевозке, укладывании и утрамбовке;
— гальванотехника. Служит электролитом и буферным раствором;
— фотодело. Входит в структуру кислых закрепляющих композиций для фото;
— сохранность экологии. Нейтрализует отработанную H2SO4 (серную кислоту) в стоках;
— быт. Используется в создании химических грелок и обогревателей, как важный элемент популярной совокупности «горячий лед». Обусловлено такое применение способностью этого вещества нагреваться до весьма значительных температур. Кристаллизуясь, натрия ацетат выделяет тепло (экзотермическая реакция). Нагрев его тригидрата с t плавления 58 °C до температуры 100 °C (например, путем размещения емкости с данным соединением в кипящей воде) приводит к расплавлению (или, если сказать точнее, к растворению в своей же кристаллизационной воде) с превращением в водный раствор ацетата натрия. Охлаждаясь, этот раствор становится перенасыщенным. Его переохлаждение к комнатной t происходит отменно, с минованием появления твердой фазы. Надавливание на диск из металла, находящийся в емкости, приводит к возникновению кристаллизационного центра, который увеличивается и переводит перенасыщенный р-вор в твердую фазу тригидрата натрия этаноата. Количество тепла, которое возникает – 264-289 кДж/кг.
Описанная реакция, кстати, лежит в основе интересного химического опыта с одноименным названием «горячий лед».
В целом, использование в той или иной отрасли находит один из двух видов выпускаемого промышленностью ацетата натрия: пищевой или технический.
Вред
Выше было упомянуто, что данному материалу характерно незначительное токсичное воздействие. Обратите внимание: незначительное, а не полное его отсутствие. Определенное пагубное влияние на здоровье и самочувствие все же возможно (при поступлении увеличенных доз и регулярности потребления). И по разным данным вред определяется от крайне малого уровня до среднего.
Так, попадая в кишечник (всасывается организмом при проглатывании), этот продукт может трансформироваться в крайне ядовитые нитраты с канцерогенным воздействием. Считается, что избыточное поступление натрия уксуснокислого в организм чревато повышением риска появления онкообразований и мощных аллергий. Но официального научного подтверждения этому нет, поэтому данную добавку не зачислено к онкогенным или опасным.
Также значительные количества могут стать причиной интоксикаций, сопровождающихся следующими признаками: головные боли и головокружения, резкие болевые ощущения в животе, побледнение кожи и слизистых, судороги, координационные нарушения, утрудненное дыхание, обмороки.
Употребление продуктов, содержащих ацетат натрия, стоит ограничить тем, кто не понаслышке знает, что такое ВСД, гипертоническая болезнь, дисбиоз, недуги мочевых путей, кишечника, желчного пузыря, печени, сердца и сосудов.
В пищевую продукцию, предназначенную для детей, эту добавку вводить нельзя. Родителям, переживающим, чтобы у ребенка не возникла аллергия, лучше не давать ему еду с Е262.
С одной стороны, мировое сообщество на сегодняшний день не установило максимальных суточных доз ацетата натрия, разрешенных к применению, считая его вполне безопасным. С другой стороны, ряд негативов и ограничений есть, а изучения в этом направлении продолжаются и некоторые данные не могут пока считаться абсолютно истинными. Поэтому каждый – будь то производитель, или потребитель – должен ответственно подходить к применению указанной добавки. Без страха, но с осознанием того, что в чрезмерных количествах к добру не приводит ничто. Соблюдайте золотую середину – и все будет хорошо.
Натрия Ацетат
Химическое название
Натриевая соль уксусной кислоты, натрия этаноат.
Химические свойства
Белый гигроскопичный мелкий порошок, растворимый в воде. Разлагается при 324 градусах Цельсия. Молекулярная масса = 82 грамма на моль для безводной формы, 136,1 грамм на моль – для тригидрата. Формула Натрия Ацетата: CH3COONa; рацемическая формула: C2H3O2Na; формула тригидрата: C2H3O2Na х 3H2O.
Химические свойства
Вещество можно получить с помощью реакции уксусной кислоты с карбонатом или гидрокарбонатом натрия, с NaOH. В домашних условиях — это реакция винного уксуса с пищевой содой, к 1 грамму соды добавляют 9 грамм уксуса.
Реакция электролиза Ацетата Натрия. Во время превращения происходит диссоциация CH3COONa до CH3COO- и Na+. У анода выделяется этан и углекислый газ. Далее углекислый газ вступает в реакцию с гидроксидом бария или натрия (NaOH), во втором случаев пробирке останется чистый этан.
Достаточно популярна в химии реакция гидролиза Ацетата Натрия. Для наглядности, образованную слабой к-ой и сильным основанием соль, смешивают с индикатором-фенолфталеином. Смесь нагревают, при этом соль частично плавится и в расплаве появляются гидроксид-ионы. Затем пробирку охлаждают, соль кристаллизуется, и смесь утрачивает фиолетовую окраску. Соединение также реагирует с алкилгалогенидами, бромэтаном с образованием сложных эфиров.
Качественная реакция на Ацетат Натрия проводится в два этапа. Сначала определяют наличие в соединении ионов Na, а затем – кислотного ацетат-остатка. Натрий будет гореть ярко желтым пламенем, если небольшое количество раствора (или сухого вещ-ва) внести в пламя спиртовой горелки. Качественную реакцию на ацетат ион можно провести с помощью любой растворимой соли трехвалентного железа. Раствор станет красно-коричневого цвета, а при нагревании выпадет темно-коричневый осадок Fe(OH)3.
Химическое соединение используют при производстве текстиля; в качестве фоторезиста после применения анилиновых красителей; при вулканизации и в кожевенном производстве. Вещество получило широкое применение в виде пищевой добавки E262, используется в качестве консерванта; его применяют для сохранения стабильного рН в биохимии. Соединение используют при производстве химических обогревателей и грелок, («горячий лёд»). В медицине также используют тригидрат Натрия Ацетата.
Фармакологическое действие
Восстанавливает водно-солевой баланс.
Фармакодинамика и фармакокинетика
Натрия Ацетат применяют в комбинации с другими хим. соединениями. Вещество используют для дезинтоксикации и регидратации. Средство обладает способностью восстанавливать водный и электролитный баланс во время обезвоживания. Стимулирует диурез и предотвращает развитие метаболического ацидоза. Обладает дезинтоксикационным, регидратирующим и плазмозамещающим действием.
Показания к применению
Применяется при регидратации, интоксикации, гиперкалиемии, обезвоживании у пациентов с пищевыми инфекциями, холерой, острой дизентерией и так далее.
Противопоказания
Побочные действия
Редко при применении растворов для внутривенного введения с данным лекарственным средством возникает отечность, тахикардия, озноб.
Инструкция по применению (Способ и дозировка)
Натрия Ацетат в составе различных препаратов для внутривенного введения применяется в условиях стационара, под контролем лабораторных показателей. Растворы вводят струйно или капельно. Дозировка зависит от состояния пациента и тяжести состояния. Как правило, если пациент находится в тяжелом состоянии, то сначала вводят лекарство струйно, затем переходят на инфузии.
Передозировка
Нет сведений о передозировке средством.
Взаимодействие
Вещество часто применяют в комбинации с другими электролитами.
Ацетат Натрия можно сочетать с натрия хлоридом и натрием фумаровокислым, при этом необходимо визуально следить за совместимостью растворов.
Условия продажи
Может потребоваться рецепт.
Особые указания
Лечение препаратом проводят под контролем уровня электролитов крови и гематокрита.