ацетилхолин что делает в желудке
Роль серотониновых рецепторов в моторно-эвакуаторной функции желудочно-кишечного тракта

В статье рассматриваются механизмы влияния некоторых нейрогуморальных веществ на моторику желудочно-кишечного тракта, в том числе на кишечные сокращения. Основная часть работы посвящена роли серотонина на двигательную активность пищеварительной трубки. Пр
Mechanisms of the effect of some neurohumoral agents on alimentary canal motor activity including intestinal abridgement are discussed in the article. Major part of the work is dedicated to serotonin effect on motor activity of digestive tube. The authors also provide comparative analysis of serotonergic preparations that affects motor activity of esophagus, stomach and bowels. Clinical manifestations of deficit and excess of serotonin and the ways of its corrections are described.
Основными классами рецепторов, участвующих в регуляции моторно-эвакуаторной функции желудочно-кишечного тракта (ЖКТ), являются холинергические, адренергические, допаминергические, серотониновые, мотилиновые и холецистокининовые. Препараты, применяемые при депрессивных и тревожных расстройствах, панических атаках и других вегетативных дисфункциях, действуют на те же рецепторы, которые отвечают за моторно-эвакуаторную функцию желудочно-кишечной трубки. Регулирование деятельности гладкой мускулатуры и подвижности кишечника происходит на нескольких уровнях. Гормоны и нейротрансмиттеры являются доминирующими компонентами, которые прямо или косвенно воздействуют на гладкомышечные клетки. Постпрандиальный эндокринный ответ включает в себя выработку инсулина, нейротензина, холецистокинина (ХХК), гастрина, глюкагоноподобных пептидов (ГПП-1 и ГПП-2), глюкозозависимый инсулинотропный полипептид (ГИП, ранее известный как желудочный ингибиторный пептид) [1], данные об эффектах нейромедиаторов и гормонов представлены в табл. 1. Например, ХХК выделяется в проксимальных отделах тонкой кишки и непосредственно влияет на сокращение мышечных клеток желчного пузыря и нейромедиированную релаксацию мышц клеток сфинктера Одди, которая опосредуется через ГИП нервно-мышечные соединения.
В настоящей статье особое внимание уделено серотонинергическим рецепторам, которые являются одними из важных регуляторов кишечной перистальтики. Серотонин, или 5-гидрокситриптамин (5-HT), — моноаминовый нейромедиатор, который является главным посредником в физиологии психологического состояния и настроения человека, а также одним из регуляторов функции сосудов и желудочно-кишечной моторики. 5-HT, как известно, представлен в тромбоцитах, ЖКТ и центральной нервной системе человека и животных [2–5]. Серотонин вырабатывается в организме человека из поступившей с пищей аминокислоты триптофана — так как именно она нужна для непосредственного синтеза серотонина в синапсах; второй путь выработки серотонина связан с поступлением глюкозы с углеводной пищей, которая стимулирует выброс инсулина в кровь, далее происходит катаболизм белка в тканях, что также приводит к повышению уровня триптофана в крови.
На основе биохимических и фармакологических критериев 5-HT-рецепторы подразделяются на семь основных подтипов, пять из которых находятся в кишечных нейронах, энтерохромаффинных (ЭХ) клетках и в гладкой мускулатуре ЖКТ — это 5-HT1, 5-HT2, 5-HT3, 5-НТ4 и 5-HT7 [6, 7]. Около 80% от общего количества 5-НТ-рецепторов находятся в ЭХ-клетках кишечника, где они принимают участие в кишечной перистальтике через несколько подтипов 5-HT-рецепторов [8, 9]. За исключением 5-HT3-рецепторов, лиганда закрытого ионного канала, все 5-HT-рецепторы связываются с рецепторами G-белка, которые активируют внутриклеточные реакции второго каскада, стимулируя возбуждающие или тормозные реакции в ЖКТ [10]. Серотонин обладает хорошо изученным воздействием на кишечную моторику, секрецию и сенситивность через центральные и периферические нейромедиаторные пути, что делает его ключевым фармакологическим средством, применяемым в лечении моторных нарушений ЖКТ [11]. Серотонин высвобождается из ЭХ-клеток в ответ на химическое или механическое раздражение слизистой оболочки [12] или в ответ при экспериментальных моделях стресса [13]. Серотонин синтезируется и хранится не только в ЭХ-клетках (90%), но и в нейронах кишечника (10%). Как говорилось выше, 5-HT выделяется в кровь после приема пищи и в ответ на изменения давления в кишечной стенке, а также при воздействии вредных раздражителей [13], а затем поступает в просвет кишечника и далее в его стенки из базолатерального депо ЭХ-клеток [14]. 5-HT стимулирует круговые и продольные мышцы желудка, двенадцатиперстной кишки и тощей кишки [15]. Важно стратегическое расположение ЭХ-клеток в непосредственной близости от сенсорных нервных окончаний слизистой оболочки кишечника, интерганглионарных нейронов и синапсов двигательных возбуждающих и тормозных нейронов. Серотонин увеличивает сокращение амплитуды мышц желудка, двенадцатиперстной кишки, тощей кишки и подвздошной кишки [16]. В тонкой кишке 5-HT стимулируют круговые сокращения мышц в течение первой манометрической фазы, вызываемые сокращения распространяются, становятся более частыми и активируют быстрые моторные комплексы [17]. В толстой кишке серотонин стимулирует подвижность на протяжении всей длины, вызывая фазовые сокращения, но не гигантские двигательные комплексы [18]. Кишечные гладкомышечные ритмические колебания определяются спонтанной активностью интерстициальных клеток Кахаля, которые работают как кардиостимулятор для клеток в ЖКТ [19–22]. Кишечная нервная система (КНС) состоит из полуавтономных эффекторных систем, которые связаны с центральной вегетативной системой. При освобождении серотонина из энтерохромаффинных клеток происходит инициация вагусных рефлексов — перистальтических, выделительных, сосудорасширяющих, ноцицептивных. Парасимпатический и симпатический отделы вегетативной нервной системы образуют КНС через афферентные и эфферентные связи. Текущие двунаправленные отношения рефлекторной дуги «мозг–кишка» с участием 5-HT оказывают существенное влияние на эффекторные системы. Нарушенная 5-HT-трансмиссия может привести к возникновению как кишечных, так и внекишечных проявлений синдрома раздраженного кишечника (СРК) [23].
Степень участия в функциональной перистальтической активности ЖКТ различных 5-HT подразделяется следующим образом — 5-HT3 — 65%, 5-НТ4 — 85% и 5-HT7 — 40%. В сочетании антагонисты этих рецепторов, приведенные в парах, способны уменьшить перистальтическую активность кишечника примерно на 16% (5-HT3 + 5-HT4), на 70% (5-HT3 + 5-HT7) и на 87% (5-HT4 + 5-HT7), а одновременное введение всех трех антагонистов неизбежно блокирует всю перистальтическую активности. Таким образом, 5-HT-рецепторы играют ключевую роль в модуляции кишечной перистальтики с одновременной блокадой трех рецепторов и подавляют перистальтическую активность. Среди 5-HT-рецепторов ЖКТ подтип 5-HT4 наиболее функционально важен для перистальтики, а 5-HT3— и 5-HT7-рецепторы играют несколько менее активную роль в этом процессе, что отражено в табл. 2 и на рис. 1 [24].
5-HT4-агонисты были доступны с введением в клиническую практику метоклопрамида в 1964 г. Этот препарат является антагонистом дофаминовых D2— и 5-HT3-рецепторов, а также агонистом 5-HT4-рецепторов и до сих пор широко используется во всем мира. Его успех привел к разработке альтернативных молекул, которые не влияют на D2-рецепторы, устраняя тем самым такие неблагоприятные события, как акатизия и экстрапирамидные двигательные расстройства.
Серотониновые рецепторы, в частности, 5-HT3 и 5-НТ4, участвуют в сенсорных и рефлекторных реакциях на раздражители при гастроинтестинальных расстройствах, обусловливая такие проявления, как рвота, запор или диарея, нарушения пищевого поведения, боли в животе, измененные сенсомоторные рефлексы [25]. Было высказано предположение, что селективные ингибиторы обратного захвата серотонина (СИОЗС) могут влиять на функцию 5-HT3-рецепторов, а также могут улучшить симптоматику СРК и сопутствующей депрессии у пациентов. Согласно ряду исследований и обзоров [26–29], трициклические антидепрессанты (амитриптилин, Мелипрамин), антидепрессанты ряда СИОЗС, такие как флуоксетин, пароксетин, циталопрам, кломипрамин, литоксетин, тразодон, и ряда селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСиН) (дулоксетин) улучшают симптомы СРК. Долгосрочные побочные эффекты данной терапии являются общими для лечения антидепрессантами и связаны с антихолинергическим, серотонинергическим, седативным, антигистаминым и альфа-адренергическим эффектами. Эти эффекты необходимо учитывать при выборе подхода к лечению, поскольку описанные выше препараты влияют на моторику кишечника, функция кишечника пациента также должна учитываться при выборе серотонинергических препаратов (рис. 2) [30].
Как указывалось ранее, 5-HT1-, 5-HT3— и 5-НТ4-подтипы рецепторов играют важную роль в двигательных, чувствительных и секреторных функциях ЖКТ. Препараты, непосредственно влияющие на 5-HT-рецепторы, в отличие от трициклических антидепрессантов и СИОЗС, модулируют 5-гидрокситриптамин (5-HT) путем связывания с 5-HT-рецепторами, их характеристики отражены в табл. 3. Кишечные функции 5-HT-рецепторов связаны с гладкими мышцами, увеличением количества дефекаций, а также со снижением кишечного транзитного времени [31, 32]. Блокада 5-НТ3-рецепторов, в частности противорвотными средствами типа ондансетрона, приводит к запорам [33]. В течение последнего десятилетия были разработаны и испытаны блокаторы 5-НТ3-рецепторов — алосетрон и силансетрон при СРК-Д (СРК с диареей). Недавний систематический обзор и метаанализ 11 рандомизированных контролируемых исследований (РКИ) сравнения этих двух 5-НТ3-антагонистов с плацебо выявили положительный эффект препаратов [34]. Тем не менее, ряд редких побочных эффектов, включая ишемический колит и тяжелые запоры, привел к тому, что производство алосетрона и исследования по силансетрону были приостановлены [35]. Алосетрон сегодня доступен только по строгим показаниям (в США) для пациенток с тяжелым резистентным СРК с диареей, которые не ответили на первую или вторую линии терапии.
5-HT4-агонисты доказали свой терапевтический потенциал для лечения больных с нарушениями моторики ЖКТ. Препараты, у которых отсутствует селективность к 5-HT4-рецепторам, имеют ограниченный клинический успех в гастроэнтерологической практике. Например, наряду со сродством к 5-HT4-рецепторам, такие препараты, как цизаприд и тегасерод, имеют заметное сродство и к другим рецепторам, каналам или белкам-трансмиттерам. Неблагоприятные кардиоваскулярные события, наблюдаемые при применении этих средств, связаны с их неселективностью и перекрестными эффектами. Систематический обзор и метаанализ показали, что тегасерод превосходит плацебо при лечении запоров, в том числе и при СРК. Большинство исследований, относящихся к тегасероду, проводились с участием женщин, и в результате препарат первоначально был одобрен для лечения СРК-З (СРК с запором) только у женщин. Тем не менее, маркетинг тегасерода был также приостановлен, когда стали сообщаться данные о возможном росте сердечно-сосудистых и цереброваскулярных событий на фоне приема препарата [6].
Важным событием в клинической фармакологии стало открытие селективного лиганда (лиганд, от лат. ligare — связывать, атом, ион или молекула, связанные с неким центром (акцептором), термин применяется в биохимии для обозначения агентов, соединяющихся с биологическими акцепторами — рецепторами, иммуноглобулинами и др.) к 5-HT4-рецептору — прукалоприда (prucalopride). Избирательность этого нового препарата значительно отличает его от старших поколений альтернативных препаратов благодаря сведению к минимуму возможностей побочных эффектов. Кроме того, концепция поиска аналогичных лигандов открывает широкие возможности для дальнейшей разработки лекарственных препаратов и создания агонист-специфических эффектов в различных типах клеток, тканей или органов. Селективный агонист 5-HT4-рецепторов прукалоприд является инновационным препаратом с привлекательным профилем безопасности для лечения пациентов, страдающих гипомоторными расстройствами ЖКТ [36]. Прукалоприд имеет высокое сродство и избирательность к 5-HT4-рецепторам ЖКТ. За время существования препарата прукалоприд было проведено несколько крупных и долгосрочных исследований, которые позволили в полной мере оценить риски и преимущества использования прукалоприда при хронических запорах [36–38]. В целом прием прукалоприда был связан с последовательным и значительным улучшением удовлетворенности пациентов в их лечении, по оценке опросника качества жизни при запорах (Patient Assessment of Constipation Quality of Life questionnaire — PAC-QOL). Доля участников, получавших прукалоприд в дозе 2 мг в сутки, которые отметили улучшение ≥ 1 пункт по 5-балльной подшкале PAC-QOL, составила 45,3%, по сравнению с 21,3% среди тех больных, кто получал плацебо (р ≤ 0,001), но число ответчиков почти во всех исследованиях было менее 50%. В ходе других испытаний — PRU-США-11 и PRU-США-13 — не было выявлено никакого существенного различия между прукалопридом и плацебо во всех суррогатных точках. Общая частота нежелательных явлений была статистически достоверно чаще у пациентов, получавших прукалоприд (72%), по сравнению с пациентами, принимавшими плацебо (59%) (отношение рисков (ОР) 1,21, 95% доверительный интервал (ДИ): 1,06, 1,38). Неблагоприятные события, которые наиболее часто сообщали пациенты, получавшие прукалоприд, были головная боль (до 30%), тошнота (до 24%), диарея (до 5%), боли в животе и метеоризм (до 23%), головокружение (до 5%) и инфекции верхних дыхательных путей [39]. R. Cinca и соавт. сравнили эффективность, безопасность и влияние на качество жизни макрогола и прукалоприда у 240 женщин с хроническими запорами, которым другие слабительные не обеспечивали адекватную помощь. В этом исследовании макрогол оказался более эффективным для лечения хронического запора, чем прукалоприд, и лучше переносился [40]. В итоге можно сделать вывод, что прукалоприд может назначать врач, имеющий опыт в лечении хронических запоров, женщинам от 18 до 75 лет в том случае, если в их лечении не были эффективны другие слабительные средства.
Важно знать, что не всегда у пациентов бывает дефицит серотонина, в ряде случаев врач может сталкиваться с его избытком. У беспокойных гастроэнтерологических пациентов, которые имеют повышенное содержание серотонина, развивается аэрофагия, что вызывает увеличение воздушного пузыря в желудке и приводит к раздражению рецепторного аппарата [41]. Повышенный уровень серотонина обуславливает частую тошноту и рвоту вследствие активации блуждающего нерва, диарею или спастический запор, гастроинтестинальные панические атаки, головную боль, тремор, гипергидроз, волнение и тревогу, сердцебиение, нестабильное артериальное давление, бессонницу.
Серотонин играет важную роль не только в регуляции моторики и секреции в ЖКТ, усиливая его перистальтику и секреторную активность, но и является фактором роста для некоторых видов симбиотических микроорганизмов, усиливает бактериальный метаболизм в толстой кишке. Сами бактерии толстой кишки также вносят некоторый вклад в секрецию серотонина кишечником, поскольку многие виды симбиотических бактерий обладают способностью декарбоксилировать триптофан. При дисбиозе и ряде других заболеваний толстой кишки продукция серотонина кишечником значительно снижается. Массивное высвобождение серотонина из погибающих клеток слизистой желудка и кишечника при воздействии цитотоксических химиопрепаратов является одной из причин возникновения тошноты и рвоты, а также диареи при химиотерапии злокачественных опухолей [42, 43].
Трудно переоценить роль серотонина в организме человека. В передней части мозга под воздействием серотонина стимулируются области, ответственные за процесс познавательной активности, а повышение серотонинергической активности создает в коре головного мозга ощущение подъема настроения. Поступающий в спинной мозг серотонин положительно влияет на двигательную активность и тонус мышц, это состояние можно охарактеризовать фразой «горы сверну». Кроме настроения, серотонин «отвечает» за самообладание или эмоциональную устойчивость. Серотонин контролирует восприимчивость мозговых рецепторов к стрессовым гормонам адреналину и норадреналину. У людей с пониженным уровнем серотонина малейшие поводы вызывают обильную стрессовую реакцию. Отдельные исследователи считают, что доминирование особи в социальной иерархии обусловлено именно высоким уровнем серотонина [42, 43].
Заключение
Когда в организм поступает пища, в том числе содержащая триптофан, увеличивается выработка серотонина, что повышает настроение. Мозг быстро улавливает связь между этими явлениями и, в случае депрессии (серотонинового голодания), незамедлительно «требует» дополнительного поступления пищи с триптофаном или глюкозой. Наиболее богаты триптофаном продукты, которые почти целиком состоят из углеводов, например, хлеб, бананы, шоколад, инжир, курага, финики, изюм, арбузы и т. п. Перечисленные продукты давно известны и как регуляторы кишечной перистальтики. Их дефицит в питании приводит к депрессиям и проблемам ЖКТ, что можно часто наблюдать у людей, соблюдающих строгую низкокалорийную диету. По этой причине прежде чем назначать пациенту лекарственные препараты, повышающие уровень серотонина, необходимо уточнить причину его дефицита. Знание о деталях строения серотониновых рецепторов, несомненно, найдет применение в лечении пациентов некардиотоксичными аналогами серотонина или препаратами, повышающими уровень серотонина, которые будут выполнять свою целебную функцию и окажутся приятны во всех отношениях, например, такие как шоколад [44]. Препараты, повышающие уровень серотонина в синаптической щели и способствующие усилению его эффектов, относятся к группе антидепрессантов. Сегодня они являются одними из самых назначаемых лекарств врачами общей медицинской практики многих стран мира, в том числе Европы и Северной Америки. Своевременное назначение антидепрессантов как в монотерапии, так и в схемах лечения различных заболеваний, позволяет повысить эффективность лечения основного заболевания и улучшить качество жизни пациентов, особенно у пациентов гастроэнтерологического профиля.
Литература
ГБОУ ВПО КемГМА МЗ РФ, Кемерово
Молекула здравого ума
Автор
Редактор
Ацетилхолин — не самое знаменитое вещество, но он играет важную роль в таких процессах, как память и обучение. Давайте приоткроем завесу тайны над одним из самых недооцененных нейромедиаторов нашей нервной системы.
Первый среди равных
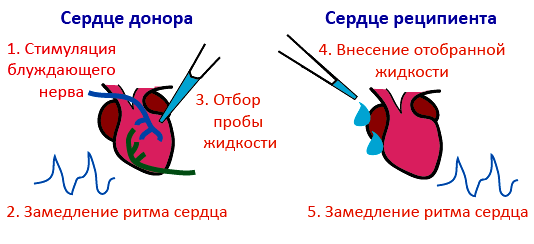
Рисунок 1. Классический опыт Отто Лёви по выявлению химических посредников передачи нервных импульсов (1921 год). Объекты — изолированные и погруженные в солевой раствор сердцá двух лягушек (донора и реципиента). Описание приведено в тексте. Рисунок с сайта en.wikipedia.org, адаптирован.
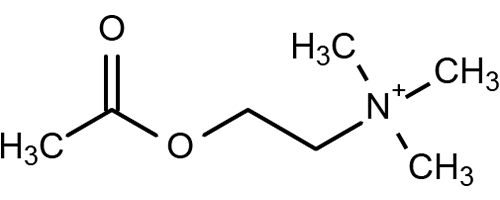
Рисунок 2. Структурная формула ацетилхолина. Рисунок с сайта www.curezone.org.
В научно-популярной литературе медицинской и нейрофизиологической направленности чаще всего речь заходит о трех нейромедиаторах: дофамине [1], серотонине [2] и норадреналине [3]. Во многом это объясняется тем, что нормальные и болезненные состояния, связанные с изменением уровня этих нейротрансмиттеров, доступнее для понимания и вызывают больше интереса у читателей. Об этих веществах я уже писал, теперь настало время уделить внимание еще одному медиатору.
Речь пойдет об ацетилхолине, и это будет символично, учитывая, что он был первым открытым нейромедиатором. В начале XX века между учеными велся спор, каким способом передается сигнал от одной нервной клетки на другую. Одни считали, что электрический заряд, пробежав по одному нервному волокну, передается на другое по каким-то более тонким «проводам». Их оппоненты утверждали, что существуют вещества, которые переносят сигнал от одной нервной клетки к другой. В принципе, обе стороны оказались правы: существуют химические и электрические синапсы. Однако сторонники второй гипотезы оказались «правее» — химические синапсы преобладают в организме человека.
Чтобы разобраться в особенностях передачи сигнала от одной клетки к другой, физиолог Отто Лёви проводил простые, но изящные опыты (рис. 1). Он стимулировал электрическим током блуждающий нерв лягушки, что приводило к уменьшению частоты сердечных сокращений*. Затем жидкость, находящуюся вокруг этого сердца, Лёви собирал и наносил на сердце другой лягушки — и оно тоже замедлялось. Это доказывало существование некоего вещества, передающего сигнал от одних нервных клеток другим. Загадочное вещество Лёви назвал vagusstoff («вещество блуждающего нерва»). Сейчас мы знаем его под названием ацетилхолин. Вопросом химической синаптической передачи занимался и британец Генри Дейл, который обнаружил ацетилхолин еще раньше Лёви. В 1936 году оба ученых получили Нобелевскую премию по физиологии и медицине «за открытия, связанные с химической передачей нервных импульсов».
* — О том, как сокращается наше сердце — об автоматизме, дирижирующих пейсмейкерах и даже смешных каналах, — читайте в обзоре «Метроном: как руководить разрядами?» [4]. — Ред.
Ацетилхолин (рис. 2) производится в нервных клетках из холина и ацетилкофермента-А (ацетил-КоА). За разрушение ацетилхолина отвечает фермент ацетилхолинэстераза, находящийся в синаптической щели; об этом ферменте будет подробный разговор позже. План строения ацетилхолинергической системы головного мозга схож со строением других нейромедиаторных систем (рис. 3). В стволе мозга существует ряд структур, выделяющих ацетилхолин, который поступает по аксонам в базальные ганглии головного мозга. Там есть свои ацетилхолиновые нейроны, чьи отростки расходятся широко по коре и проникают в гиппокамп.
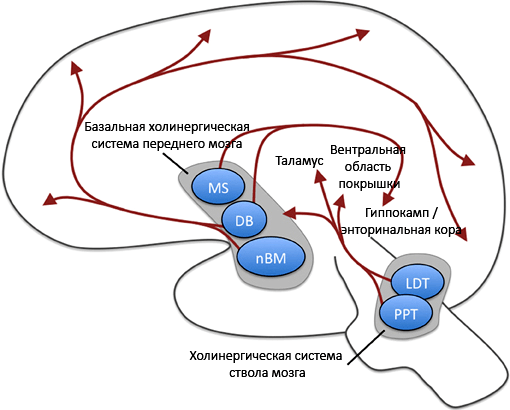
Рисунок 3. Ацетилхолиновая система мозга. Мы видим, что в глубоких отделах головного мозга находятся скопления нервных клеток (в переднем мозге и стволе), которые посылают свои отростки в различные отделы коры и подкорковых областей. В конечных пунктах из нейронных окончаний выделяется ацетилхолин. Местные эффекты нейромедиатора различаются в зависимости от типа рецептора и его расположения. MS — медиальное ядро перегородки, DB — диагональная связка Брока, nBM — базальное магноцеллюлярное ядро (ядро Мейтнера); PPT — педункулопонтийное тегментальное ядро, LDT — латеральное дорсальное тегментальное ядро (оба ядра — в ретикулярной формации ствола мозга). Рисунок из [8], адаптирован.
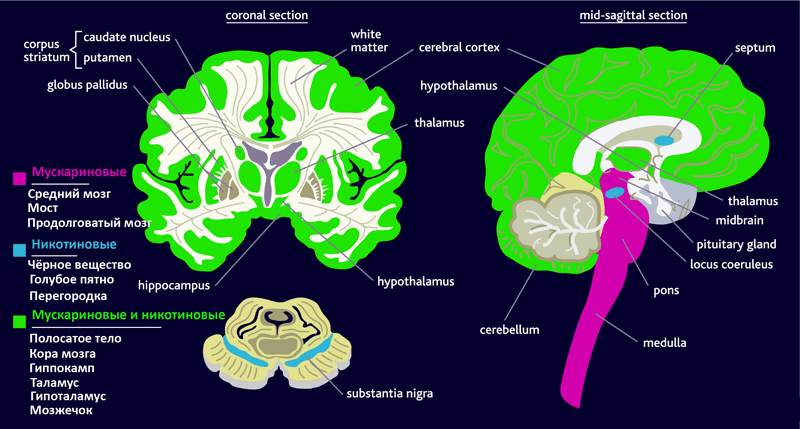
Рецепторы ацетилхолина делятся на две группы — мускариновые и никотиновые. Стимуляция мускариновых рецепторов приводит к изменению метаболизма в клетке через систему G-белков* (метаботропные рецепторы), а воздействие на никотиновые — к изменению мембранного потенциала (ионотропные рецепторы). Это происходит благодаря тому, что никотиновые рецепторы связаны с натриевыми каналами на поверхности клеток. Экспрессия рецепторов различается в разных участках нервной системы (рис. 4).
* — О пространственных структурах нескольких представителей громадного семейства GPCR-рецепторов — мембранных рецепторов, действующих через активацию G-белка, — доступно рассказано в статьях: «Рецепторы в активной форме» (об активной форме родопсина) [5], «Структуры рецепторов GPCR „в копилку“» (о дофаминовом и хемокиновом рецепторах) [6], «Рецептор медиатора настроения» (о двух серотониновых рецепторах) [7]. — Ред.
Рисунок 4. Распределение мускариновых и никотиновых рецепторов в головном мозге человека. Рисунок с сайта www.cnsforum.com, адаптирован.
Медиатор памяти и обучения
Ацетилхолиновая система головного мозга напрямую связана с таким явлением как синаптическая пластичность — способность синапса усиливать или снижать выделение нейромедиатора в ответ на увеличение или уменьшение его активности. Синаптическая пластичность является важным процессом для памяти и обучения, поэтому ученые стремились обнаружить его в отделе мозга, отвечающем за эти функции — в гиппокампе. Большое количество ацетилхолиновых нейронов направляет свои отростки в гиппокамп, и там они влияют на высвобождение нейромедиаторов из других нервных клеток [8]. Способ осуществления этого процесса довольно простой: на теле нейрона и его пресинаптической части расположены различные никотиновые рецепторы (в основном, α7— и β2-типов). Их активация будет приводить к тому, что прохождение сигнала по иннервируемой клетке упростится, и он с большей вероятностью перейдет на следующий нейрон. Наибольшее влияние такого рода испытывают на себе ГАМК-ергические нейроны — нервные клетки, чьим нейромедиатором является γ-аминомасляная кислота [9].
ГАМК-ергические нейроны являются важной частью системы, генерирующей электрические ритмы нашего мозга. Эти ритмы можно записать и изучить при помощи электроэнцефалограммы — широкодоступного метода исследования в нейрофизиологии. Ритмы различной частоты обозначаются греческими буквами: 8–14 Гц — альфа-ритм, 14–30 Гц — бета-ритм и так далее. Использование стимуляторов ацетилхолиновых рецепторов приводит к тому, что в мозге возникает тета- (0,4–14 Гц) и гамма-ритм (30–80 Гц). Эти ритмы, как правило, сопровождают активную когнитивную деятельность. Стимуляция постсинаптических мускариновых ацетилхолиновых рецепторов, расположенных на нейронах гиппокампа (центра памяти) и префронтальной коры (центр сложных форм поведения), приводит к возбуждению этих клеток и генерации упомянутых выше ритмов. Они сопровождают различную когнитивную деятельность — например, выстраивание временнόй последовательности событий [10].
Гиппокамп и префронтальная кора играют важную роль в обучении. С точки зрения рефлексов любое обучение происходит двумя путями. Допустим, вы экспериментатор, и объектом вашего эксперимента является мышь. В первом случае в ее клетке зажигается свет (условный стимул), и грызун получает кусочек сыра (безусловный стимул) еще до того, как свет погаснет. Формирующийся рефлекс можно назвать задержанным. Во втором случае свет также зажигается, но мышь получает лакомство через некоторое время после выключения лампочки. Этот тип рефлекса называется следовым. Рефлексы второго типа зависят от осознанности стимулов больше, чем рефлексы первого типа. Угнетение активности ацетилхолинергической системы приводит к тому, что у животных не вырабатываются следовые рефлексы, хотя с задержанными проблем не возникает [11].
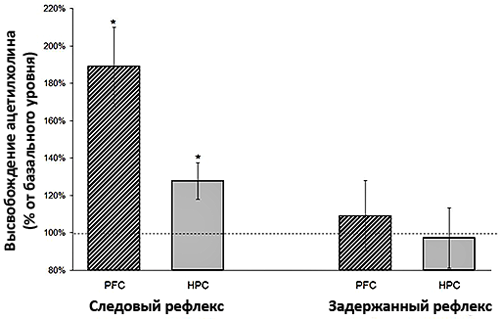
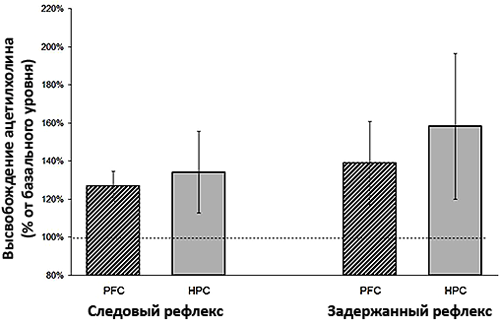
При сравнении секреции ацетилхолина в мозге крыс, у которых вырабатывали оба вида рефлексов, были получены интересные данные [12]. У крыс, которые успешно справлялись с усвоением временнόй связи между условным и безусловным стимулом, обнаруживалось значительное увеличение уровня ацетилхолина в медиальной префронтальной коре (рис. 5) по сравнению с гиппокампом. Особенно существенной была разница в уровнях ацетилхолина у крыс, которые выработали следовый рефлекс. Те грызуны, которые не справились с обеими задачами, обнаруживали приблизительно равные уровни нейромедиатора в исследуемых отделах мозга (рис. 6). Исходя из этого можно заключить, что непосредственно в обучении бóльшую роль играет префронтальная кора, а гиппокамп сохраняет полученные знания.
Рисунок 5. Выброс ацетилхолина в гиппокампе (HPC) и префронтальной коре (PFC) крыс при успешной выработке рефлексов. Максимальный уровень ацетилхолина наблюдается в префронтальной коре при выработке следового рефлекса. Рисунок из [12].
Рисунок 6. Выброс ацетилхолина в гиппокампе (HPC) и префронтальной коре (PFC) крыс в случае «провала» в обучении. Регистрируется почти одинаковое содержание ацетилхолина в двух зонах вне зависимости от рефлекса. Рисунок из [12].
Рецепторы внимания
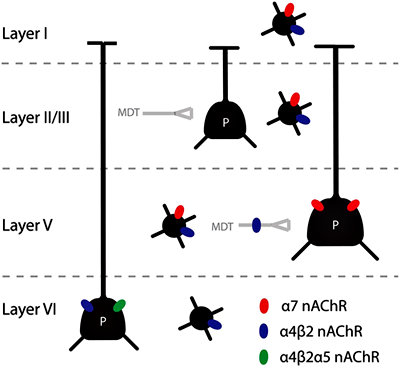
Рисунок 7. Многообразие ацетилхолиновых рецепторов (nAChR) в слоях префронтальной коры головного мозга. Рисунок из [15].
Для обучения важен не только интеллект или объем памяти, но и внимание. Без внимания даже самый успешный ученик будет двоечником. Ацетилхолин участвует также в процессах, регулирующих внимание.
Внимание — сфокусированное восприятие или обдумывание проблемы — сопровождается повышенной активностью в префронтальной коре. Ацетилхолиновые волокна направляются в лобную кору из глубоких отделов мозга. В связи с тем, что часто нам требуется быстрое переключение внимания, вполне логично, что в регуляции внимания участвуют никотиновые (ионотропные) рецепторы ацетилхолина, а не мускариновые, которые вызывают более медленные и преимущественно структурные изменения в нейронах. Повреждение ацетилхолиновых структур глубоких отделов мозга снижает активность медиальной префронтальной коры и нарушает внимание [13]. Кроме того, взаимодействие глубоких ацетилхолиновых структур с префронтальной корой не ограничивается восходящими сигналами. Нейроны лобной коры также отправляют свои сигналы в нижележащие отделы, что позволяет создавать саморегулирующуюся систему поддержания внимания [14]. Внимание поддерживается за счет воздействия ацетилхолина на пресинаптические и постсинаптические рецепторы (рис. 7).
При разговоре о никотиновых рецепторах и внимании возникает вопрос об улучшении когнитивных функций при помощи курения, то есть введения дополнительной дозы никотина, пусть и в виде сигаретного дыма [16]. Ситуация здесь довольно ясная, и результаты не дают курильщикам лишнего аргумента в пользу их пагубного пристрастия. Никотин, пришедший извне, нарушает нормальное развитие мозга, что может приводить к расстройствам внимания (на долгие годы) [17]. Если сравнивать курильщиков и некурящих, то у первых показатели внимания хуже, чем у их оппонентов [18]. Улучшение внимания у курильщиков возникает в случае выкуривания сигареты после долгого воздержания, когда их плохое настроение и когнитивные проблемы улетучиваются вместе с дымом.
Лекарство для памяти
Если в норме ацетилхолинергическая система нашего мозга отвечает за память, внимание и обучение, то заболевания, при которых нарушается этот тип трансмиссии в нашем мозге, должны проявляться соответствующими симптомами: потерей памяти, снижением внимания и способности учиться новому. Здесь надо сразу оговориться, что в ходе нормального старения у подавляющего большинства людей снижается и способность к запоминанию нового, и живость ума в целом. Если эти нарушения выражены настолько, что мешают пожилому человеку заниматься повседневной деятельностью и удовлетворять свои повседневные потребности (обслуживать себя), то тогда врачи могут заподозрить деменцию. Если вы хотите узнать о деменции больше, то рекомендую начать с изучения информационного бюллетеня ВОЗ, посвященного этой патологии [19].
Строго говоря, деменция — это не отдельное заболевание, а синдром, встречающийся при ряде заболеваний. Одной из самых частых болезней, которая приводит к деменции, является болезнь Альцгеймера. Считается, что при болезни Альцгеймера в нервных клетках накапливается патологический белок β-амилоид [20, 21], который и нарушает деятельность нервных клеток, что в итоге приводит к их гибели. Кроме этой теории существует ряд других, которые имеют свои доказательства. Вполне вероятно, что при болезни Альцгеймера в клетках головного мозга разных пациентов происходят неодинаковые процессы, но приводят они к схожим симптомам. Однако β-амилоид интересен тем, что он может подавлять эффект, производимый ацетилхолином на клетку через никотиновые рецепторы [22]. Если у нас получится интенсифицировать ацетилхолинергическую передачу, то мы можем уменьшить проявления болезни и продлить самостоятельную жизнь человеку с деменцией.
К препаратам, используемым при деменции, относятся ингибиторы ацетилхолинэстеразы (АХЭ) — фермента, разрушающего ацетилхолин в синаптической щели. Применение ингибиторов АХЭ приводит к повышению содержания ацетилхолина в межнейронном пространстве и улучшению передачи сигнала. Исследование эффективности ингибиторов АХЭ при болезни Альцгеймера определило, что они способны уменьшить симптомы заболевания [23] и замедлить его прогрессирование [24]. Три наиболее применяемых препарата из этой группы — ривастигмин, галантамин и донепезил — сравнимы по эффективности и безопасности. Также существует небольшой, но успешный опыт применения ингибиторов АХЭ в лечении музыкальных галлюцинаций у пожилых людей [25].
При помощи ацетилхолина наш мозг обучается, фокусирует внимание на разных объектах и явлениях окружающего мира. Наша память «работает» на ацетилхолине, а его дефицит можно компенсировать при помощи лекарств. Надеюсь, что вам понравилось знакомство с ацетилхолином.
.gif)
.gif)
.gif)
_575.gif)