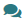ацидемия что это такое
Органические ацидемии
Органические ацидемии — это группа редких наследственных болезней обмена, которые в типичных случаях проявляются у новорожденных и грудных детей в форме острого метаболического криза, угрожающего жизни ребенка, после бессимптомного периода продолжительностью несколько дней.
Симптомы болезни
Повышение уровня аммония в плазме до токсичного уровня часто является основным проявлением метаболического криза, может привести к жизнеугрожающим неврологическим осложнениям и поэтому требует интенсивных лечебных мероприятий.
Своевременная постановка диагноза и проведение лечебных мероприятий являются сложной задачей для педиатров без глубоких знаний в области метаболических нарушений. В статье представлены практические рекомендации, которые могут помочь в выборе тактики лечения гипераммониемии в ранний период метаболического криза у новорожденных и детей грудного возраста с ОА.
Описано более 65 различных ОА, c общей частотой 1 на 3 000 новорожденных. Начальные признаки и симптомы метаболической декомпенсации — отказ от еды, рвота, обезвоживание и заторможенность — являются
неспецифичными и могут имитировать другие заболевания, в частности бактериальный сепсис, создавая дополнительные трудности в условиях, когда требуется быстрая диагностика и вмешательство с целью предотвратить
развитие необратимых неврологических осложнений. Повышение уровня аммиака в крови непосредственно влияет на неврологические исходы, а гипераммониемия выше 200 мкмоль/л, как правило, сопровождается сонливостью и летаргией (нарушением сознания).
Три ОА, для которых наиболее характерны метаболические кризы с гипераммониемией: пропионовая ацидемия (ПА), метилмалоновая ацидемия
(ММА) и изовалериановая ацидемия (ИВА) вместе с болезнью «кленового сиропа» часто обозначаются как «классические» ОА. Гипераммониемия — важное клиническое проявление ПА, ММА и ИВА, однако необходимо также принимать во внимание другие метаболические
нарушения, в частности, ацидоз, появление кетоновых тел и лактатацидоз.
Гипераммониемия не всегда сопутствует дебюту ПА, ММА или ИВА, но у большинства детей она возникает в периоде новорожденности и в дальнейшем рецидивирует при метаболических кризах.
Клиническая картина органических ацидемий
Внезапное развитие жизнеугрожающего состояния у ранее здорового новорожденного — основной признак наследственной болезни обмена веществ.
При дебюте в период новорожденности, грудное вскармливание или смесь на фоне процесса катаболизма после родов приводят к возникновению
метаболического криза. У более старших детей провоцирующими факторами метаболических кризов, как правило, являются состояния с повышенным катаболизмом — голодание, рвота или инфекции с фебрильной лихорадкой.
На 2-7 сутки после рождения у новорожденных нарушается аппетит, возникает рвота, обезвоживание, заторможенность, тахикардия и гипотермия, которые при отсутствии лечения могут быстро прогрессировать до дыхательной
недостаточности, коматозного состояния и смерти.
Следует учитывать, что эти симптомы также наблюдаются при более распространенных состояниях, например, инфекциях, о чем врачу также следует помнить. При наличии неврологических расстройств, лабораторная диагностика для исключения ОА (биохимические показатели, уровень аммиака
в крови) и сепсиса должна проводиться одновременно.
После периода новорожденности, у детей с ОА могут наблюдаться: задержка развития, низкая прибавка массы тела, нарушения сознания, мышечная
дистония, судороги и двигательные нарушения. Могут присутствовать другие признаки и симптомы острой или хронической декомпенсации: потеря массы (часто наблюдается у новорожденных), угнетение кроветворения в костном мозге при ПА и ММА, а также характерный запах «потных ног» у пациентов с ИВА.
Диагностика заболевания
Для предотвращения неврологических осложнений, лечение следует начинать незамедлительно, как только возникло подозрение на ОА. Следует
в экстренном порядке проконсультироваться со специалистом в области обменных нарушений, чтобы обеспечить параллельное проведение диагностических и начальных лечебных мероприятий.
При стандартном лабораторном обследовании часто выявляются метаболический ацидоз, увеличение анионной разницы, гипераммониемия, кетоз и лактат-ацидоз. Диагноз ОА ставится по результатам биохимических анализов: уровня органических кислот в моче, ацилкарнитинового профиля и аминокислотного профиля в плазме (это исследование необходимо для исключения нарушений цикла мочевины). Длительность гипераммониемии, нарушение кислотно-щелочного баланса в виде метаболического ацидоза (снижение рН и бикарбоната при увеличенной анионной разнице), а также
длительность пребывания в коме коррелируют с плохим неврологическим
исходом. У детей грудного возраста эти нарушения должны быть скорректированы максимально быстро.
Терапия метаболического криза
Ближайшая задача терапии — остановить процессы эндогенного катаболизма и обеспечить организм достаточным количеством энергии для поддержания анаболических реакций. Поскольку аминокислоты являются основными предшественниками органических кислот, следует временно прервать поступление белка внутрь (максимально на 24–48 часов). С целью ускорения почечной экскреции карнитиновых эфиров органических кислот назначается терапия карнитином (рекомендуемая доза 200 мг/кг/сут).
Согласно рекомендациям действующих руководств, терапия бензоатом
или фенилбутиратом натрия рекомендуется при гипераммониемии неустановленной этиологии (> 150–250 мкмоль/л у новорожденных, 100–250
мкмоль/л у более старших детей), сопровождающейся клинической симптоматикой. Эти препараты следует с осторожностью использовать у пациентов
с органическими ацидемиями, поскольку при ПА и ММА концентрация глутамина может быть снижена вследствие нарушения работы цикла Кребса.
N‑карбамоил-L‑глутамат (карглумовая кислота, Карбаглю®) — стабильный синтетический аналог N‑ацетилглутамата (кофактор первого фермента в цикле синтеза мочевины КФС‑1 ) может стимулировать первую реакцию цикла мочевины и снижает концентрацию аммиака при вторичной гипераммониемии. Результаты двух ретроспективных наблюдательных исследований и сообщения об отдельных случаях свидетельствуют о том, что карглумовая кислота может снижать уровень аммиака в крови у новорожденных и более старших детей с ПА, ММА и ИВА, независимо от применения бензоата
или фенилбутирата натрия. Карглумовая кислота рекомендуется для лечения гипераммониемии неустановленной этиологии, сопровождающейся
клиническими проявлениями, а также включена в европейское руководство
2014 г. по лечению ПА и ММА. У пациентов с гипераммониемией и тяжелой
энцефалопатией при неэффективности медикаментозного лечения возможно применение гемодиализа.
Длительная терапия
Долгосрочные цели лечения пациента с органической ацидемией — предотвращение метаболических кризов, минимизация осложнений, поддержание нормального роста и развития ребенка. Для этого используется
тройной подход: диетотерапия, медикаментозная терапия и постоянное наблюдение с целью выявления и лечения возможных осложнений, в число которых входят панкреатит, почечная недостаточность, кардиомиопатия,
нарушения сердечного ритма и остеопороз.
Диета с низким содержанием белка — основной компонент долгосрочной терапии при всех классических ОА. Пациенты с ПА или ММА также должны дополнительно получать витамины, микроэлементы, жиры и аминокислотные смеси без прекурсоров. В большинстве случаев медикаментозное лечение включает L‑карнитин, витамин В12 (в виде гидроксикобаламина при В12-зависимой форме ММА) и периодические курсы антибактериальной терапии
(например, метронидазолом) для подавления кишечной микрофлоры, продуцирующей пропионовую кислоту. При ПА может быть полезным назначение цитрата ( 7,5 мэкв/кг/сут), который может способствовать достижению
компенсации метаболического ацидоза и пополнению субстратов цикла Кребса. На фоне диеты с низким содержанием белка, пациенты с ИВА также должны постоянно получать дополнительно глицин и карнитин. Диета с достаточным количеством калорий, ограничением белка и перечисленными
выше добавками позволяет достигнуть оптимальной компенсации обменных нарушений при ОА, что выражается в стабильном течении заболевания,
несмотря на сохранение умеренной гипераммониемии у некоторых детей. В ряде случаев для достижения компенсации необходимо наложение гастростомы — это позволяет обеспечить достаточную энергетическую ценность рациона и вводить питательные смеси в ночное время для предотвращения катаболических реакций. Неустойчивое метаболическое равновесие может быть нарушено при упорной рвоте или рецидивирующих инфекциях, когда потребление калорий
снижается, а энергетические потребности возрастают, что в итоге ведет к повышению концентрации аммиака и развитию метаболического ацидоза у некоторых пациентов.
При тяжелых формах ПА и ММА с рецидивами гипераммониемии может быть эффективной длительная терапия карглумовой кислотой. Недавно опубликованы результаты применения карглумовой кислоты 50 мг/кг/сут) продолжительностью 7–16 месяцев у 8 пациентов с ПА или ММА, у которых в течение предшествующего года наблюдалось от 3 до 11 метаболических кризов.
Терапия карглумовой кислотой сопровождалась значительным снижением тяжести и числа метаболических кризов: у трех пациентов кризы прекратились, у остальных пациентов тяжесть кризов не требовала госпитализации.
Опубликован клинический случай пациента, у которого в течение первых 9 лет жизни наблюдалось 78 госпитализаций по поводу кризов — в среднем 7–10 поступлений в стационар в год. В 9-летнем возрасте начата непрерывная
терапия карглумовой кислотой в дозе 100 мг/кг/сут с последующим снижением до 50 мг/кг/сут через 6 месяцев. В интервале от 9 до 15 лет жизни пациент
был всего лишь дважды госпитализирован по поводу метаболического криза, оба раза — на 1 году лечения карглумовой кислотой. Наблюдения доказывают пользу длительной терапии карглумовой кислотой пациентов с тяжелым течением ПА и ММА и рецидивирующими эпизодами гипераммониемии.
При ПА или ММА с рецидивирующими метаболическими кризами или недостаточной эффективности диеты и фармакотерапии, трансплантация
печени может уменьшить количество госпитализаций и улучшить качество жизни. Пересадка печени может снизить риск развития некоторых осложнений, в частности кардиомиопатии; однако это вмешательство не оказывает
никакого влияния на риск неврологических или офтальмологических осложнений и, конечно, связано с риском смертельного исхода. Некоторым взрослым пациентам с терминальной стадией почечной недостаточности, вызванной ММА, может быть показана трансплантация почек.
Метилмалоновая ацидемия (ацидурия)
Статья обновлена: 2021-08-13
Метилмалоновая ацидемия (ацидурия) – генетически гетерогенное наследственное заболевание из группы органических ацидемий, обусловленное блокированием обмена пропионатов на уровне перехода метилмалонил-КоА в сукцинил-КоА и нарушением метаболизма ряда аминокислот (изолейцин, валин, треонин, метионин), жирных кислот с нечетным числом атомов углерода и холестерина. КОД МКБ-10 Е71.1
ЭПИДЕМИОЛОГИЯ
ЭТИОЛОГИЯ, ТИП НАСЛЕДОВАНИЯ
ПАТОГЕНЕЗ
Патогенез заболевания связан с накоплением производных метилмалоновой и пропионовой кислот вследствие блокирования обмена на уровне перехода метилмалонил-КоА в сукцинил-КоА. Предшественниками пропионатов в организме служат аминокислоты изолейцин, валин, треонин и метионин (50% общего количества пропионатов), жирные кислоты с нечетным числом атомов углерода и холестерин (25%); остальная часть пропионатов образуется в кишечнике в результате деятельности эндогенной флоры. Накопление органических кислот (пропионовой, метилмалоновой, метиллимонной кислот и др.) ведет к тяжелому метаболическому кетоацидозу, вторичной гипераммониемии, гиперглицинемии, гипогликемии. Повышенный уровень в крови и высокая почечная экскреция пропионилкарнитина обусловливают истощение запасов карнитина и его вторичный дефицит
КЛАССИФИКАЦИЯ
Выделяют В12-резистентную (около 1/2 случаев) и В12-зависимую формы метилмалоновой ацидурии. В12-резистентная форма характеризуется более ранней манифестацией и тяжелым приступообразным течением. По срокам появления первых признаков болезни различают неонатальную, младенческую и позднюю формы.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
В12-зависимая форма болезни обычно имеет более позднюю манифестацию – после неонатального периода. При всех формах в период метаболического криза у детей отмечаются следующие обменные расстройства: тяжелый метаболический ацидоз, кетоз, гиперглицинемия, гипераммониемия, нейтро- и тромбоцитопения, гиперурикемия, у части больных – гипогликемия. Иногда наблюдается гипергликемия.
В крови повышается уровень пропионилкарнитина (С3), в некоторых случаях метилмалонилкарнитина C4DC и снижается содержание свободного карнитина (С0). В моче значительно повышается концентрация метилмалоновой кислоты, а также 3-гидроксипропионовой, 3-гидрокси-nвалериановой, метиллимонной.
ДИАГНОСТИКА
Для подтверждения диагноза и медико-генетического консультирования проводится молекулярно-генетическое исследование.
Обследованию на метилмалоновую ацидурию подлежат следующие группы детей:
— дети любого возраста из семей, имеющих больных с данным заболеванием (в первую очередь, братья и сестры больного);
— дети первых недель и месяцев жизни, у которых после некоторого периода (иногда очень короткого, в течение нескольких суток) удовлетворительного состояния появились рвота, отказ от еды, летаргия, гипотония, судороги, кома, метаболический ацидоз, кетонурия;
— дети любого возраста с повторными приступами рвоты, вялости, сонливости, гипотонии, кетоацидоза;
— дети, отстающие в психомоторном развитии, с эпилепсий, нарушением мышечного тонуса
Для установления диагноза метилмалоновой ацидурии у пациентов с клиническими симптомами заболевания специфическими диагностическими тестами следует считать (сила А по Оксфордской шкале):
— количественное определение пропионилкарнитина (С3), свободного карнитина (С0), глицина в крови;
-количественное определение метилмалоновой, 3-гидроксипропионовой, 3-гидрокси-n-валериановой, метиллимонной кислот в моче;
— выявление мутаций в генах MUT, MMAA, MMAB, MCEE.Биохимические методы диагностики Методом тандемной масс-спектрометрии (МС/МС) в плазме крови, в пятнах высушенной крови выявляют концентрацию аминокислот и ацилкарнитинов. При метилмалоновой ацидурии наблюдается повышение концентрации С3 (пропионилкарнитина) и С4DC (метилмалонилкарнитина).
Необходимо с большой осторожностью относится к интерпретации данных показателей, которые являются возраст-зависимыми. В ряде случаев, концентрация С3 может быть в пределах нормы, а повышается соотношение С3/С2.
Аминокислотный анализ Уровень изолейцина, валина, метионина и треонина в крови у многих пациентов может быть в пределах нормы, что не позволяет на основании анализа аминокислот подтвердить или исключить заболевание. У многих пациентов с метилмалоновой ацидурией в крови и моче может наблюдаться повышение уровня глицина. Однако, это не является специфичным и может наблюдаться при других наследственных нарушениях обмена веществ. Наиболее важным для дифференциальной диагностики служит определение уровня гомоцистеина в крови, концентрации гомоцистина в моче.
Методом газовой хроматографии масс-спектрометрии в моче пациентов выявляют повышение концентрации метилмалоновой кислоты, а также ряда ее производных (табл. 1). По уровню метилмалоновой кислоты в моче невозможно точно установить форму заболевания, однако наиболее высокие концентрации обычно встречаются при метилмалоновой ацидурии, обусловленной мутациями в генах MUT и MMAB.
Таблица 1. Концентрация метаболитов в моче при метилмалоновой ацидурии
Также в разной степени могут повышаться другие органические кислоты и их производные: 2-метилглутаконовая, 3-кето-2-метилмасляная, метиллимонная, 3-гидроксибутират, лактат, пируват. На основании анализа органических кислот мочи возможно проведение дифференциальной диагностики с другими формами органических ацидурий. Наиболее близкой по клиническим проявлениям и по изменениям спектра ацилкарнитинов является пропионовая ацидурия, при которой не наблюдается повышение концентрации метилмалоновой кислоты в моче, а присутствуют только метаболиты пропионовой кислоты.
Можно рекомендовать после получения результатов тандемной массспектрометрии проведение простого качественного теста на присутствие метилмалоновой кислоты в моче.
На культуре кожных фибробластов возможно осуществление нагрузочных тестов, которые позволяют более точно установить форму метилмалоновой ацидурии. Поскольку эти исследования сопряжены с применением инвазивной технологии (забор культуры фибробластов), связаны с техническими трудностями (исследования проводятся лишь в единичных лабораториях мира) и работой с мечеными изотопами, с целью установления формы заболевания предпочтительным являются молекулярногенетические исследования.
Молекулярно-генетические методы диагностики
С помощью стандартных молекулярно-генетических методов проводят исследование генов, ответственных за развитие метилмалоновой ацидурии. Проведение ДНК-диагностики строго показано для пренатальной или преимплантационной диагностики. В ряде случаев, установление первичного молекулярно-генетического дефекта позволяет скорректировать тактику ведения пациента. Лечение пациентов с метилмалоновой ацидурией должно начинаться незамедлительно после подтверждения диагноза биохимическими методами.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальная диагностика проводится с гипоксическими поражениями нервной системы, внутриутробными инфекциями, поствакцинальными осложнениями, сахарным диабетом (при выявлении гипергликемии), наследственными нарушениями обмена веществ, в частности с другими формами органических ацидурий и с дефектами цикла синтеза мочевины.
ЛЕЧЕНИЕ
Основными компонентами комплекса лечения больных служат малобелковая диетотерапия, препараты левокарнитина и витамин В12 при В12- зависимой форме. Терапию дополняют назначением глицина, антибактериальных препаратов, других витаминов группы В, по показаниям антиконвульсантов, симптоматических средств.
Лечение детей вне периода метаболического криза
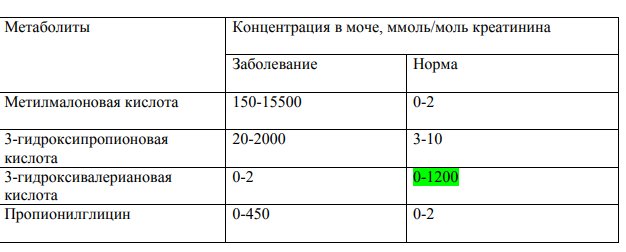
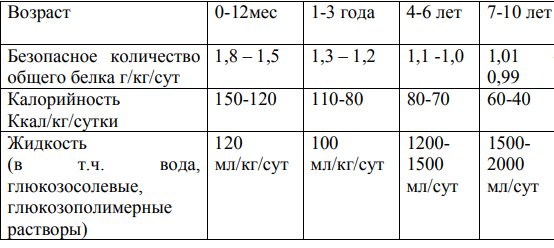
Таблица 2. Среднесуточные нормы потребностей в основных пищевых веществах и энергии для детей первого года жизни (на кг массы тела)
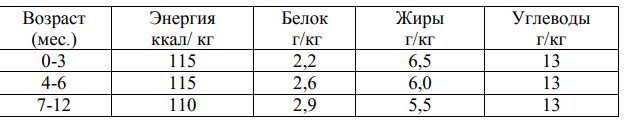
Таблица 3. Нормы физиологической потребности в основных пищевых веществах и энергии для здоровых детей старше года*
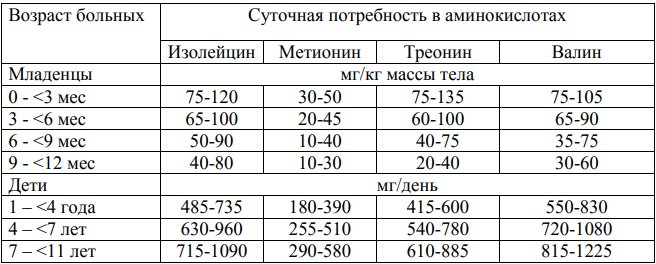
Таблица 4. Ориентировочная потребность в метионине, треонине, валине, изолейцине у больных метилмалоновой ацидурией в зависимости от возраста
Таблица 5. Специализированные продукты на основе аминокислот без метионина, треонина, валина, изолейцина.
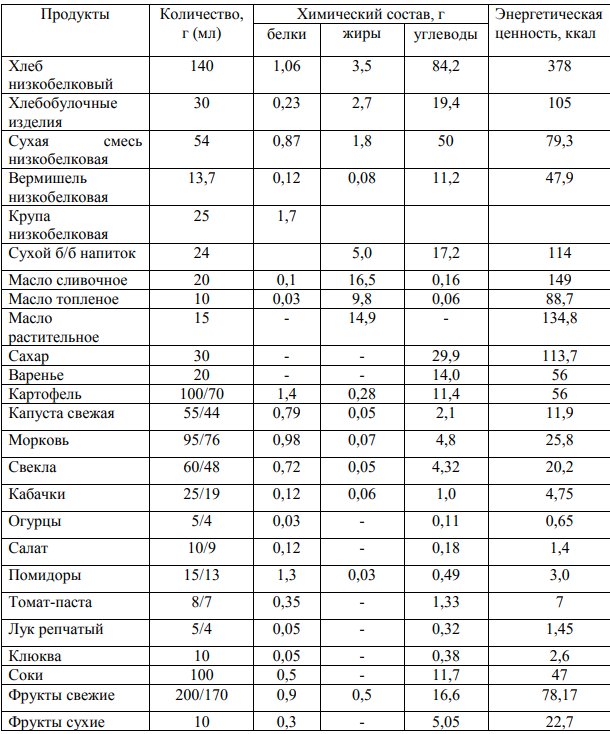
В таблице 6 представлен суточный набор продуктов для детей дошкольного возраста с метилмалоновой ацидемией
Таблица 6. Примерный суточный набор продуктов, его химический состав и энергетическая ценность для детей дошкольного возраста с метилмалоновой ацидемией
Кофакторная терапия.
Терапия левокарнитином.
С целью усиления связывания пропионового радикала и ликвидации карнитиновой недостаточности больным назначают большие дозы карнитина. Рекомендуется использовать только L-формы карнитина (элькар 30%, карнитен). Дети раннего возраста получают карнитин из расчета 100-150 мг/кг массы тела в сутки за 2-3 приема, дети более старшего возраста – 60-80 мг/кг/сут. Суточная доза не должна превышать 3 г. Терапия проводится непрерывно.
Антибактериальная терапия.
Учитывая, что около 1/4 количества пропионатов образуются в кишечнике под влиянием функционирования местной бактериальной флоры, дополнительным способом коррекции обмена является антибактериальная терапия. С целью подавления активности кишечной флоры больным показаны курсы антибактериальных препаратов. Назначают ампициллин в возрастной дозе в течение 8-10 дней или метронидазол в дозе 10-15 мг/кг/сут в течение 10-14 дней; через 3-4 недели курс повторяют.
Другие используемые лекарственные средства.
Дополнительно в комплексе лечения детей применяют глицин, который, подобно карнитину, обладает способностью конъюгировать производные органических кислот. Суточная доза составляет 0,3-0,6 г/сут в течение 4-6 мес. Назначают витамины группы В в возрастных дозах. По показаниям используют антиконвульсанты; ноотропные препараты назначают с осторожностью во избежание провокации эпилептических приступов.
Лечение детей в период метаболического криза
Ранними признаками метаболического криза служат вялость, сонливость или раздражительность, отказ от еды, рвота. Неврологические расстройства прогрессируют вплоть до ступора или комы, обусловливая высокую летальность. Тяжесть состояния, главным образом, определяется выраженным метаболическим кетоацидозом. Кроме того, могут иметь место гипогликемия (в некоторых случаях гипергликемия), гипераммониемия, обезвоживание. Состояние метаболического криза, особенно у детей раннего возраста, является показанием для госпитализации и основанием для проведения интенсивной терапии.
При угрозе или в случае развития метаболического криза лечение должно начинаться незамедлительно. Лечебные мероприятия направлены на прекращение образования и накопления токсичных органических соединений и выведение их из организма. Тактика лечения детей в период криза включает коррекцию диетотерапии, активацию связывания накапливающихся органических кислот путем увеличения дозы левокарнитина, коррекцию метаболического ацидоза, гипераммониемии и водно-электролитных нарушений, дополнительное введение глюкозы для энергетической поддержки и уменьшения интенсивности процессов катаболизма.
Таблица 8. Диетические рекомендации в период метаболического криза
Активация связывания накапливающихся органических кислот. Суточную дозу карнитина резко увеличивают до 300-400 мг/кг. Предпочтительно внутривенное или внутримышечное введение препарата. Цель терапии – поддержание содержания свободного карнитина в крови выше нормальных значений для усиления связывания накапливающихся пропионил-радикалов и их выведения из организма в виде пропионилкарнитина.
Коррекция водно-электролитных нарушений, гипераммониемии и энергетической недостаточности. Для устранения гипогидратации назначают внутривенное введение физиологического раствора, используя следующий расчет в зависимости от массы ребенка: 100 мл/кг/сут (масса 20 кг). В случае тяжелой интоксикации для лучшей элиминации накапливающихся пропионатов и метилмалоновой кислоты рекомендуется использовать метод форсированного диуреза с дополнительным введением жидкости и назначением фуросемида (лазикса) в дозе 1-3 мг/кг 1-2 раза в сутки (с интервалом не менее 6-8 час.).
С целью устранения энергетического дефицита и снижения уровня аммиака в крови проводят внутривенное введение 10%-20% раствора глюкозы из расчета 20 мл/кг с инсулином (1 Ед./8 г глюкозы). После двухчасового введения рекомендуется контроль содержания лактата и глюкозы в крови; допустимо поддерживать уровень глюкозы выше 3,3 ммоль/л у новорожденных и 5,5 ммоль/л – у старших детей. При уровне аммиака в крови выше 200 мкмоль/л дополнительно для стимуляции синтеза мочевины показано введение аргинина (250-300 мг/кг) или цитруллина (350 мг/кг). Назначают фолиевую кислоту 0,1 мг/кг/сут, пиридоксин 5 мг/сут. Осуществляют обязательный контроль уровня натрия и калия в крови. Пациентам в состоянии острого метаболического криза, при отсутствии быстрой положительной реакции на интенсивную терапию, сохраняющемся кетоацидозе и гипераммониемии, для более эффективного выведения токсичных метаболитов проводят перитонеальный диализ или гемодиализ.
Контроль терапии
Уровни метионина, треонина, валина, изолейцина в крови в результате лечения должны быть приближены к референсным возрастным значениям (табл. 9). Особенно важно обеспечивать нормальный сывороточный уровень аминокислот с разветвленной углеродной цепью. Так, недостаточное потребление белка и дефицит изолейцина являются причиной развития тяжелого акродерматита и служат основанием для дополнительного введения в рацион питания L-изолейцина в дозе 50-100 мг/сут в зависимости от степени дефицита.
Таблица 9. Референсные значения изолейцина, метионина, треонина и валина в плазме крови детей
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
В ряде случаев (при тяжелом поражении почек, плохо корректируемых метаболических нарушениях) возникает необходимость решать вопрос о трансплантации печени и почек.
ПРОГНОЗ
Прогноз состояния и уровня психического развития больных зависит от тяжести заболевания (В12-резистентная форма mut0 отличается более ранней манифестацией, большей степенью тяжести болезни и нестабильностью течения), вовлечения в патологический процесс внутренних органов (почки, сердце, поджелудочная железа), а также сроков начала специализированной терапии и качества лечения, способного предупредить приступы метаболической декомпенсации.
Пренатальная диагностика
Пренатальная диагностики возможна с помощью молекулярногенетического исследования биоптата хориона с выявлением мутации соответствующего гена.
Источник: МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РФ, Федеральные клинические рекомендации по диагностике и лечению метилмалоновой ацидемии, Москва 2013