аводарт или финастерид что лучше при аденоме простаты
Сравнение эффективности дутастерида и финастерида в лечении доброкачественной гиперплазии предстательной железы
В статье представлены результаты открытого проспективного исследования, проведенного в условиях амбулаторного приема урологом поликлиники с целью оценки клинической эффективности и экономической целесообразности применения дутастерида и финастерида в лечении пациентов с доброкачественной гиперплазией предстательной железы. Несмотря на довольно большое количество публикаций по данной теме, актуальность исследования обусловливает тот факт, что большинство больных доброкачественной гиперплазией предстательной железы – пенсионеры, вынужденные выбирать эффективное, но в то же время доступное лекарство.
В статье представлены результаты открытого проспективного исследования, проведенного в условиях амбулаторного приема урологом поликлиники с целью оценки клинической эффективности и экономической целесообразности применения дутастерида и финастерида в лечении пациентов с доброкачественной гиперплазией предстательной железы. Несмотря на довольно большое количество публикаций по данной теме, актуальность исследования обусловливает тот факт, что большинство больных доброкачественной гиперплазией предстательной железы – пенсионеры, вынужденные выбирать эффективное, но в то же время доступное лекарство.
Дутастерид и финастерид – препараты для лечения доброкачественной гиперплазии предстательной железы из группы блокаторов 5-альфа-редуктазы. Дутастерид подавляет активность изоферментов 5-альфа-редуктазы первого и второго типа, ответственных за превращение тестостерона в дигидротестостерон – основной андроген, ответственный за развитие гиперплазии железистой ткани простаты [1]. Финастерид – специфический ингибитор 5-альфа-редуктазы второго типа и соответственно тоже подавляет образование дигидротестостерона [2]. Известно, что 5-альфа-редуктаза первого типа экспрессируется в небольших количествах и малоактивна в предстательной железе, но обеспечивает основную долю активности фермента в других тканях, например коже и печени. А 5-альфа-редуктаза второго типа экспрессируется и действует в основном в простате.
Лечебный эффект препаратов развивается постепенно в течение 6–12 месяцев. Продолжительное лечение финастеридом снижает концентрацию дигидротестостерона в крови примерно на 70%, а дутастеридом – на 95%, однако концентрация обоих препаратов в предстательной железе одинакова – около 85–90% [3].
Результаты применения и финастерида, и дутастерида, по данным литературы, в целом положительные. Однако не ясно, насколько целесообразно в реальной клинической практике использовать дутастерид, более современный и дорогостоящий по сравнению с финастеридом.
Сравнение клинической эффективности и экономической целесообразности применения дутастерида и финастерида в лечении больных доброкачественной гиперплазией предстательной железы.
Открытое проспективное исследование проведено с 10.09.2015 по 10.09.2016 в условиях амбулаторного приема урологом поликлиники городской клинической больницы № 11 (Рязань).
В исследовании приняли участие 25 больных доброкачественной гиперплазией предстательной железы первой-второй стадии, не подлежащих хирургическому лечению. Все пациенты были проинформированы о вариантах возможного лечения и подписали добровольное информированное согласие.
Пациенты были разделены на две группы: основную и контрольную. В основной группе (n = 11) назначалась комбинация альфа-1-адреноблокатора тамсулозина и ингибитора 5-альфа-редуктазы второго поколения дутастерида 0,5 мг один раз в день. Контрольная группа (n = 14) получала стандартное сочетание альфа-1-адреноблокатора тамсулозина с ингибитором 5-альфа-редуктазы первого поколения финастеридом 5 мг один раз в день.
Эффективность терапии оценивалась на основании выраженности симптомов нижних мочевых путей по Международной шкале оценки симптомов заболеваний предстательной железы (International Prostate Symptom Score – IPSS), пальцевого ректального исследования, уровня простатического специфического антигена в крови, трансабдоминального ультразвукового исследования с определением объема простаты и объема остаточной мочи. Пациенты обследовались при первичном обращении и через шесть месяцев от начала лечения, когда оценивались результаты терапии.
В большинстве случаев препараты переносились хорошо, однако один пациент из основной группы выбыл в связи с побочным эффектом, развившемся на фоне применения дутастерида.
Результаты и их обсуждение
В обеих группах наблюдалось сопоставимое уменьшение объема предстательной железы (в среднем на 13,2 и 11,1 см 3 соответственно) и количества остаточной мочи (на 30,3 и 42,3 мл соответственно) – после лечения данный параметр в обеих группах оказался в пределах нормы (табл. 1 и 2). При оценке выраженности симптомов нижних мочевых путей тоже отмечалась положительная динамика – суммарный балл по шкале IPSS уменьшился с 17,5 до 12,3 в группе дутастерида и с 16,2 до 10,9 в группе финастерида. Показатели лечения в обеих группах были оценены как сопоставимые, положительные. В связи с малой выборкой дополнительная статистическая обработка материала не проводилась.
Финастерид и дутастерид оказывают сравнимый эффект. Дутастерид 0,5 мг принимается по одной капсуле ежедневно, финастерид 5 мг – по одной таблетке также ежедневно. Курс лечения обоими препаратами длительный, не менее шести месяцев. Применение как дутастерида, так и финастерида позволяет снизить объем простаты и остаточной мочи, уменьшить выраженность симптомов (по IPSS), улучшить самочувствие пациентов. Однако дутастерид в среднем в пять – семь раз дороже финастерида, поэтому использование дутастерида (по результатам данной работы) представляется экономически нецелесообразным.
Сравнение эффективности дутастерида и финастерида в лечении доброкачественной гиперплазии предстательной железы
В статье представлены результаты открытого проспективного исследования, проведенного в условиях амбулаторного приема урологом поликлиники с целью оценки клинической эффективности и экономической целесообразности применения дутастерида и финастерида в лечении пациентов с доброкачественной гиперплазией предстательной железы. Несмотря на довольно большое количество публикаций по данной теме, актуальность исследования обусловливает тот факт, что большинство больных доброкачественной гиперплазией предстательной железы – пенсионеры, вынужденные выбирать эффективное, но в то же время доступное лекарство.
В статье представлены результаты открытого проспективного исследования, проведенного в условиях амбулаторного приема урологом поликлиники с целью оценки клинической эффективности и экономической целесообразности применения дутастерида и финастерида в лечении пациентов с доброкачественной гиперплазией предстательной железы. Несмотря на довольно большое количество публикаций по данной теме, актуальность исследования обусловливает тот факт, что большинство больных доброкачественной гиперплазией предстательной железы – пенсионеры, вынужденные выбирать эффективное, но в то же время доступное лекарство.
Дутастерид и финастерид – препараты для лечения доброкачественной гиперплазии предстательной железы из группы блокаторов 5-альфа-редуктазы. Дутастерид подавляет активность изоферментов 5-альфа-редуктазы первого и второго типа, ответственных за превращение тестостерона в дигидротестостерон – основной андроген, ответственный за развитие гиперплазии железистой ткани простаты [1]. Финастерид – специфический ингибитор 5-альфа-редуктазы второго типа и соответственно тоже подавляет образование дигидротестостерона [2]. Известно, что 5-альфа-редуктаза первого типа экспрессируется в небольших количествах и малоактивна в предстательной железе, но обеспечивает основную долю активности фермента в других тканях, например коже и печени. А 5-альфа-редуктаза второго типа экспрессируется и действует в основном в простате.
Лечебный эффект препаратов развивается постепенно в течение 6–12 месяцев. Продолжительное лечение финастеридом снижает концентрацию дигидротестостерона в крови примерно на 70%, а дутастеридом – на 95%, однако концентрация обоих препаратов в предстательной железе одинакова – около 85–90% [3].
Результаты применения и финастерида, и дутастерида, по данным литературы, в целом положительные. Однако не ясно, насколько целесообразно в реальной клинической практике использовать дутастерид, более современный и дорогостоящий по сравнению с финастеридом.
Сравнение клинической эффективности и экономической целесообразности применения дутастерида и финастерида в лечении больных доброкачественной гиперплазией предстательной железы.
Открытое проспективное исследование проведено с 10.09.2015 по 10.09.2016 в условиях амбулаторного приема урологом поликлиники городской клинической больницы № 11 (Рязань).
В исследовании приняли участие 25 больных доброкачественной гиперплазией предстательной железы первой-второй стадии, не подлежащих хирургическому лечению. Все пациенты были проинформированы о вариантах возможного лечения и подписали добровольное информированное согласие.
Пациенты были разделены на две группы: основную и контрольную. В основной группе (n = 11) назначалась комбинация альфа-1-адреноблокатора тамсулозина и ингибитора 5-альфа-редуктазы второго поколения дутастерида 0,5 мг один раз в день. Контрольная группа (n = 14) получала стандартное сочетание альфа-1-адреноблокатора тамсулозина с ингибитором 5-альфа-редуктазы первого поколения финастеридом 5 мг один раз в день.
Эффективность терапии оценивалась на основании выраженности симптомов нижних мочевых путей по Международной шкале оценки симптомов заболеваний предстательной железы (International Prostate Symptom Score – IPSS), пальцевого ректального исследования, уровня простатического специфического антигена в крови, трансабдоминального ультразвукового исследования с определением объема простаты и объема остаточной мочи. Пациенты обследовались при первичном обращении и через шесть месяцев от начала лечения, когда оценивались результаты терапии.
В большинстве случаев препараты переносились хорошо, однако один пациент из основной группы выбыл в связи с побочным эффектом, развившемся на фоне применения дутастерида.
Результаты и их обсуждение
В обеих группах наблюдалось сопоставимое уменьшение объема предстательной железы (в среднем на 13,2 и 11,1 см 3 соответственно) и количества остаточной мочи (на 30,3 и 42,3 мл соответственно) – после лечения данный параметр в обеих группах оказался в пределах нормы (табл. 1 и 2). При оценке выраженности симптомов нижних мочевых путей тоже отмечалась положительная динамика – суммарный балл по шкале IPSS уменьшился с 17,5 до 12,3 в группе дутастерида и с 16,2 до 10,9 в группе финастерида. Показатели лечения в обеих группах были оценены как сопоставимые, положительные. В связи с малой выборкой дополнительная статистическая обработка материала не проводилась.
Финастерид и дутастерид оказывают сравнимый эффект. Дутастерид 0,5 мг принимается по одной капсуле ежедневно, финастерид 5 мг – по одной таблетке также ежедневно. Курс лечения обоими препаратами длительный, не менее шести месяцев. Применение как дутастерида, так и финастерида позволяет снизить объем простаты и остаточной мочи, уменьшить выраженность симптомов (по IPSS), улучшить самочувствие пациентов. Однако дутастерид в среднем в пять – семь раз дороже финастерида, поэтому использование дутастерида (по результатам данной работы) представляется экономически нецелесообразным.
Современные возможности медикаментозного лечения доброкачественной гиперплазии ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
К числу наиболее распространенных урологических заболеваний у пациентов пожилого возраста относится доброкачественная гиперплазия предстательной железы (ДГПЖ) [2].
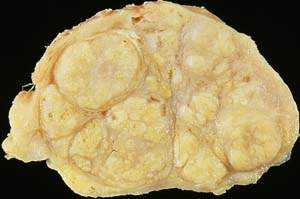 |
| Рисунок 1. Доброкачественная гиперплазия предстательной железы (макропрепарат) |
К числу наиболее распространенных урологических заболеваний у пациентов пожилого возраста относится доброкачественная гиперплазия предстательной железы (ДГПЖ) [2]. Около 80% мужчин старше 80 лет страдают этим заболеванием. Другая статистика свидетельствует, что из всех заболеваний, которым подвержены мужчины старше 50 лет, на долю доброкачественной гиперплазии простаты приходится 36% [1]. Эти сведения настолько общеизвестны, что ухудшение качества мочеиспускания часто рассматривается как естественное явление.
Клинически данное заболевание проявляется различными симптомами, связанными с нарушением пассажа мочи по нижним мочевым путям. При значительно выраженной инфравезикальной обструкции, как правило, прибегают к хирургическому вмешательству. Оперативное лечение по поводу ДГПЖ показано 30% больных в возрасте от 50 до 80 лет [4]. Однако в последние годы все большую популярность завоевывает медикаментозная терапия доброкачественной гиперплазии предстательной железы. Это, с одной стороны, объясняется вполне логичным желанием врача и пациента по возможности избежать операции, с другой — развитием представлений о патогенезе расстройств мочеиспускания при доброкачественной гиперплазии предстательной железы.
До недавнего времени патогенез расстройств мочеиспускания при доброкачественной гиперплазии предстательной железы рассматривали с позиции классических представлений о механической инфравезикальной обструкции и развитии вторичных структурно-функциональных изменений детрузора (компенсация, декомпенсация). За последние два десятилетия получены принципиально новые данные о природе повышенного внутриуретрального сопротивления. Его перестали отождествлять исключительно с механическим сдавлением шейки мочевого пузыря и задней уретры. Обнаружен динамический компонент обструкции, который состоит в повышении тонуса указанных анатомических структур за счет активности a-адренорецепторов. Появились также иные трактовки происхождения ирритативных симптомов. Их считают проявлением первичного нестабильного мочевого пузыря и не связывают напрямую с обструкцией [5].
Результаты нашей работы свидетельствуют, что при ДГПЖ клиническая симптоматика развивается вследствие недостаточности энергетического метаболизма и гипоксии детрузора в условиях повышенного уретрального сопротивления [3]. Об этом свидетельствуют:
Причины нарушений энергетического метаболизма и функций детрузора крайне многообразны. В частности, к таким нарушениям могут привести повышение активности симпатической нервной системы, расстройства органного кровообращения, авитаминоз (группа В), хронические заболевания дыхательной и сердечно-сосудистой систем, влияние приема ряда фармакологических препаратов, угнетающих дыхательную цепь, и, естественно, обструктивные нарушения уродинамики и т. д. Весьма важно, что нарушения гипоксического характера в гладкомышечной ткани могут иметь и первичный митохондриальный генез (первичные нарушения энергетического метаболизма детрузора [3].
Необходимо отметить, что у больных ДГПЖ в нижнем отделе мочевого тракта протекают два параллельных процесса — формирование уретральной обструкции и нарушение энергетического метаболизма детрузора (митохондриальная недостаточность).
Подобное представление патогенеза расстройств мочеиспускания открывает широкие возможности для фармакотерапии. Сокращения и расслабления детрузора можно достичь с помощью средств метаболической терапии, прямого улучшения снабжения детрузора кислородом и т. д. Наиболее значимые расстройства основных функций мочевого пузыря все же опосредованы расстройствами кровообращения. И если процесс обратим, то до или после хирургического вмешательства можно существенно влиять на функциональное состояние мочевого пузыря с помощью вазоактивных препаратов, к которым в первую очередь относятся a1-адреноблокаторы.
При определении критериев отбора пациентов для медикаментозной терапии ДГПЖ мы воспользовались рекомендациями IV Международного консультативного комитета по ДГПЖ.
Основу настоящего исследования составили собственные клинические наблюдения за 1724 пациентами (средний возраст 61,4 года), страдающими ДГПЖ и получавшими различные варианты медикаментозного лечения. Нами применялись препараты всех групп, использующихся в настоящее время для лечения ДГПЖ: a-адреноблокаторы, блокаторы 5-a-редуктазы, препараты растительного происхождения и их комбинации. Схемы проведенного лечения и характеристика групп пациентов приведены в табл. 1.
Из наиболее многочисленной и популярной сегодня группы препаратов для медикаментозного лечения ДГПЖ — селективных a-адреноблокаторов мы использовали альфузозин, теразозин, доксазозин и тамсулозин. Общее число пациентов, получавших a-адреноблокаторы, составило 1408. Финастерид был взят нами как классический представитель блокаторов 5-a-редуктазы. Из препаратов растительного происхождения мы использовали пермиксон и таденан.
В пяти группах общей численностью 1305 человек проводилась терапия селективными a-адреноблокаторами в течение длительного периода времени по стандартным схемам и в стандартных дозах. Результаты лечения приведены в табл. 2.
Улучшение качества мочеиспускания отметили в среднем 86,74% пациентов. Суммарный балл I-PSS сократился на 38,68% к окончанию первого года лечения и на 43,4% к окончанию курса терапии. Балл QOL уменьшился на 29,04% и 35,58% соответственно. Максимальная скорость потока мочи увеличилась на 45,25% к окончанию первого года лечения и стабилизировалась на достигнутом уровне. Количество остаточной мочи сократилось в среднем на 57,6%. Процент пациентов, по тем или иным причинам выбывших из исследования, был тождествен во всех группах и равнялся 14,38%.
Особо следует остановиться на препарате тамсулозин (омник, Yamanouchi) — пока единственном простатселективном a1А-адреноблокаторе на отечественном рынке. Этот препарат обладает рядом свойств, которые позволяют его использовать в различных функциональных тестах. Прежде всего это возможность назначения единой терапевтической дозы (один раз в сутки по 0,4 мг). А отсутствие выраженного влияния на артериальное давление и сердечную деятельность избавляет от необходимости титрования дозы. Мы согласны с рядом авторов, которые считают возможным применение коротких курсов терапии тамсулозином в качестве прогностических тестов эффективности лечения a1-адреноблокаторами, что может иметь решающее значение при выборе того или иного метода медикаментозного лечения ДГПЖ [4].
Части больных (группа А5) проведена проверка возможности разрешения острой задержки мочеиспускания (ОЗМ) приемом альфузозина по 5 мг два раза в сутки. Эта терапия проводилась пациентам с впервые возникшей ОЗМ и отсутствием симптомов нарушения мочеиспускания в анамнезе. Положительный эффект был достигнут у 8 из 14 пациентов (57,1%), которым параллельно приему альфузозина производилось кратковременное (трое суток) дренирование мочевого пузыря катетером. Единовременный прием суточной дозы альфузозина (10 мг) способствовал восстановлению самостоятельного мочеиспускания лишь у одного из четырех пациентов, которым проводилась подобная терапия. Вероятно, это объясняется гипотонией детрузора, усугубляющейся в ситуации длительного перерастяжения мочевого пузыря на фоне задержки мочеиспускания.
Для изучения эффективности и безопасности комбинированной медикаментозной терапии ДГПЖ препаратами разных групп, а также для уточнения целесообразности проведения терапии нами были созданы три группы.
В первой группе (К1) пациенты получали проскар по 5 мг/сут. параллельно с приемом теразозина по 5-10 мг/сут. Обращало на себя внимание значительное повышение показателей максимальной скорости потока мочи (+40%), характерное для группы монотерапии a-адреноблокаторами, и постепенное, на протяжении курса лечения, снижение объема предстательной железы (-20,4%), характерное для группы монотерапии финастеридом. Очевидно, что положительные изменения показателей мочеиспускания в этой группе являются следствием воздействия обоих препаратов. Тем не менее процент выбывших пациентов в этой группе был крайне высоким — 32,3%. Основной причиной прекращения комбинированной терапии ДГПЖ пациенты называли неприемлемо высокую стоимость лечения.
В третьей группе комбинированной терапии (К3) лечение проводилось финастеридом по 5 мг/сут. в сочетании с пермиксоном по 160 мг два раза в сутки. Через два года после начала лечения 50% пациентов покинули группу, приводя причиной отказа от дальнейшей терапии высокую стоимость лечения при отсутствии быстрого улучшения качества мочеиспускания. При сравнении полученных данных с результатами в других группах очевидно, что эффективность лечения в третьей существенно ниже.
Таким образом, эффективность медикаментозной терапии больных ДГПЖ при соблюдении показаний и противопоказаний к ее назначению, правильном выборе препарата и схемы его назначения высока и достигает в среднем 80,2%. При этом эффективность монотерапии a-адреноблокаторами составляет 86,7%, блокаторами 5a-редуктазы — 69,4%, препаратами растительного происхождения — 69,3% и при комбинированной терапии — 95,45%. Комбинированная медикаментозная терапия a-адреноблокаторами в сочетании с блокаторами 5a-редуктазы эффективнее монотерапии этими препаратами. С целью снижения стоимости лечения возможен переход на монотерапию блокаторами 5a-редуктазы после достижения выраженного регресса обструктивной симптоматики. Медикаментозная терапия a-адреноблокаторами является эффективным способом консервативного лечения острой задержки мочеиспускания. Терапия должна проводиться на фоне кратковременного (трое суток) дренирования мочевого пузыря уретральным катетером.
Литература
1. Гориловский Л. М. Эпидемиология и факторы риска развития доброкачественной гиперплазии предстательной железы. В кн.: Доброкачественная гиперплазия предстательной железы / Под ред. Н. А. Лопаткина. М., 1997, с. 10-18.
2. Лопаткин Н. А., Перепанова Т. С. Клинический опыт лечения больных доброкачественной гиперплазией предстательной железы a1-адреноблокатором альфузозином // Урол. и нефрол., 1997, № 5, с. 14-17.
3. Лоран О. Б., Вишневский Е. Л., Вишневский А. Е. Лечение расстройств мочеиспускания у больных доброкачественной гиперплазией простаты a-адреноблокаторами. Монография. М., 1998.
4. Сивков А. В. Медикаментозная терапия доброкачественной гиперплазии предстательной железы. В кн.: Доброкачественная гиперплазия предстательной железы / Под ред. Н. А. Лопаткина. М., 1997, с. 67-83.
5. McConnell J. D. Prostatic growth: new insights into hormonal regulation // Br. J. Urol. 1995. Vol.76.(suppl.1). P. 5-10.
Аводарт или финастерид что лучше при аденоме простаты
Доброкачественная гиперплазия предстательной железы (ДГПЖ) – распространенный морфологический диагноз, который устанавливается у 90 % мужчин старше 80 лет [1]. Пациенты с клиническими признаками ДГПЖ предъявляют различного рода жалобы, связанные с симптомами нижних мочевыводящих путей (СНМП), непосредственно с увеличением простаты и наличием инфравезикальной обструкции (ИВО) [2]. В связи с общим постарением населения планеты группа больных ДГПЖ претерпела значительные изменения [3, 4].
Лечение этого заболевания можно разделить на три основных направления:
Хирургическое лечение долгие годы было единственным эффективным методом борьбы с нарушениями мочеиспускания, обусловленными ДГПЖ, а трансуретральная резекция простаты стала “золотым стандартом” лечения этого заболевания. Начало 1990–х гг. ознаменовалось резким ростом интереса урологов и к вопросам медикаментозной терапии расстройств мочеиспускания, причем популярность этого подхода неуклонно растет [5, 6].
Клинические исследования показали, что терапия ингибиторами 5–альфа –редуктазы (5–АР) и альфа1–адреноблокаторами способна существенно снизить выраженность СНМП, обусловленных ДГПЖ, и увеличить скорость потока мочи [7]. Альфа–адреноблокаторы уменьшают тонус гладкой мускулатуры шейки мочевого пузыря, простаты и заднего отдела уретры. Механизм действия ингибиторов 5–АР заключается в блокаде перехода тестостерона в его активную форму – дигидротестостерон (ДГТ), что приводит к уменьшению объема предстательной железы, снижению риска прогрессирования заболевания, улучшению симптоматики со стороны нижних мочевых путей. Альфа–адреноблокаторы уменьшают тонус гладкой мускулатуры шейки мочевого пузыря, простаты и заднего отдела уретры, не влияя на патогенез развития ДГПЖ. Многочисленные клинические исследования продолжительностью от 3 до 5 лет доказали высокую эффективность медикаментозной терапии ДГПЖ [8–11]. Наш обзор литературы посвящен перспективам консервативной терапии ДГПЖ, связанным с появлением нового ингибитора 5–АР – Аводарта ® (дутастерида).
ДГПЖ: морфологические аспекты, этиология, эпидемиология
Морфологически ДГПЖ представлена стромальной и эпителиальной гиперплазией. Эти пролиферативные процессы выявляются исключительно в переходной зоне и периуретральных железах [12]. Несмотря на пристальный интерес ученых всего мира к этой проблеме, до сих пор не существует единого мнения о том, начиная с какого объема простаты следует говорить о наличии ДГПЖ. Клинически ДГПЖ проявляется рядом характерных признаков: СНМП; ИВО; ощущением неполного опорожнения мочевого пузыря; развитием острой (ОЗМ) и хронической задержки мочи; высоким риском развития инфекции мочевыводящих путей или уросепсиса; камнями мочевого пузыря, гематурией и хронической почечной недостаточностью (ХПН) [13]. Учитывая тот факт, что многие урологические заболевания могут сопровождаться сходной с ДГПЖ симптоматикой, окончательный диагноз зачастую устанавливается лишь после исключения всех прочих.
Распространенность ДГПЖ в различных возрастных группах населения можно достоверно выяснить только на основании изучения аутопсийного материала. В 1984 г. Berry и соавт. [1] обобщили результаты пяти подобных исследований. Морфологически ДГПЖ отсутствовала у всех мужчин в возрастной категории до 30 лет, но они имелись примерно у половины мужчин в возрасте от 50 до 60 лет. У мужчин старше 80 лет ДГПЖ выявлялась почти в 90 % случаев. По данным обзоров литературы, распространенность ДГПЖ примерно одинакова во всех странах мира [14].
Клинический диагноз ДГПЖ может быть установлен при наличии хотя бы двух из нижеперечисленных признаков: умеренных или выраженных СНМП по результатам вопросников (IPSS ≥ 8); увеличении объема предстательной железы (V > 30 мл); снижении максимальной скорости потока мочи (Qmax ® (дутастерид), ингибирующий 5–АР обоих типов.
Росту популярности ингибиторов 5–АР отчасти препятствовал тот факт, что эффект от лечения становится заметен только по прошествии определенного времени. Появление Аводарта ® (дутастерида) – препарата, который эффективнее финастерида за счет одновременного ингибирования двух изоформ 5–АР, – может изменить эту ситуацию. При большей эффективности профиль безопасности Аводарта ® (дутастерида) не отличается от такового у финастерида [66, 67]. Основным фактором, способствующим продвижению ингибиторов 5–АР, является их доказанная способность предотвращать прогрессирование ДГПЖ [68, 69].
Как известно, финастерид является селективным ингибитором 5–АР 2 типа. Практически сразу после его изобретения начались работы по поиску препарата, который мог бы ингибировать оба изофермента, что теоретически привело бы к усилению терапевтического эффекта. В начале 1990–х гг. компания MSD довела до II фазы клинических испытаний молекулу с подобным эффектом (МК–434), однако исследования были стремительно свернуты из–за высокой токсичности препарата. На изобретение ингибитора 5–АР обоих типов компания GlaxoSmithKline затратила 10 лет. Препарат получил рабочее название по названию фирмы–производителя – Gl198745, далее – Аводарт ® (дутастерид). В 1998 г. были опубликованы результаты первых фаз клинических испытаний [71]. Подбор дозировки препарата был обоснован в исследовании по протоколу ARIA 2001. В исследование были включены 399 пациентов с ДГПЖ, которые получали Аводарт ® (дутастерид) в различных дозировках один раз в сутки (0,01; 0,05; 0,5; 2,5 и 5 мг), плацебо или финастерид 5 мг/сут. Исследование показало, что минимальной эффективной дозировкой Аводарта ® (дутастерида), приводящей к максимальному снижению уровня ДГТ и уменьшению объема простаты, оказалась доза 0,5 мг/сут. Ее прием приводил к снижению уровня ДГТ на 95 % по сравнению с 97 % при приеме 2,5 и 5 мг Аводарта ® (дутастерида). В то же время прием 5 мг финастерида в сутки приводил к снижению уровня ДГТ на 70 %. Несмотря на то что длительные сравнительные клинические исследования дутастерида и финастерида не проводились, результаты III фазы исследования, опубликованные в 2002 г., показали, что дутастерид приводил к улучшению симптоматики уже через 3 месяца терапии и уменьшению простаты в объеме более чем на 25 % по сравнению с плацебо [66]. Время достижения эффекта лечения на фоне терапии дутастеридом было меньше, а эффективность больше, чем у финастерида.
Различия между двумя препаратами показаны в табл. 1.
Сравнение клинических исследований финастерида и дутастерида
Как уже указывалось, финастерид избирательно ингибирует 5–АР 2 типа, тогда как дутастерид ингибирует оба типа 5–АР. Сравнительные клинические исследования финастерида и дутастерида позволяют оценить их фармакологические параметры: время достижения клинического эффекта; краткосрочную клиническую эффективность и безопасность, однако, к сожалению, до сих пор не проведено ни одного долгосрочного сравнительного исследования этих препаратов [72].
Результаты II фазы двойного слепого плацебо–контролируемого сравнительного дозозависимого исследования дутастерида и финастерида четко показали, что уровень ДГТ сыворотки более значительно снижался на фоне приема дутастерида (0,5 мг/сут) по сравнению с финастеридом (5 мг/сут) [73]. Среднее снижение уровня ДГТ от исходного уровня у пациентов, получавших дутастерид 0,5 мг/сут, составило 94,7 ± 3,3 %, а для группы финастерида (5 мг/сут) – 70,8 ± 18,3 % (р ® (дутастерида) были получены в ходе трех схожих по дизайну рандомизированных двойных слепых плацебо–контролируемых исследований длительностью 2 года с последующим 2–летним открытым периодом (ARIA 3001, ARIA 3002, ARIA 3003) [66, 79]. В двойную слепую фазу были включены 4325 мужчин, которые после рандомизации были разделены на группу плацебо (n = 2158) и группу лечения Аводартом ® (дутастеридом) (n = 2167) в дозировке 0,5 мг/сут. В открытую фазу были включены 2340 пациентов, из которых 1188 в первой части исследования получали Аводарт ® (дутастерид) (D/D группа), а 1152 – плацебо (P/D группа). В открытой фазе исследования все пациенты получали Аводарт ® (дутастерид) 0,5 мг/сут. Критериями включения в исследование были: уровень простатспецифического антигена (ПСА) ≥ 1,5 нг/мл; объем простаты > 30 мл; возраст > 50 лет; AUA–SI ≥ 12; Qmax ≤ 15 мл/сек; объем остаточной мочи ® (дутастерид) приводит к уменьшению объема простаты и увеличению Qmax уже через месяц после начала терапии [80]. Через два года терапии Аводартом ® (дутастеридом) было отмечено снижение общего объема простаты на 25,7 % по сравнению с увеличением на 1,8 % в группе плацебо, увеличение Qmax на 2,2 мл/сек против 0,6 мл/сек в группе плацебо. Уровень ПСА сыворотки крови увеличился по сравнению с исходными значениями на 15,8 % в группе плацебо и снизился на 52,9 % в группе Аводарта ® (дутастерида). Риск развития ОЗМ в группе Аводарта ® (дутастерида) снизился на 57 %, а риск необходимости оперативного лечения по поводу ДГПЖ – на 48 % по сравнению с группой плацебо.
O’Leary и соавт. [80], изучив влияние терапии Аводартом ® (дутастеридом) на качество жизни пациентов в двойной слепой фазе исследования, пришли к выводу, что динамика этого показателя в группе активной терапии намного благоприятнее таковой в группе плацебо. Аводарт ® (дутастерид) обеспечил клинически и статистически значимое улучшение качества жизни, измерявшееся по шкале BII за 6 месяцев лечения. У пациентов с изначальным показателем BII ≥ 5 (сильная обеспокоенность симптомами) после лечения балл BII в среднем уменьшился на 2,41 (по сравнению с 1,64 балла в группе плацебо). У пациентов, которые отметили улучшение симптоматики в начальные месяцы исследования на фоне приема плацебо начиная с 18–го месяца отмечалось нарастающее ухудшение качества жизни по шкале BII, что, вероятно, связано с прогрессированием ДГПЖ. В группе терапии Аводартом ® (дутастеридом), наоборот, на протяжении всего исследования отмечалось постепенное улучшение качества жизни.
Результаты лечения Аводартом ® (дутастеридом) на протяжении 4 лет продемонстрировали устойчивое и продолжительное снижение уровня ДГТ, прогрессивное уменьшение объема предстательной железы, уменьшение выраженности симптоматики ДГПЖ и улучшение скорости потока мочи. Среднее снижение уровня ДГТ составило 95,3 %. Постепенное снижение объема простаты наблюдалось у мужчин в D/D группе в течение 48 месяцев, хотя уменьшение органа за период с 24–го по 48–й месяц было статистически не значимым. Тем не менее у больных из D/D группы уменьшение простаты в объеме оказалось значительно более выраженным по сравнению с теми, кто получал Аводарт ® (дутастерид) только последние 24 месяца.
На фоне длительного лечения Аводартом ® (дутастеридом) зафиксировано ослабление симптоматики по шкале AUA–SI и скорости потока мочи. В D/D группе снижение симптоматики по шкале AUA–SI с 24–го по 48–й месяц оказалось статистически значимым. Пациенты, получавшие плацебо во время двойной слепой фазы, продемонстрировали значительное улучшение по шкале симптомов после начала лечения дутастеридом, однако так и не достигли уровня пациентов D/D группы, у которых терапия Аводартом ® (дутастеридом) проводилась на протяжении всего исследования. Динамика шкалы симптомов от исходного уровня на 4,4 пункта через 24 месяца и 6,5 пункта через 48 месяцев лечения в группе D/D была расценена как клинически значимое уменьшение симптоматики (≥ 3,1 пункта) [81].
Применение Аводарта ® (дутастерида) на протяжении 4 лет вызывало более выраженное уменьшение объема простаты, ослабление симптоматики и увеличение скорости потока мочи по сравнению с 2–летним периодом терапии.
Терапия Аводартом ® (дутастеридом) хорошо переносилась пациентами на протяжении всех 4 лет исследований, при этом прослеживалась общая тенденция к уменьшению частоты возникновения побочных явлений, связанных с нарушением половой функции. Исключение составила лишь гинекомастия, выявляемость которой была примерно одинаковой на протяжении всего исследования (от 0,7 до 1,3 %). Пациенты, начавшие прием Аводарта ® (дутастерида) через 2 года после начала исследования, имели схожий профиль безопасности по сравнению с больными, изначально лечившимися ингибитором 5–АР. Количество связанных с исследуемым препаратом побочных эффектов постепенно уменьшалось с 24–го по 48–й месяц терапии.
Суммируя данные трех исследований можно прийти к выводу, что Аводарт ® (дутастерид) (0,5 мг/сут) достоверно снижает риск развития ОЗМ и необходимости оперативного лечения по сравнению с плацебо, ослабляет симптоматику ДГПЖ, уменьшает объем простаты и увеличивает скорость потока мочи.
При сравнении результатов клинических исследований с применением финастерида и дутастерида, побочные эффекты, связанные с приемом препаратов (нарушения сексуальной функции, гинекомастия и сыпь) регистрировались чаще в группах ингибиторов 5–АР, чем в группах плацебо. Наиболее частыми побочными явлениями, связанными с приемом этих препаратов, оказались различные нарушения сексуальной функции: импотенция, снижение либидо, эякуляторные расстройства, а также гинекомастия (табл. 4.)
Данные побочные явления возникали на первом году приема препаратов, и их частота по сравнению с плацебо не увеличивалась в дальнейшем. Оба ингибитора 5–АР продемонстрировали хорошую безопасность и переносимость.
Обоснование комбинированной терапии ДГПЖ
Для некоторых пациентов с выраженной симптоматикой ДГПЖ необходимо более быстрое наступление эффекта лечения, которое на фоне монотерапии ингибитором 5–АР не может быть достигнуто. В связи с этим появилась идея комбинированной терапии альфа1–адреноблокаторами (короткий курс) и ингибиторами 5–АР у пациентов с ДГПЖ. Подобная схема лечения быстрее облегчает симптоматику (эффект альфа1–адреноблокаторов) и может положить начало обратному развитию заболевания (эффект ингибиторов 5–АР). Аводарт ® (дутастерид) обеспечивает устойчивое уменьшение симптоматики и предотвращает прогрессирование заболевания у пациентов с объемом простаты более 30 мл [82]. Qmax и объем простаты изменяются уже в течение первого месяца терапии, что, вероятно, связано с ингибированием обоих типов 5–АР [83]. Комбинированная терапия альфа1–адреноблокаторами и ингибиторами 5–АР оптимизирует подход к консервативному лечению пациентов с большим объемом предстательной железы и выраженной симптоматикой, позволяя добиться быстрого улучшения качества мочеиспускания параллельно с уменьшением объема простаты.
MTOPS (Medical Therapy of Prostate Symptom) в настоящее время является наиболее длительным и обширным исследованием эффективности и безопасности медикаментозной терапии ДГПЖ [83, 84]. Ее влияние на риск прогрессирования ДГПЖ было оценено на протяжении 4 лет наблюдения. Пациенты были разделены на четыре группы, получавшие доксазозин, финастерид, доксазозин + финастерид или плацебо. В общей сложности были рандомизированы 3047 больных ДГПЖ. Наиболее важные результаты исследования отражены в табл. 5.
По результатам MTOPS наиболее выраженное уменьшение объема простаты было отмечено в группе терапии финастеридом (–16 %), в группе комбинированной терапии оно было несколько менее выраженным (–13 %). В группе доксазозина и плацебо, напротив, зарегистрирован значительный рост простаты за 4 года (+18 %). Комбинированная терапия за 4 года показала наибольшую эффективность в отношении улучшения симптоматики по шкале AUA–SI. В группе комбинированной терапии отмечено снижение симптомов на 7 баллов по сравнению с исходным уровнем, в группе финастерида – на 5, в группе доксазозина – на 6 и на фоне приема плацебо – на 4. Снижение риска прогрессирования ДГПЖ составило 67 % в группе комбинированного лечения, 39 % – в группе доксазозина и 34 % – в группе финастерида. Риск развития ОЗМ снизился соответственно на 79, 31 и 67 %, риск оперативного лечения вследствие прогрессирования ДГПЖ – на 69, 8 и 64 %. Монотерапия доксазозином замедляла прогрессирование заболевания, снижала риск развития ОЗМ и необходимости инвазивных вмешательств, но не снижала достоверно средний риск развития каждого из этих осложнений.
По результатам исследования MTOPS был сделан вывод, что в режиме монотерапии только применение ингибиторов 5–АР приводит к стойкому уменьшению риска развития ОЗМ и необходимости оперативного вмешательства у больных ДГПЖ в сочетании с улучшением симптоматики и увеличением скорости потока мочи. Комбинированная терапия ингибиторами 5–АР и альфа1–адреноблокаторами приводит к наиболее выраженному положительному эффекту в сравнении с другими исследовавшимися схемами лечении ДГПЖ.
Способность ингибиторов 5–АР поддерживать эффект a1–адреноблокаторов после их отмены
Долговременный клинический эффект от приема ингибиторов 5–АР, являющийся следствием уменьшения объема простаты, может быть достигнут только при длительном приеме препарата. С другой стороны, расслабление гладкой мускулатуры под действием альфа1–адреноблокаторов способствует быстрому облегчению симптоматики ДГПЖ. Было отмечено, что ингибиторы 5–АР способны поддерживать эффекты, достигнутые на фоне комбинированной терапии, даже после отмены альфа1–адреноблокаторов. Первое исследование, подтвердившее это, было нерандомизированным и включало 240 пациентов, принимавших финастерид (5 мг/сут) в сочетании с различными дозами доксазозина (2, 4 и 8 мг/сут) с последующей отменой доксазозина через 3, 6, 9 или 12 месяцев. Терапия финастеридом не прерывалась [85]. Через месяц после отмены доксазозина все пациенты проходили контрольное обследование, призванное подтвердить или опровергнуть ухудшение качества мочеиспускания. Среди больных, закончивших прием доксазозина через 3 месяца лечения, успех, определяемый как отсутствие ухудшения симптомов по шкале AUA–SI, составлял от 13 до 20 %; при отмене через 6 месяцев положительный результат составлял 40–48 %; через 9 месяцев – 73–84 %, и при прекращении приема доксазозина через 12 месяцев достигнутый эффект оставался стабильно хорошим у 84–87 % пациентов. Авторы пришли к выводу, что у пациентов, получавших комбинированное лечение, не отмечается ухудшения симптоматики после отмены альфа1–адреноблокаторов, если провести ее не ранее 9 месяца терапии.
Влияние Аводарта ® (дутастерида) на развитие рака простаты
Влияние андрогенов на развитие РПЖ сегодня ни у кого не вызывает сомнений. Теоретически снижение уровня простатического ДГТ может в значительной степени влиять на развитие и прогрессирование РПЖ. Интересные данные, касающиеся уменьшения риска развития РПЖ на фоне терапии финастеридом, были опубликованы по результатам исследования PCPT (Prostate Cancer Prevention Trial) [87]. В исследование были включены 18 882 мужчины старше 55 лет и ПСА сыворотки крови ® (дутастерида) на риск развития РПЖ были опубликованы Andriole и соавт. [88]. Был проведен анализ заболеваемости РПЖ у пациентов в трех схожих клинических исследованиях (ARIA 3001, ARIA 3002 и ARIA 3003). Частота выявления РПЖ была определена по результатам биопсии, выполнявшейся вне протокола во время двойной слепой фазы и в первые 3 месяца открытой фазы исследования. Общая выявляемость рака простаты как побочного явления исследования была значительно ниже у пациентов, получавших Аводарт ® (дутастерид), по сравнению с группой плацебо: через 24 месяца 1,1 против 1,9 % (p = 0,025); через 27 месяцев 1,2 против 2,5 % соответственно (p = 0,002). При этом в первые 15 месяцев исследования разницы в частоте выявляемости РПЖ отмечено не было. По данным этих исследований, средний уровень ПСА сыворотки крови на фоне приема Аводарта ® (дутастерида) снизился на 48 % через 12 месяцев терапии и на 52,4 % через 24 месяца. Необходимо отметить, что исследование не было непосредственно посвящено возможности профилактики рака простаты с помощью Аводарта ® (дутастерида). Выводы были сделаны на основании дополнительного анализа полученных в ходе исследования данных.
В другом интересном исследовании, выполненном Andriole и соавт. [89], изучалось влияние Аводарта ® (дутастерида) на маркеры регресса опухоли у больных РПЖ. Сорок шесть мужчин с локализованным РПЖ были рандомизированы в две группы. В первой назначался Аводарт ® (дутастерид) 5 мг/сут, во второй – плацебо на протяжении 6–10 недель перед радикальной простатэктомией. Лечение Аводартом ® (дутастеридом) привело к снижению уровня интрапростатического ДГТ на 97 % и сочеталось с усилением апоптоза, что было подтверждено лабораторными данными. У пациентов, получавших Аводарт ® (дутастерид) более 45 дней, отмечалось значительное усиление апоптоза и прослеживалась тенденция к уменьшению плотности микрососудов в ткани простаты, пораженной опухолью. В группе терапии Аводартом ® (дутастеридом) средняя плотность доброкачественных эпителиальных клеток снизилась на 18 % по сравнению с плацебо.
В 2004 г. начато исследование REDUCE (The Reduction by Dutasteride of Prostate Cancer Events) [90]. Это 4–летнее исследование проводится с целью оценки эффективности и безопасности Аводарта ® (дутастерида) в дозировке 0,5 мг/сут у мужчин с повышенным риском развития РПЖ. К настоящему моменту рандомизировано около 8000 пациентов в возрасте от 50 до 75 лет с уровнем ПСА 2,5–10 нг/мл (возраст –50–60 лет) или с ПСА 3,0–10 нг/мл (старше 60 лет) и наличием в анамнезе “отрицательной” биопсии простаты в течение 6 месяцев до включения в исследование. Главной задачей исследования является определение выявляемости РПЖ через 2 и 4 года с момента начала лечения. К дополнительным задачам относятся: определение степени дифференцировки опухоли по шкале Глисона, наличия ПИН (простатическая интраэпителиальная неоплазия) высокой степени в биоптатах, процентного соотношения участков, пораженных раком в биоптатах, количества позитивных биоптатов, а также оценка лечебного патоморфоза опухоли. Исследование должно значительно повлиять на наше представление о природе РПЖ и роли Аводарта ® (дутастерида) в его предотвращении, включая изучение влияния снижения уровня ДГТ на градацию РПЖ.
Безопасность ингибиторов 5–АР
Вопрос безопасности применения ингибиторов 5–АР заслуживает особого внимания, так как эти препараты требуют длительного постоянного приема. Кроме того, пациенты, которым показан прием этих препаратов, зачастую принадлежат к старшей возрастной категории и имеют множество сопутствующих заболеваний, требующих медикаментозного лечения. Финастерид и Аводарт ® (дутастерид) лишают простату андрогенной стимуляции без возникновения резко выраженной сексуальной дисфункции, остеопороза, анемии, мышечной атрофии или приливов, которые часто возникают на фоне максимальной антиандрогенной блокады, химической или хирургической кастрации. Это преимущество достигается благодаря тому, что ингибиторы 5–АР блокируют только выработку ДГТ, снижая его концентрацию в простате. Уровень тестостерона сыворотки крови, отвечающего за андрогенную стимуляцию, остается нормальным или незначительно повышается (на 10–20 %) вследствие энзимного блока [28, 30, 31]. Именно поэтому использование ингибиторов 5–АР является методом, безопасно влияющим на рост простаты, приводящим к ее уменьшению, ослаблению симптоматики и снижению риска прогрессирования и развития осложнений заболевания [66, 67, 70].
Данные множества клинических исследований продемонстрировали, что финастерид и Аводарт ® (дутастерид) в целом хорошо переносятся большинством пациентов [66, 74]. Наиболее частые побочные явления связаны с различного рода нарушениями сексуальной функции. Согласно полученным данным, ингибиторы 5–АР имеют профиль безопасности, сравнимый с таковым у плацебо, как при кратковременном, так и при длительном применении. Например, на фоне терапии Аводартом ® (дутастеридом) побочные эффекты, связанные с приемом препарата, в среднем отмечались у 19 % пациентов (в группе плацебо – у 14 %). Разница между группами Аводарта ® (дутастерида) и плацебо составляла 3 % по частоте выявляемости нарушений потенции, 2 % – по уменьшениям либидо, 1 % – по эякуляторным нарушениям и гинекомастии. Большинство из перечисленных выше побочных явлений возникали на первом году приема препарата.
Теоретически ингибиторы 5–АР могут нарушать сперматогенез, так как он находится под контролем андрогенов, однако данные различных исследований показали, что ни финастерид (1 мг в течение 48 недель), ни Аводарт ® (дутастерид) (0,5 мг в течение 52 недель) не влияли на сперматогенез [76].
Результаты клинических исследований, включавших более 6000 больных ДГПЖ и сотни здоровых добровольцев, показали, что Аводарт ® (дутастерид) хорошо переносится при ежедневном приеме на протяжении более 2 лет. В обширных контролируемых исследованиях у пациентов с ДГПЖ Аводарт ® (дутастерид) продемонстрировал профиль переносимости, сравнимый с плацебо, за исключением умеренного учащения случаев импотенции и снижения либидо. Выявляемость клинически значимых изменений в лабораторных показателях была сопоставимой в группах терапии Аводарта ® (дутастерида) и плацебо. Ежедневный прием Аводарта ® (дутастерида) на протяжении года не оказывал клинически значимого влияния на уровень минерализации костей скелета и на липиды крови. Профиль безопасности Аводарта ® (дутастерида) не отличался от такового у финастерида по данным масштабных сравнительных исследований в параллельных группах. При приеме Аводарта ® (дутастерида) в комбинации с альфа–адреноблокаторами побочные явления, соответствовали особенностям исследуемых препаратов. Полученные данные свидетельствуют о том, что Аводарт ® (дутастерид) имеет хорошую переносимость при длительном применении.
Аводарт ® (дутастерид) является новым перспективным препаратом для лечения больных ДГПЖ. Подводя итоги, хотелось бы остановиться на характеристике основных эффектов Аводарта ® (дутастерида), имеющих значение для общей клинической практики.
Согласно данным плацебо–контролируемых исследований, терапия Аводартом ® (дутастеридом) приводит к понижению уровня ДГТ сыворотки крови более чем на 93 % начиная со второй недели приема и способствует уменьшению объема простаты уже после 1–го месяца лечения. К концу 2–летнего курса терапии объем простаты сокращается, в среднем на 27 %. Аводарт ® (дутастерид) снижает уровень ПСА сыворотки крови примерно на 40 % в течение 3 месяцев лечения и далее на 50 % начиная с 6–го месяца. Это свидетельствует о том, что через 6 месяцев приема Аводарта ® (дутастерида) пороговое значение нормальных показателей ПСА должно быть снижено в два раза с целью избежания ошибок в ранней диагностике рака простаты.
Было доказано, что Аводарт ® (дутастерид) улучшает скорость мочеиспускания начиная с 1–го месяца приема, а облегчение симптоматики ДГПЖ отмечается после 3 месяцев терапии. Эти данные имеют большое значение для повседневной клинической практики. Для пациентов с выраженной ИВО монотерапия Аводартом ® (дутастеридом) может быть недостаточной для быстрого облегчения симптоматики. Кроме того, у этой категории больных предстательная железа часто бывает значительно увеличена в размерах, что делает необходимым проведение комбинированной терапии ингибитором 5–АР (Аводартом ® ) совместно с альфа1–адреноблокатором. Последний может быть отменен после 6–месячной непрерывной комбинированной терапии в зависимости от выраженности симптоматики.
Как известно, ДГПЖ – прогрессирующее заболевание, которое может привести к развитию ОЗМ и необходимости оперативного лечения. [74, 91]. Ингибиторы 5–АР тормозят прогрессирование ДГПЖ, что подтверждено данными клинических исследований [74, 91]. Аводарт ® (дутастерид) эффективно снижает риск развития ОЗМ и необходимости оперативного лечения, особенно у пациентов с большим объемом предстательной железы (> 30 см3) и уровнем ПСА более 1,5 нг/мл. Вопросы безопасности и переносимости лечения являются очень важными при длительном курсе терапии. Аводарт ® (дутастерид), по результатам долговременных исследований, показал хороший профиль переносимости и безопасности, по многим показателям сравнимый с профилем плацебо.
Способность Аводарта ® (дутастерида) очень существенно понижать уровень ДГТ теоретически должна давать ему значительное преимущество перед финастеридом в плане предупреждения развития РПЖ. Ожидаемые результаты исследования REDUSE позволят получить ответ на этот вопрос. Данные проводящихся в настоящее время долговременных плацебо–контролируемых исследований позволят дать окончательную оценку роли Аводарта ® (дутастерида) в лечении больных ДГПЖ.