биопласт дент что это
Применение «Биопласт-Дент»
Не так давно ко мне обратилась пациентка, 38 лет. Обратилась за консультацией по вопросу восстановления двух зубов верхней челюсти (25, 26).
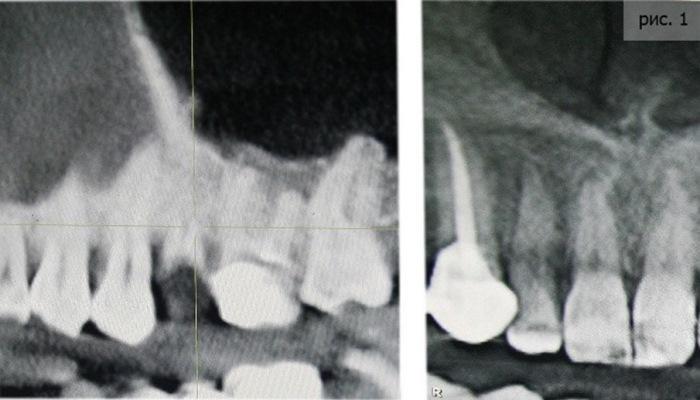
До обращения к нам пациентке ставили на эти зубы сначала пломбы, потом коронки. Оба раза неудачно. После проведения первичного осмотра и разбора снимков 3D КТ стало ясно, что один из зубов разрушен очень глубоко, «под десну».
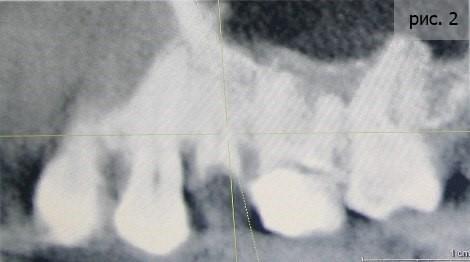
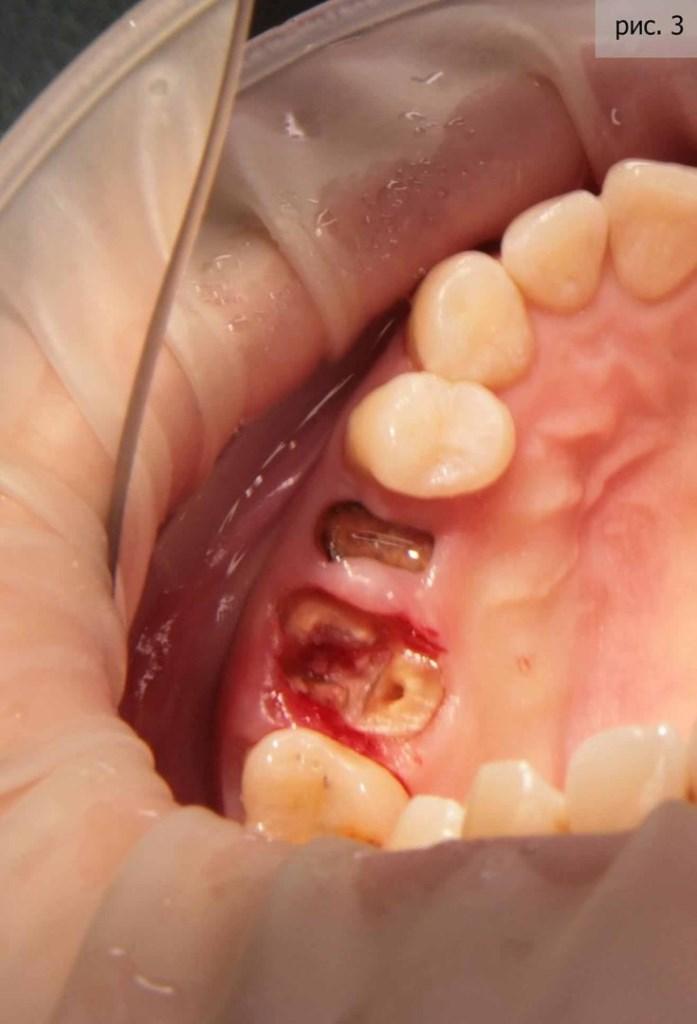
Оба зуба подвергались значительному внешнему воздействию (сначала точили для установки пломб, потом «обтачивали» под коронки). У первого зуба раскололся корень. Второй зуб радовал не больше – воспаление уже дошло до гайморовой пазухи (фото 3).
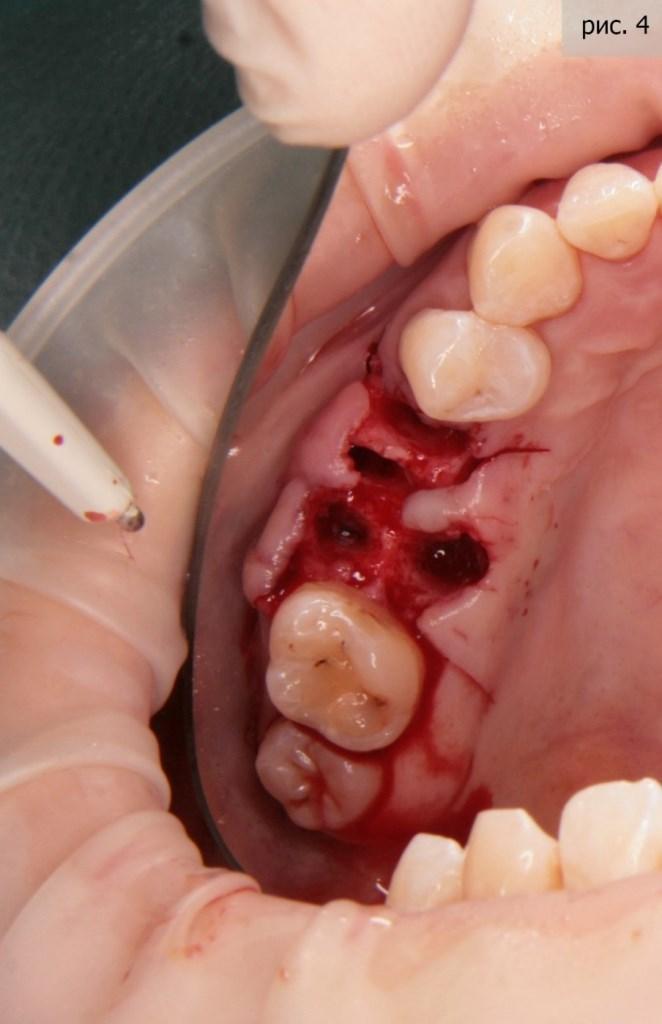
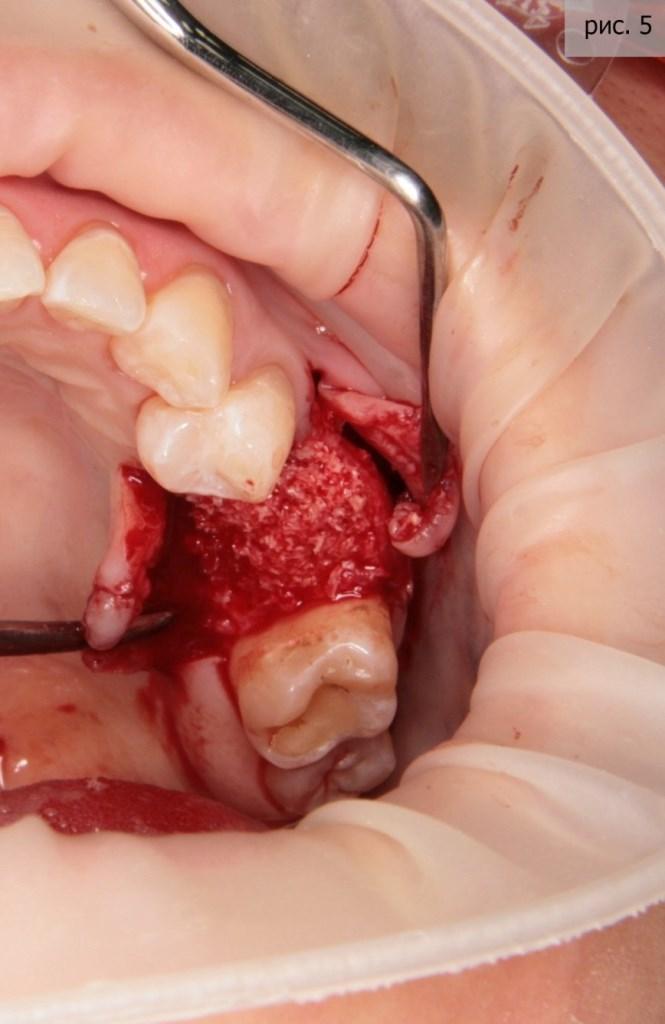
Я видел единственный адекватный выход из сложившейся ситуации – имплантация. Благо, пациентка сразу согласилась с предложенной схемой лечения. Первым этапом, как вы уже поняли, стало удаление. Я применил технику атравматичного удаления (фото 4).
За «основу» был взят материал «Биопласт-дент» (крошка). Это натуральный материал, изготовленный из кости крупного рогатого скота. Причина моего выбора – природная структура микропоры материала схожа со структурой кости человека. Кроме того, в нем прекрасно формируются сосуды, и он отлично преобразовывается в костную ткань человека. Да, и, если уж откровенно, альтернатив данному материалу в той же ценовой категории просто не существует (фото 5).
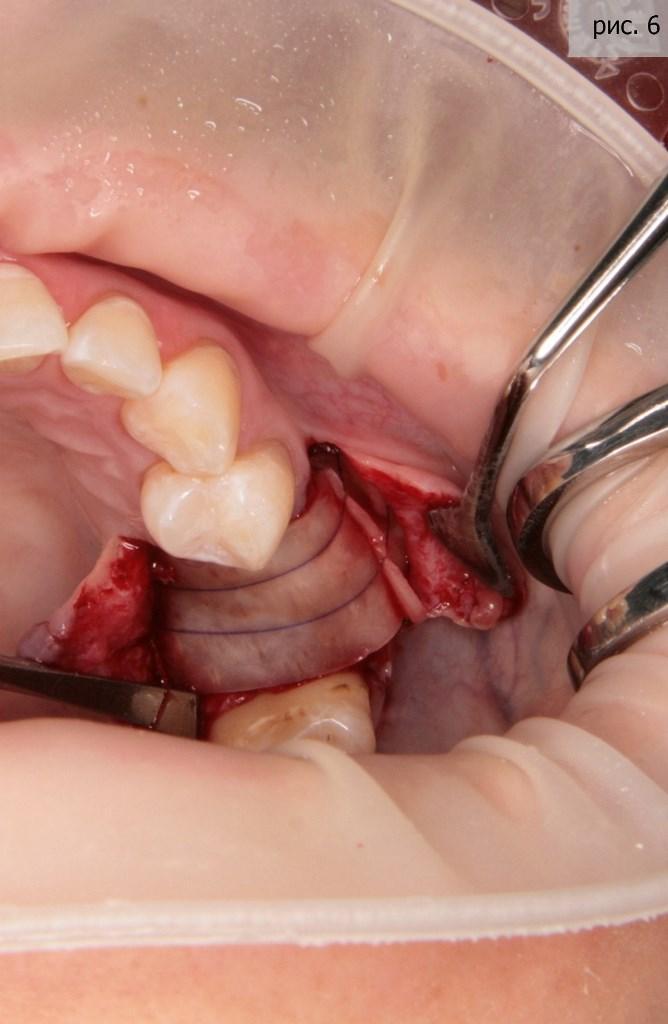
Однако, проблемы на этом не закончились. После наполнения лунок Биопласт-дентом (крошка), обнаружилась критическая нехватка объема слизистой ткани для герметичной и эстетичной фиксации и ушивания зоны операции. Для решения подобных проблем, обычно, я использую специальную мембрану – Биопласт-дент (коллагеновый матрикс). Ее основная отличительная особенность – она толще обычных. То есть, с помощью данной мембраны мы можем увеличивать как ширину, так и толщину плотной кератинизированной десны, как это представлено на фото 6.
Применение этой мембраны позволило нам полностью решить проблему объема слизистой ткани без травматичных операций и вмешательств.
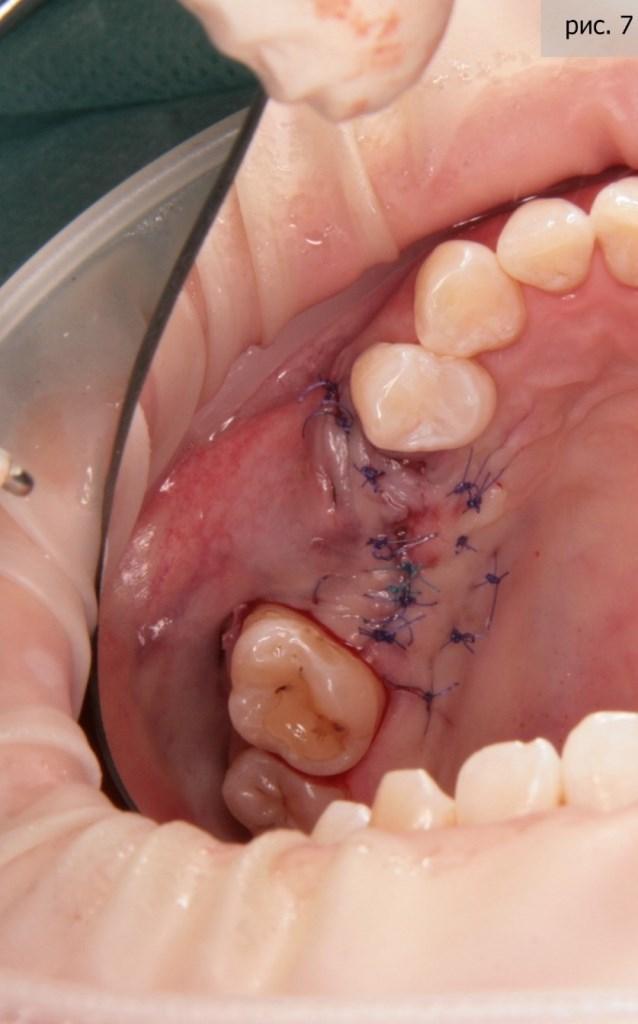
Подведем итог – в ходе процедуры нам удалось удалить разрушенные зубы, увеличить объем костной и слизистых тканей (фото 7).
Все это позволяет мне делать очень хороший прогноз на имплантацию и гарантировать пациенту долговечность итоговой конструкции.
Использование остеопластического материала «Биопласт-Дент» в стоматологии или челюстно-лицевой хирургии
Утрата костной ткани, возникающая в результате травматичных экстракционных вмешательств на зубах верхней и нижней челюсти является актуальной проблемой в современной хирургической стоматологии и челюстно-лицевой хирургии.
Проблема регенерации костной ткани является одной из самых актуальных и интересных в современной хирургии и стоматологии. На сегодняшний день при лечение разнообразных стоматологических заболеваний (периодонтиты, кисты, новообразования и др.) используются материалы различного происхождения – алло-, ауто-, ксенотрансплантаты и синтетические аналоги, отличающиеся по структуре и назначению. Дефицит костной ткани челюстно-лицевой области возникает в результате травматических заболеваний костей лицевого скелета, внутрикостных образований, при осложнённых экстракционных, реконструктивных вмешательствах, дентальной имплантологии, различных костно-пластических операциях. Применение аллотрансплантатов связано с опасностью инфицирования, возникновением отрицательных иммунных реакций и неконтролируемой резорбируемостью имплантата. Полного исключения иммунологических и инфекционных осложнений можно достичь, используя аутотрансплантаты («золотой стандарт»), что в реальности доступно только крупным специализированным учреждениям. Поэтому разработка отечественных конкурентоспособных биосовместимых, резорбируемых ксеноматериалов и их синтетических аналогов с повышенными остеоиндуктивными свойствами представляется необходимой и сохраняет свою актуальность.
Известно, что восстановление объёмных костных дефектов нередко занимает продолжительное время (до 4–5 лет) и не всегда происходит в полном объёме. Наличие сопутствующей патологии может способствовать ещё большему увеличению сроков регенерации.
На сегодняшний день, теоретически обоснована и клинически доказана возможность управления процессом остеоинтеграции посредством применения различных по строению и происхождению стимуляторов регенерации.
С развитием имплантологии, а также совершенствованием методик хирургических операций возникла потребность оптимизации репаративного остеогенеза (восстановления и формирования новой костной ткани).
Требования к остеопластическому материалу были сформированы Frame ещё в 1975 году, но по сей день остаются актуальными. Материал должен обладать свойствами:
Имплантируемый биоматериал, помещённый в дефект костной ткани, должен обладать свойством остеокондукции и остеоиндукции. Остеокондукция – свойство имплантируемого материала выполнять функцию инертного каркаса, необходимого для прорастания сосудов и клеток из костного ложа, привлечения и миграции остеобластов на его поверхность, через остаток кровяного сгустка, сформированного вокруг имплантата. Остеоиндукция – это способность имплантируемого материала трансформировать недифференцированные мезенхиальные клетки в остеобласты, воздействуя на клетки-предшественники, которые стимулируют их пролиферацию и дифференцировку в остеогенные клетки.
Структурные и морфологические характеристики остеопластического материала являются важнейшими показателями, влияющими на качество остеорегенеративных процессов принимающего костного ложа. К этим показателям можно отнести: микро- и макропористость материала, объёмную долю пор по отношению к костному веществу, форму и размер пор, удельную площадь поверхности материала. Известно, что идеальный остеопластический материал биологического или синтетического происхождения должен быть пористым композиционным материалом, максимально близким по вышеуказанным морфологическим характеристикам к нативной кости человека. Заданная морфология и пористость.
Считается, что для достижения необходимой биорезорбции в организме человека пористый имплантат должен содержать систему взаимосвязанных открытых и сопряжённых между собой пор. Распределение по размерам этих пор должно находиться в пределах 50–500 μк – аналогично костной ткани человека. При этом нижняя граница – 50 μк может быть значительно ниже
10–100 нм, одновременно и верхняя граница может быть больше 500 μк, в зависимости от природы самого материала, скорости его деградации и области применения. С учётом большого разнообразия форм костной ткани требуются биоматериалы с различными характеристиками.
Остеопластические материалы, представляющие собой композиции ортофосфатов кальция, оллагена, полисахаридов и других биополимеров, широко используется в стоматологии, челюстно-лицевой и восстановительной хирургии. После имплантации в костный дефект эти материалы способствуют репаративной регенерации окружающей ткани, собственно говоря, организуют её, полностью деградируя, как бы выполняя роль строительных лесов.
Восстановление дефицита кости в должном объёме за счёт физиологической регенерации не всегда является возможным. Это может привести к отдалённым нежелательным последствиям: деформации и последующей атрофии дистального отдела альвеолярного отростка верхней и нижней челюсти, обнажению корней прилежащих к дефекту зубов, развитию вторичных послеоперационных невритов третьей ветви тройничного нерва.
В современной литературе имеются работы, посвящённые сравнительному клинико-экспериментальному изучению влияния различных по происхождению остеопластических материалов на динамику остеогенеза и заживления костных дефектов.
Свойства биоинтеграции и биосовместимости, то есть быть деградируемыми и не вызывать у пациента воспалительных и иммунных реакций, достигают как за счёт введения в костный материал протеогликанов, морфогенетических белков и факторов роста. Согласно литературным данным, костный коллаген и гликозаминогликаны, взяты по отдельности, обладают в основном лишь остеокондуктивными свойствами. Биоматериалы, которые содержат в своём составе основные компоненты межклеточного матрикса – коллаген, гидроксиапатит, гликозаминогликаны, способны оказывать определённый остеоиндуктивный эффект.
Комплекс на основе коллагена и сульфатированных гликозаминогликанов (сГАГ) служит эффективным и активным субстратом для активации и связывания факторов роста, костных морфогенных белков, агрегации тромбоцитов, остеобластов и остеокластов, что способствует ремодулированию костной ткани и стимуляции репарации мягких тканей и костного дефекта. Сульфатированные гликозамино-гликаны непосредственно не индуцируют остеогенез, но создают оптимальную среду для пролиферации и дифференцировки остеогенных клеток и усиливают действие имеющихся факторов роста. Установлено, что коллаген аффинно связанный с функциональными группами сГАГ, обладает способностью повышать его устойчивость к биодеградации.
На стоматологическом рынке представлен отечественный остеопластический материал «Биопласт-Дент» «ЗАО ОЭЗ «ВладМиВа» – высокоочищенный материал с сохранённой природной структурой на основе ксеноколлагена и гидроксиапатита биологического происхождения. Материал обладает естественной системой пор, которая способствует восстановлению кости посредством прорастания кровеносных сосудов и миграции костных клеток, что имеет решающую роль при костной интеграции имплантата. Предназначен для заполнения костных дефектов в стоматологии, челюстно-лицевой хирургии. «Биопласт-Дент» не иммуногенен, остеокондуктивен и остеоиндуктивен, обладает высокой биосовместимостью и биоинтеграцией с костной тканью пациента.
В источнике изучалось влияние остеопластических материалов различных фракций «Клипдент», «Биопласт-Дент» на скорость и качество течения процессов остеорепарации костного дефекта, возникшего в результате травматического удаления зубов нижней челюсти. Отмечается морфологически подтверждённое повышение интенсивности процессов остеорепарации в области дефекта костной ткани. По результатам морфологического экспериментального исследования установлено: регенерация микроциркуляторного русла более выражено и ускорена в среднем на 3–5 суток по сравнению с нормальным процессом. Ускорение процесса формирования костных лакун с погруженными остеоцитами был более выражен при использовании мелкодисперсных веществ, ускорение процесса в сравнении с нормой в среднем на 6–8 суток. Коллагеновый каркас формируется на 6–8 сутки эксперимента, что опережало нормальный процесс на 5–7 суток. Адекватный выбор вида остеопластического препарата и чёткое соблюдение показаний для его применения позволяет повысить эффективность лечения дефектов костной ткани челюстно-лицевой области и сократить сроки временной нетрудоспособности пациентов.
Изучение морфологии образцов в источнике показало, что остеопластический материал «Биопласт-Дент» имеет схожую с костной тканью человека морфологию и систему сопряжённых пор. На микроуровне в материале «Биопласт-Дент» присутствуют поры, совпадающие по размерам с костной тканью
5–10. Однако на макроуровне в губчатой костной ткани нижней челюсти человека, кроме микропор, появляются макропоры с размерами более 500 μк. Полученные данные позволяют сделать предположение об успешном применении данного материала с целью оптимизации процессов остеорепарации при лечении костных дефектов челюстно-лицевой области.
При заполнении костных дефектов в стоматологии, челюстно-лицевой хирургии оправдано применение остеопластического материала отечественного производства «Биопласт-Дент», стимулирующего процессы с образованием полноценного костного регенерата, предупреждающие возникновение осложнений воспалительного характера и атрофии костной ткани в зоне проведения хирургического вмешательства.
Таким образом, отечественный остеопластический материал «Биопласт-Дент» «ЗАО ОЭЗ «ВладМиВа» является биосовместимым, способным к поддержанию гистотипической дифференцировки клеток и обеспечению репаративной регенерации соединительной ткани. Введённый в костный коллаген сГАГ образует активный комплекс, снижающий первичную воспалительную реакцию на имплантированный материал, что повышает его устойчивость к биодеструкции. При этом, полученный биокомпозит является активным субстратом для индукции и связывания факторов роста, костных морфогенных белков, агрегации тромбоцитов, остеобластов и остеокластов, что способствует ремоделированию костной ткани.
Авторы:
Флейшер Г.М., врач-стоматолог-консультант, ГУЗ «Областная стоматологическая поликлиника – Стоматологический центр», г. Липецк
Посохова В.Ф., к.х.н., с.т.н., Начальник центральной заводской лаборатории, ЗАО «ВладМиВа»
Лыкова И.В., инженер – биохимик Центральной Заводской Лаборатории ЗАО «ОЭЗ «ВладМиВа»
Замещаем дефект: применение остеопластических материалов после удаления третьих моляров
Ретенция нижних третьих моляров выявляется более чем у половины населения. Увеличение болезней прорезывания, в частности, ретенции и полуретенции «зубов мудрости» подтверждено литературными данными: 1971 – 23% (Morris and Jerman), 1988 – 72% (Hugoson A. с соавт.), 2006 – 84% (Albert J. Haddad). Закономерно возрастает число осложнений прорезывания — кист и опухолей. Так, например, парадентальные кисты развиваются в 2,1% — 25% случаев (Шейнберг В.М., 1955; Colgan C.M., 2002).
Увеличение числа показаний к операции удаления этих зубов связано не только с большим количеством развивающихся осложнений, обусловленных аномалиями развития и затрудненным прорезыванием, но и с широким использованием высокоинформативных методов лучевой диагностики и комплексным подходом к ведению пациентов с зубо-челюстными аномалиями при ортодонтическом лечении.
Среди основных показаний к удалению нижнего третьего моляра выделяют значительное количество причин, основными из которых являются: хронический воспалительный процесс (перикоронит или периостит), абсцессы и флегмоны, обширные кариозные дефекты, фолликулярная, парадентальная или радикулярная кисты, ретенция и дистопия, хроническая травма щеки при прикусывании моляром.
Удаление ретенированных нижних третьих моляров относится к оперативным вмешательствам определенной степени сложности. Для экстракции зубов 38 и 48 предложен ряд методик, включающих формирование и отслоение слизисто-надкостничного лоскута, трепанацию наружной кортикальной пластинки и удаление участков кости, нависающей над коронкой зуба, фрагментацию зуба и его извлечение.
Лунка ретенированных 38 и 48 зубов, как правило, занимает больший объем, чем располагающийся в альвеолярный дуге зуб. Формирующийся костный дефект имеет параметры, включающие не только саму лунку, но и дефект кости, созданный хирургом в процессе удаления при формировании оперативного доступа к зубу. Размеры послеоперационного дефекта могут значительно увеличиться в тех клинических случаях, где имеются кисты челюстей: парадентальная, радикулярная или фолликулярная. На его восстановление требуется более длительный срок.
В процессе удаления вывихивание ретенированного моляра из лунки производится элеватором. В качестве точки «опоры» щечки элеватора используется костная перегородка между вторым и третьим молярами, что приводит к ее частичной утрате.
В некоторых клинических случаях перегородка отсутствует изначально как следствие мезиального наклона коронки или горизонтального положения нижних зубов мудрости.
За дистальной стенкой лунки вторых нижних моляров и в лунке удаленного зуба формируется карман, в котором происходит зазержка пищи в послеоперационном периоде, что приводит к развитию воспаления и замедлению заживления.
Одним из способов профилактики такого пародонтального кармана, развития воспалительных осложнений и оптимизации восстановления костной ткани челюстей является использование остеопластических материалов.
С целью стимуляции восстановления костной ткани и замещения костных дефектов после хирургического вмешательства рекомендуется применение остеопластических материалов различного происхождения и степени обработки.
К ним относят лиофилизированные, формалинизированные, деминерализованные, депротеинизированные препараты кости и хряща, а также брефоматериалы, препараты крови, коллагеновые материалы, аутотрансплантаты, биопластмассы и тканевые трансплантаты.
Перспективным методом местной коррекции метаболических процессов в кости является применение гидроксиапатита (ГАП), оказывающего специфическое остеотропное действие.
С целью повышения эффективности операции удаления ретенированных нижних третьих моляров, а также для профилактики воспалительных осложнений после удаления зуба, нами в алгоритм лечебно-профилактических мероприятий было включено заполнение послеоперационного дефекта костной ткани сочетанием биокомпозиционных материалов «Остеоматрикс», «Биоимплант-ГАП» по методике Д.А. Саващука, предложенной для консервации лунки перед дентальной имплантацией (ООО «Конектбиофарм», Москва).
Протокол операции
Рис. 1. Линия разреза при формировании вестибулярного лоскута.
После извлечения зуба (рис. 2) и обработки лунки (кюретаж) проводили укладку остеопластического материала. Первым в лунку помещался Остеоматрикс, остеоиндуктивный материал, ремоделирующийся в кость. Его выкладывали слоями без утрамбовывания. Поверх Остеоматрикса укладывался остеокондуктивный материал Биоимплант-ГАП, который при дальнейшем заживлении уплотнялся и играл роль своеобразной «сыпучей мембраны», защищающей Остеоматрикс от прорастания эпителия слизистой оболочки (рис. 3).
Рис. 2. Экстракция зуба (направление выведения из лунки).
Рис. 3. Последовательность заполнения лунки.
Рис. 4. Схема установки мембраны Биоматрикс.
При глухом ушивании раны над лункой нижнего зуба мудрости существует риск развития послеоперационной гематомы, поэтому большинство хирургов стоматологов предпочитают дренировать рану с помощью выпускника из перчаточной резины. При использовании любого костнопластического материала требуется «плотное» наложение швов для профилактики попадания инфекции и изоляции раны от содержимого полости рта. Присутствие кальция в костной крошке придает ей гемостатический эффект, но эти факторы не могут гарантировать отсутствие гематомы, особенно если она является следствием кровотечения из слизистой оболочки отслоенного лоскута. Наиболее удобным местом для установки дренажной полоски является край раны на уровне переходной складки преддверия полости рта ниже края установленной на лунку мембраны Биоматрикс. Использование дренажа позволяет осуществить профилактику послеоперационной гематомы, не влияя на аугментат.
Удаление зубов 48, 38 проводили с разницей в две недели.
Рис. 5. Ортопантомограмма пациентки А., 23 г.
Рис. 6. Вид ретенированного зуба 4.8 в полости рта.
Рис. 7. Проведение инфильтрационной анестезии.
Рис. 8 а. Проведения разреза со щечной поверхности.
Рис. 8 б. Проведения разреза по вершине альвеолярного отростка.
Рис. 9 а. Отслаивание лоскута со стороны щеки.
Рис. 9 б. Отслаивание лоскута со стороны языка.
Рис. 10 а. Трепанация кости над коронкой зуба 48.
Рис. 10 б. Вывихивание зуба элеватором.
Проводилось извлечение зуба из лунки вместе с оболочкой парадентальной кисты.
Рис. 11 а. Извлеченный зуб.
Рис. 11 б. Лунка зуба после удаления.
Рис. 12 а. Заполнением лунки зуба 38 Остеоматриксом.
Рис. 12 б. Упаковка препарата.
Рис. 13. Крошка «Биоимплант-ГАП», уложенная поверх Остеоматрикса.
Рис. 14 а. Вид мембраны до установки.
Рис. 14 б. Вид мембраны после установки.
Рис. 15 а. Рана после наложения швов.
Рис. 15 б. Рана после установки дренажа из перчаточной резины.
Зуб 38 удаляли спустя две недели по аналогичной методике.
Рис. 16 а. Ортопантомограммы после удаления зуба 48.
Рис. 16 б. Ортопантомограммы после удаления зуба 38.
Послеоперационный период протекал без осложнений. На контрольной рентгенограмме можно проследить восполнение дефекта костной ткани в области дистальной поверхности нижних вторых моляров и отсутствие пародонтального кармана после удаления нижних третьих моляров.
Таким образом, использование костнопластических материалов «Остеоматрикс» и «Биоимплант-ГАП» в сочетании с биодеградируемой мембраной «Биоматрикс» позволяет ускорить заживление лунки зуба после удаления ретенированных третьих моляров, избежать расхождения краев раны с последующей задержкой пищи и образованием пародонтального кармана после полного заживления лунки. Послойная укладка остеоиндуктивного препарата «Остеоматрикс», остеокондуктивного «Биоимплант-ГАП» и мембраны «Биоматрикс» предотвращает высыпание костной крошки и прорастание эпителия в поверхностные слои аугментата за счет образования плотного поверхностного слоя.
Дмитрий Алексеевич Саващук, врач хирург-стоматолог «РМО» («Конектбиофарм»)
Ирина Ивановна Бородулина, д. м. н., профессор кафедры челюстно-лицевой хирургии и хирургической стоматологии ФГБВОУ ВО ««Военно-медицинская академия им. С.М. Кирова» Министерства обороны Российской Федерации
Андрей Андреевич Жевлаков, аспирант кафедры челюстно-лицевой хирургии и хирургической стоматологии ФГБВОУ ВО ««Военно-медицинская академия им. С.М. Кирова» Министерства обороны Российской Федерации
Replace the defect: the use of osteoplastic materials after the removal of the third molars
Аннотация. Удаление ретенированных нижних третьих моляров относится к оперативным вмешательствам определенной степени сложности. Формирующийся костный дефект имеет параметры, включающие не только саму лунку, но и дефект кости, созданный хирургом в процессе удаления при формировании оперативного доступа к зубу. С целью стимуляции восстановления костной ткани и замещения костных дефектов после хирургического вмешательства рекомендуется применение остеопластических материалов различного происхождения и степени обработки.
Annotation. Removal of the retarded lower third molars refers to surgical interventions of a certain degree of complexity. The emerging bone defect has parameters that include not only the hole itself, but also the bone defect created by the surgeon in the process of removal during the formation of operative access to the tooth. In order to stimulate the restoration of bone tissue and replacement of bone defects after surgery, the use of osteoplastic materials of different origin and degree of treatment is recommended.
Ключевые слова: Третий моляр; зуб мудрости; ретенированные моляры; остеопластические материалы; костный дефект.
Keyword: Third molar; wisdom tooth; impacted molars; osteoplastic materials; bone defect.
Остеопластические материалы от компании «ВладМиВа»
К сожалению, запчасти при рождении не выдают. Регенерация мягких тканей протекает достаточно быстро, но как быть, когда необходимо восстановить поврежденные участки кости? Для реконструкции их анатомической целостности используют разнообразные пластические материалы биологического и неорганического происхождения. Однако, несмотря на то, что институты и университеты ведут многоплановые исследования, результаты этих исследований не коммерциализуются, поэтому ассортимент отечественных материалов на российском рынке оставляет желать лучшего.
Рис. 1. Лиофильная сушилка
Рис. 2. Реакторная установка с температурным датчиком
Серийно выпускаемые материалы «Клипдент» и «Биопласт-Дент» открывают не только новую страницу в развитии потенциала компании, но и подтверждают реальную возможность отечественных производителей по импортозамещению в различных областях применения высоких технологий.
Выпускаемая продукция соответствует требованиям внутренних российских и международных стандартов, системе менеджмента качества ISO 13485–2003 и ГОСТ ISO 9001–2011.
БИОМАТЕРИАЛЫ для регенерации твердых тканей
Значительную долю костнопластических материалов компании «ВладМиВа» составляют высокоочищенные фосфаты кальция (β-трикальцийфосфат и(или) гидроксиапатит), так как их химический состав сходен с костной тканью.
Материалы «Клипдент» применяются в различных клинических случаях. В частности, в пародонтологии: заполнение двух- или многостеночных костных карманов, а также би- и трифуркации зубов, аугментация атрофированной челюстной пазухи. В имплантологии: синуслифт или поднятие синусового основания (субантральная аугментация), заполнение альвеолярных дефектов для поддержания челюстной пазухи после экстракции зуба, заполнение экстракционных дефектов с целью создания основы для имплантата. В случае кистовых дефектов: дефекты после экстирпации костной кисты, дефекты после резекции верхушки корня и дефекты после удаления ретенированных зубов хирургическим путем, а также прочие многосеточные костные дефекты альвеолярных отростков и лицевых костей черепа.
Материал «КЛИПДЕНТ» выпускается в виде:
Гранулы на основе чистой фазы β – трикальцийфосфата «Клипдент», а также на основе β – трикальцийфосфата (60 %) и гидроксиапатита (40 %) «Клипдент»-ТКФ/ГАП, полученные в процессе спекания синтетического сырья, не содержат веществ животного происхождения, биологически совместимы с тканями организма, обладают высокой микро-, макро- и межгранулярной пористостью, что создает идеальные условия для восстановления дефекта кости. Специальная добавка делает материал рентгеноконтрастным.
Остеоиндуктивные гранулы, содержащие в составе гиалуронат натрия «Клипдент»-ГЛ и коллаген «Клипдент»-КЛ, оказывают стимулирующее действие на рост клеток и способствуют активации репаративного остеогенеза в области травмы, ускоряют процесс дифференциации новообразованной костной ткани, что выражается прежде всего в резком повышении удельного веса костной компоненты регенерата, а также в более интенсивном созревании костного вещества.
Остеокондуктивный материал «Клипдент»-ПЛ представляет собой минерал-полимерные гранулы состоящие из чистой фазы β – трикальцийфосфата и полилактидгликолидного покрытия (5 мкм).
Технология получения гранул заданной пористости и архитиктоники, максимально приближенной к биологическому костному матриксу, способствует ускорению интеграции имплантата с костной тканью.
Материал «Клипдент»-ПЛ сорастворитель состоит из гранул β – трикальцийфосфата покрытых тонкой оболочкой биодеградируемого сополимера полилактидгликолида (10 мкм) и сорастворителя. После смешивания гранул с сорастворителем, гранулы склеиваются между собой, образуя пластичный материал с высокой микро- и межгранулярной пористостью, который можно вводить в костный дефект непосредственно из шприца. При контакте с кровью или ротовой жидкостью материал приобретает форму костного дефекта, что обеспечивает стабильность его в дефекте и облегчает процедуру ушивания раны.
Рис. 3. Гранулы в шприце смачиваем сорастворителем, в результате чего они склеиваются между собой.
Рис. 4. Перемещая поршень, добиваемся полного смачивания гранул.
Рис. 5. Удаление избытка сорастворителя.
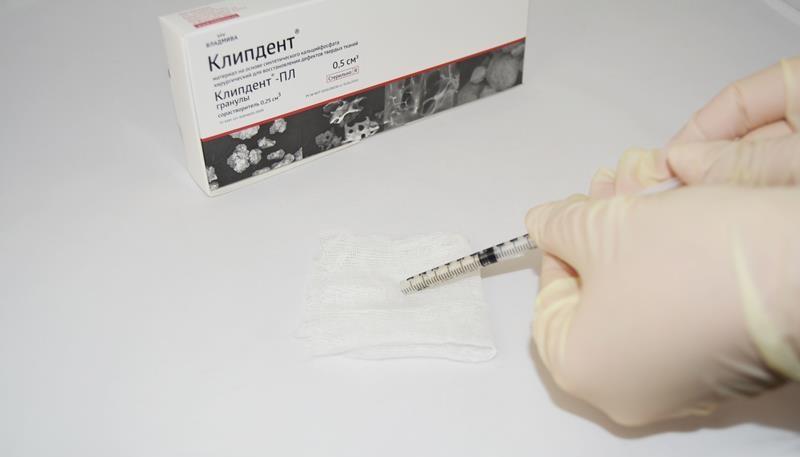
Рис. 6. Материал остается пластичным до того момента, пока он не вступит в контакт с кровью дефекта.
Рис. 7. В дефекте в течение нескольких минут материал формирует стабильную, пористую матрицу, идеальную для регенерации костной ткани.
Рис. 8. Демонстрация подготовленного материала для внесения в область костного дефекта.
При восстановлении пародонтальных дефектов (заполнение двух- или многостеночных костных карманов, би- и трифуркации зубов, аугментация атрофированной челюстной пазухи) рекомендуется использовать остеопластический материал «Клипдент» пародонтологический, оптимизирующий регенерацию мягких и костных тканей.
Рис. 9. ВладМиВа Клипдент пародонтологический.
Материал представляет собой резорбируемые кальций-фосфатные многослойные гранулы с пролонгированным высвобождением активных действующих веществ. Основа гранулы состоит из рентгеноконтрасных β – трикальцийфосфата (20%) / гидроксиапатита (80%) в полилактидгликолидной матрице. Внутренний слой покрытия содержит гиалуронат натрия, который оказывает стимулирующее действие на рост клеток и способствует активации репаративного остеогенеза в области травмы, ускоряя процесс дифференциации новообразованной костной ткани, что выражается прежде всего в резком повышении удельного веса костной компоненты регенерата, а также в более интенсивном созревании костного вещества. Внешний слой покрытия включает в себя гидрокортизон, хлоргексидин и лидокаин, которые обладают антибактериальным действием по отношению к анаэробным простейшим и бактериям, ингибируют синтез белков в микроорганизмах, оказывая бактериостатическое и бактерицидное действие, активны в отношении широкого спектра вегетативных форм грамотрицательных и грамположительных микроорганизмов, дрожжей и липофильных вирусов.
В состав биоматериала «Клипдент-Цем» входит β – трикальцийфосфат, моногидрат монокальцийфосфат, гиалуронат натрия, регуляторы пластичности и целостности структуры материала.
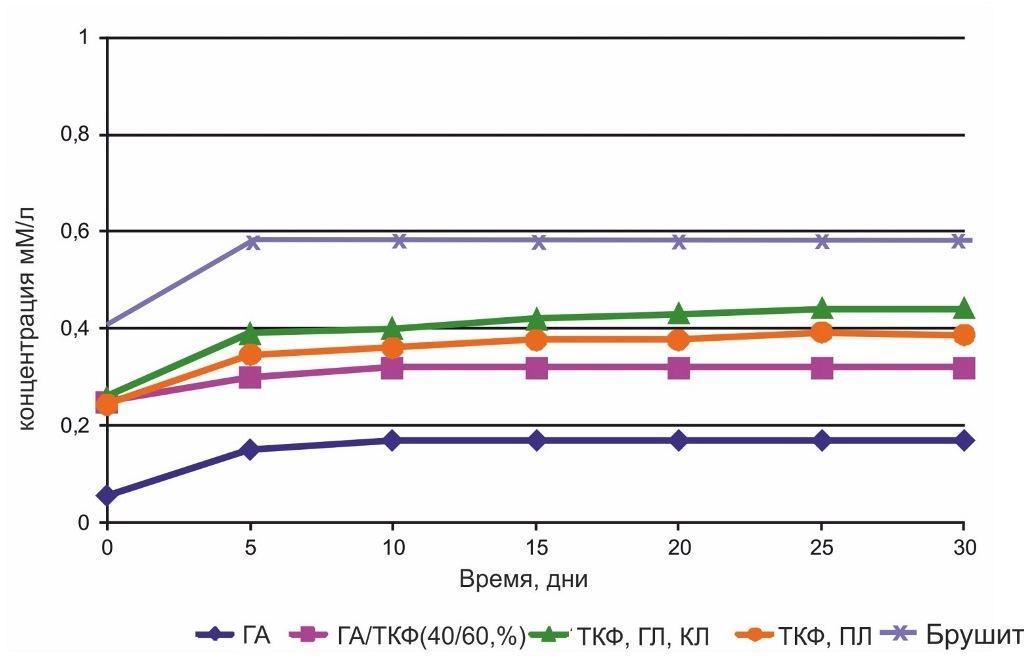
Твердение материала происходит в результате кислотно-основного взаимодействия с образованием в качестве основного продукта кристаллогидратов дигидрата дикальцийфосфата, имеющего структуру брушита:
Са(Н2РО4)2·Н2О + β-Са3(РО4)3 + 7Н2О→ 4СаНРО4·2Н2О
обладающего большей скоростью резорбции (3-4 месяца), чем цементы на основе гидроксиапатита (8-12 месяцев).
Рис. 10. Изменение концентрации ионов Са2+ в изотоническом 0,1 М растворе.
Гиалуронат натрия, входящий в состав материала, значительно улучшает его остеоиндуктивные свойства. Плотный контакт между костью и поверхностью дентального имплантата, способствует формированию новой аутогенной костной ткани, а также препятствует врастанию мягких тканей, являясь эффективной заменой традиционной комбинации «гранулированный материал-мембрана». Показатель прочности затвердевшего материала эквивалентен прочности губчатой кости.
Альтернатива аутокости — «БИОПЛАСТ-ДЕНТ»
Несмотря на значительные успехи достигнутые в биоматериаловедении синтетически полученный апатит отличается от натурального по физическим и химическим свойствам, что не всегда обеспечивает стабильную регенерацию. В большинстве клинических случаев предпочтение отдается натуральным биоматериалам, полученным из костной ткани. Биоматериалы натурального происхождения остаются единственной функционально надежной субстанцией полностью совместимой с живым организмом, обладающей высокой биосовместимостью, регулируемым и контролируемым процессом деструкции в живом организме.
Компания «ВладМиВа» выпускает высокоочищенный остеопластический материал «Биопласт-Дент» с сохранением гидроксиапатита биологического происхождения и пространственной архитектоники, что способствует фиксации биологически активных веществ на структурах биоматериала без снижения их биологической активности.
Технология получения материала «Биопласт-Дент» основана на поэтапной многостадийной очистке губчатой (кортикальной) костной ткани КРС методом химико-ферментированной обработки или депротеинизации. Материал лишен клеточных элементов и белковых фракций. Материал является идеальным остовом прорастания кровеносных сосудов и врастания клеток из костного ложа, т.к. обладает пористой структурой трабекулярной и диафизарной части трубчатых костей (микропоры, макропоры, гаверсовы каналы).
Гидроксиапатит биологического происхождения способствует ангиогенезу, миграции и прикреплению к поверхности гранул стромальных стволовых клеток костного мозга, их дифференцировке в остеобласты и репаративному остеогенезу.
Материал обладает остеогенными (остеокондуктивными и остеоиндуктивными) свойствами, содержит высокоочищенные сульфатированные гликозаминогликаны.
Биоматериал «Биопласт-Дент» обладает высокой биологической совместимостью, способствующей отсутствию иммунных реакций организма реципиента, а также сочетается со всеми видами трансплантатов, имплантатов, эндофиксаторов.
Биоматериалы являются достаточно прочной, резорбируемой во времени матрицей (6-8 месяцев), со скоростью биорезорбции синхронизированной по времени с процессом образования новой ткани. Физиологическая резорбция протекает с образованием нетоксичных продуктов распада.
Область применения материала «Биопласт-Дент» охватывает практически все клинические случаи при восстановлении структурной целостности костных дефектов в хирургической стоматологии и челюстно-лицевой хирургии:
Кроме того, биоматериал «Биопласт-Дент» рекомендован к использованию в травматологии, ортопедии, офтальмохирургии и других областях медицины.
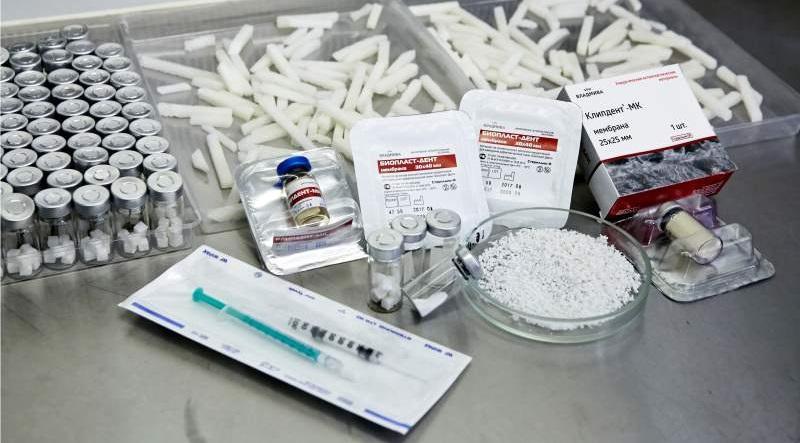
Материал «Биопласт-Дент» выпускается в виде:
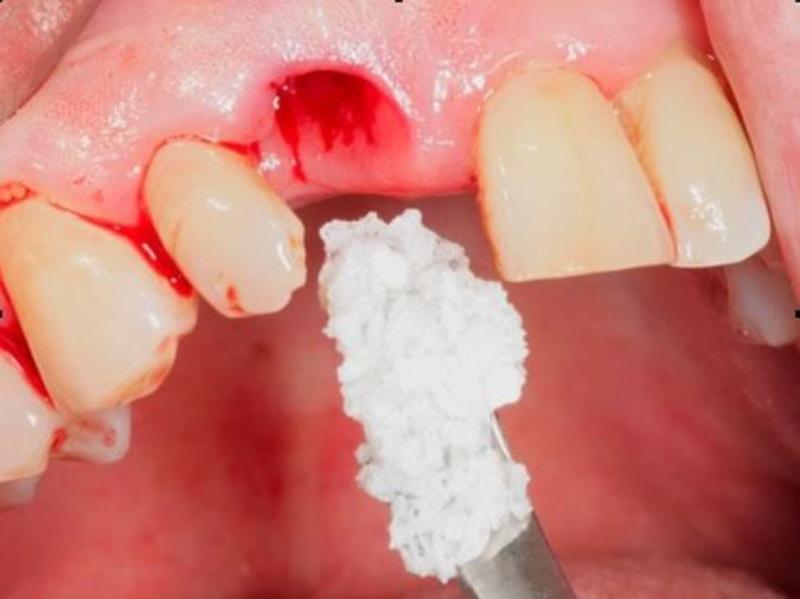
Остеопластический материал «Биопласт-Дент» (крошка, чипсы) полученный методом химико-ферментированной обработки содержит в своем составе гидроксиапатит животного происхождения и высокоочищенный нативный коллаген, а также сульфатированные гликозаминогликаны в пределах биологической нормы (не менее 800 мкг/см3).
Деминерализированные блоки идеально подходят для заполнения дефектов сложной анатомической формы.
Крошка пропитанная линкомицином или хлоргексидином и метронидазолом наиболее эффективна для применения в хирургической парадонтологии. Входящий в состав крошки линкомицин ингибирует синтез белков в микроорганизмах, оказывая бактериостатическое и бактерицидное действие. Линкомицин эффективен в отношении грамположительных микроорганизмов и микоплазм.
Метронидазол входящий в состав крошки обладает антипротозойным и антибактериальным действием по отношению к анаэробным простейшим и бактериям. Механизм действия заключается в биохимическом восстановлении нитрогрупп метронидазола и дальнейшем их взаимодействии с ДНК клетки микроорганизмов, что ингибирует синтез нуклеиновых кислот и ведет к гибели бактерий. Хлоргексидин активен в отношении широкого спектра вегетативных форм грамотрицательных и грамположительных микроорганизмов, дрожжей и липофильных вирусов. Бактерицидный эффект обусловлен связыванием катионов, образующихся в результате диссоциации хлоргексидина в физиологической среде с отрицательно заряженными фосфатными группами бактериальных клеточных мембран и экстрамикробных комплексов.
Остеопластический материал «Биопласт-Дент» (крошка, блоки) полученный методом депротеинезации ксеноматериала посредством полного удаления органических компонентов с сохранением прочной трехмерной структуры и минеральной составляющей костной ткани. Материал является достаточно прочной, постепенно резорбируемой матрицей (6-8 месяцев), на поверхности которой в условиях костных дефектов формируется новообразованная кость. В результате депротеинизации материал лишен клеточных элементов и белковых фракций.
БИОМАТЕРИАЛЫ для регенерации мягких тканей
Резорбируемая, коллагеновая мембрана предназначена для создания механического барьера, предупреждающего миграцию мягких тканей в костный дефект при хирургическом вмешательстве:
Двухслойная мембрана «Биопласт-Дент» представляет собой коллаген I типа (дерма), не содержит дополнительных химических добавок.
Рис. 11. ВладМиВа БиопластДент остеопластический материал на основе костного коллагена, мембрана.
Мембрана имеет морфологию плотных ориентированных волокон для достижения механической прочности, иммуногенна, инертна, что приводит к отсутствию воспалительной реакции или выраженной реакции на инородное тело.
Мембрана не антигенна, высоко биосовместима, предотвращает пролиферацию и миграцию эпителия, создавая оптимальные условия для направленной регенерации костной ткани. Структура коллагена позволяет надежно закрыть костный дефект. Материал полностью резорбируется без фиброзного перерождения.
КЛИПДЕНТ-МК мембрана представляет собой коллаген II типа, межволоконная структура которого восстановлена за счет поперечного сшивания полипептидных цепей. Мембрана биосовместима, способствует связыванию факторов роста, агрегации тромбоцитов, остеобластов и остеокластов, вызывает ремоделирование костной ткани и стимулирует репарацию костного дефекта.
КЛИПДЕНТ-МК мембрана сохраняет барьерную функцию в процессе регенерации ткани без фиброобразований, не содержит антигенных факторов, способна интегрироваться с окружающими тканями, не вызывая ответной иммунной реакции. Легко моделируется, обладает оптимальной жесткостью и пластичностью.
Для надежной защиты и ускоренного заживления ран
КЛИПДЕНТ гель — фиксирует аугментационный материал, выполняя функцию биологической мембраны. Входящий в состав геля гиалуронат натрия представляет собой биополимер высокой степени очистки, по составу эквивалентный естественному человеческому. Это, а также отсутствие белков животного происхождения снижает риск аллергических реакций. Благодаря высокой вязкости гель замедляет процесс проникновения бактерий и вирусов в ткани, что положительно влияет на процесс заживления.
Смесь гиалуроновой кислоты с материалами для регенерации кости значительно улучшает клинические результаты, повышая остеоиндуктивность и фиксацию этих материалов в местах применения, предотвращая смещение аугментационного материала и обеспечивая стабильность объема.
Рис. 12. Заполнение лунки удаленного зуба подготовленным остеопластическим материалом «Клипдент» гель.
Гель, выполняя функцию биологической мембраны, эффективно фиксирует ауто- или аллогенные аугментационные материалы. Защитное действие и медленное всасывание гиалуроновой кислоты обеспечивает надежную и предсказуемую регенерацию аугментата, особенно при операциях синус-лифтинга. Гиалуроновая кислота положительно воздействует на образование нового костного материала и прочно связывает частицы гранулята, что позволяет проводить аугментацию дефектов даже в труднодоступных местах.
БИОПЛАСТ-ДЕНТ гель эффективно снимает отек и воспаление слизистой полости рта до и после хирургических манипуляций. Входящий в состав геля хондроитин сульфат, способствует заживлению воспаленного пародонта, за счет снижения активности протеолитических ферментов и гиалуронидазы бактериальной флоры. Гель нормализует обмен веществ в клетках эпителия и фибробластах и микроциркуляцию крови, что приводит к быстрому уменьшению отечности и кровоточивости десен, способствует локализации воспаления. Кроме того, хондроитин сульфат значительно улучшает состояние дентина и обмен в одонтобластах.
Антибактериальный компонент хлоргексидин обеспечивает пролонгированный бактерицидный эффект на микроорганизмы зубного налета, способствует предупреждению и лечению гингивитов, уменьшает воспаление десен.
При длительном применении гель не вызывает аллергических реакций. Применяется для уменьшения отека и воспаления тканей слизистой ротовой полости при хирургических операциях по поводу травм, переломов, шинирования челюстей; закрытия перфораций гайморовой пазухи и прободений нижнечелюстного канала; при удалении зуба (осложненном/неосложненном). Показаниями также являются профилактика и лечение пародонтитов, гингивитов и стоматитов. Гель можно использовать в качестве стабилизатора сгустка.