биотерапия при ревматоидном артрите что это такое
Что такое генно-инженерная терапия?
Принимать ГИБП можно лишь по заключению врача
Генно-инженерная терапия — это современная терапия с применением генно-инженерных биологических препаратов. Генно-инженерные биологические препараты (ГИБП) — это лекарственные средства, различными по механизму действия. Они могут блокировать и ингибировать цитокиновые рецепторы, являются гуманизированными или человеческими моноклональными антителами и.т.д.
Говоря простым языком, в препаратах имеются молекулы, способные прерывать взаимодействия между клетками хозяина и субстанциями, провоцирующими бесконтрольное воспаление.
Такие лекарства используют только ревматологи?
Нет. Также эти препараты используют гематологи, онкологи, гастроэнтерологи, офтальмологи и неврологи, но назначаться они могут только узкоспециализированными экспертами. Ревматолог не может назначить терапию онкологическому пациенту, гастроэнтеролог — пациенту офтальмолога.
Всем ли пациентам с аутоиммунной патологией можно назначать такую терапию?
Связано ли это с высокой стоимостью препаратов?
Экономический аспект, естественно, имеет значение. Но во главу угла ставится здоровье пациента. Это довольно новая группа препаратов, нуждающаяся в крайне аккуратном и выверенном назначении. До первого введения или приема медикамента пациент должен быть детально обследован, необходимо оценить активность заболевания. Необходимо, чтобы это была не субъективная оценка самочувствия, а ряд исследовательских индексов активности. Помимо этого, должна быть доказана неэффективность других лекарственных средств.
Стоит ли приобретать генно-инженерные препараты, не попробовав другие лекарства?
Нет! Это серьезное решение, и принимается оно совместно с врачом — нужно взвесить все «за» и «против».
За генной инженерией будущее, а цитостатики — вчерашний день?
Это совсем не так. Нельзя делить лекарства по принципу «новое — значит надёжное, а старое — неэффективное». Это в корне неверно, а иногда и крайне опасно.
Можно ли принимать такие препараты без заключения ревматолога?
Данная группа средств требует регулярного взаимодействия с ревматологом. Самолечение может привести к огромному количеству проблем, например: отсутствие лекарственного обеспечения, ускользание эффекта, нежелательные побочные явления и обострение скрытых инфекций. Даже несколько инъекций, выполненных без назначения и контроля ревматолога, могут привести к плачевным исходам. Это авантюра, которая в некоторых случаях может привести к летальному исходу. Принимать ГИБП можно лишь по заключению врача, который умеет работать с ними и осуществлять контроль безопасности. Это очень важно.
Запишитесь на консультацию к врачу-ревматологу в медицинский центр «Неббиоло» и получите ответы на все интересующие вас вопросы о генно-инженерной биологической терапии!
Биоаналоги в лечении ревматических болезней: pro et contra
Генно-инженерные биологические препараты (ГИБП) в настоящее время достаточно широко применяются для лечения многих ревматических болезней, в том числе ревматоидного артрита, анкилозирующего спондилита, псориатического артрита, системных васкулитов и др. Чаще всего их используют в качестве препаратов второй линии в случае неэффективности или плохой переносимости стандартных базисных противовоспалительных препаратов. Основным препятствием к более частому назначению ГИБП является их высокая стоимость, которая приводит к увеличению затрат на лечение и экономического бремени для системы здравоохранения. Частичным решением этой проблемы является создание экономически более привлекательных биоаналогов ГИБП, которое стало возможным после завершения срока патентов на некоторые оригинальные препараты. Однако следует учитывать, что ГИБП, в отличие от синтетических лекарственных средств (“малых молекул”), характеризуются сложным и многоэтапным процессом производства, что определяет строгие требования к их разработке и регистрации. Чтобы гарантировать не менее высокую эффективность и безопасность биоподобных препаратов по сравнению с оригинальными, потенциальные биоаналоги следует тщательно изучать не только в доклинических, но и рандомизированных контролируемых клинических исследованиях. Сбор данных о безопасности и эффективности биоаналога необходимо продолжать и после его регистрации и внедрения в клиническую практику. В статье обсуждаются результаты клинических исследований российских биоаналогов ритуксимаба, инфликсимаба и адалимумаба, которые были одобрены для применения при ревматических заболеваниях.
Генно-инженерные биологические препараты (ГИБП) применяются в ревматологии на протяжении двух десятилетий. За это время список их значительно пополнился и продолжает расширяться (ингибиторы фактора некроза опухоли [ФНО]-α, В-лимфоцитов, рецепторов интерлейкина-6, костимуляции Т-лимфоцитов, интерлей кинов-12/23, интерлейкина-17, интерлейкина-1), как и показания к применению. Последние сегодня включают не только ревматоидный артрит, но и многие другие ревматические заболевания, в том числе редкие. К настоящему времени у некоторых ГИБП закончился срок патентной защиты, в связи с чем начался процесс регистрации их аналогов. На сегодняшний день в Российской Федерации для лечения ревматических заболеваний были одобрены биоаналоги инфликсимаба (инфликсимаб, BIOCAD, Россия, и Фламмэгис, Celltrion Pharm, Республика Корея), ритуксимаба (Ацеллбия, BIOCAD, Россия) и адалимумаба (Далибра, BIOCAD, Россия.)
Современные принципы разработки биоаналогов
Появление более дешевых биоаналогов приводит к снижению затрат для системы здравоохранения, в том числе за счет падения цен на оригинальные ГИБП, что позволяет охватить лечением большее число пациентов. Например, в одном исследовании было показано, что появление биоаналогов на американском рынке в течение ближайшего десятилетия позволит сократить расходы бюджета более чем на 44 млрд долларов при условии, что стоимость биоподобных препаратов будет на 35% ниже оригинальных ГИБП [1]. Однако очевидно, что сокращение затрат не должно происходить в ущерб эффективности и безопасности лечения ГИБП. В связи с этим в литературе последних лет активно обсуждаются требования к процессу регистрации биоаналогов, в частности необходимость в проведении рандомизированных клинических исследований для подтверждения их сопоставимых эффективности и безопасности по сравнению с оригинальным ГИБП 3. Если подобные исследования не проводились, то препарат предлагается считать “предполагаемой копией» (intended copy) референтного ГИБП, а не биоаналогом.
ГИБП, применяющиеся для лечения ревматических заболеваний, представляют собой сложные белковые молекулы (моноклональные антитела, циркулирующие рецепторы, гибридные молекулы), которые производятся с помощью генно-инженерного метода и, в отличие от низкомолекулярных препаратов, не являются точными копиями оригинальных веществ. Это связано с тем, что даже незначительные изменения процесса производства белковых молекул могут привести к изменению их биологической активности и/или иммуногенности и, соответственно, безопасности и эффективности [3]. Свойства белков могут зависеть и от трудно воспроизводимых посттрансляционных изменений, таких как гликозилирование, окисление, метилирование и/или деаминирование [5].
В последние годы Всемирная организация здравоохранения (ВОЗ) и регуляторные органы Европейского Союза и США предложили определения биоаналогов. Например, ВОЗ считает таковыми биотерапевтические препараты, которые по качеству, безопасности и эффективности подобны зарегистрированным референтным препаратам [6]. В определении Европейского агентства по лекарствам (ЕМА) и сходном определении Евразийской экономической комиссии указано, что подобие биоаналога референтному препарату по параметрам качества, биологической активности, безопасности и эффективности должно быть подтверждено при всестороннем исследовании сопоставимости [7,8]. В определении Американского управления по контролю качества пищевых продуктов и лекарств (FDA) отмечается возможность незначительных различий в клинически неактивных компонентах между биоаналогом и зарегистрированным в США оригинальным ГИБП при отсутствии клинически значимых различий по безопасности, чистоте и активности [9].
Сегодня большинство экспертов сходятся во мнении, что регистрация биоаналога должна производиться на основании результатов не только доклинических, но и клинических исследований 3 фазы, предполагающих прямое сравнение потенциального биоаналога с оригинальным ГИБП (рис. 1) [2,5]. Таким образом, фактически программа разработки биоаналога в значительной степени соответствует таковой оригинального препарата за исключением отсутствия необходимости в проведении исследований 2 фазы, предполагающих изучение режимов введения и выбор оптимальных доз препарата. Регуляторные органы Европы и США, а также Евразийская экономическая комиссия считают целесообразным придерживаться пошагового подхода при изучении биоаналогов 9. При этом объем и характер доклинических и клинических исследований зависят от результатов, полученных на предыдущем этапе. Следует отметить, что необходимо учитывать все полученные данные, а не отдавать предпочтение тому или иному аспекту. Цель любых исследований – выявление потенциальных различий между биоаналогом и оригинальным ГИБП и установление клинического значения различий, если, конечно, таковые будут обнаружены [2].
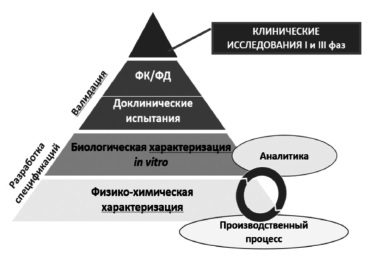
В доклинических исследованиях изучают аминокислотную последовательность, физико-химические свойства, показатели качества белков, подтверждают сопоставимость серий биоаналога и оригинального ГИБП по различным характеристикам, таким как наличие заряженных изоформ, гликозилирование и другие посттрансляционные изменения, составу примесей [8]. Ключевое значение имеет сравнение функциональных свойств ГИБП, таких как связывание моноклональных антител с антигеном-мишенью или Fc-рецепторами, антителозависимая клеточная и комплементзависимая цитотоксичность, активация комплемента [8]. Методы анализа должны быть достаточно чувствительными для выявления различий зависимости активности от концентрации между биоподобным и референтным препаратами. Это означает, что в доклинических исследованиях важно не просто показать наличие у белка определенного свойства, а доказать, что по соответствующему показателю он не отличается от оригинального ГИБП, т.е. является биоподобным.
Такая же цель преследуется в клинических исследованиях, в которых изучают фармакокинетическую и фармакодинамическую эквивалентность биоаналога и оригинального ГИБП (границы сопоставимости по первичным параметрам обычно составляют 80-125%) и подтверждают их сопоставимые клиническую эффективность и безопасность.
Как указано выше, необходимым этапом разработки биоаналога является подтверждение его сопоставимости с оригинальным ГИБП в рандомизированном контролируемом исследовании 3 фазы, которое следует проводить в наиболее “чувствительной» выборке пациентов [2]. Такие исследования должны быть достаточно продолжительными, чтобы изучить сохранение достигнутого ответа в отдаленные сроки и безопасность и иммуногенность более длительной терапии. Одно вре менно сопоставление результатов лечения в более ранние сроки, например, через 8-12 недель, позволяет сравнить скорость действия препаратов сравнения [10]. Выбор критериев эффективности в сравнительных клинических исследованиях должен быть научно обоснованным. При оценке эффективности необходимо свести к минимуму роль факторов, которые зависят от пациента и заболевания.
Любые белки обладают иммуногенностью, т.е. могут вызывать образование антител, в том числе нейтрализующих, которые нивелируют эффективность лечения ГИБП. По иммуногенности биоаналоги могут гипотетически отличаться от оригинальных препаратов, особенно если в процессе их производства используются иные экспрессирующие конструкции, которые могут привести к модификации свойств биологического препарата [8]. Соответственно, при проведении сравнительного клинического исследования необходимо определять общую частоту образования антител и частоту образования как связывающих, так и особенно нейтрализующих антител, а также их влияние на эффективность ГИБП. Изучение иммуногенности более информативно у пациентов, которым ранее не проводилась терапия ГИБП [11]. В идеале они также не должны получать сопутствующую терапию иммуносупрессивными препаратами. Необходимо учитывать, что иммуногенность ГИБП может зависеть от дозы ГИБП, генетических факторов, особенностей заболевания [2]. Например, в сравнительных клинических исследованиях оригинального инфликсимаба и его биоаналога частота антител к инфликсимабу у пациентов с ревматоидным артритом, получавших инфликсимаб в дозе 3 мг/кг и метотрексат, была выше, чем у больных анкилозирующим спондилитом, которым проводили терапию одним инфликсимабом в дозе 5 мг/кг [12,13].
Экстраполяция показаний к применению биоаналого
Нужно ли подтверждать биоподобие биоаналога и референтного препарата по каждому показанию к применению? Некоторые специалисты считают необходимым проводить рандомизированные клинические исследования по каждому зарегистрированному показанию [14,15]. Однако подобная практика представляется чрезмерной. По мнению группы экспертов, если на этапе доклинических исследований доказана эквивалентность качественных и функциональных характеристик, а в рандомизированном клиническом исследовании подтверждена сопоставимость клинической эффективности и безопасности биоаналога оригинальному препарату по крайней мере по одному показанию, то полученные данные могут быть экстраполированы на другие показания, по которым биоаналог не изучался [2]. Данная практика правомочна в отношении тех показаний, при которых механизм действия одинаков. Так, многие ГИБП в ревматологии применяются по различным показаниям, например, ингибиторы ФНО-α используют для лечения ревматоидного артрита, анкилозирующего спондилита, псориатического артрита, а также псориаза и воспалительных заболеваний кишечника. Cпециально изучать фармакокинетические свойства или клиническую эффективность биоаналогов ингибиторов ФНО-α у пациентов со всеми заболеваниями, которые служат показаниями к их применению, не имеет особого смысла, учитывая однотипную роль ФНО-α в иммуновоспалительном процессе [2]. Однако некоторые ГИБП, например, ритуксимаб, используются у пациентов не только с ревматическими, но и онкологическими заболеваниями, что может потребовать проведения отдельных фармакокинетических исследований, учитывая потенциальные различия мишень-опосредованного клиренса.
В настоящее время экстраполяция показаний для биоаналогов стала общемировой практикой, которая позволяет производителю не только сократить затраты на клинические исследования и обеспечить препарату более привлекательную стоимость, но и быстрее внедрить его в клиническую практику.
Переключение пациентов с оригинального препарата на биоаналог
Применение биоаналогов в качестве первого ГИБП получает все большее распространение, так как подобная практика увеличивает доступность современных методов лечения для пациентов и ограничивает рост затрат системы здравоохранения. Однако для практикующего специалиста остро стоит вопрос о возможности переключения пациентов с оригинальных ГИБП на биоаналоги. Этот вопрос изучался в клинических исследованиях 19 и затрагивается в последних международных рекомендациях по ревматоидному артриту [20] и анкилозирующему спондилиту [21]. В клинической практике можно встретить следующие ситуации, связанные с переключениями между референтным препаратом и его биоаналогом.
Российская практика разработки и применения биоаналогов
С 2017 г. в Российской Федерации по ревматическим показаниям зарегистрировано 3 биоаналога ГИБП российского производства: ритуксимаб (Ацеллбия, BIOCAD), инфликсимаб (Инфликсимаб, BIOCAD) и адалимумаб (Далибра, BIOCAD). Разработка и полный цикл локального производства российских биоаналогов позволили выпустить на рынок препараты высокого качества по более конкурентной цене. Ниже мы приводим краткий обзор клинических исследований данных биоподобных препаратов.
Через 24 недели после начала лечения частота улучшения по критериям ACR20 в группе пациентов, получавших биоаналог ритуксимаба, составила 84,1% (95% доверительный интервал [ДИ] 74,8–90,5), а в группе сравнения – 87,0% (95% ДИ 77,7–92,8). Разница между группами была недостоверной (р=0,773) [23]. На втором этапе исследования, когда изучались результаты переключения пациентов, ранее получавших лечение референтным препаратом, на биоаналог, и наоборот, не было отмечено изменений эффективности, безопасности и иммуногенности терапии.
В Российской Федерации зарегистрированные показания к применению референтного ритуксимаба и его биоаналога в ревматологии включают в себя не только ревматоидный артрит, но и АНЦА-ассоциированные васкулиты – гранулематоз с полиангиитом и микроскопический полиангиит. Регистрационное исследование препарата Ацеллбия у пациентов с АНЦА-ассоциированными васкулитами не проводилось, т.е. это показание было зарегистрировано на основании опыта изучения оригинального ГИБП и принципа экстраполяции. Следует отметить, что эффективность и безопасность Ацеллбии были показаны в ретроспективном исследовании у 42 больных АНЦА-ассоциированным васкулитом, выполненном на базе Клиники им. Е.М. Тареева (Москва) [25].
Биоаналог инфликсимаба (Инфликсимаб). Российский биоаналог Инфликсимаб (BCD-055) был зарегистрирован в Российской Федерации на основании результатов двух клинических исследований 3 фазы: ASART-2 (анкилозирующий спондилит) и LIRA (ревматоидный артрит). Биоаналог сравнивали с референтным препаратом Ремикейд® (“МСД Фармасьютикалс»).
В международное многоцентровое, рандомизированное, двойное слепое клиническое исследование ASART2 были включены 199 пациентов с анкилозирующим спондилитом, которых рандомизировали на две группы в соотношении 2:1. Им назначали BCD-055 или Ремикейд в дозе 5 мг/кг в режиме 0–2–6-я неделя, затем каждую 8-ю неделю. Результаты оценивали через 14, 30 и 54 недель у всех рандомизированных пациентов, получивших хотя бы одну дозу инфликсимаба (выборка intent-to-treat; ITT), и через 54 недели у пациентов, завершивших участие в исследовании согласно протоколу (выборка per protocol; РР). Частота ответа по критериям ASAS20 и ASAS40 через 14, 30 и 54 недели была сопоставимой в группах сравнения (р>0,05) [26]. Через 54 недели доля пациентов, достигших ответа по критериям ASAS20 при лечении BCD-055 и Реми кей дом, в выборке ITT составила 67,4% и 52,2%, соответственно (р=0,053), а в выборке РР – 80,9% и 68,6% (р=0,128). Частота ответа по критериям ASAS40 в двух группах составила, соответственно, 53,0% и 38,8% в выборке ITT (р=0,081) и 63,6% и 50,9% в выборке РР (р=0,177) [26].
В многоцентровом исследовании LIRA у 426 пациентов с активным ревматоидным артритом, рандомизированных на две группы в соотношении 2:1 (BCD-055 и Ремикейд), биоаналог инфликсимаба не отличался от референтного ГИБП по частоте ответа по критериям ACR20/50/70 и частоте ремиссии по критерию ACR/ EULAR [27].
Биоаналог адалимумаба (Далибра®). В 2019 году был зарегистрирован российский биоаналог адалимумаба (Далибра®). Регистрационное исследование 3 фазы проводилось у 346 пациентов со средне-тяжелым и тяжелым псориазом, которые были рандомизированы на две группы в соотношении 1:1. В этом исследовании была установлена эквивалентность исследуемого препарата BCD-057 (Далибра®, BIOCAD) оригинальному адалимумабу (Хумира®, Веттер Фарма-Фертигунг Гмбх и Ко.КГ, Германия) по эффективности, безопасности, фармакокинетике и иммуногенности. Также продемонстрировано отсутствие негативного влияния на описанные параметры переключения с оригинального препарата на биоаналог [28]. Весь спектр показаний к применению оригинального препарата был экстраполирован на биоаналог.
Заключение
Выход на рынок биоаналогов и их внедрение в клиническую практику позволяет существенно снизить затраты системы здравоохранения и обеспечить большее число пациентов эффективной терапией. Как правило, в течение 2-3 лет после выхода на рынок биоаналогов наблюдаются следующие тенденции: (1) снижение рыночной стоимости соответствующих МНН; (2) повышение доступности терапии для пациентов без дополнительной нагрузки на государственный бюджет; (3) замещение оригинальных препаратов в государственных закупках биоаналогами. В связи с увеличением частоты использования биоаналогов перед регуляторами встает вопрос о возможной взаимозаменяемости оригинальных препаратов и их копий. В Европейском союзе полномочия по решению этого вопроса переданы на национальный уровень. В настоящее время принято считать, что переключение с референтного препарата на его биоаналог является безопасным и эффективным. Более того, нет оснований предполагать другой кли нический исход при переключении между двумя биоаналогами. Обоснованность данного подхода подтверждается анализом опыта реальной клинической практики и национальных регистров.
Выбор биологического препарата у пациентов с ревматоидным артритом
Ревматоидный артрит – системное аутоиммунное заболевание, характеризующееся воспалительным синовиитом и прогрессирующей деструкцией суставов. У больных ревматоидным артритом отмечается повышенный риск инвалидизации и летальных исходов.
Высокую эффективность в лечении пациентов демонстрирует терапия, направленная на подавление ФНО-α. Помимо ФНО-α важную роль в прогрессии заболевания играют янус-киназы. Барицитиниб представляет собой обратимый ингибитор янус-киназы 1 и 2, эффективность которого исследуется у больных ревматоидным артритом.
Методы
Проведено 52-х недельное двойное слепое исследование RA-BEAM 3 фазы с плацебо контролем и активным контролем с включением 1307 пациентов с активным ревматоидным артритом. До включения в анализ пациенты получали терапию метотрексатом. Больные рандомизированы в соотношении 3:3:2 для получения плацебо (переход на барицитиниб после 24 недели), 4 мг барицитиниба 1 раз в день и адалимумаб 40 мг 1 раз в 2 недели.
Первичной конечной точкой исследования было 20% улучшение заболевания согласно критериям Американского Колледжа Ревматологии (ACR20), Disease Activity Score for 28 joints (DAS28), Health Assessment Questionnaire–Disability Index и Simplified Disease Activity Index на 12 неделе. Также у больных на 24 неделе оценивали рентгенологическую прогрессию повреждений суставов (согласно модифицированной шкале total Sharp/van der Heijde (mTSS); шкала от 0 до 448 баллов, более высокий балл соответствует более выраженным структурным изменениям).
Ревматоидный артрит: современные представления об эволюции болезни и новые возможности фармакотерапии
В обзоре литературы рассматриваются перспективные подходы к лечению и профилактике ревматоидного артрита на основании изучения механизмов развития заболевания.
Ревматоидный артрит (РА) – иммуновоспалительное (аутоиммунное) ревматическое заболевание, характеризующееся тяжелым прогрессирующим поражением суставов и внутренних органов, развитие которого определяется сложным взаимодействием факторов окружающей среды и генетической предрасположенности, ведущих к глобальным нарушениям в системе гуморального и клеточного иммунитета [1]. Эволюция РА включает несколько последовательно (или дискретно) развивающихся стадий. «Преклини чес кие» стадии трансформируются в «симптоматические» и завершаются формированием клинико-лабораторного симптомокомплекса, характерного для раннего, а затем развернутого РА 2. Взаимодействие факторов окружающей среды, генетической предрасположенности и иммунных механизмов, определяющих переход от стадии к стадии, варианты прогрессирования, характер и выраженность внесуставных (системных) проявлений и риск коморбидных заболеваний, до конца не ясны и в настоящее время являются предметом интенсивных исследований [5,6].
Поскольку РА относится к числу классических аутоиммунных заболеваний, гиперактивация В-клеток играет важную роль в иммунопатогенезе заболевания [7,8]. В сыворотке и синовиальной жидкости больных РА выявляют широкий спектр аутоантител с различной специфичностью: ревматоидные факторы (РФ) IgG, IgM и IgA изотипов, представляющие собой антитела к Fc-фрагменту молекулы IgG, и аутоантитела, реагирующие с разнообразными антигенными эпитопами, универсальной характеристикой которых является посттрансляционная модификация (ПТМ), опосредованная их цитруллинированием, а также карбамилированием, ацетилированием, перекисным окислением и др. [9]. Напомним, что цитруллинирование представляет собой биохимический процесс, опосредованный ферментом пептидил аргининдезаминазой (ПАД) 2 и 4 и заключающийся в конверсии кодируемой ДНК положительно заряженной аминокислоты аргинин в аминокислоту цитруллин, обладающую нейтральным зарядом. Карбамилирование – химическая реакция, опосредуемая цианидом и вызывающая конверсию лизина в гомоцитруллин. В целом, аутоантитела с той или иной специфичностью обнаруживаются более, чем у 80% пациентов, страдающих РА. Следует напомнить, что IgM РФ и антитела к цитруллинированным белкам (АЦБ) являются основными лабораторными диагностическими маркерами РА, включенными в классификационные критерии этого заболевания (ACR/EULAR, 2010) [10]. Гиперпродукция АЦБ (особенно в комбинации с РФ) ассоциируется с активностью заболевания, прогрессированием деструкции суставов 12, внесуставными (системными) проявлениями [12], риском общей смертности, связанной с развитием коморбидных состояний, в первую очередь, сердечно-сосудистых осложнений [14,15], «резистентностью» или, напротив «чувствительностью» к терапии базисными противовоспалительными препаратами (БПВП) и генно-инженерными биологическими препаратами (ГИБП) [16]. Выделяют два основных клинико-иммунологических субтипа РА: АЦБ-позитивный и АЦБ-негативный. Они отличаются по молекулярным механизмам развития, факторам генетической предрасположенности (HLADR и др.) и окружающей среды (курение, периодонтит, патология легких и др.), тяжести течения и эффективности проводимой терапии [17,18]. Принципиальное значение имеет тот факт, что РФ и антитела к ПТМ белкам могут определяться в сыворотках пациентов c РА (и здоровых кровных родственников больных РА), а также у пациентов с артралгией или неспецифическими мышечно-скелетными симптомами за много лет до появления клинических симптомов РА [19]. Гипер про дукция антител рассматривается как важное доказательство существования «преклинической» системной «аутоиммунной» фазы РА [6,17].
Важной характеристикой патогенных АЦБ при РА является нарушение гликозилирования (процесс при соединения моносахаридов к белку) Fc фрагмента молекулы Ig с формированием так называемого «провоспалительного фенотипа» этих антител [20]. Один из механизмов цитруллинирования белков связан с активацией NETosis (neutrophil extracellular trap – нейтрофильная внеклеточная ловушка) нейтрофилами, коррелирующей с гиперпродукцией АЦБ и маркерами системного воспаления [21].
В последние годы накоплено много данных, свидетельствующих о том, что АЦБ (и РФ) являются не только чувствительным и специфичным биомаркером РА (невинный свидетель – innocent bystander), но могут иметь патогенетическое значение, выступая в роли дополнительных медиаторов боли, воспаления и деструкции костной ткани [22,23]. Установлено, что АЦБ, взаимодействуя с виментином, присутствующим на мембране предшественников остеокластов, обладают способностью индуцировать дифференцировку остеокластов посредством стимуляции синтеза фактора некроза опухоли (ФНО)-α и хемокина интерлейкина (ИЛ)-8 и тем самым стимулировать резорбцию костной ткани. По данным экспериментальных исследований, АЦБ могут вызывать болевые ощущения (механическая и термальная гиперчувствительность) при отсутствии признаков воспаления [24]. Этот эффект опосредуется ИЛ-8 зависимым механизмом. Недавно получены данные, свидетельствующие об активации оси ИЛ-23/Th17 клетки [25], как фактора формирования «провоспалительного» потенциала АЦБ [26]. Установлено, что ИЛ-23 обладает способностью индуцировать «провоспалительный» профиль гликозилирования молекулы IgG за счет подавления экспрессии фермента b-галактозид-α2,6-сиалилтрансферазы (St6gal1) в плазмабластах и плазматических клетках в продромальную фазу экспериментального артрита и у пациентов с ранним РА. Это соответствует результатам исследований, свидетельствующих о низкой эффективности моноклональных антител к ИЛ-17 или ИЛ-17 рецепторам при развернутом РА [27].
Рассматривая факторы, индуцирующие цитруллинирование, как потенциальный механизм формирования аутоантигенного репертуара, в первую очередь обращается внимание на курение, которое вызывает образование цитруллинированных белков [28]. У здоровых людей (без клинических признаков поражения суставов), в сыворотках которых обнаруживаются РФ и/или АЦБ, при компьютерной томографии с высоким разрешением выявляют нарушения структуры легочной ткани [29]. Наряду с тканью легких, важным местом образования ПТМ белков является ткань десен. Во многих исследованиях было показано увеличение распространенности РА у пациентов с периодонтитом, а также связь между развитием периодонтита, серопозитивностью по РФ/АЦБ и активностью РА [30]. Полагают, что это связано со способностью Porphyro monas gingivalis (периодонтальный патоген) активировать цитруллинирование белков-мишеней для АЦБ (фибриноген, α-энолазы). Другим «патогеном», индуцирующим эндоцитруллинирование, является Aggregati bac ter actinomycetemcomitants.
Среди генетических факторов предрасположенности к развитию РА лучше всего изучены антигены класса II главного комплекса гистосовместимости (ГКГ) (HLADR1) в рамках концепции «общего» (shared) эпитопа (SE) [31]. Установлено, что специфическая аминокислотная последовательность, локализующаяся в антигенсвязывающем участке HLA-DRB1*01, *04 и *010 (а также, вероятно, некоторых молекул HLA класса 1), ассоциируется с риском развития АЦБ-позитивного РА. Молекулярной основой для данной ассоциации является тот факт, что положительный заряд этого участка молекулы HLA блокирует связывание аргинин-содержащих пептидов, но облегчает (и усиливает аффинность) взаимодействие с пептидами, содержащими цитруллин [32]. В процессе широкомасштабного скрининга генома у пациентов с РА получены данные о роли других генов [33], к которым относятся гены, участвующие в активации Т-клеток – PTPN22 (protein tyrosine phosphatase, non-receptor type 22), CTLA4 (cytotoxic T-lymphocyte-associated protein 4) и STAT4 (signal transducer and activator of transcription 4) [33]. Особое внимание привлечено к полиморфизму PTPN22, от которого зависят «порог активации» Т-клеток и негативная селекция В-клеток, а, следовательно, формирование «аутоиммунного» ре пер туара Т- и В-лимфоцитов. Недавно было показано, что у пациентов, имеющих факторы риска развития РА, наблюдается нарушение функциональной активности PTPN22, ведущее к гиперцитруллинированию белков мононуклеарных клеток периферической крови [34].
Клинические перспективы
В течение последнего десятилетия, благодаря расшифровке ведущих иммунных механизмов развития РА, для лечения этого заболевания разработан (и продолжают разрабатываться) широкий спектр инновационных лекарственных препаратов. К ним относятся ГИБП (моноклональные антитела и рекомбинантные белки, блокирующие активность «провоспалительных» цитокинов и/или патологическую активацию Т- и В-лимфоцитов), и новые синтетические препараты (так называемые «малые молекулы»), интерферирующие с внутриклеточными сигнальными белками, регулирующими синтез медиаторов воспаления 37. Наряду с разработкой новых лекарственных препаратов, совершенствуется стратегия фармакотерапии РА, сформулированная в рамках концепции «Лечение до достижения цели; Treat To Target». Она базируется на ранней диагностике РА, определяющей возможность инициации активной тщательно контролируемой (tight control) противовоспалительной терапии БПВП, в первую очередь метотрексатом (МТ), а при необходимости ГИБП, начиная с дебюта болезни («окно возможности») [38] и даже на «преклинической» стадии в рамках профилактики этого заболевания [39]. Однако, несмотря на большие успехи в лечении РА, которые привели к кардинальному улучшению прогноза у многих пациентов, проблема фармакотерапии РА далека от решения [40]. Это определяется отсутствием чувствительных и специфичных диагностических и прогностических биомаркеров на ранней стадии заболевания и, что самое главное, гетерогенностью механизмов развития как в дебюте, так и в процессе прогрессирования РА, затрудняющей персонификацию терапии у пациентов [41,42]. Более того, стало очевидным, что селективное блокирование медиаторов воспаления с использованием инновационных лекарственных препаратов нередко ассоциируется с «первичной» неэффективностью, «вторичной» резистентностью, развитием генерализованной иммуносупрессии (как это может наблюдаться на фоне лечения БПВП и глюкокортикоидами), парадоксальной активацией аутоиммунного процесса и утяжелением течения сопутствующих заболеваний. В то же время, поиск новых «мишеней» для фармакотерапии РА затруднен, поскольку характер иммунопатологических нарушений у пациентов может существенно отличаться от воспалительного процесса, который имеет место при моделировании артрита у лабораторных животных [43].
Препараты, ингибирующие ФНО-α, используются для лечения РА на протяжении многих лет и фактически являются родоначальниками направления терапии, связанного с применением ГИБП при этом заболевании [44]. Ингибиторы ФНО-α дают многообразные эффекты на ревматоидное воспаление: подавление активации стромальных клеток, выживаемости воспалительных клеток, синтеза воспалительных медиаторов (цитокины, хемокины, липидные медиаторы), матриксных металлопротеиназ, ангиогенеза (активация эндотелиальных клеток, неоваскуляризация, экспрессия клеточных молекул адгезии), лимфоангиогенеза, костного метаболизма (остеокласт-опосредованная костная резорбция), гиперноцицепции (центральная и периферическая сенситизация нейронов и др.), нормализация функции Т регуляторных (рег) клеток [45]. В то же время необходимо принимать во внимание важнейшие гомеостатические функции ФНО-α – защиту от экзогенных и эндогенных патогенов, участие в органогенезе и лимфогенезе, регенерации тканей (нервная и хрящевая ткани, ремоделирование кардиомиоцитов и др.), подавление туморогенеза, иммунорегуляцию (десентитизация макрофагов, апоптоз воспалительных клеток). Очевидно, что подавление гомеостатических эффектов ФНО-α может приводить к развитию характерных для ингибиторов ФНО-α нежелательных реакций: инфекционные осложнения (в том числе оппортунистические инфекции), реактивация туберкулезной инфекции, индукция аутоиммунных реакций (волчаночно-подобный синдром, демиелинизация, псориаз, саркоидоз), увеличение риска злокачественных новообразований, в первую очередь лимфопролиферативных опухолей [46]. Рациональная стратегия, направленная на повышения эффективности фармакотерапии ингибиторами ФНО-α (как и другими ГИБП), в первую очередь связана с их комбинацией с МТ, обладающим синергическими механизмами действия с этими препаратами и подавляющим их иммуногенность (синтез анти-лекарственных антител) [47]. Недостаточная эффективность ингибиторов ФНО-α при РА может быть связана с существованием определенных ФНО-зависимых субтипов РА, генетическими факторами, ассоциирующимися с эффективностью или резистентностью к терапии, различной ролью ФНО-α на разных стадиях заболевания (ранняя и поздняя) и/или существованием реципрокных «обратных связей» между ФНО-α и другими «провоспалительными» цитокинами в рамках «цитокиновой сети». ФНО-α проявляет выраженный синергизм в отношении провоспалительной и деструктивной активности с другим важнейшим провоспалительным цитокином – ИЛ-17, а на фоне лечения ингибиторами ФНО-α наблюдается увеличение числа Th17 клеток и концентрации ИЛ-17 в сыворотке крови, ассоциирующееся с резистентностью к терапии этими препаратами. Это создает основу для разработки нового подхода к лечению РА, связанного с «двойным» ингибированием ФНО-α и ИЛ-17 с использованием «биспецифических» антител [48]. В настоящее время в процессе лабораторных и ранней стадии клинических исследований находятся несколько биспецифических антител к ИЛ17/ФНО-α. Особый интерес представляют исследования российских ученых («БИОКАД»), которые разработали биспецифические моноклональные антитела к ФНО-α и ИЛ-17 (BCD-121). По данным экспериментальных исследований, BCD-121 демонстрирует противовоспалительную активность в тестах in vitro и in vivo, причем специфическая активность BCD-121 в отношении мишеней ФНО-α и ИЛ-17 выше, чем у моноклональных антител к ФНО-α (адалимумаб) и моноклональных антител к ИЛ-17. Альтер нативная возможность повышения эффективности и безопасности ингибиторов ФНО-α основана на разработке нового поколения препаратов, селективно подавляющих «провоспалительную» биоактивность ФНО-α, не затрагивая гомеостатические функции этого цитокина [45]. Это связано с функциональной дихотомией сигнальных путей, опосредуемых ФНО рецепторами (Р) типа 1 (патогенетические) и типа 2 (гомеостатические). В настоящее время сконструированы ингибиторы ФНОα, блокирующие в первую очередь ФНОР1 и являющиеся селективными агонистами ФНОР2 или объединяющие функции антагонистов/агонистов соответствующих ФНОР.
ИЛ-6 – плейотропный цитокин, который синтезируется многими иммунными клетками и проявляет многообразные провоспалительные биологические эффекты, занимающие важное место в иммунопатогенезе РА [49]. С позиций разработки ингибиторов ИЛ-6 необходимо иметь в виду, что этот цитокин осуществляет передачу внутриклеточного сигнала двумя путями: классическая сигнализация, обусловленная связыванием ИЛ-6 с мембранным (м) ИЛ-6 рецептором (Р), и транс-сигнализация (trans-signalling). Для понимания сути этой проблемы необходимо напомнить, что ИЛ-6Р не имеет тирозинкиназного домена и поэтому не участвует в передаче внутриклеточного сигнала, для чего необходим другой белок, представляющий собой мембранный гликопротеин с молекулярной массой 130 кДа, – gp130 (ИЛ-6Рb цепь, CD130). При этом, наряду с мИЛ-6Р, существует растворимая (р) форма ИЛ-6Р (без трансмембранного и цитоплазматического доменов), которая образуется за счет протеолитического расщепления, опосредуемого ферментами ADAM-17 и ADAM10 (a disintegrin and metalloproteinase domain). Связывание рИЛ-6Р с ИЛ-6 приводит к образованию комплекса, который обладает способностью связываться с gp130 и индуцировать передачу ИЛ-6 зависимого активационного сигнала (транс-сигнализация) в клетках, не экспрессирующих мИЛ-6Р. Оба пути сигнализации проводят к активации JAK (Janus family tyrosine kinase) тирозин киназы (JAK1, JAK2 и Tyk2), в свою очередь, вызывающей рекрутирование и фосфорили рование факторов транскрипции STAT-1 и STAT-3, которые регулируют синтез широкого спектра провоспалительных медиаторов. Полагают, что транс-сигнализация ИЛ-6, связанная с экспрессией gp130, лежит в основе патогенных провоспалительных эффектов ИЛ-6, в то время как классическая сигнализация, опосредуемая ИЛ-6Р, в большей степени участвует в регуляции гомеостаза, в том числе острого воспаления (как защитной реакции организма на повреждение тканей), гемопоэза, метаболизма липидов, глюкозы, целостности эпителиального барьера. Наиболее хорошо охарактеризованным ингибитором ИЛ-6 является тоцилизумаб (ТЦЗ) – гуманизированные моноклональные антитела к ИЛ-6Р [37]. В настоящее время разработано несколько ГИБП, специфичных как в отношении ИЛ-6Р, так и самого ИЛ-6 [50]. Каковы патогенетические и клинические различия между блокированием ИЛ-6Р или самого ИЛ6 при РА и как это может повлиять на выбор препарата в контексте персонифицированной терапии, не ясно, поскольку все эти препараты обладают способностью подавлять как классическую сигнализацию, так и «транс-сигнализацию», опосредуемую ИЛ-6. В связи с этим особый интерес представляет изучение клинической эффективности селективного блокирования «транс-сигнализации» ИР-6 с помощью растворимого gp130 рекомбинантного белка (оламкицепт) или моноклональных антител, подавляющих связывание gp130 с комплексом ИЛ-6/ИЛ-6Р [50].
По современным представлениям патологическая активация и экспансия Th17 клеток – основной источник семейства «провоспалительных» цитокинов ИЛ-17А→ИЛ-17F, играет ведущую роль в развитии РА и других иммуновоспалительных заболеваний [51,52]. Эти цитокины (в первую очередь ИЛ-17А) дают разнообразные (плейотропные) эффекты на различные клеточные популяции, что и определяет фундаментальное физиологическое (защита от инфекций) и патофизиологическое (хроническое иммунное воспаление) этого класса цитокинов. В настоящее время проведено большое число исследований, убедительно свидетельствующих о важной роли ИЛ-17 в иммунопатогенезе РА [53]. Это послужило стимулом для разработки ГИБП, действие которых основано на блокировании патологических эффектов ИЛ-17 и других цитокинов (ИЛ-23, ИЛ-22 и др.), участвующих в активации Th17 клеток. Однако, как уже отмечалось, результаты клинических исследований свидетельствует о низкой (или умеренной) эффективности моноклональных антител к ИЛ-17 или к ИЛ-17Р при РА [27,53], что контрастирует с выраженным положительным эффектом этих препаратов при псориатическом артрите, анкилозирующем спондилите, а также псориазе. Это может быть связано с тем, что активация оси ИЛ-17/ИЛ-23 имеет патогенетическое значение в первую очередь на самых ранних стадиях РА [26], а именно в период формирования «провоспалительного» потенциала АЦБ [25], играющих важную роль в иммунопатогенезе РА. Таким образом, место ГИБП, блокирующих ИЛ-17 и/или ИЛ-23, при РА требует дальнейшего изучения.
Гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) – провоспалительный цитокин, участвующий в дифференцировке и пролиферации миелоидных клеток, включая нейтрофилы, дендритные клетки (ДК) и макрофаги, миграции и пролиферации клеток сосудистого эндотелия (ЭК) [54]. ГМ-КСФ синтезируется миелоидными клетками, лимфоцитами, хондроцитами, фибробластами, остеобластами и ЭК и индуцируется липополисахаридом (ЛПС), ФНО-α, ИЛ-1, ИЛ-23. Связывание ГМ-КСФ с гетеродимерным рецептором ГМ-КСФ индуцирует активацию JAK-STAT, а также PIK3K (phosphoinositide-3kinase) и MAPK (mitogen-activated protein kinase) сигнальных путей. ГМ-КСФ усиливает эффекторные функции нейтрофилов и макрофагов, экспрессию клеточных молекул адгезии, синтез провоспалительных цитокинов, активацию макрофагов. Кроме того, ГМ-КСФ участвует в развитии, созревании, антиген-презентирующей функции и синтезе цитокинов ДК. ГМ-КСФ экспрессируется в синовиальной мембране у пациентов с РА и присутствует в высокой концентрации в синовиальной жидкости. В опытах in vitro было показано, что ГМ-КСФ индуцирует пролиферацию синовиальных фибробластов и резистентность ДК к иммуносупрессивному действию «противовоспалительного» цитокина ИЛ-10. Все это вместе взятое позволяет рассматривать ГМ-КСФ как перспективную мишень для лечения РА. Маврили мумаб (МАВ) представляет собой моноклональные антитела против α-цепи рецептора ГМ-КСФ. В серии исследований было показано, что на фоне лечения МАВ наблюдается снижение активности РА, при этом развития тяжелых нежелательных реакций отмечено не было [55]. Другой препарат этого класса намилумаб (AMG203; namilumab) по данным рандомизированных клинических исследований фазы 1b эффективно контролирует воспаление суставов при РА [56].
Как уже отмечалось, среди многообразных меха низмов развития РА особое внимание привлечено к патологической активации В-клеток, ведущей к гиперпродукции патогенных аутоантител (РФ, АЦБ и др.), активации аутореактивных Т-клеток, синтезу провоспалительных цитокинов и хемокинов (ИЛ-6, ФНО-α, ИЛ12 и др.). Это послужило теоретической базой для успешного применения ритуксимаба (РТМ) (химерные моноклональные антитела к CD20 антигену В-лим фоцитов) при РА и других иммуновоспалительных заболеваниях, характеризующихся гиперпродукцией аутоантител [57,58]. Наряду с РТМ, разработаны другие моноклональные антитела, вызывающие деплецию или модуляцию функциональной активности В-клеток [59], которые условно подразделяют на 2 основные категории: тип I и тип II. Антитела типа I распознают CD20 в липидных рафтах (микродомены плазматической мембраны клеток, обогащенные гликосфинголипидами и холестерином) и, связываясь с C1q компонентом комплемента, индуцируют комплемент-зависимую клеточную цитотоксичность (КЗКЦ) и в меньшей степени антитело-зависимую (IgG Fс) клеточную цитотоксичность (АЗКЦ). Напротив, антитела типа II взаимодействуют с участком CD20, который находится вне липидного рафта, плохо связываются с C1q, но являются сильными индукторами клеточной гибели, связанной с CD20-зависимой сигнализацией. В настоящее время разработано два новых представителя моноклональных антител к CD20 типа I – окрелизумаб и офатумумаб. Как и РТМ, офатумумаб вызывает деплецию В-клеток за счет КЗКЦ и АЗКЦ, но распознает другой эпитоп CD20. Этот препарат проходит апробацию при РА в рамках клинических исследований фазы III. Испытание моноклональных антител типа II при РА пока не планируется. Другими потенциальными В-клеточными мишенями являются CD19 и FcgRIIB (immunoreceptor tyrosine-based inhibitory Motif [ITIM]-contaning inhibitor receptor) и BAFF/APRIL (B cell activating factor/a proliferation-inducing ligand). Особый интерес представляют BAFF/APRIL, которые принадлежат к суперсемейству ФНО. Моноклональные антитела к BAFF (белимумаб, табалумаб) оказались весьма эффективными при системной красной волчанке (СКВ), но не продемонстрировали противовоспалительной активности при РА [60]. Другой препарат, одномоментно блокирующий BAFF и APRIL, атацицепт также оказался неэффективным при РА (в том числе в комбинации с РТМ), а его применение ассоциировалось с нарастанием риска инфекционных осложнений [61,62].
В настоящее время доказана важная роль Трег в контролировании прогрессирования воспаления при РА [63,64]. Примечательно, что многие лекарственные препараты, используемые для лечения РА (МТ, ингибиторы ФНО-α, ТЦЗ), обладают способностью восстанавливать супрессорную функцию Трег, что коррелирует с их противоспалительными эффектами [64]. Проводятся исследования, направленные на разработку подходов к коррекции дефектов Трег при РА. В опытах in vitro было показано, что моноклональные антитела к CD28 (TGN141112/TABQ8), обладающие свойствами «суперагониста» CD28, способны восстанавливать функцию Трег при РА [65]. В то же время необходимо иметь в виду, что попытка назначения высоких доз этих антител здоровым добровольцам привела к развитию тяжелой нежелательной реакции – синдрома «высвобождения цитокинов». Другой препарат трегализумаб, представляющий собой гуманизированные моноклональные антитела против уникального эпитопа CD4 Т-клеток, расположенного в IgG-подобном домене 1 С2 типа, обладает способностью активировать Трег клетки [66]. Однако, несмотря на положительные результаты рандомизированного, плацебо-контролируемого исследований фазы I и фазы II (TREAT 2b), дальнейшие испытания этого препарата при РА приостановлены.
К крупным достижениям фармакологии 21 века относится разработка нового класса лекарственных препаратов, представляющих собой низкомолекулярные (

