бисглицинат железа чем лучше
Эффективность и переносимость препаратов железа. Что важнее? Существует ли оптимальное решение?
Опубликовано в журнале:
Поликлиника 2/2014
Н.И. Стуклов, д.м.н., профессор кафедры госпитальной терапии РУДН, руководитель курса гематологии и клинической базы кафедры
М.Ю. Кунина, врач гематолог ООО Клиники «Будь здоров»
Е.Н. Семенова, учебный мастер кафедры госпитальной терапии РУДН Эффективность терапии железодефицитной анемии определяется не только биодоступностью железа из препарата, но также зависит от приверженности к лечению самого больного, на что существенным образом влияет переносимость препарата и стоимость лечения. Эффективность препаратов, содержащих двухвалентное железо доказана в многочисленных исследованиях (степень доказательности 1А) и не вызывает сомнения. Препараты на основе трехвалентного железа лучше переносятся, но не всегда эффективны и требуют более длительных курсов лечения. Благодаря уникальному составу (глюконат железа II + глюконат меди + глюконат марганца), препарат Тотема («Laboratoire Innotech International», Франция) позволяет быстро восстанавливать концентрацию гемоглобина и депо железа и при этом обладает хорошей переносимостью. Более того, Тотема может применяться в более низких дозах, чем сульфат железа без потери эффективности лечения. Медь и марганец входят в активные центры белков, обеспечивающих активный транспорт железа в кишечнике и быструю утилизацию, поступившего в кровь железа, тканями. Они входят в состав основных белков антиоксидантной защиты. Также марганец участвует в синтезе гемоглобина, регулирует поступление железа в митохондрии. Сравнение результатов трех мета-анализов показало, что Тотема обладает лучшей переносимостью (частота побочных эффектов 10,4%), чем сульфат железа II (34,1% и 20,4%; р
Эффективность и безопасность препаратов трехвалентного железа в лечении железодефицитной анемии
Рассмотрено применение препаратов железа на основе гидроксид-полимальтозного комплекса в лечении железодефицитной анемии. Показано, то они сопоставимы по эффективности с солевыми препаратами железа, но при их использовании значительно реже возникают нежел
Application of iron preparations based on hydroxide-polimaltosis for complex treatment of iron-deficiency anemia is examined. It is stated that in terms of efficiency they can be compared with the salt preparations of iron, but with their use undesirable phenomena appears considerably more rarely.
В настоящее время фармацевтическая промышленность выпускает довольно большое количество препаратов железа для лечения железодефицитной анемии (ЖДА) и продолжается разработка новых препаратов. Возникла необходимость классифицировать препараты железа (рис. 1) и описать их свойства для того, чтобы облегчить выбор. В зависимости от способа введения в организм препараты железа делятся на пероральные и парентеральные (внутривенные, внутримышечные). Пероральные препараты могут содержать различные соли железа (молекулы небольшого размера) или гидроокись железа с полимальтозным комплексом (молекулы большого размера, более 50 кД). Пероральные препараты железа могут быть простыми, т. е. содержащими только соединение железа, или комбинированными с добавлением других веществ (аскорбиновой кислоты, фолиевой кислоты, витамина В12, микроэлементов и других веществ). Комплексы железа для внутривенного введения могут содержать декстран (высокомолекулярный или низкомолекулярный), сахарозу или карбоксимальтозу.
Многие годы «золотым стандартом» среди пероральных препаратов железа являлся сульфат железа. Последний представляет собой солевой препарат железа, который недорог в производстве и, соответственно, имеет невысокую стоимость. Кроме того, оказалось, что сульфат железа обладает высокой всасываемостью в организме, которая выше, чем у глюконата, хлорида или фумарата железа. По этой причине в настоящее время выпускается большое количество препаратов железа, содержащих сульфат железа (Актиферрин, Гемофер пролонгатум, Сорбифер Дурулес, Тардиферон, Ферроплекс, Ферроградумет, Ферро-Фольгамма и др.) [1].
При использовании солевых препаратов железа возможно локальное раздражение слизистой оболочки желудка в месте растворения препарата и слизистой оболочки двенадцатиперстной кишки, где преимущественно происходит всасывание препарата. Процесс всасывания является пассивным, быстрым и дозозависимым. В связи с низкой молекулярной массой солевые препараты железа могут всасываться в большом количестве, приводя к опасным для организма концентрациям, что может вызвать интоксикацию и отравление. Диссоциация солей двухвалентного железа происходит в желудочно-кишечном тракте и сопровождается выделением свободных ионов железа. Следующим процессом метаболизма солевых препаратов железа является окисление, которое осуществляется также в желудочно-кишечном тракте и заключается в переходе двухвалентного железа в трехвалентное. Последнее поступает в кровь и в плазме связывается с транспортным белком — трансферрином и в виде этого комплекса (металлопротеина) направляется в костный мозг и органы депо железа (печень, селезенка). Возврат железа из этих органов осуществляется через лимфатическую систему. Нарушение процесса окисления приводит к высвобождению электронов, образованию свободных радикалов, активации перекисного окисления липидов, повреждению клеток паренхиматозных органов.
В процессе лечения ЖДА солевыми препаратами железа могут возникнуть следующие проблемы:
.jpg)
Препараты железа на основе ГПК обладают следующими свойствами и преимуществами перед солевыми препаратами железа [5]:
На сегодняшний день в арсенале врача имеются современные препараты трехвалентного железа на основе различных полисахаридных комплексов [1]: пероральные препараты железа на основе ГПК (Мальтофер, Мальтофер Фол, Феррум Лек); препараты железа на основе ГПК (Феррум Лек — раствор для внутримышечного введения); препараты железа на основе гидроксид сахарозного комплекса (Венофер — раствор для внутривенного введения); препараты железа на основе карбоксимальтозата (Феринжект) и другие.
Международной тенденцией является смена солевых препаратов железа на препараты железа на основе ГПК [6].
ЖДА — самое «благодарное» гематологическое заболевание и должна вылечиваться сразу и навсегда, что и наблюдается в большинстве случаев. Причинами неуспешного лечения ЖДА препаратами железа являются:
Лечение латентного дефицита железа (ЛДЖ), который рассматривается как предстадия ЖДА и характеризуется снижением запасов железа в депо при нормальной концентрация гемоглобина, проводится пероральными препаратами железа в 50-процентной дозировке в течение 2 мес [9]. Основная задача лечения ЛДЖ — пополнить запасы железа в депо и не дать этому состоянию перейти в ЖДА.
.gif)
Особенностью лечения указанных двух форм дефицита железа (ЛДЖ и ЖДА) является длительное применение пероральных препаратов железа, при котором часто возникают указанные выше нежелательные явления [11].
Показано, что препараты железа на основе ГПК обладают сходной с сульфатом железа биодоступностью [12], обладают стабильной структурой молекулы, имеют контролируемую абсорбцию железа из комплекса [13]. Метаанализ сравнительных исследований [14] подтвердил одинаковую эффективность препаратов железа на основе ГПК и сульфата железа в лечении ЖДА.
В литературе имеется большое количество работ, в которых сравнивается эффективность и переносимость различных солевых препаратов железа и препаратов железа на основе ГПК. Однако лишь недавно были опубликованы результаты рандомизированных исследований, которые являются наиболее доказательными в медицине. Например, в работе B. Yasa и соавт. [15] проведено сравнение эффективности лечения ЖДА и переносимости препаратов железа. Больные были рандомизированы на 2 группы: 1-я группа (52 пациента) получала лечение препаратом железа на основе ГПК в дозе 5 мг/кг в сутки в 1 прием, 2-я группа (51 больной) — сульфат железа в дозе 5 мг/кг в сутки в 2 приема. Эффективность лечения оценивали по приросту концентрации гемоглобина в двух точках — к концу 1-го и к концу 4-го месяцев лечения. Прирост концентрации гемоглобина у пациентов, которые получали препарат железа на основе ГПК, к концу 1-го и 4-го месяца в среднем составил 12 ± 9 и 23 ± 13 г/л соответственно (в обоих случаях р = 0,001 по сравнению с исходной концентрацией гемоглобина), а у пациентов, которые получали сульфат железа, — 18 ± 17 и 30 ± 23 г/л соответственно (в обоих случаях р = 0,001 по сравнению с исходной концентрацией гемоглобина). Статистически значимых различий между группами не получено. Переносимость препаратов оценивали с помощью регистрации нежелательных явлений (боли в животе, тошнота, запоры или сочетание этих симптомов). Нежелательные явления были зарегистрированы у 26,8% пациентов, которые получали препарат железа на основе ГПК, и у 50,8% пациентов, которые получали сульфат железа (р = 0,012).
Таким образом, препараты железа на основе ГПК сопоставимы по эффективности с солевыми препаратами железа, но при их использовании значительно реже возникают нежелательные явления, что обосновывает все возрастающий интерес врачей к препаратам этой группы.
Литература
* ФНКЦ ДГОИ им. Дмитрия Рогачева МЗ РФ,
** ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
Стоит ли пить добавки с железом?
Почему возникает дефицит
Самая частая причина — кровопотери, например из-за травмы или болезни кишечника, а также из-за слишком сильных менструальных кровотечений.
«Дефицит железа лежит в основе более половины анемий, — говорит к. м. н. кардиолог и диетолог, GMS Clinic Наталья Поленова. — Основные причины дефицита железа: несбалансированная диета, нарушение всасывания, циклические кровопотери у женщин репродуктивного возраста, донорство, беременность, лактация, быстрый рост в пубертатном периоде».
Вторая причина — плохое всасывание железа. Это может происходить при приеме лекарств, хронических болезнях кишечника, воспалениях или генетических нарушениях.
Гематолог ФГБУ «НМИЦ Гематологии» Минздрава России уточняет, что железодефицитные состояния возникают при многих заболеваниях с нарушениями всасывания, начиная от серьезных онкологических и заканчивая гельминтозами и наличием бактерий Helicobacter pylori, которые поглощают железо.
Как узнать о наличии анемии
Обычно на начальных стадиях железодефицитные состояния внешне не проявляются. Но могут появиться незначительные симптомы, которые обычно игнорируются и приводят к дальнейшему развитию болезни.
«При недостатке железа нарушается процесс образования белка, который переносит кислород к клеткам — гемоглобина. Когда его мало снижается работоспособность, повышается усталость, возникают одышка, головокружения и обмороки при незначительных нагрузках», — говорит гематолог.
Узнать о недостатке железа в организме можно только по анализу крови. Сдавать его имеет смысл если появились все симптомы без видимой на то причины.
В списке анализов обязательно должны быть тест на уровень гемоглобина, гематокрит, средний объем эритроцитов (MCV) и среднее содержание гемоглобина в эритроцитах (MCH).
Наталья Поленова отмечает, что назначения одного общего анализа крови с оценкой уровня гемоглобина часто бывает недостаточно, особенно для женщин или людей с хронической сердечной недостаточностью.
Только врач может, изучив анализы, выявить причину дефицита и назначить лечение.
Кому и как нужно принимать железо
Без одобрения врача — никому. Витамины и БАДы с дополнительным железом могут быть опасны. Например у людей с нарушением обмена железа, его излишки в рационе приводят к развитию цирроза печени, сахарного диабета и кардиомиопатий.
«Перегрузка железом из-за необдуманного приема препаратов ведет к очень опасным последствиям. В практике несколько раз встречались пациенты с перегрузкой железа. Их печень больше похожа на металлический таз», — рассказывает гематолог.
При наличии железодефицитной анемии простой диеты или БАДов будет мало. Такие серьезные состояния лечат с помощью инъекций железа и лекарственных препаратов.
Если в анализах врач увидит небольшой дефицит железа, то лучше всего его регулировать с помощью добавления продуктов содержащих железо. Оно в пище бывает гемовое — легкоусвояемое и негемовое — трудноусвояемое. Гемовое железо содержится в мясе, птице, рыбе и морепродуктах. Оно легко усваивается и не зависит от других пищевых факторов.
«Главные источники пищевого железа — красное мясо и субпродукты, особенно, печень, — говорит Наталья Поленова. — Железа в них много, и оно хорошо усваивается. Далее по списку следуют рыба и морепродукты, в особенности сардины, тунец, креветки, мидии и моллюски. Кроме самой рыбы, довольно много железа содержится в ее икре».
Негемовое железо содержится в основном в растительных продуктах. Но для того чтобы организм усвоил его нужна помощь органических кислот, прежде всего аскорбиновой.
Поленова уточняет, что из растительных продуктов больше всего железа в свекле, спарже, цветной и белокочанной капусте и шпинате. Но для успешного усвоения понадобятся, например, цитрусовые соки. При составлении рациона нужно учитывать, что железо усваивается из пищи на 10–15%.
Применение бисглицината железа у беременных и кормящих женщин
Несмотря на возросший уровень жизни, железодефицитная анемия (ЖДА) продолжает занимать ведущую позицию в структуре заболеваемости во всем мире. Распространённость анемии во время беременности значительно варьирует из-за различий в социально-экономических условиях, стиле жизни и практик по улучшению здоровья, применяемых в разных странах. По подсчётам ВОЗ, у 41,8% беременных женщин в мире наблюдается концентрация гемоглобина, указывающая на наличие анемии, что составляет 56 миллионов человек [1].
Уровни распространённости анемии среди беременных женщин варьируют в пределах 17,3–30,8% для Америки, 18,6–31,6% для Европы, 43,9–52,5% для Юго-Восточной Азии и 52,8–61,3% для Африки [1]. Экспертами ВОЗ опубликованы уровни значимости анемии для общественного здоровья и оценка количества стран относительно встречаемости анемии при беременности (таблица 1) [1,2].
анемии в популяции (%)
Уровень значимости для общественного здоровья
Не представляет значимости для
Представляет умеренную значимость для общественного здоровья
Значима для общественного здоровья
Представляет высокую значимость для
Опубликованные данные свидетельствуют о том, что у 2–7% беременных женщин концентрация гемоглобина составляет менее 70 г/л, и, вероятно у 15–20% уровень гемоглобина составляет менее 80 г/л [3,4]. Совет экспертов ВОЗ считает тяжелую анемию одной из основных причин материнской смертности в мире [5]. Кроме того, материнская анемия все еще является причиной высокой перинатальной заболеваемости и смертности [6, 7, 8].
По данным различных авторов до 95% случаев анемии у беременных женщин связаны с ДЖ [9,10]. К другим причинам анемии при беременности относят дефицит фолатов и витамина В12, гемолитические заболевания (серповидноклеточная анемия, малярия), хроническую кровопотерю, гельминтозы, гемоглобинопатии и др. [6, 11].
Анемия во время беременности определяется Всемирной организацией здравоохранения как уровень гемоглобина ≤ 11. г / дл. По оценкам Всемирной организации здравоохранения, в мире показатель распространенности составляет 38% среди беременных женщин. Лечение железодефицитной анемии во время беременности остается в числе основных направлений здравоохранения. Для лечения железодефицитной анемии рекомендуют пероральные соли железа, например, фумарат железа. Увеличение дозы фумарата двухвалентного железа увеличивает биодоступность препарата железа, однако такое увеличение приводит к росту частоты побочных эффектов со стороны желудочно-кишечного тракта таких как: тошнота, запор, диарея, метеоризм и окрашивание стула в черный цвет. Кроме того, биодоступность фумарата железа в желудочно-кишечном тракте может снизиться при приеме многих продуктов и/или препаратов, которые мешают его абсорбции, что приводит к вариабельности коррекции гемоглобина во время лечения. [12]
Бисглицинат железа представляет собой хелатный комплекс двухвалентного железа ковалентно соединенного с двумя молекулами аминокислоты глицина (хелатирование железа). В исследованиях подтверждается, что бисглицинат железа лучше переносится пациентами из-за меньшего количества побочных эффектов со стороны желудочно-кишечного тракта. [12]

Также исследования показывают, что бисглицинат железа улучшает абсорбцию и запасы железа, а также повышает уровень гемоглобина лучше, чем ионные соли железа [12, 14] или полимальтозный комплекс железа [15]. Так, в исследовании Nils Milman и соавторы показано, что бисглицинат железа в дозировке 25 мг так же эффективен, как и сульфат железа 50 мг в профилактике дефицита железа и анемии во время беременности. [12, 14]
В исследовании Oscar Pineda и соавт. показано, что хелат бисглицината двухвалентного железа абсорбируется в 3,4 раза лучше, чем сульфат железа (биодоступность бисглицината железа и сульфата железа составила 90,9% и 26,7%, соответственно); а прием хелатного комплекса бисглицината железа привел к значительному увеличению ферритина (P [18] L-метилфолат, как кофермент, фактор роста и деления клеток, обеспечивает необходимый уровень эритропоэза.[19]
Для лечения анемии беременных компания «Ламира» предлагает Multizan® Феррум L, в состав которого входит оба компонента: бисглицинат железа 30 мг и L-метилфолат 400 мкг – в необходимой дозировке, рекомендованной ВОЗ.
Таким образом, очевидные преимущества Multizan® Феррум L в отношении эффективности, безопасности и переносимости дают основание рекомендовать его беременным и лактирующим женщинам с дефицитом железа, а также, для его профилактики.
1. Worldwide prevalence of anaemia 1993–2005: WHO global database on anaemia / B. Benoistr [et al.]. – Geneva: WHO Press, 2008. – 41 p.
2. Iron deficiency anemia assessment, prevention, and control. A guide for programme managers. – Geneva: World Health Organization, 2001. – 115 p.
3. Kongnyuy, E. Effets de la supplémentation systématique en fer, par voie orale, avec ou sans acide folique, chez la femme enceinte: Aspects pratiques de la BSG (dernière mise à jour: 4 janvier 2007) / E. Kongnyuy, N. van den Broek // Bibliothèque de Santé Génésique de l’OMS; Genève: Organisation mondiale de la Santé. [Ressource électronique]. – 2007.
4. Van den Broek, N. Anemia and micronutrient deficiencies / N. van den Broek // Br. Med. Bull. – 2003. – № 67. – P. 149–160.
5. Walraven, G. Treatments for iron-deficiency anaemia in pregnancy: RHL commentary (last revised: 20 June 2007). / G. Walraven // The WHO Reproductive Health Library; Geneva: World Health Organization. [Electronic resource]. – 2007.
6. Candio, F. Treatments for iron-deficiency anaemia in pregnancy: RHL commentary (last revised: 23 November 2007) / F. Candio, G.J. Hofmeyr // The WHO Reproductive Health Library; Geneva: World Health Organization. [Electronic resource]. – 2007.
7. Cutner, A. Failed response to treat anaemia in pregnancy: reasons and evaluation / A. Cutner, R. Bead, J. Harding // J. Obstet. Gynecol. – 1999. – № 102. – P. 523–527.
8. Maternal anaemia and its impact on perinatal outcome / F.W. Lone [et al.] // Tropical Medicine and International Health. – 2004. – Vol. 9, № 4. – P. 486 – 490.
9. Лакотко, Н.Н. Дефицит железа у беременных женщин: лечебно-диагностические аспекты, лактация, качество жизни: дис. … канд. мед.наук : 14.00.01 / Н.Н. Лакотко. – Минск, 2008. – 146 л.
10. Хух, Р. Анемия во время беременности и в послеродовом периоде / Р. Хух, К. Брейман. – Москва: Триада-Х, 2007. – 73 с.
11. Reveiz, L. Treatments for iron-deficiency anaemia in pregnancy (Review) / L. Reveiz, G.M.L. Gyte, L.G. Cuervo // The Cochrane Library. – 2007. – Issue 4. – John Wiley & Sons, 2007. – 109 p.
12. Реестр клинических исследований США «Эффективность бисглицината железа в лечении железодефицитной анемии у беременных»
14. Nils Milman, Lisbeth Jønsson, Pernille Dyre, Palle Lyngsie Pedersen and Lise Grupe Larsen
Ferrous bisglycinate 25 mg iron is as effective as ferrous sulfate 50 mg iron in the prophylaxis of iron deficiency and anemia during pregnancy in a randomized trial. JOURNAL OF PERINATAL MEDICINE. Mar 2014, p.197
16. Oscar Pineda, PhD, and H. DeW ayne Ashmead, PhD Effectiveness of Treatment of Iron-Deficiency
Anemia in Infants and Young Children With Ferrous Bis-glycinate Chelate Nutrition 2001;17:381–384.
17. Pineda O, Ashmead HD, Perez JM, Ponce-Lemus C. Effectiveness of iron amino acid chelate on the treatment of iron deficiency anemia in adolescents. J Appl Nutr 1994;46:2
18. Рандомизированное клиническое исследование по двойному слепому методу. Международный журнал по акушерству и гинекологии, сентябрь 2002 г., том 109, стр. 1009-1014 Джордж Джарез-Вазкез (а), Эрминио Бониззони (b), Аурелио Скотти (с*)
19. «ДОСТИЖЕНИЯ И РИСКИ ПРИМЕНЕНИЯ ФОЛАТОВ ВНЕ И ВО ВРЕМЯ БЕРЕМЕННОСТИ» О.А. ПУСТОТИНА, д.м.н., профессор, кафедра акушерства, гинекологии и репродуктивной медицины Российского университета дружбы народов. Медицинский совет, №9,2015
Сравнительная эффективность и переносимость различных железосодержащих препаратов у больных железодефицитной анемией
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
МГМСУ им. Н.А. Семашко
50 ГКБ Департамента здравоохранения Правительства Москвы
Ж елезодефицитная анемия является самым распространенным анемическим синдромом и составляет приблизительно 80% всех анемий (ВОЗ, 1970). Дефицит железа той или иной степени имеется почти у 30% населения планеты (ВОЗ, 1998), причем скрытый его дефицит встречается в два раза чаще, чем железодефицитная анемия.
В 1998 г. в России насчитывалось около 480 тыс. больных анемией взрослых и подростков; из них примерно 432 тыс. – с железодефицитной анемией (Отдел медицинской статистики и информатики Информационно–аналитического центра МЗ РФ, 2001).
В настоящее время имеется большой выбор ферросодержащих препаратов. Для повышения биодоступности и улучшения переносимости железа фармакологическими фирмами используются различные методические подходы. Среди них – поддержание железа в двухвалентном состоянии, использование «носителей», усиление гемопоэза, утилизации и абсорбции железа, замедление всасывания и обеспечение независимости от pH среды и активности ферментов, задействование специальных рецепторов для абсорбции Fe 3+ в виде комплексов. Однако до настоящего времени отсутствуют сравнительные исследования по эффективности и переносимости этих препаратов.
Целью настоящего исследования явилась объективизация выбора ферросодержащих препаратов на основе сравнительного изучения их эффективности и переносимости у больных железодефицитной анемией.
Под наблюдением находилось 83 человека (22 мужчины и 61 женщина) в возрасте от 17 до 92 лет (средний возраст – 57,7±1,4 года) с анемией различной степени тяжести.
В среднем по группе уровень гемоглобина был снижен до 87,8±0,4 г/л, средняя длительность анемии составила 1,5±0,1 года. Причины анемии: острая или хроническая кровопотеря в 54,3% случаев, нарушение всасывания в 28,3 %, другие или комбинированные причины в 17,3 % случаев.
Анемия послужила причиной госпитализации у 10 больных, явилась осложнением основного заболевания у 28 и у 45 была обнаружена в процессе обследования по поводу другого заболевания, послужившего причиной госпитализации.
Причинами острой или хронической кровопотери были: в 22 (26,5%) случаях мено– и метроррагии, у 12 (14,5%) хронический кровоточащий геморрой, у 7 (8,4%) кровотечение из язвы 12–ти перстной кишки, у 2 (2,4%) грыжа пищеводного отверстия диафрагмы и по 1 (1,2%) случаю кровотечение из варикозно расширенных вен пищевода, неспецифический язвенный колит, болезнь Крона, длительно существующая цистостома по поводу доброкачественной гиперплазии предстательной железы с макрогематурией.
Нарушение всасывания железа было результатом синдрома раздраженной толстой кишки у 17 (20,5%) больных, резецированного желудка по поводу язвенной болезни у 4 (4,8%) пациентов, атрофического гастрита в 1 (1,2%) случае.
Анемия отмечалась на фоне вегетарианства (1 случай, 1,2%), в разные сроки после родов (2 случая, 2,4%) и при комбинации различных причин (у 10 пациентов, 12,1%).
Сопутствующей патологией в большинстве случаев (62 пациента, 75%) были заболевания сердечно–сосудистой системы (ИБС, АГ, ревматический митральный порок сердца) с признаками недостаточности кровообращения (не выше I стадии по классификации Стражеско–Василенко).
Все пациенты случайным методом были разделены на 5 групп, которым назначались разные антианемические препараты (табл. 1).
Пациенты I группы получали Ферроплекс (ФП), выпускающийся в драже, содержащих железа сульфат (50 мг или 10 мг элементарного железа) и кислоту аскорбиновую (30 мг). Суточная доза составляла 8 драже, которые назначали за 30–40 минут до еды.
Пациентам II группы назначали Актиферрин (А). Препарат выпускается в капсулах, содержащих железа сульфат (113,85 мг или 34,5 мг элементарного железа) и D,L–серин (129 мг). Доза актиферрина составляла 3 капсулы в сутки за 30–40 минут до еды.
В III группе использовался Актиферрин композитум (АК), выпускающийся в капсулах и содержащий, кроме железа сульфата (113,85 мг или 34,5 мг элементарного железа) и D,L–серина (129 мг), кислоту фолиевую (0,5 мг) и цианокобаламин (0,3 мг). Препарат назначали в дозе 2 капсулы в сутки за 30–40 минут до еды.
Пациенты IV группы получали Ферро–Фольгамму (ФФ) фармацевтической компании Woerwag Pharma (Германия). Препарат выпускается в капсулах, содержащих железа сульфат (100 мг или 37 мг элементарного железа), кислоту фолиевую (5 мг), цианокобаламин (10 мкг), кислоту аскорбиновую (100 мг). Препарат назначали в дозе 3 капсулы в день за 30–40 минут до еды.
Больные V группы получали Сорбифер дурулес (С). Препарат выпускается в таблетках, покрытых оболочкой, которые содержат железа сульфат (320 мг или 100 мг элементарного железа) и кислоту аскорбиновую (60 мг). Сорбифер дурулес назначали в дозе 2 таблетки в день за 30–40 минут до еды.
Клинический анализ крови с измерением уровня гемоглобина, подсчетом количества эритроцитов, ретикулоцитов, тромбоцитов и лейкоцитов, определением цветового показателя и СОЭ, а также морфологическим исследованием эритроцитов выполнялся в клинической лаборатории ГКБ № 50 (совместно с к.б.н. Барской Н.В.).
Уровень гемоглобина (Hb) капиллярной крови определяли унифицированным гемиглобинцианидным методом, а подсчет количества эритроцитов проводили в счетной камере Горяева под микроскопом.
Все показатели обмена железа определялись в ГНЦ РАМН (совместно с к.м.н. Левиной А.А.).
Уровень сывороточного железа (СЖ) и общей железосвязывающей способности сыворотки крови (ОЖСС) определяли колориметрическим методом с бетафенантролином с использованием реактивов фирмы «La Chema».
Ферритин сыворотки (ФС) и ферритин гемолизата (ФГ) определяли радиометрическим методом наборами ИРМА–ферритин, производства ИОХ, Минск. ФГ был использован, как показатель ферритина эритроцитов.
Насыщение трансферрина железом (НТЖ) является произвольной величиной и рассчитывается по формуле: НТЖ=100% (СЖ/ОЖСС).
Трансферрин определяли иммунодиффузным методом с моноспецифичной антисывороткой против трансферрина, полученной в лаборатории отделения химиотерапии лейкозов ГНЦ РАМН.
Из данных, приведенных в таблице 2, видно, что сформированные группы были однородными по тяжести анемии и выраженности нарушений обмена железа.
Дизайн исследования (рис. 1). Каждое обследование включало: анализ жалоб пациента, оценку объективных клинических признаков анемии, определение уровня гемоглобина, эритроцитов, цветового показателя, определение показателей обмена железа – сывороточного железа, ферритина сыворотки, ферритина эритроцитов, трансферрина, насыщения трансферрина железом, общей железосвязывающей способности сыворотки крови.
Рис. 1. Схема дизайна исследования
После исходного обследования пациенты получали соответствующий препарат до достижения уровня гемоглобина, превышающего 115 г/л (целевого уровня). Через месяц после окончания лечения оценивали стабильность полученного результата. В течение месяца контролировался уровень гемоглобина для исключения его снижения менее 100 г/л (чего в обследованной группе не было отмечено ни в одном случае). После третьего обследования больным назначалось продолжение терапии ферропрепаратами для создания адекватных депо железа.
Статистическая обработка полученного материала проводилась на ЭВМ IBM типа PC в программе Microsoft Excel (версия для Microsoft Windows–98). Достоверность различий определялась с помощью t–критерия Стъюдента для независимых и попарно связанных величин. Различия или динамика считались достоверными при р Полученные результаты и их обсуждение
У всех 83 наблюдавшихся пациентов на фоне терапии были получены благоприятный клинический эффект (табл. 3) и положительные сдвиги лабораторных показателей. При этом, поскольку клинические проявления сидеропенического синдрома отмечались лишь в отдельных случаях и чаще всего имелись признаки анемического синдрома, в данной части работы анализировались последние.
В целом субъективные симптомы анемии купировались несколько быстрее, чем объективные. Из субъективных признаков в каждой из групп быстрее всего регрессировала одышка при физической нагрузке. На фоне приема современных комбинированных препаратов железа она наблюдалась до 4–5 суток лечения; к 8–10 суткам исчезли головокружение и общая слабость.
В группе больных, получавших Актиферрин, Актиферрин композитум, Ферро–Фольгамма, Сорбифер дурулес, среди объективных признаков быстрее всего регрессировала бледность слизистых оболочек, а дольше всего сохранялась бледность кожи. В целом у них имелась следующая последовательность регресса субъективных и объективных признаков анемии: одышка при физической нагрузке, бледность слизистых оболочек, тахикардия, головокружение, общая слабость и бледность кожи.
На фоне приема Ферроплекса эта последовательность нарушалась: хотя быстрее всего регрессировала одышка при физической нагрузке, однако на втором месте по длительности сохранения оказалась тахикардия, затем исчезли головокружение, бледность слизистых оболочек, общая слабость и, наконец – бледность кожи. Длительность сохранения каждого симптома на фоне лечения Ферроплексом превышала таковую в группах больных, получавших другие комбинированные препараты, в 1,7–3,4 раза.
Ни жалобы пациентов, ни объективные клинические признаки анемии не появлялись вновь после прекращения приема препаратов и не были отмечены при обследовании через месяц после окончания лечения.
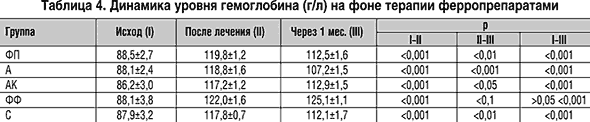
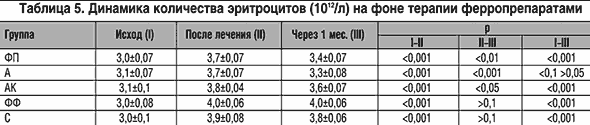
На фоне лечения все препараты обеспечивали достоверное (р (табл. 4 и 5). Однако через месяц после прекращения лечения в большинстве групп наблюдалось снижение уровня гемоглобина и только после приема Ферро–Фольгаммы отмечалась тенденция к нарастанию уровня Hb (0,1>р>0,05).
Количество эритроцитов, достигнутое во время лечения, удерживалось на полученном уровне в течение месяца после отмены лечения у пациентов, получавших Ферро–Фольгамму и Сорбифер дурулес, а в других группах оно достоверно снизилось.
При использовании современных комбинированных препаратов время достижения целевого уровня гемоглобина было одинаковым (от 14,4±1,3 суток для Сорбифера дурулес до 16,4±1,3 суток для Актиферрина композитум; p>0,1). Прием же Ферроплекса потребовал наибольшего времени – 21,8±0,9 суток. Он же обеспечивал наименьшую скорость прироста гемоглобина (1,3±0,1 г/л/сутки). Более быстрый прирост наблюдался на фоне Актиферрина (1,7±0,1 г/л/сутки), а наибольшая скорость – при использовании Ферро–Фольгаммы (2,5±0,4 г/л/сутки). Скорости прироста гемоглобина на фоне приема Актиферрина композитум и Сорбифера дурулес были практически одинаковыми (2,1±0,4 и 2,2±0,2 г/л/сутки, соответственно).
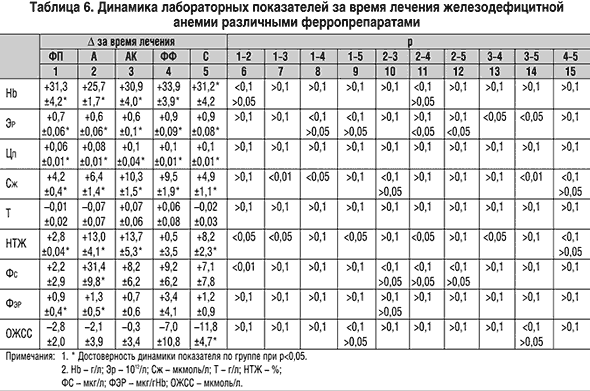
Более существенные различия выявлены по приросту количества эритроцитов, который был наибольшим на фоне Ферро–Фольгаммы и Сорбифера дурулес, где он превышал динамику в других группах. Динамика цветового показателя была значимой во всех группах и заключалась в возрастании этого показателя на 0,06–0,1. Однако несмотря на некоторые различия между группами по динамике уровня гемоглобина и количества эритроцитов этот прирост во всех группах был близким и не различался достоверно на фоне приема всех применявшихся ферропрепаратов (р>0,1 для всех пар).
В то же время прием всех препаратов, за исключением Ферро–Фольгаммы, сопровождался достоверным увеличением насыщения трансферрина железом. Наибольший прирост НТЖ наблюдался на фоне приема Актиферрина композитум и Актиферрина, наименьший – при применении Ферроплекса, что не отличалось от недостоверной динамики, наблюдавшейся в группе Ферро–Фольгаммы. Можно высказать предположение, что малая динамика НТЖ в группе Ферроплекса, где была наименьшей скорость прироста гемоглобина, отражает низкую эффективность данного препарата. В то же время отсутствие нарастания НТЖ в группе Ферро–Фольгаммы, где достигнута наибольшая скорость прироста гемоглобина, связано с быстрой утилизацией железа в результате активного синтеза гемоглобина и быстрым освобождением трансферрина (апотрансферрина), несмотря на высокую скорость абсорбции железа в кишечнике.
1. Комбинированные препараты Ферро–Фольгамма и Актиферрин композитум, а также медленно абсорбирующийся Сорбифер дурулес в короткий срок обеспечивают регресс клинических симптомов железодефицитной анемии и быстрое нарастание уровня гемоглобина даже при относительно непродолжительном лечении.
2. Несмотря на то, что в большинстве случаев достигнутый уровень гемоглобина не удерживается в течение месяца после отмены лечения, показатели ферростатуса в этот период либо не менялись, либо сдвигались в положительную сторону (исключение – Ферроплекс).
3. Среди больных, принимавших Актиферрин, Актиферрин композитум и Ферро–Фольгамму, не было отмечено побочных эффектов, что позволяет говорить об их хорошей переносимости; Сорбифер дурулес переносится хуже, что, однако, при использованной схеме терапии не потребовало отмены препарата или коррекции дозы.
4. Самая низкая скорость прироста гемоглобина, наибольшая длительность терапии до достижения целевого уровня гемоглобина и худшая переносимость лечения отмечены при применении Ферроплекса.
5. При интегральной оценке эффективности в процессе лечения, стойкости достигнутого эффекта и переносимости безусловными преимуществами обладает комбинированный препарат Ферро-Фольгамма.
_500.gif)