блуждающий ген что это такое
Блуждающие гены внутри нас
Английский генетик Джон Бердон Холдейн как-то остроумно заметил: «Мир не просто удивительнее, чем мы себе представляем, — он удивительнее, чем мы можем себе представить». Что бы вы подумали о человеке, который бы вдруг заявил, что внутри наших клеток некоторые участки генома прыгают по спирали ДНК, словно блохи по воротнику бродяги? Что у него чересчур разыгралась фантазия?
Немало подобных критических замечаний пришлось выслушать американскому ученому-генетику Барбаре Макклинток, которая первой объявила научному сообществу о существовании подвижных генов. В конце 1940-х, изучая геном кукурузы, она обнаружила, что на активность генов могут действовать какие-то неведомые элементы, способные, по ее предположению, перемещаться по ДНК. Эта новая гипотеза была настолько революционной, что коллеги-генетики встретили ее, по воспоминаниям самой Макклинток, полным непониманием и «каменным молчанием».
Понадобилось почти четыре десятилетия, чтобы ее новаторские идеи получили полное признание. Как метко заметил российский физик, нобелевский лауреат В.Л. Гинзбург, ученый обязан быть долгожителем, если хочет дождаться признания своих работ. В 1983 году Нобелевский комитет вручил 80-летней Макклинток премию по физиологии и медицине «за открытие мобильных генетических элементов». В своей нобелевской речи она произнесла такие слова: «Геном является высокочувствительным органом клетки, который способен в условиях стресса инициировать собственную реструктуризацию и обновление». По-настоящему мобильные элементы генома (они же транспозоны, или «прыгающие гены») были открыты через три десятилетия после их теоретического предсказания, в 1970-х. Вначале П. Штарлингер и Д. Шапиро обнаружили простейшие мобильные элементы, названные инсерционными (вставочными), у бактерий. Была установлена их способность вызывать мутации у простейших организмов. Выяснилось, что таких инсерционных элементов в бактериальном геноме может быть от нескольких штук до нескольких сотен. К примеру, у дизентерийной бактерии Shigella dysenteriae на сегодня известно целых 200 копий мобильных элементов. Изучение подвижных генов бактерий имеет большое практическое значение, так как с ними непосредственно связана способность бактерий приобретать устойчивость к антибиотикам.
После бактерий мобильные элементы были обнаружены в сложных организмах. В 1976 году группа советских генетиков, В.А. Гвоздев и его коллеги, смогли найти их у дрозофилы. Уже много лет спустя выяснится, что эти элементы у плодовых мушек в своем роде уникальны. Они исполняют у них функции теломеразы — фермента, наращивающего укорачивающиеся при каждом делении клетки концы ДНК (теломеры). Также обнаружится, что эти элементы имеют большое сходство в строении с человеческими ретровирусами, среди которых самый известный — вирус иммунодефицита человека (ВИЧ).
Теперь, после изучения простейших организмов и дрозофилы, настала очередь найти «прыгающие» гены у позвоночных, в том числе и у человека, что и было в скором времени сделано. Стало ясно, что мобильные элементы генома чрезвычайно распространены в живой природе. В настоящее время они обнаружены во всех живых организмах, которые только попались под руку ученым — от бактерий до млекопитающих. У человека на их долю приходится огромная часть последовательности ДНК — более 40%.
Некоторые из мобильных генов, словно домашние любимцы, получили от своих первооткрывателей имена: Магеллан, Аттила, Пенелопа, Турист, Чарли, Спящая Красавица, Эмигрант, Аврора (этот «бывший» — потерявший подвижность — транспозон был открыт российскими учеными и назван так в честь легендарного крейсера).
Вырезать и вставить
Сегодня все подвижные элементы генома у высших организмов принято делить на два больших класса: ДНК-транспозоны (или просто транспозоны) и ретротранспозоны. Такое деление возникло из-за разных молекулярных механизмов, при помощи которых эти элементы перемещаются по ДНК. В статье мы сможем рассмотреть лишь первый класс мобильных элементов.
«Как обычно бывает в экспериментальной фундаментальной науке, открытия появляются неожиданно, их нельзя запланировать — ставится одна задача, а в процессе попыток ее решения обнаруживается что-то совсем новое и неожиданное, только не надо проходить мимо. Так, когда-то поставленная Г. П. Георгиевым задача исследовать принципы устройства регуляторной зоны генов у многоклеточных животных привела к открытию перемещающихся элементов генома у плодовой мушки — дрозофилы, замечательного модельного объекта молекулярной генетики. А совсем в других работах в это же время, уже не на дрозофиле, было обнаружено, что гены состоят из отдельных кусочков, кодирующих отрезки РНК, которые затем сшиваются с образованием полноценной РНК, кодирующей белок. Этого никто не мог предсказать, и это открытие было удостоено Нобелевской премии».
ДНК-транспозоны используют для своих перемещений механизм, который получил в научной литературе определение cut and paste (вырезать и вставить). После получения определенного сигнала извне происходит активация гена, ответственного за синтез специального фермента, транспозазы. Этот ген находится внутри транспозона, составляя его важнейшую часть. После этого транспозаза, перемещаясь вдоль ДНК, находит на ней свой транспозон по специальным меткам (инвертированным повторам), ограничивающим его с обеих сторон. Найденный транспозон аккуратно вырезается транспозазой и перемещается в другое место, подготовленное для него на ДНК, то есть вставляется в вырезанную заранее брешь.
Иногда транспозаза, закодированная в одном транспозоне, перемещает и другие, похожие мобильные элементы, в том числе те, у которых собственный ген транспозазы поврежден. Получается своеобразная взаимопомощь среди мобильных элементов (или, если хотите, паразитирование одних на других). Поражает удивительная сложность и согласованность всех этих процессов, как будто ими управляет какая-то неведомая сила, словно хороший дирижер оркестром. Надо признать, что многое в этих внутренних процессах тяжело поддается пониманию исследователей — настолько они четко организованы, сложны и скоординированы между собой.
И заключительный этап: внедренный транспозон сшивается с ДНК в новом месте. Место, откуда транспозон «выпрыгнул», подвергается процессу репарации (восстановлению целостности ДНК). Или, если «прыжок» произошел во время деления клетки, в пустое место вставляется копия элемента, снятая с сестринской молекулы ДНК. Во втором варианте происходит «размножение» транспозона — в хромосоме становится на один мобильный элемент больше. Такие перемещения несут потенциальную опасность для клетки и всего организма.
Дикие и домашние
Сегодня по приблизительным подсчетам существует около 100 генетических патологий человека, которые вызываются непосредственно мобильными элементами. И этот список продолжает расширяться. Также очевидно, что подвижные гены каким-то образом связаны со старением — с возрастом обнаруживается усиление их деятельности, вызванное ослаблением репрессивных механизмов.
Потенциальную опасность мобильных элементов для живых организмов косвенно подтверждает тот факт, что у нас имеется сразу несколько способов подавления их активности. Это прежде всего метилирование подвижных генов, когда к участку ДНК, где они расположены, присоединяется метильная группа (один атом углерода и три атома водорода — CH3). Метильную группу можно сравнить с «заглушкой»: после ее присоединения к ДНК мобильные элементы не в состоянии проявлять свою активность (подробнее о метилировании читайте в «ПМ» № 2’2015). Также в борьбе с транспозонами живые организмы активно используют механизм РНК-сайленсинга — подавления экспрессии генов подвижных элементов при помощи коротких одноцепочечных РНК. Этот механизм обеспечивают так называемые piwiРНК, действие которых было впервые обнаружено в 2001 году в Институте молекулярной генетики РАН академиком В.А. Гвоздевым, А.А. Аравиным и их коллегами.
Долгое время после открытия считалось, что от подвижных элементов можно ожидать лишь неприятностей — например, приводящих к болезням мутаций при встраивании транспозона в ген, кодирующий белок или РНК или регулирующий их работу. Такой точки зрения придерживались и первооткрыватели структуры ДНК Д. Уотсон и Ф. Крик. Но в последние годы появились данные, что транспозоны могут все-таки «одомашниваться» и превращаться из паразитов в полезные структуры.
Считается, что мобильные элементы из класса транспозонов были активны в период ранней эволюции многоклеточных животных, а у предка человека и обезьян прекратили свои перемещения по геному около 40 млн лет назад. В наследство от этих древних транспозонов человек тоже получил некоторые рабочие гены, в том числе обеспечивающие работу уникального механизма, при помощи которого мы боремся с чужеродными вторжениями в наш организм.
К этому механизму относятся белки RAG — прямые потомки мобильного фермента транспозазы из семейства транспозонов класса transib (элемент, открытый известным «охотником за транспозонами», российским генетиком Владимиром Капитоновым). Причем данный вид транспозонов идентифицирован исключительно в геномах беспозвоночных, которые передали в процессе эволюции свой главный фермент позвоночным, что дало нам возможность синтезировать белки RAG. Именно они, подобно умелому конструктору, собирают из разных структур гены антител, комбинируя фрагменты ДНК в клетках иммунной системы — лимфоцитах.
Вероятно, в процессе эволюции транспозоны не раз выступали в роли активных инструментов мутаций, инициируя своими перемещениями создание генетического разнообразия. Сегодня, после секвенирования генома человека известно около 50 генов, произошедших напрямую от транспозонов. Так, постепенно, в свете накопленных данных, уходит исключительно негативная оценка деятельности мобильных элементов. Напротив, сегодня многие ученые склонны рассматривать их как «генный резерв» организмов, который те используют для своего развития и противостояния стрессам. Все, что сегодня связано с мобильными генетическими элементами, активно изучается во многих лабораториях во всем мире, так как, кроме чисто научного интереса, имеет большое прикладное значение — подвижные гены оказались тесно связаны с развитием, старением и многими патологиями.
Блуждающие гены внутри нас
Когда в 2000 году в ходе одного из самых амбициозных научных проектов было расшифровано около 90% генома человека, многим ученым показалось, что теперь все тайны нашего организма будут окончательно разгаданы. Но очень скоро головокружение от успехов сменилось большим недоумением. Как оказалось, почти полная расшифровка генома не только не помогла генетикам ответить на старые вопросы, накопившиеся к тому времени, но и добавила множество новых.

Английский генетик Джон Бердон Холдейн как-то остроумно заметил: «Мир не просто удивительнее, чем мы себе представляем, — он удивительнее, чем мы можем себе представить». Что бы вы подумали о человеке, который бы вдруг заявил, что внутри наших клеток некоторые участки генома прыгают по спирали ДНК, словно блохи по воротнику бродяги? Что у него чересчур разыгралась фантазия?
Немало подобных критических замечаний пришлось выслушать американскому ученому-генетику Барбаре Макклинток, которая первой объявила научному сообществу о существовании подвижных генов. В конце 1940-х, изучая геном кукурузы, она обнаружила, что на активность генов могут действовать какие-то неведомые элементы, способные, по ее предположению, перемещаться по ДНК. Эта новая гипотеза была настолько революционной, что коллеги-генетики встретили ее, по воспоминаниям самой Макклинток, полным непониманием и «каменным молчанием».
Понадобилось почти четыре десятилетия, чтобы ее новаторские идеи получили полное признание. Как метко заметил российский физик, нобелевский лауреат В. Л. Гинзбург, ученый обязан быть долгожителем, если хочет дождаться признания своих работ. В 1983 году Нобелевский комитет вручил 80-летней Макклинток премию по физиологии и медицине «за открытие мобильных генетических элементов». В своей нобелевской речи она произнесла такие слова: «Геном является высокочувствительным органом клетки, который способен в условиях стресса инициировать собственную реструктуризацию и обновление».
По-настоящему мобильные элементы генома (они же транспозоны, или «прыгающие гены») были открыты через три десятилетия после их теоретического предсказания, в 1970-х. Вначале П. Штарлингер и Д. Шапиро обнаружили простейшие мобильные элементы, названные инсерционными (вставочными), у бактерий. Была установлена их способность вызывать мутации у простейших организмов. Выяснилось, что таких инсерционных элементов в бактериальном геноме может быть от нескольких штук до нескольких сотен. К примеру, у дизентерийной бактерии Shigella dysenteriae на сегодня известно целых 200 копий мобильных элементов. Изучение подвижных генов бактерий имеет большое практическое значение, так как с ними непосредственно связана способность бактерий приобретать устойчивость к антибиотикам.
После бактерий мобильные элементы были обнаружены в сложных организмах. В 1976 году группа советских генетиков, В. А. Гвоздев и его коллеги, смогли найти их у дрозофилы. Уже много лет спустя выяснится, что эти элементы у плодовых мушек в своем роде уникальны. Они исполняют у них функции теломеразы — фермента, наращивающего укорачивающиеся при каждом делении клетки концы ДНК (теломеры). Также обнаружится, что эти элементы имеют большое сходство в строении с человеческими ретровирусами, среди которых самый известный — вирус иммунодефицита человека (ВИЧ).
Загадочный геном
Экзон — участок гена, несущий информацию о строении белка.
CpG-островки — участки компактного расположения нуклеотидной пары цитозин-гуанин.
Интрон — часть гена, не содержащая информации об аминокислотной последовательности.
Сателлиты — последовательности нуклеотидов, представляют собой очень длинные (в несколько сотен тысяч пар нуклеотидов) участки ДНК с тандемно («голова к хвосту») повторяющимися короткими блоками из 5−200 пар нуклеотидов.
LTR-ретротранспозоны — мобильные ретроэлементы с длинными концевыми повторами (long terminal repeats).
SINE — короткие перемежающиеся ретроэлементы (short interspersed elements).
LINE — длинные перемежающиеся ретроэлементы (long interspersed elements).
Теперь, после изучения простейших организмов и дрозофилы, настала очередь найти «прыгающие» гены у позвоночных, в том числе и у человека, что и было в скором времени сделано. Стало ясно, что мобильные элементы генома чрезвычайно распространены в живой природе. В настоящее время они обнаружены во всех живых организмах, которые только попались под руку ученым, — от бактерий до млекопитающих. У человека на их долю приходится огромная часть последовательности ДНК — более 40%.
Некоторые из мобильных генов, словно домашние любимцы, получили от своих первооткрывателей имена: Магеллан, Аттила, Пенелопа, Турист, Чарли, Спящая Красавица, Эмигрант, Аврора (этот «бывший» — потерявший подвижность — транспозон был открыт российскими учеными и назван так в честь легендарного крейсера).
Наследство от вирусов
На долю транспозонов приходится около 3% всей последовательности человеческой ДНК. И обнаружение новых подвижных генов этого класса продолжается. Так, несколько лет назад российским генетиком Владимиром Капитоновым и его коллегами были открыты еще несколько видов мобильных элементов: Harbinger, Helitron и Polinton. Как выяснилось, они имеют большое сходство с некоторыми вирусами и с подвижными генами бактерий.
Вырезать и вставить
Сегодня все подвижные элементы генома у высших организмов принято делить на два больших класса: ДНК-транспозоны (или просто транспозоны) и ретротранспозоны. Такое деление возникло из-за разных молекулярных механизмов, при помощи которых эти элементы перемещаются по ДНК. В статье мы сможем рассмотреть лишь первый класс мобильных элементов.
ДНК-транспозоны используют для своих перемещений механизм, который получил в научной литературе определение cut and paste (вырезать и вставить). После получения определенного сигнала извне происходит активация гена, ответственного за синтез специального фермента, транспозазы. Этот ген находится внутри транспозона, составляя его важнейшую часть. После этого транспозаза, перемещаясь вдоль ДНК, находит на ней свой транспозон по специальным меткам (инвертированным повторам), ограничивающим его с обеих сторон. Найденный транспозон аккуратно вырезается транспозазой и перемещается в другое место, подготовленное для него на ДНК, то есть вставляется в вырезанную заранее брешь.
Ctrl-C или Ctrl-X?
Подвижные элементы генома делятся на два больших класса: ДНК-транспозоны и ретротранспозоны. Первые используют для передвижения принцип «вырезать и вставить», а вторые — «копировать и вставить».

Иногда транспозаза, закодированная в одном транспозоне, перемещает и другие, похожие мобильные элементы, в том числе те, у которых собственный ген транспозазы поврежден. Получается своеобразная взаимопомощь среди мобильных элементов (или, если хотите, паразитирование одних на других). Поражает удивительная сложность и согласованность всех этих процессов, как будто ими управляет какая-то неведомая сила, словно хороший дирижер оркестром. Надо признать, что многое в этих внутренних процессах тяжело поддается пониманию исследователей — настолько они четко организованы, сложны и скоординированы между собой.
И заключительный этап: внедренный транспозон сшивается с ДНК в новом месте. Место, откуда транспозон «выпрыгнул», подвергается процессу репарации (восстановлению целостности ДНК). Или, если «прыжок» произошел во время деления клетки, в пустое место вставляется копия элемента, снятая с сестринской молекулы ДНК. Во втором варианте происходит «размножение» транспозона — в хромосоме становится на один мобильный элемент больше. Такие перемещения несут потенциальную опасность для клетки и всего организма.
Дикие и домашние
Сегодня по приблизительным подсчетам существует около 100 генетических патологий человека, которые вызываются непосредственно мобильными элементами. И этот список продолжает расширяться. Также очевидно, что подвижные гены каким-то образом связаны со старением — с возрастом обнаруживается усиление их деятельности, вызванное ослаблением репрессивных механизмов.
Потенциальную опасность мобильных элементов для живых организмов косвенно подтверждает тот факт, что у нас имеется сразу несколько способов подавления их активности. Это прежде всего метилирование подвижных генов, когда к участку ДНК, где они расположены, присоединяется метильная группа (один атом углерода и три атома водорода — CH3). Метильную группу можно сравнить с «заглушкой»: после ее присоединения к ДНК мобильные элементы не в состоянии проявлять свою активность (подробнее о метилировании читайте в «ПМ» № 2’2015 «Какие возможности дает изменение алфавита ДНК?»).
Также в борьбе с транспозонами живые организмы активно используют механизм РНК-сайленсинга — подавления экспрессии генов подвижных элементов при помощи коротких одноцепочечных РНК. Этот механизм обеспечивают так называемые piwiРНК, действие которых было впервые обнаружено в 2001 году в Институте молекулярной генетики РАН академиком В. А. Гвоздевым, А. А. Аравиным и их коллегами.
Долгое время после открытия считалось, что от подвижных элементов можно ожидать лишь неприятностей — например, приводящих к болезням мутаций при встраивании транспозона в ген, кодирующий белок или РНК или регулирующий их работу. Такой точки зрения придерживались и первооткрыватели структуры ДНК Д. Уотсон и Ф. Крик. Но в последние годы появились данные, что транспозоны могут все-таки «одомашниваться» и превращаться из паразитов в полезные структуры.
НАШ ЭКСПЕРТ:
Владимир Алексеевич Гвоздев, заведующий Отделом молекулярной генетики клетки Института молекулярной генетики РАН, профессор МГУ, академик РАН:
«Как обычно бывает в экспериментальной фундаментальной науке, открытия появляются неожиданно, их нельзя запланировать — ставится одна задача, а в процессе попыток ее решения обнаруживается что-то совсем новое и неожиданное, только не надо проходить мимо. Так, когда-то поставленная Г. П. Георгиевым задача исследовать принципы устройства регуляторной зоны генов у многоклеточных животных привела к открытию перемещающихся элементов генома у плодовой мушки — дрозофилы, замечательного модельного объекта молекулярной генетики. А совсем в других работах в это же время, уже не на дрозофиле, было обнаружено, что гены состоят из отдельных кусочков, кодирующих отрезки РНК, которые затем сшиваются с образованием полноценной РНК, кодирующей белок. Этого никто не мог предсказать, и это открытие было удостоено Нобелевской премии».
Считается, что мобильные элементы из класса транспозонов были активны в период ранней эволюции многоклеточных животных, а у предка человека и обезьян прекратили свои перемещения по геному около 40 млн лет назад. В наследство от этих древних транспозонов человек тоже получил некоторые рабочие гены, в том числе обеспечивающие работу уникального механизма, при помощи которого мы боремся с чужеродными вторжениями в наш организм.
К этому механизму относятся белки RAG — прямые потомки мобильного фермента транспозазы из семейства транспозонов класса transib (элемент, открытый известным «охотником за транспозонами», российским генетиком Владимиром Капитоновым). Причем данный вид транспозонов идентифицирован исключительно в геномах беспозвоночных, которые передали в процессе эволюции свой главный фермент позвоночным, что дало нам возможность синтезировать белки RAG. Именно они, подобно умелому конструктору, собирают из разных структур гены антител, комбинируя фрагменты ДНК в клетках иммунной системы — лимфоцитах.
Вероятно, в процессе эволюции транспозоны не раз выступали в роли активных инструментов мутаций, инициируя своими перемещениями создание генетического разнообразия. Сегодня, после секвенирования генома человека известно около 50 генов, произошедших напрямую от транспозонов.
Так, постепенно, в свете накопленных данных, уходит исключительно негативная оценка деятельности мобильных элементов. Напротив, сегодня многие ученые склонны рассматривать их как «генный резерв» организмов, который те используют для своего развития и противостояния стрессам. Всё, что сегодня связано с мобильными генетическими элементами, активно изучается во многих лабораториях во всем мире, так как, кроме чисто научного интереса, имеет большое прикладное значение — подвижные гены оказались тесно связаны с развитием, старением и многими патологиями.
Болезнь Альцгеймера: ген, от которого я без ума
Болезнь Альцгеймера, настигающая большинство людей в старости, является одной из самых острых проблем здравоохранения
Автор
Редакторы
В начале XX века с помощью немецкого психиатра Алоиса Альцгеймера мир узнал о существовании новой нейродегенеративной болезни. И хотя долгое время исследователи не воспринимали генетическую предрасположенность в качестве важного фактора для развития болезни Альцгеймера, вскоре ситуация изменилась. Однако и сейчас о природе этого заболевания идут ожесточенные споры: кто же во всем виноват — β-амилоид или APOE4?
Бета-амилоид, образующий при болезни Альцгеймера нерастворимые бляшки в нервных клетках, традиционно считался основной причиной нейротоксичности при этом заболевании, однако в действительности дело обстоит не так просто. В частности, токсичными могут быть не только фибриллярные, но и промежуточные сферические агрегаты Aβ (см. «Альцгеймеровский нейротоксин: ядовиты не только фибриллы» [14]), на вероятность развития БА положительно влияет недосып (см. «Новый шаг к пониманию болезни Альцгеймера: возможно, недосыпание является одним из факторов риска» [15]), ну а на сладкое — в реальности бета-амилоид может быть вообще не нейротоксином, а компонентом врождённого иммунитета в нервной системе человека (см. «Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета» [16]). — Ред.
Профессор Роузес сразу понял, что его коллега нашел нечто важное. Двумя годами ранее ими было обнаружено, что экспрессия некоторых генов из хромосомы 19 способствует развитию деменции, а поскольку Роузес знал, что ген, кодирующий ApoE, также находится на этой хромосоме, его молниеносно осенила идея участия ApoE в развитии болезни Альцгеймера (БА).
В организме человека есть три варианта гена APOE, кодирующих изоформы белка Е2, Е3 и Е4, и Роузес решил выяснить их влияние на развитие болезни Альцгеймера. Для определения отдельных аллелей нужно было провести полимеразную цепную реакцию (ПЦР) [17]. Так как ученый имел весьма скромный опыт работы с ПЦР, он хотел привлечь в свою команду нейрофизиологов, но получил отказ: хотя они и были заняты охотой за генами, которые лежат в основе болезни Альцгеймера, АРОЕ показался им неподходящим кандидатом. Роузес вспоминает, как позже в лаборатории ходили разговоры: «. начальник совсем потерял голову от своих безумных идей».
Но Роузес не сдавался. Он попросил помощи у своей жены, генетика Энн Сондерс (Ann Saunders), которая использовала ПЦР в своих исследованиях. Она только что родила дочь и была в декретном отпуске, и потому они заключили соглашение. «Она сделала все эксперименты, пока я присматривал за ребенком», — говорит профессор. В течение трех недель супруги собрали данные, которые в дальнейшем легли в основу серии знаковых публикаций. Они выяснили, что аллель APOE4 способствует развитию БА [1].
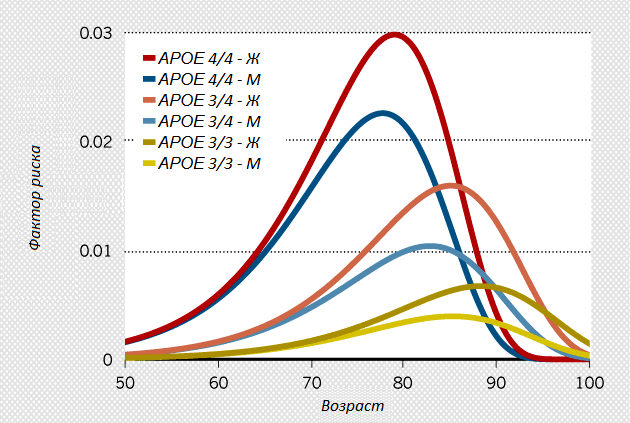
Сегодня, двадцать лет спустя, APOE4 остается ведущим фактором риска для наиболее распространенной формы деменции. Наследование одной копии APOE4 вчетверо повышает риск возникновения заболевания, двух копий — в 12 раз (рис. 1). Однако данные Роузеса в основном не воспринимали всерьез или критиковали. Впоследствии, даже когда мнение об ApoE поменялось, большинство ученых все равно продолжали работать с β-амилоидом, как бы «зациклившись» на классике. Но некоторые лаборатории все равно исследовали ApoE, несмотря на равнодушие финансирующих учреждений и научного сообщества и на отсутствие ресурсов, необходимых для проведения масштабных экспериментов.
Рисунок 1. Носители аллеля APOE4 более подвержены развитию болезни Альцгеймера по сравнению с теми, кто унаследовал две копии аллеля APOE3
Долгое время было неизвестно, какие функции белок ApoE выполняет в головном мозге, и постепенно эта головоломка стала интересовать многих нейрофизиологов. Интерес к липопротеинам продолжал расти, — отчасти потому, что клинические испытания лекарств, нацеленных на β-амилоид, часто заканчивались неудачей. Многие исследователи начали скрупулезно изучать белок ApoE4 и, как следствие, привлекли внимание фармацевтических компаний. «Амилоидные подходы» постепенно перестали использовать, зато начали разрабатывать препараты, направленные на аполипопротеин.
«Несмотря на отсутствие уверенных доказательств, амилоидная гипотеза стала в свое время сильным научным постулатом», — говорит Завен Хачатурян, президент некоммерческой компании «Предотвратим Болезнь Альцгеймера» (Prevent Alzheimer’s Disease 2020) и бывший координатор деятельности, связанной с исследованием БА в Национальных институтах здоровья США. До недавнего времени, по его словам «никто не пытался задать фундаментальный вопрос — правильно ли мы определили основную предпосылку болезни?».
Жесткая конкуренция
Существуют разные доводы относительно того, почему открытие Роузеса было проигнорировано. Многие сходятся во мнении, что генетик выбрал неудачное время для обнародования своих результатов. В 1991 году Джон Харди (John Hardy) и Дэвид Олсоп (David Allsop) предложили «гипотезу амилоидного каскада». Они утверждали, что болезнь Альцгеймера является результатом аномального накопления β-амилоидных бляшек в тканях мозга [3]. Научное сообщество поддержало предложенную идею, которую вскоре начали активно финансировать.
Но Роузес не подписался под этой теорией: «. амилоиды являются одними из многих веществ, которые формируют бляшки; в конечном итоге они разрушают клетки и вызывают атрофию мозга. У меня и мысли не было, что это было причиной деменции». Говоря так, он, возможно, хотел скрыть возможную связь ApoE/Аβ, и случайно создал конкуренцию между двумя гипотезами за финансирование. К сожалению, Роузес так и не получил гранты для работы с ApoE.
Были и технические препятствия для изучения ApoE. Белок входит в состав различных липопротеинов плазмы крови и является довольно сложной фармакологической мишенью при работе с головным мозгом. ApoE имеет липофильную часть и поэтому при биохимическом анализе может агрегировать с другими молекулами. Работа с такими белками требует глубокого понимания биохимии липопротеинов и методик работы с ними.
Три оставшихся препарата, которые нацелены на β-амилоид, в настоящее время проходят испытания на больных, а также на людях с высоким риском БА, у которых еще не развились симптомы. Позитронно-эмиссионная томография показала, что мозг подопытных с высоким риском развития БА отличается от здорового мозга за десятилетия (!) до того, как начинает накапливаться β-амилоид или разрушаться нейроны [4]. В результате исследований, которые будут проводиться в течение следующих шести лет, ученые поймут, способны ли данные лекарства отсрочить наступление заболевания или нет. Среди исследователей и представителей фармацевтической индустрии появилось ощущение, что это — последний шанс для амилоидной гипотезы. На фоне этих сомнений ApoE вновь оказался в центре внимания.
По словам Мака, если испытания закончатся неудачей, ученые будут отчитываться перед инвесторами, предоставляя все данные доклинических и ранних клинических испытаний. Он надеется, что исследователи АроЕ вскоре получат большое преимущество. Несмотря на препятствия в этой области, у ученых продолжает крепнуть подозрение, что именно ApoE4 является предпосылкой для возникновения болезни. Этот факт подтверждают группы Мака и Гольцмана (Holtzman) в опытах на трансгенных мышах, которые несут в себе изоформы ApoE человека.
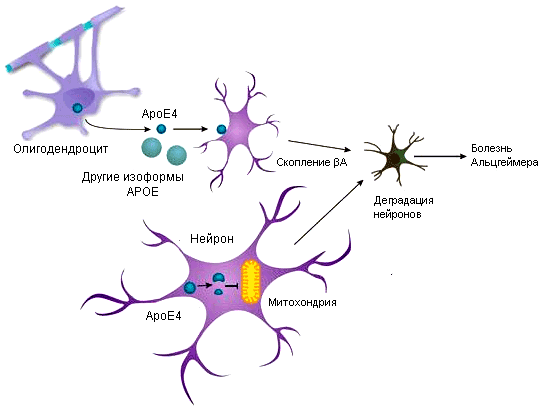
Скорее всего, ApoE участвует в развитии БА двумя различными путями, один из которых — амилоид-зависимый. И у животных, и у человека ApoE4 способствует отложению Aβ в мозговом веществе, в то время как ApoE3 считается «нейтральной» изоформой, а ApoE2 — «защитной» формой, уменьшающей накопление бляшек [5]. «Это достаточно убедительные данные», — говорит Хольцман.
Другой механизм не предусматривает взаимосвязи с амилоидом. Когда нейроны находятся в состоянии стресса, они экспрессируют ApoE для своего восстановления. «Плохая» форма — ApoE4, — как правило, разрушается на токсичные фрагменты, которые повреждают митохондрии и модифицируют цитоскелет.
Рисунок 2. Две расходящиеся гипотезы о том, как АроЕ способствует болезни
Оценить вклад этих двух механизмов в риск развития болезни Альцгеймера крайне сложно, говорит Хольцман, но он и его коллеги считают, что трансформация вредоносной изоформы ApoE в «нейтральную» может стать перспективным подходом для лечения БА. В Гладстоне исследователи начали изучать этот вопрос, и уже найдены небольшие регуляторные молекулы, которые трансформируют ApoE4 в ApoE3-образный белок и тем самым снижают аномальную фрагментацию первого [7]. В культуре клеток даже низкие концентрации этих молекул могут уменьшить разрушение митохондрий и дисфункцию нейронов [8]. В настоящее время эти молекулы проходят испытания на животных, и если они в конечном счете окажутся безопасными и эффективными, врачи будут назначать их пациентам, предрасположенных к БА, так же, как статины — больным с высоким уровнем холестерина и с повышенным риском сердечно-сосудистых заболеваний.
Более чем достаточно
Несмотря на отсутствие грантов на исследования ApoE, Роузес никогда не сдавался. Но через несколько лет, когда его группа обнаружила связь между ApoE и болезнью Альцгеймера, он устал от постоянного денежного противостояния и оставил науку. Проработав в фармацевтической индустрии десять лет, в течение которых он не переставал исследовать ApoE, в 2008 году он снова возвращается в Дьюковский университет.
В 2009 году его группа описала участок некодирующей ДНК с геном TOMM40, который располагается рядом с APOE на девятнадцатой хромосоме. Этот участок ДНК (сокращенно — 523) варьирует по длине и, в зависимости от этого, может определять уровень экспрессии генов TOMM40 и АРОЕ [9].
По словам Роузеса, это было важное открытие, так как белок, кодируемый геном TOMM40 — Tom40, — является необходимым для «здоровых» митохондрий. Tom40 образует канал во внешней митохондриальной мембране, через который импортируются белки, необходимые для нормального деления этой органеллы. «Мы знали о существовании такого механизма в течении 10 лет, — говорит ученый, — но то, что он приводит к болезни Альцгеймера, мы и не подозревали».
Роузес продолжал утверждать, что участок 523 можно использовать для разработки терапии и более точного предсказания болезни. Подавляющее большинство людей рискует встретиться со своим Альцгеймером, если только проживет достаточно долго, а ведь носителями аллеля APOE4 являются только 25% населения. Значит, тест на носительство этого аллеля никогда не будет до конца точным предиктором. Но генотипирование по обоим генам — АРОЕ и TOMM40 — может существенно увеличить точность, как говорит Роузес. В его лаборатории открыли, что APOE3 — наиболее частая изоформа — обычно наследуется вместе или с коротким, или с очень длинным участком 523. И у носителей двух аллелей APOE3 возраст наступления заболевания будет зависеть от конкретного варианта участка 523, наследуемого вместе с APOE.
Некоторым лабораториям удалось найти доказательства, подтверждающие гипотезу Роузеса, однако у других повторить исследования на TOMM40 так и не удалось, и возникли сомнения в реальности влияния этого гена на риск развития БА [10]. Однако Роузес не сомневается в правильности своих гипотез и считает, что геномные исследования, не подтвердившие его результатов, обладали недостаточной силой для выявления сцепливания TOMM40 и болезни Альцгеймера.
Роузес надеется, что вскоре он сможет подкрепить свои результаты клиническими исследованиями, которые будут проводиться в основанной им компании Zinfandel Pharmaceuticals. Вместе с японской фармацевтической компанией Takeda Зинфандель в настоящее время финансирует фазу III клинических испытаний (под названием TOMMORROW), призванную проверить идеи Роузеса на деле. TOMMORROW должна оценить риски развития БА в зависимости от возраста пациента и вариантов APOE и TOMM40. Для запуска программы будут отобраны около 6000 здоровых пожилых людей, и исследования будут продолжаться около 5 лет.
Программа будет также исследовать возможность того, что пиоглитазон — препарат для лечения пациентов с сахарным диабетом 2 типа, — в малых дозах будет задерживать развитие БА у лиц, отнесенных к группе высокого риска развития болезни Альцгеймера. Проверка этой идеи вызвана тем, что опубликованы результаты опытов на животных и даже на людях, которые говорят о способности пиоглитазона предотвращать или уменьшить патологию и симптомы, связанные с болезнью Альцгеймера [11]. Роузес думает, возможный механизм этого — стимуляция деления митохондрий.
Даже если получить мощное лекарство против болезни Альцгеймера так и не удастся, толк в этих испытаниях все равно будет: научившись задерживать развитие БА хотя бы на два года, можно уменьшить число больных в США через 50 лет на 2 млн. человек, что очень и очень неплохо [12]. Кроме того, результаты этих испытаний заставят исследователей всего мира по-новому взглянуть на деменцию. Такое сложное расстройство, как болезнь Альцгеймера, нельзя изучать только с одной стороны, — пусть и включающей ApoE4 или еще что-нибудь. По-видимому, нейрофизиологи близки к тому, чтобы признать ограниченность своих прежних взглядов и частично пересмотреть их, направив исследования по новым дорожкам, в конце которых будет разгадка проблемы, лишающей нас ума.
По материалам рубрики News Feature в Nature [13].