болезнь альперса что это
Болезнь альперса что это
Синонимы синдрома Альперса. Диффузная прогрессирующая атрофия коры головного мозга (Wolf, Cowen). Прогрессирующая диффуззная дегенерация серого вещества головного мозга (Alpers). Poliodystrophia cerebri progressiva infantilis (Christensen, Krabbe). Диффузный кортикальный склероз (Rusk, Nixon). Семейная дегенерация серого вещества у детей (Ford et al.).
Определение синдрома Альперса. Диффузная прогрессирующая дегенерация коры больших полушарий мозга у детей с явлениями так называемого кортикального склероза.
Автор. Alpers Bernard J. — американский нейрохирург, Филадельфия. Синдром впервые описан в 1931 г.
Этиология и патогенез синдрома Альперса. Вероятно, семейно-наследственное заболевание, однако встречаются и спорадические случаи. Нозологическая самостоятельность еще не установлена.
Патологическая анатомия синдрома Альперса. Диффузное исчезновение ганглиозных клеток, пролиферация микроглии, астроцитарный глиоз. Особенно тяжелые изменения обычно обнаруживают в сером веществе головного мозга и мозжечка, а также в зрительном бугре и в области клеток базальных ганглиев. Макроскопически эти данные соответствуют тяжелой диффузной мозговой атрофии.
Дифференциальный диагноз синдрома Альперса. S. Greenfieb. S. Wilson S. Тау—Sachs, S. Krabbe (I). S. Pelizaeus—Merzbacher. S. Alexander. Энцефалит van Bogaert. S. Hallervorden—Spatz. S. Friedman—Roy. S. West.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лечение в Италии
(925) 50 254 50
Синдром Альперса (прогрессирующая или инфантильная полидистрофия мозга) — наследственное заболевание с аутосомно-рецессивным механизмом передачи. Относится к группе болезней, связанных с дефектом функционирования митохондрий, что приводит к нарушению энергетических функций в организме, замедлению психомоторного развития, эпилептическим припадкам и печеночным поражениям.
Впервые синдром описал Альфонс Мария Якоб – учитель американского нейрохирурга Бернарда Якоба Альперса. Последний опубликовал результаты исследования своего наставника в 1931 году.
Заболевание проявляет себя в младенческом возрасте внезапными судорожными припадками – генерализованными или локальными. Явные признаки поражения печени отсутствуют, но при биохимических печеночных пробах наблюдаются некоторые изменения. Следующими симптомами заболевания являются задержка в психомоторном и физическом развитии, мышечная гипотония, нарушение координации движений. Возможны также рвота, снижение зрения и слуха, быстропрогрессирующие заболевания печени, переходящие в цирроз и печеночную недостаточность.
Синдром Альперса различается двумя формами:
Похожие расстройства:
На данный момент существует несколько исследований, по результатам которых диагностируют заболевание:
Сегодня невозможно остановить развитие этой болезни. Тем не менее, некоторые из симптомов можно взять под контроль с тем, чтобы пациент чувствовал себя как можно комфортнее, при этих обстоятельствах. Физиотерапевты могут помочь родителям с поиском более комфортных позиций для ребенка в позиции сидя или стоя. Любые другие методики лечения болезни Альперса только симптоматические и поддерживающие.
! Несмотря на то, что многие из описанных в данном разделе болезней считаются неизлечимыми, в Центре лечения редких заболеваний в Милане постоянно ведется поиск новых методов. Благодаря генной терапии удалось добиться выдающихся результатов и полностью излечить некоторые редкие синдромы.
Болезнь Альперса ( Синдрома Альперса-Хуттенлохера )
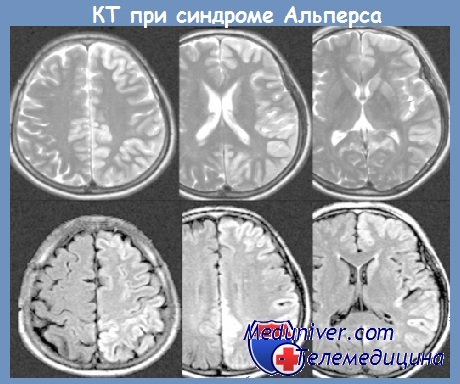
Болезнь Альперса — это редкое митохондриальное заболевание, которое характеризуется прогрессирующей энцефалопатией в сочетании с циррозом печени. Патология возникает вследствие мутации ДНК гамма-полимеразы (POLG1). Синдром проявляется эпилептическими приступами, угнетением психомоторных функций, токсическим поражением печени. Для диагностики используется ЭЭГ, МР-сканирование головного мозга, УЗИ печени, а также лабораторные исследования (биохимический анализ крови, коагулограмма, генетический тест). Терапия поддерживающая: антиконвульсанты, метаболические препараты, парентеральное питание.
МКБ-10
Общие сведения
Заболевание было впервые описано Б. Альперсом в 1931 г. у 4-месячной девочки с резистентными эпилептическими приступами. В 1976 г. П.Хуттенлохер уточнил характер наследования патологии, дополнил описание клинической картины. Частота встречаемости синдрома Альперса-Хуттенлохера составляет 1 случай на 100000 живорожденных детей. Болезнь отличается неблагоприятным течением, быстрым ухудшением состояния пациентов, присоединением соматических заболеваний, поэтому, несмотря на редкость, она не теряет актуальности в современной неврологии.
Причины
Болезнь Альперса обусловлена мутацией гена POLG1 (в локусе 15q25), который отвечает за функционирование гамма-полимеразы в митохондриях. Самые распространенные генные дефекты — A467T и W748S. Заболевание наследуется по аутосомно-рецессивному механизму, поэтому вероятность повторения патологии составляет 25% при следующей беременности. Риск развития синдрома повышается при близкородственных браках, другие предрасполагающие факторы не установлены.
Патогенез
Молекулярную основу заболевания составляет недостаточность гамма-полимеразы — единственной эукариотической ДНК-полимеразы, поддерживающей репликацию ДНК в митохондриях. При синдроме Альперса уровень репликации генетического материала снижается до критического, ухудшается активность митохондриальных ферментов. Дефицит АТФ сказывается на наиболее энергозависимых структурах — органах центральной и периферической нервной системы, печени, ЖКТ.
При болезни Альперса первыми поражаются проводники глубокой чувствительности, расположенные в задних столбах спинного мозга, также нарушаются функции мозжечка. Вовлечение в процесс коры обусловлено патологической электрической активностью в головном мозге. Резистентные к препаратам судорожные приступы обычно провоцируют склероз гиппокампа.
Симптомы болезни Альперса
Типичный возраст манифестации заболевания — от 2 до 4 лет, хотя описаны случаи раннего (3-4 месяца) и позднего начала болезни (до 8 лет). Для синдрома Альперса характерно бимодальное распределение, второй пик приходится на период 17-24 года. До появления первых клинических признаков дети имеют нормальное психомоторное развитие, достаточный уровень интеллекта. После старта неврологической симптоматики происходит резкий регресс ранее приобретенных навыков.
В половине случаев болезнь Альперса манифестирует судорожными приступами. Это могут быть фокальные судороги, миоклонические формы (ритмичные мышечные подергивания без спазмов мускулатуры), генерализованные тонико-клонические судороги, которые называют «большим эпилептическим пароксизмом». У детей первые приступы часто провоцируются фебрильной лихорадкой при инфекционных заболеваниях.
Синдром Альперса характеризуется множественными неврологическими нарушениями. У больных наблюдается шаткость походки, дискоординация движений, расстройства мелкой моторики. Сенсорная полинейропатия проявляется нарушением всех видов чувствительности, парестезиями. Как правило, возникают расстройства зрения (корковая слепота). Беспокоят мигренозные головные боли, в том числе как компонент ауры судорожных приступов.
Важным симптомом болезни является поражение печени. Клинически это проявляется тошнотой, ухудшением аппетита, нарушениями пищеварения. Зачастую больной испытывает слабость, сонливость, у него усугубляется неврологический дефицит. При угнетении синтеза печеночных факторов свертывания открываются спонтанные кровотечения из носа, десен, легких или желудочно-кишечного тракта.
Осложнения
Наиболее опасное последствие синдрома Альперса — фатальный токсический гепатит, который возникает при приеме препаратов из группы вальпроевой кислоты, купирующих судорожные приступы. При этом развивается тяжелая печеночная недостаточность, из-за чего пациенты погибают на протяжении 2-4 месяцев, независимо от проводимого лечения. Поражение гепатобилиарной системы может проявляться изменением архитектоники желчных путей, фиброзом печени.
При прогрессировании заболевания на фоне мышечной гипотонии развивается дисфагия, нарушения перистальтики ЖКТ. Возникает необходимость во введении желудочного зонда или использовании парентерального питания. Изредка поражение пищеварительной системы дополняется панкреатитом. У 10% больных развивается кардиомиопатия, результирующая тяжелой сердечной недостаточностью.
Диагностика
При первичном приеме у детского невролога выявляется атипичная эпилептическая энцефалопатия, которая требует обязательного подтверждения или исключения болезни Альперса. К обследованию больного привлекают генетика, гепатолога, кардиолога. Учитывая полиморфность клинических проявлений, для верификации диагноза назначаются инструментальные и лабораторные методы исследования:
Лечение болезни Альперса
Консервативная терапия
Сложность оказания медицинской помощи страдающим болезнью Альперса связана с отсутствием эффективных этиопатогенетических медикаментов. Лечащим врачом индивидуально для пациента подбирается симптоматическая терапия, которая корректирует неврологические нарушения, стабилизирует параметры гомеостаза. Лечение проводится в неврологических или реанимационных отделениях, применяются следующие группы препаратов:
Паллиативная помощь
Поскольку болезнь всегда заканчивается смертью пациента, необходимо обеспечить полноценный уход и медицинскую помощь на терминальном этапе заболевания. Лечение предполагает внутривенную гидратацию и введение питательных смесей, купирование судорог, устранение гипоксии путем гипербарической оксигенации, кислородной поддержки, ИВЛ. В рамках паллиатива проводится социальная и психологическая помощь членам семьи больного.
Прогноз и профилактика
Решающее значение во вторичной профилактике болезни имеет контроль показателей крови во время лечения больных с эпилепсией с помощью препаратов вальпроевой кислоты. При повышении показателей печеночных проб и снижении уровня тромбоцитов неврологи должны предполагать возможность митохондриальной патологии, своевременно направлять пациента на консультацию в генетический центр.
Alpers Disease
Related terms:
Mitochondrial Hepatopathies
Alpers Syndrome (Alpers-Huttenlocher Syndrome or Alpers Hepatopathic Poliodystrophy)
Diagnostic criteria include refractory mixed-type seizures with a focal component; psychomotor regression that is episodic and triggered by intercurrent infections; and hepatopathy with or without acute liver failure. Alpers syndrome manifests from infancy up to 8 yr of age with seizures, hypotonia, feeding difficulties, psychomotor regression, and ataxia. Patients develop hepatomegaly and jaundice and have a slower progression to liver failure than those with cytochrome- c oxidase deficiency. Elevated blood or cerebrospinal fluid lactate and pyruvate levels are supportive of the diagnosis, in addition to characteristic electroencephalographic findings (high-amplitude slow activity with polyspikes), asymmetric abnormal visual evoked responses, and low-density areas or atrophy in the occipital or temporal lobes on computed tomography scanning of the brain. In some patients complex I deficiency has been found in liver or muscle mitochondria. The disease is inherited in an autosomal recessive fashion; mutations in the catalytic subunit of the nuclear gene mtDNA POLG have been identified in multiple families with Alpers syndrome, leading to the advent of molecular diagnosis for Alpers syndrome. Patients with POLG mutations are susceptible to valproate-induced liver dysfunction.
Alpers’ Disease (Progressive Infantile Poliodystrophy)☆
Introduction
Alpers’ disease, also called Alpers-Huttenlocher syndrome, progressive infantile poliodystrophy, or mitochondrial deoxyribonucleic acid (DNA) depletion syndrome-4A, is an autosomal recessive genetic syndrome of progressive refractory seizures, hepatopathy, and two of 11 other findings (described by Nguyen et al., 2006; as modified by Cohen and Naviaux, 2010):
Elevated cerebrospinal fluid (CSF) protein (>100 mg dL −1 ).
Brain proton MRS showing reduced N-acetyl aspartate, normal total creatine, and elevated lactate.
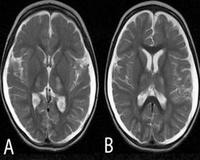
Cerebral volume loss (central > cortical) on repeat brain magnetic resonance imaging (MRI) or computed tomography studies.
Electroencephalography (EEG) showing a multifocal paroxysmal activity with high-amplitude slow waves (200–1000 V, 0.75–3 Hz), and asymmetric low-amplitude polyspikes (10–100 V, 12–25 Hz).
Cortical blindness or optic atrophy.
Abnormal visual evoked potentials and normal electroretinogram.
Quantitative mitochondrial DNA depletion in skeletal muscle or liver (35% mean).
Deficiency in polymerase γ (POLG) enzyme activity (10%) in skeletal muscle or liver.
Elevated blood or CSF lactate (3.0 mM) on at least one occasion in the absence of acute liver failure.
Isolated complex IV or a combined complex I, III, and IV electron transport complex defects (20% of normal) upon liver respiratory chain testing.
A sibling confirmed to have Alpers’ syndrome.
The eponym refers to a case report of Alpers (1931) in which he described a young infant who had acute onset of intractable seizures followed by spasticity and resulting in death, and at autopsy he was found to have severe degeneration of cortical neurons. Fewer than 100 cases of this syndrome have been described, although a population-based study revealed a preschool-age incidence of 1 in 51 000. Most patients present with loss of cognitive and motor skills, sometimes after a period of preexisting developmental delay, and intractable seizures that can be generalized tonic-clonic, partial motor, infantile spasms, or occasionally, epilepsia partialis continua. Seizures are the initial symptom in about half of cases. Myoclonus and choreoathetosis are frequently present, and neuropathy (typically with areflexia) and ataxia are universal unless death occurs early in the disease course. Cortical vision loss is a later finding, and abnormal eye movements may occur due to dysfunction of both the central and peripheral nervous systems. Generalized hypotonia is often initially observed, but as the disease progresses patients become spastic, ultimately progressing to decerebration and death. Majority of the patients will manifest liver disease, typically indolent liver disease progressing slowly to end-stage liver failure, with multiple, variable histological abnormalities (see section Pathology ). Liver failure may be accelerated by the administration of valproic acid but may also occur without that drug. In some cases, liver failure progresses rapidly.
The age at onset of symptoms is usually between 2 and 4 years, with death occurring by the age of 5 or 6. There are atypical forms of this syndrome with a later onset of symptoms and signs, with a second peak at 17–24 years, and cases reported up to age 25–35 years.
Alpers-Huttenlocher Syndrome
Abstract
Alpers-Huttenlocher syndrome is an uncommon mitochondrial disease most often associated with mutations in the mitochondrial DNA replicase, polymerase-γ. Alterations in enzyme activity result in reduced levels or deletions in mitochondrial DNA. Phenotypic manifestations occur when the functional content of mitochondrial DNA reaches a critical nadir. The tempo of disease progression and onset varies among patients, even in identical genotypes. The classic clinical triad of seizures, liver degeneration, and progressive developmental regression helps define the disorder, but a wide range of clinical expression occurs. The majority of patients are healthy before disease onset, and seizures herald the disorder in most patients. Seizures can rapidly progress to medical intractability, with frequent episodes of epilepsia partialis continua or status epilepticus. Liver involvement may precede or occur after seizure onset. Regardless, eventual liver failure is common. Both the tempo of disease progression and range of organ involvement vary from patient to patient, and are only partly explained by pathogenic effects of genetic mutations. Diagnosis involves the constellation of organ involvement, not the sequence of signs. This disorder is relentlessly progressive and ultimately fatal.
Mitochondrial disorders
8.8.1 Alpers–Huttenlocher Syndrome 38,39 (OMIM #203700)
Alpers–Huttenlocher syndrome (AHS) is an autosomal recessive disorder caused by mutations in the POLG gene. This gene encodes DNA polymerase gamma, which is essential for mitochondrial DNA replication. Over 60 mutations are currently known that result in this phenotype. Deficiency of this function results in a mitochondrial DNA depletion syndrome. While mutations in POLG can result in other phenotypes, Alpers–Huttenlocher disease is the most severe. Hallmark features of this disorder, with typical onset between the ages of 2 and 4 years of age, include intractable seizures, developmental regression, and liver dysfunction. While lactic acid levels may be within reference ranges, liver dysfunction is always present. There is a bimodal age of onset, with a second peak of onset between the ages of 17 and 24 years of age. Symptoms are progressive and ultimately fatal. Exposure to valproic acid is often implicated as a trigger and CSF pleocytosis is often present.
Neurological disorders
Poliodystrophies
MRI can also assist in diagnosing some degenerative diseases affecting predominantly the grey matter in the brain. These include the neuronal ceroid lipofuscinoses (NCLs), Alpers, and the fatal complication of measles, subacute sclerosing panencephalitis (SSPE). This was almost eradicated in many countries by immunization, but has reemerged in some countries following reduced uptake of the measles vaccine. SSPE presents 6–8 years after measles in preschool childhood with progressive dementia, dystonia and visual impairment, and characteristic periodic jerks best identified on EEG.
Juvenile Alpers-Huttenlocher Syndrome
Diagnostic Approach
| Naviaux Diagnostic Criteria for Alpers-Huttenlocher Syndrome Set Forth in 2006 [12,19] : |
| 1. |
Clinical triad of refractory seizures, psychomotor regression, and hepatopathy
In the absence of hepatopathy or additional findings, the diagnosis can be confirmed by polymerase gamma gene sequencing, liver biopsy, or postmortem examination
Additional clinical findings (at least 2 of the 11 findings must be present):
Cranial proton MRS indicating reduced N-acetyl aspartate, normal creatine, and elevated lactate
Elevated cerebrospinal fluid protein (>100 mg/dL)
Cerebral volume loss (central more than cortical, with ventriculomegaly) on repeated MRS imaging or computed tomography
At least one electroencephalogram revealing multifocal paroxysmal activity with high amplitude delta slowing (200–1000μV) and spikes/polyspikes (10–100μV, 12–25Hz)
Cortical blindness or optic atrophy
Abnormal visual-evoked potentials and normal electroretinogram findings
Quantitate mitochondrial DNA depletion in skeletal muscle or liver (35% of the mean)
Deficiency in polymerase gamma enzymatic activity (≤10%) in skeletal muscle or liver
Elevated blood or cerebrospinal fluid lactate (3 mM) on at least one occasion in the absence of acute liver failure
Isolated complex IV or a combination of complex I, III, IV electron transport defects (≤20% of normal) upon liver respiratory chain testing
A sibling confirmed as manifesting AHS
Examining the Naviaux criteria, our case clearly had enough features to have a diagnosis of AHS even without frank clinical hepatopathy. She has AHS and given her age, Juvenile AHS.
Alpers’ Disease (Progressive Infantile Poliodystrophy)
Abstract
Alpers’ disease is an autosomal recessive genetic syndrome characterized by progressive psychomotor retardation, refractory seizures, and hepatopathy. The intractable seizures usually include generalized or partial motor seizures. Initial generalized hypotonia typically evolves to spasticity, decerebration, and death. Most patients manifest liver disease, usually progressing to end-stage liver failure, which may be accelerated by the administration of valproic acid. Electroencephalogram (EEG), magnetic resonance imaging (MRI), magnetic resonance spectroscopy (MRS), and several laboratory studies may be used to establish the diagnosis. Testing for mutations in the associated POLG gene is clinically available. Treatment includes vigorous anticonvulsive therapy, but is generally supportive, and the prognosis is usually poor.
Childhood Alpers-Huttenlocher Syndrome
Genetics
Pediatric Neurology Part III
Alpers syndrome
Progressive infantile poliodystrophy (Alpers syndrome) is a progressive encephalopathy of early onset, characterized by the occurrence of rapid and severe neurological deterioration in early childhood, in a previously healthy or mildly retarded child, with intractable seizures and fatal outcome in a few months ( Harding, 1990; Khan et al., 2012 ). Multifocal seizures and recurrent and intractable status epilepticus are associated with erratic myoclonus. Ictal EEG consists of migrating focal discharges involving, nearly continuously, both hemispheres, mainly the posterior areas. Interictal recordings show high amplitude very slow polyrhythmic activity, with more or less periodic polyspikes mainly in the posterior areas ( Boyd et al., 1986 ). Repeat recordings reveal progressive impoverishment of the tracing, culminating in bursts of suppression of the cerebral activity. Severe cortical atrophy develops in a few months ( Fig. 168.5 ). This degeneration of the gray matter is associated with insidious liver involvement which usually progresses to ultimate hepatic failure. Liver histology may initially be normal or show steatosis with possible progression to cirrhosis. CSF lactate level and spectroscopy can be normal. The cause of Alpers syndrome is genetically quite homogeneous, due to mitochondrial DNA depletion ( Tesarova et al., 2004 ) and mutations in the POLG gene. Interestingly, oxidative phosphorylation in the skeletal muscle is usually normal, supporting the view that a needle biopsy of the liver for the screening of mitochondrial respiratory chain should be performed in case of unexplained epileptic encephalopathy. This needle biopsy of the liver should be performed prior to valproate administration, especially as this drug is likely to trigger hepatic failure and fatal outcome, especially where there is mtDNA depletion.
Epilepsy
Alpers syndrome (Alpers–Huttenlocher syndrome, Alpers hepatopathic poliodystrophy)
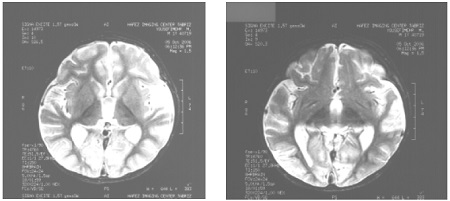
Alpers syndrome, first described in 1931, is a severe progressive encephalopathy with onset in infancy or childhood (onset in adulthood has been seldom reported). Recently the syndrome has been associated with deficiency in mtDNA polymerase gamma (POLG) catalytic activity ( Naviaux et al., 1999; Naviaux and Nguyen, 2004; Isohanni et al., 2011 ). It is characterized by epilepsy, myoclonus, acquired microcephaly, cortical blindness, and spastic tetraparesis, and is associated with hepatic failure that may be precipitated by valproate therapy. The pathological correlate described by Huttenlocher in 1975 is spongy degeneration of gray matter with severe loss of neurons and astrogliosis, and liver steatosis or cirrhosis. The course of epilepsy has been described in patients before and after the identification of the molecular defect: epilepsy may mark the onset of the disease but often it is preceded by developmental delay, failure to thrive, and ataxia. Epilepsy may manifest with simple and complex partial seizures, or with generalized convulsive seizures. It is invariably drug resistant and almost invariably complicated by epilepsia partialis continua or recurrent status epilepticus that may be the cause of death ( Harding, 1990; Engelsen et al., 2008; Wolf et al., 2009a ). Occipital seizures with positive (illusional or delusional) or negative symptoms, nystagmus, or oculoclonus appear to be particularly frequent and are often the first ictal symptoms. Consistent EEG abnormalities are very slow activity, of high amplitude, and rhythmic high-amplitude delta waves with superimposed spikes or polyspikes that involve the occipital leads early on ( Engelsen et al., 2008; Wolf et al., 2009a ). MRI that is normal at the onset of disease shows progressive impairment of gray matter with cortical atrophy and signal abnormalities within the occipital regions, deep cerebellar nuclei, thalamus, and basal ganglia ( Tzoulis et al., 2006 ).
A clinical phenotype resembling those associated with recessive POLG1 mutations has also been described recently in patients carrying recessive mutations of C10orf2, a gene encoding for the mtDNA helicase Twinkle, which works in close connection with POLG1 ( Hakonen et al, 2007 ). A similar clinical phenotype has been described in patients affected by different mitochondrial disorders including defects of pyruvate dehydrogenase and cytochrome c oxidase ( Prick et al., 1981, 1982; Uusimaa et al., 2003 ).