болезнь гофмана что это
Болезнь гофмана что это
Частота возникновения спинальной мышечной атрофии (СМА) I типа составляет 1 на 20 000 живорожденных, частота носительства гена 1 на 60-80 (Pearn, 1980). Она ассоциирована с делецией экзона 7 гена SMN более, чем в 95% случаев.
Делеция в гене NAIP (neuronal apoptosis inhibitory protein — белок, подавляющий нейрональный апоптоз) также найдена в 50-60% случаев I типа СМА (Rodrigues et al., 1996), и представляется, что большая делеция в области 5ql3 коррелирует с тяжелым типом СМА (Spiegel et al., 1996). Тем не менее, 27% случаев I типа СМА имеют только делецию гена SMN. Делеция в экзоне 3 была найдена у некоторых пациентов без делеции экзона 7 (Cobben et al., 1995), являясь результатом сдвига рамки и преждевременного терминирующего кодона.
а) Патоморфология. Основой патологии является бросающаяся в глаза гибель клеток передних рогов. Сохранившиеся мотонейроны участвуют в процессе дегенерации с хроматолизом и возможным фагоцитозом сателлитными клетками. Возможна поразительная сохранность нейронов в шейном отделе (Kuzuhara и Chou, 1981). Зоны глиоза наблюдались в передних корешках (Chou и Nonaka, 1978) и в сморщенных задних корешках. Значение этой находки остается неясным. Признаки вовлечения периферического нерва с потерей больших миелинизированных аксонов (Chien и Nonaka, 1989) скорее согласуются с валлеровской дегенерацией, чем указывают на признак процесса «отмирания».
Но в некоторых случаях имеет место более обширное сенсорное поражение (Anagnostou et al., 2005). Сенсорная невропатия была подтверждена в систематических исследованиях биоптатов икроножного нерва и пониженной скоростью сенсорной проводимости в 6 из 7 случаев СМА I типа, но не II или III типа, выявленной при молекулярных исследованиях (Rudnik-Schoneborn et al., 2003b). Супраспинальные очаги поражения равномерно представлены в моторных ядрах ствола мозга, особенно в ядре п. hypoglossus, nucleus ambiguus и ядре п. facialis. Часто встречается и вовлечение таламуса. Такие поражения могут быть ответственными за патологические изменения сенсорных вызванных потенциалов, включая соматосенсорные и зрительные потенциалы, о чем сообщают Cheliout-Heraut et al. (2003).

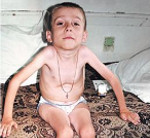
Обратите внимание на суженную из-за паралича межреберных мышц грудную клетку, сгибательное положение пальцев, ретрогнатизм и настороженный вид.
б) Клинические признаки. Клинические признаки начала болезни характерны, позволяя почти сразу поставить диагноз за исключением случаев очень раннего начала. Приблизительно в 30% случаев начало относится к пренатальному периоду, и младенец рождается со слабостью проксимальных отделов конечностей и арефлексией. Слабость распространяется быстро, и через несколько недель отмечается тетраплегия с некоторой сохранностью движений в дистальных отделах, особенно в верхних конечностях. Паралич симметричен и также вовлекает мышцы, связанные с осевым скелетом, особенно шеи.
Паралич межреберных мышц — ключевой признак состояния. Он приводит к характерной деформации грудной клетки, которая распластана и остается неподвижной или, как это ни парадоксально, уменьшается в окружности при вдохе, тогда как живот выпячивается, напоминая движение качелей. Дыхательные движения выполняются почти исключительно диафрагмой, которая сохранна до поздних стадий болезни. Ретрогнатизм, иногда сопровождающийся фасцикуляцией мышц подбородка, является постоянным и, вместе с неизмененными движениями глаз и живым взглядом, завершает характерную картину внешнего вида пациентов.
Глубокие сухожильные рефлексы утрачены. Фасцикуляции языка часто присутствуют, но их трудно отличить от частых дрожательных движений языка у нормальных детей. Отсутствуют признаки сенсорного дефицита, пирамидных знаков и нарушений работы сфинктера. Интеллект сохранен, и младенцы обычно описываются как очень привлекательные.
Тип 0 спинальной мышечной атрофии (СМА) (Dubowitz, 1999) обозначает самую тяжелую степень болезни с пренатальным началом, приводящую к смерти или неспособности начать и поддерживать дыхание с момента рождения. Эта форма требует неотложной механической респираторной поддержки, и внимания к значительным трудностям с глотанием. Похожие случаи описывают MacLeod et al. (1999). Даже в пределах этой формы степень тяжести может варьировать, подтверждая, таким образом, концепцию континуума тяжести заболевания.


Биоптат мышцы, демонстрирующий пучковую (фасцикулярную) атрофию, типичную для поражения клеток передних рогов.
Обратите внимание, что атрофированные волокна сохраняют округлый контур.
Он необычен при спинальной мышечной атрофии с более поздним началом, при которой, как правило, наблюдаются угловатые атрофированные волокна.
в) Диагноз. Диагноз спинальной мышечной атрофии (СМА) I может быть подтвержден электромиографическим исследованием, которое показывает неврогенные изменения со снижением паттерна активности во время максимального усилия, увеличением продолжительности и амплитуды отдельных потенциалов моторной единицы, и увеличением сферы распространения полифазных потенциалов. Спонтанная активность в форме ритмической импульсации двигательных единиц присутствует в 69% случаев, и фибрилляции и положительные острые волны выявляются в 35% (Hausmanowa-Petrusewicz и Karwanska, 1986), но фасцикуляции редко видны у маленьких детей. Значительные потенциалы вызываются расширением зоны регенерации моторных единиц, принятой сохранившимися клетками передних рогов. Полифазные потенциалы распространены и, вероятно, являются результатом наличия в мышцах многочисленных групп мелких волокон без признаков реиннервации и менее плотно упакованных волокон в пределах двигательной единицы.
Скорость проведения по нерву нормальная или немного замедленная у большинства пациентов, но может наблюдаться более заметное снижение, особенно у тяжело пораженных пациентов (Imai et al., 1990).
Уровень креатинкиназы сыворотки обычно нормальный, хотя может быть несколько повышен у младенцев с быстро прогрессирующей формой.
Биопсия мышцы демонстрирует пучки маленьких округленных волокон, которые относятся как к I, так и ко II типу. Гипертрофированные волокна разбросаны среди атрофических пучков и принадлежат к типу I. Нормальный рисунок типа шахматной доски заменяется вариантом группировки больших количеств волокон одного типа. Биопсия мышцы не является необходимой для диагноза СМА, когда клинические и ЭМГ-данные характерны, и подтверждение оптимально при генетическом тестировании. Действительно, биопсию может быть трудно интерпретировать в начальной стадии заболевания или из-за проблем, связанных с препаратом, в то время как клинический и электромиографический диагноз не вызывает сложностей при интерпретации клинических признаков.
Диагностические тесты, основанные на анализе ДНК, в настоящее время заменили прежние диагностические методы. Они также эффективны для пренатальной диагностики (Stewart et al., 1998; Milunsky и Cheney, 1999) и имеют высокий уровень надежности благодаря отсутствию контаминации материнской ДНК. Jedrzejowska et al. (2005) смогли поставить диагноз в 263 из 266 случаев (96,6%), исследованных путем выявления экзона 7 стандартной ПЦР и количественной ПЦР в реальном времени для более сложных случаев. В настоящее время возможен достоверный предимплантационный диагноз (Malcov et al., 2004; Burlet et al., 2005).
Дифференциальный диагноз спинальной мышечной атрофии (СМА) типа 1 обычно не представляет сложности даже с учетом множества причин для гипотонии в грудном возрасте. Врожденные миопатии и врожденные мышечные дистрофии могут представлять сходную картину с отсутствием сухожильных рефлексов. Вовлечение дыхательной системы в подобных случаях отличается переднезадним выравниванием грудной клетки в противоположность боковому сжатию при СМА. Обычно присутствует поражение лица, а неврогенный ЭМГ-паттерн не наблюдается. Уровень креатинкиназы повышен. Обязательно нужно учитывать миастению как поддающееся лечению состояние, но клиническая картина отличается преобладающим в большинстве случаев вовлечением лица и глаз. Поперечное рассечение спинного мозга и врожденные спинальные опухоли в некоторых случаях могут демонстрировать поверхностное сходство, особенно в отношении вовлечения дыхательных мышц и деформации грудной клетки. Поэтому важно систематическое исследование чувствительности в нижней части тела и малых пирамидных знаков.
Инфантильный гликогенов типа 2 (болезнь Помпе), вызывающий подобное обширное вовлечение мышц, всегда связан с поражением сердца и, часто, с симптомами со стороны ЦНС. Описаны редкие случаи врожденной или ранней невропатии (Korinthenberg et al, 1997). У таких пациентов отмечается снижение нервной проводимости и возможны признаки сенсорных нарушений. В ЦСЖ может быть повышен белок (глава 20). Редкое митохондриальное заболевание с дефицитом цитохрома с вызывает тяжелую гипотонию с дыхательной недостаточностью в период новорожденности. Могут присутствовать почечные тубулярные симптомы и аномалии ЦНС (DiMauro et al., 1985). Необычная форма этой болезни возникает из-за преходящего дефицита цитохрома с, и выздоровление связано с отсроченным созреванием фермента (Zeviani et al., 1987). Необычные случаи гликогеноза IV типа могут давать сходную картину (Тау et al, 2004).
д) Лечение. Эффективное лечение еще недоступно. Показано интенсивное лечение респираторных инфекций. Механическая вентиляция легких вызывает расширение и рост легких и может продлить выживание пораженных младенцев и облегчить страдания родителей, но интенсивность терапии, и особенно показания к длительной механической вентиляции чрезвычайно сложно оценить с позиций гуманизма и этики (Gilgoff et al., 1989; Gordon, 1991).
Редактор: Искандер Милевски. Дата публикации: 10.1.2019
Детская спинальная мышечная атрофия I тип (болезнь Верднига-Гоффманна)
Общая информация
Краткое описание
Протокол «Детская спинальная мышечная атрофия I тип (болезнь Верднига-Гоффманна)»
Коды по МКБ: G 12.0
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
1. Злокачественная инфантильная спинальная амиотрофия.
2. Хроническая инфантильная спинальная амиотрофия.
3. Поздне-детская форма спинальной амиотрофии.
Диагностика
Диагностические критерии
Лабораторные исследования: общий анализ крови и мочи без патологии.
Инструментальные исследования
Наличие в биоптатах скелетных мышц групп мелких круглых волокон, гипертрофированных волокон I типа и атрофированных волокон I и II типов.
Показания для консультации специалистов:
Минимум обследования при направлении в стационар:
— общий анализ крови;
Основные диагностические мероприятия:
1. Общий анализ крови (6 параметров).
3. Осмотр психолога, логопеда.
Дополнительные диагностические мероприятия:
2. УЗИ органов брюшной полости.
3. Компьютерная томография.
Дифференциальный диагноз
Признак
Спинальная мышечная атрофия
Структурные миопатии
ДЦП, атонически-астатическая форма
Генерализованная мышечная гипотония, атрофии мышц и фасцикуллярные подергивания в мышцах спины, туловища, проксимальных отделах верхних и нижних конечностей, гипорефлексия до арефлексии, задержка моторного развития при сохранном психо-речевом развитии
Мышечная гипотония преимущественно в проксимальных отделах конечностей, гипотрофия мышц, гипорефлексия, утомляемость мышц, задержка психо-речевого развития, костно-суставных стоп, пальцев
Мышечная гипотония, гипорефлексия с последующей гиперрефлексией, задержка психо-рече-моторного развития, судороги, деформации (сколиоз, деформации грудной клетки)
Дебют заболевания в пренатальном периоде и в первые 6 месяцев жизни
Дебют заболевания в неонатальном периоде, задержка моторного развития
Дебют заболевания с рождения
Признаки денервации при ЭМГ исследовании, II тип ЭМГ
I тип ЭМГ со снижением амплитуды
I тип ЭМГ со снижением амплитуды
Непрогрессирующий или медленно прогрессирующий характер
Постепенная положительная динамика с улучшением двигательных функций
Спорадический и аутосомно-рецессивный
Наследственность не отягощена
Лечение
Тактика лечения
Цели лечения:
1. Коррекция двигательных нарушений.
2. Обеспечить больному социальную адаптацию.
3. Определить форму спинальной амиотрофии и обеспечить адекватное лечение.
Немедикаментозное лечение:
2. Лечебная физкультура.
4. Ортопедическая коррекция.
Медикаментозное лечение:
1. Антиоксидатная терапия:
— никотинамид 10-20 мг/сут.;
2. Общеукрепляющая терапия: витамины группы В, фолиевая кислота, препараты магния.
3. Аминокислоты: церебролизин, метионин, глутаминовая кислота.
4. Препараты, влияющие на тканевой метаболизм: рибоксин, карнитин, коэнзим Q.
5. Препараты, улучшающие периферическое кровообращение: трентал, теоникол.
Профилактические мероприятия: полноценное белковое питание с ограничением углеводов, жиров; отдых, профилактика инфекций, контрактур.
Дальнейшее ведение: диспансерный учет у невропатолога по месту жительства. Регулярно занятия ЛФК, проводить курсы поддерживающей терапии через каждые 3-4 месяца.
Основные медикаменты:
2. Актовегин ампулы по 2 мл, 80 мг
3. Винпоцетин (кавинтон), таблетки 5 мг
4. Пиридоксина гидрохлорид, ампулы по 1 мл, 5%
5. Прозерин ампулы по 1 мл, 0,05%
6. Фолиевая кислота, таблетки 0,001
7. Церебролизин, ампулы по 1 мл
8. Цианокобаламин, ампулы по 200 и 500 мкг
Дополнительные медикаменты:
1. Гинко- Билоба, (Танакан) таблетки 40 мг
2. Глицин, таблетки 0,1
3. Дибазол, таблетки 0,02
4. Карнитин хлорид, 20%, 100 мл во флаконах
6. Метионин, таблетки 0,25
7. Нейромидин, таблетки 20 мг
8. Нейромультивит, таблетки
9. Неуробекс, таблетки
10. Никотинамид, таблетки 0,025, ампулы 2,5%, 1 мл
11. Пирацетам, ампулы 5 мл, 20%
12. Пирацетам, таблетки 0,2
13. Рибоксин, таблетки 0,2
14. Сермион ампулы и таблетки 5 мг, 10 мг
15. Тиамина хлорид, ампулы 1 мл, 5%
16. Цитохром С, 025%, 4 мл во флаконе, таблетки 10 мг
Индикаторы эффективности лечения:
1. Стабилизация патологического процесса.
2. Повышение мышечного тонуса.
3. Увеличение двигательной активности.
Госпитализация
Показания к госпитализации (плановая): прогрессирующая мышечная слабость, атрофии мышц, дрожание конечностей, ограничение активных движений, мышечная гипотония, отставание в моторном развитии.
Информация
Источники и литература
Информация
Список разработчиков:
Разработчик
Место работы
Должность
Мухамбетова Гульнара Амерзаевна
Каз.НМУ, кафедра нервных болезней
Ассистент, кандидат медицинских наук
Кадыржанова Галия Баекеновна
РДКБ «Аксай», психоневрологическое отделение №3
Серова Татьяна Константиновна
РДКБ «Аксай», психоневрологическое отделение №1
Балбаева Айым Сергазиевна
РДКБ «Аксай», психоневрологическое отделение №3
Причины и диагностика спинальной мышечной атрофии (СМА)
Отмирание моторных нейронов приводит к прогрессивному развитию слабости мышц, их атрофии, и в итоге, обездвиживанию пациента. Спинальная мышечная атрофия делится на несколько типов, в зависимости от того, насколько серьезны симптомы и в каком возрасте они начались:
Частота и тип наследования СМА
Спинальная мышечная атрофия встречается у 1 из 6000 — 10 000, с частотой носительства 1 из 38 человек. Больной ребенок рождается, при наличии двух мутаций, со стороны матери и со стороны отца. Родители, являющиеся носителями мутации в гене SMN1, не имеют клинических симптомов. Спинальная мышечная атрофия наследуется по аутосомно-рецессивному типу:
Есть и другие гены (например ATP7A и др.), поломки в которых приводят к развитию СМА. Поэтому возможны и другие типы наследования (доминантный/X-сцепленный) и, соответственно, другие риски.
Причина заболевания и патогенез СМА
Тяжесть течения болезни модифицируется вторым геном SMN2. Он очень похож на ген SMN1, но отличается последовательностью нуклеотидов в 7 и 8 экзонах. Ген SMN2 не способен продуцировать функциональный белок SMN в достаточном количестве, однако количество копий SMN2, а также последовательность этих копий влияют на фенотип. Поэтому важно получить информацию о количестве копий генов SMN1и SMN2, не только у пациента с признаками СМА, но и у пар, планирующих беременность.
Скрининг новорожденных на СМА
Хотя скрининг новорожденных еще не является стандартной практикой, время имеет решающее значение. Более ранняя диагностика СМА может помочь улучшить исходы для детей с атрофией дыхательных и скелетных мышц.