болезнь грейвса что это лечение
Что такое зоб диффузный токсический (Базедова болезнь)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Родионова Е. А., терапевта со стажем в 13 лет.
Определение болезни. Причины заболевания
Диффузный токсический зоб — это аутоиммунное поражение щитовидной железы.
В англоязычных странах это заболевание называют болезнью Грейвса, а немецкоязычных — Базедовой болезнью. Диффузный токсический зоб развивается из-за нарушенной функции СД8+-лимфоцитов и выработки антитиреоидных антител, среди которых особое значение придаётся тем, которые имеют сродство к рецепторам тиреотропного гормона в щитовидной железе. Эти антитела выявляются в среднем у 50% пациентов с диффузным токсическим зобом. С этими рецепторами в норме связывается тиреотропный гормон (ТТГ), что стимулирует выработку и выделение тиреоидных гормонов (ТГ). Антитела при связывании с рецепторами ТТГ увеличивают секрецию тироксина (Т4) и трийодтиронина (Т3) «в обход» регуляции ТТГ. Повышенный уровень тиреотропного гормона обуславливает развитие тиреотоксикоза. До конца не ясна причина такого дефекта иммунной системы. Имеются данные, позволяющие говорить о роли генетической предрасположенности, в частности, более широкой распространённости аллелей HLA-B8 и BW-35 у пациентов с этой болезнью. [4] Однако не выявлено какой-то одной аллели, ответственной за болезнь Грейвса. Вероятно, здесь имеет место взаимодействие нескольких аллелей.
Симптомы диффузного токсического зоба
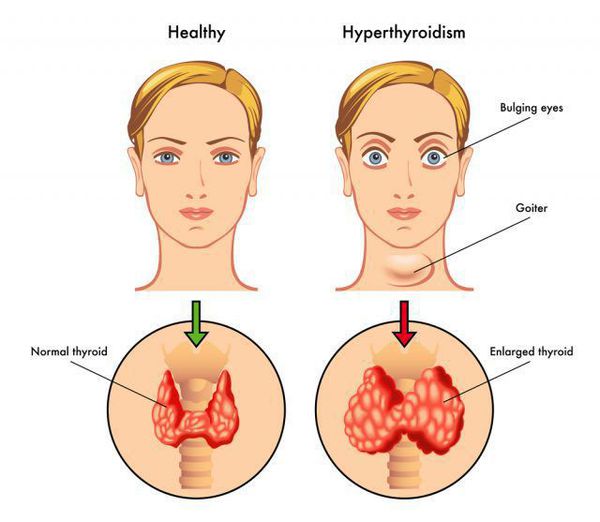
При Базедовой болезни могут появляться признаки эндокринной офтальмопатии, возникающей из-за поражения периорбитальной клетчатки: выраженный экзофтальм (не всегда симметричный), диплопия, отечность век, ощущение «инородного тела в глазах». Это сильно облегчает работу врача в плане диагностики, так как среди всех состояний с тиреотоксикозом эндокринная офтальмопатия характерна именно для диффузного токсического зоба. Не следует путать эндокринную офтальмопатию с глазными симптомами тиреотоксикоза, среди которых можно выделить синдром Грефе и синдром Кохера (верхнее веко отстаёт при взгляде вверх и вниз соответственно), синдром Мебиуса (взгляд не фиксируется вблизи), синдром Штельвага (уменьшение частоты морганий). Стоит отметить, что выраженность глазных симптомов не зависит от тяжести дисфункции щитовидной железы. [4]
Некоторые авторы в развитии диффузного токсического зоба выделяют четыре стадии:
Патогенез диффузного токсического зоба
Классификация и стадии развития диффузного токсического зоба
Согласно классификации тиреотоксикоза по Фадееву В.В. и Мельниченко Г.А., выделяется:
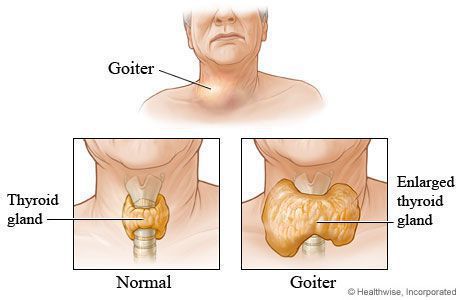
Также существует классификация зоба (патологического увеличения щитовидной железы), в которой выделяется три степени зоба, в зависимости от данных осмотра и пальпации щитовидной железы.
Классификация зоба, рекомендованная ВОЗ (2001)
Осложнения диффузного токсического зоба
Развившийся при диффузном токсическом зобе тиреотоксикоз поражает все системы организма. Если надлежащим образом не лечить это заболевание, то оно грозит тяжёлой инвалидизацией, а аритмии и сердечная недостаточность даже могут привести к летальному исходу.
Наиболее опасным осложнением болезни Грейвса является тиреотоксический криз, развитие которого связывают с неблагоприятными факторами (стресс, различные заболевания, выраженная физическая нагрузка, операция и др.). Появляется резкое возбуждение, температура повышается до 40 о С, частота сердечных сокращений достигает 200 ударов в минуту, может развиться фибрилляция предсердий, усиливаются явления диспепсии (тошнота, рвот, понос, жажда), повышается пульсовое артериальное давление. Затем могут появиться признаки недостаточности надпочечников (гиперпигментация, нитевидный пульс, нарушение микроциркуляции). Состояние ухудшается за несколько часов. Это ургентная ситуация, требующая неотложных мер, направленных на снижение концентрации ТГ, борьбу с надпочечниковой недостаточностью, дегидратацией, гипертермией, метаболическими нарушениями и недостаточностью кровообращения. В/в вводится гидрокортизон, проводится дезинтоксикационная и тиреостатическая терапия. К осложнениям диффузного токсического зоба также можно отнести осложнения хирургического его лечения: гипопаратиреоз, повреждение n. laryngeus recurrens (при повреждении одного нерва появляется осиплость голоса, при повреждении двух может возникнуть асфиксия), кровотечения, аллергические реакции на препараты. Об осложнениях тиреостатической терапии будет сказано ниже. [5]
Диагностика диффузного токсического зоба
При наличии у пациента признаков тиреотоксикоза ему определяют уровень тиреотропного гормона (ТТГ) высокочувствительным методом (чувс. 0,01 мЕд/л). Если уровень ТТГ меньше нормы, то исследуют концентрацию св. Т4 (тетрайодтиронин, тироксин) и Т3 (трийодтиронин). Существует понятие о так называемом субклиническом тиреотоксикозе, когда уровни Т4 и Т3 оказываются в норме. Среди антител наибольшее клиническое значение имеет уровень антител к рецепторам ТТГ (АТ-рТТГ). Высокие их титры с большой долей вероятности указывают на то, что мы имеем дело именно с болезнью Грейвса. Другие антитела, такие, как антитела к тиреоидной пероксидазе и тиреоглобулину (АТ-ТПО и АТ-ТГ), выявляются и при других состояниях, поэтому имеют значение только в комплексной оценке, и их определение может помочь в некоторых ситуациях.
Лечение диффузного токсического зоба
Лечение болезни Грейвса может проводиться эндокринологом или терапевтом. К сожалению, в настоящее время лечение диффузного токсического зоба направлено только на орган-мишень, то есть щитовидную железу, а не на выработку антител, являющуюся непосредственной причиной развития болезни. Даже после удаления щитовидной железы продолжают синтезироваться антитела к рецепторам тиреотропного гормона, хотя тиреотоксикоза уже не возникает (при адекватной заместительной терапии). [9]
Итак, существует три способа лечения диффузного токсического зоба:
Выбор метода зависит от возраста, сопутствующих заболеваний, степени увеличения щитовидной железы, желания пациента и возможностей лечебного учреждения. Консервативный метод лечения диффузного токсического зоба заключается в назначении тиреостатиков. В некоторых случаях (до 30%) курс такого лечения способен привести к стойкой ремиссии, в некоторых — является подготовкой к использованию другого, более радикального метода (хирургическое лечение или терапия йодом-131). Считается, что консервативная терапия неэффективна при выраженном увеличении щитовидной железы (более 40 см 3 ) и с признаками сдавления окружающих тканей, при наличии крупных узлов в ней, а также при наличии осложнений (фибрилляция предсердий, остеопороз и др.). При рецидиве после курса терапии тиреостатиком, повторный длительный курс не назначается. [5] В подобных случаях проводится курс медикаментозной подготовки к радиойодтерапии или операции.
Важным условием адекватного проведения консервативного лечения является приверженность пациента к лечению и доступность лабораторного контроля. Тиреостатики блокируют синтез тиреоидных гормонов и купируют тиреотоксикоз. По прошествии 4-6 недель тиреостатической терапии, при наступлении эутиреоидного состояния, обычно к лечению добавляют левотироксин. [4] В период тиреотоксикоза (до нормализации Т4) также целесообразно назначение препаратов из группы β-адреноблокаторов: они подавляют тканевое превращение Т4 в Т3, снижают частоту сердечных сокращений. Критерием адекватности лечения является нормальный уровень Т4 и ТТГ. Курс лечения продолжается 12-18 месяцев. Во время лечения необходимо контролировать показатели общего анализа крови. Это необходимо для контроля грозных осложнений тиреостатической терапии — агранулоцитоза и тромбоцитопении, требующих немедленной отмены препаратов. Симптомы агранулоцитоза: лихорадка, боль в горле, жидкий стул. [4] При их появлении пациенту необходимо экстренно сдать кровь на общий анализ и прекратить приём тиреостатиков до получения результатов анализа. Рецидив чаще всего наступает в первые 12 месяцев после завершения курса.
Под хирургическим лечением подразумевается удаление всей или большей части щитовидной железы. [8] Операция проводится только в состоянии эутиреоза. В настоящее время удаление этого органа не является фатальным для человека, так как имеются все возможности адекватной и недорогой заместительной терапии левотироксином. С другой стороны, при оставлении даже небольшого фрагмента железы, сохраняется вероятность рецидива заболевания, это орган-мишень для антитиреоидных антител, выделяемых иммунной системой. Таким образом, послеоперационный гипотиреоз теперь не рассматривается в качестве осложнения операции, а является её целью. Доза левотироксина после операции подбирается индивидуально и обычно составляет 1,7 мкг/кг в сутки.
Прогноз. Профилактика
Диффузный токсический зоб (Болезнь Грейвса)
Впервые эту болезнь описали сразу два ученых: ирландец Тринити Роберт Джеймс Грейвс и немец Карл Адольф фон Базедов. Поэтому в англоязычной литературе она известна как болезнь Грейвса, а в немецкой литературе – как Базедова болезнь, именно этот термин получил распространение и в России.
Болезнь Грейвса или диффузный токсический зоб – это аутоиммунное заболевание, которое связано с появлением в организме антител к рецептору тиреотропного гормона.
В норме на щитовидной железе есть рецепторы тиреотропного гормона (ТТГ), который вырабатывается гипофизом и регулирует работу щитовидной железы. При болезни Грейвса организмом начинают вырабатываться антитела, которые связываются с этими рецепторами подобно самому ТТГ. Это приводит к гиперстимуляции щитовидной железы и её гиперфункции, она начинает активно вырабатывать гормоны. У пациента развивается тиреотоксикоз. При этом степень увеличения щитовидной железы и тяжесть тиреотоксикоза – это два фактора, которые не связаны между собой. Пораженная щитовидная железа может увеличиваться в размерах, а может быть и нормального объёма. Причины болезни пока не определены. Известно, что существует генетическая предрасположенность, а также тот факт, что болезнь чаще возникает у людей с другими заболеваниями эндокринной системы (сахарный диабет, болезнь Аддисона).
Ситуация тиреотоксикоза, возникающая на фоне гиперфункции железы, потенциально опасна для жизни. Гормоны щитовидной железы регулируют обмен веществ. Высокая концентрация этих гормонов в организме человека сравнима с ситуацией выполнения тяжёлой физической работы или больших нагрузок. Человек с тиреотоксикозом испытывает высокие нагрузки на все органы и системы даже пребывая в покое. Это приводит к тому, что организм начинает истощаться, многие больные теряют вес, жалуются на появление патологической утомляемости и усталости, повышенную потливость, нарушение работы пищеварительного тракта (рвота, диарея), нервной системы (раздражительность, нарушения сна). Интенсивная нагрузка приводит к декомпенсации сердечной деятельности. Появляются отёки, может повышаться температура тела, нарушается сердечный ритм. Человеческий организм не в силах «постоянно бежать стометровку», пациент может погибнуть.
Более чем в половине всех случаев болезнь Грейвса сопровождается так называемой эндокринной офтальмопатией или эндокринной орбитопатией. Это два разных заболевания, которые имеют один пусковой механизм. Нарушение работы щитовидной железы способствует разрастанию ретробульбарной клетчатки, которая приводит к тому, что глаза у пациента как бы выкатываются наружу. Поражаются глазодвигательные мышцы, ухудшается трофика глаз, процесс может закончиться полной потерей зрения.
Болезнь Грейвса является ограничением для роботических и эндоскопических операций. Удалять щитовидную железу при болезни Грейвса гораздо сложнее, чем удалять железу, поражённую раком. При болезни Грейвса щитовидная железа гипертрофирована за счёт увеличения клеток в размерах. Чем больше железа в размерах, тем сложнее хирургу выделять возвратные гортанные нервы, искать и сохранять околощитовидные железы. Поэтому при болезни Грейвса применяются открытые операции на щитовидной железе.
Гигантские объёмы щитовидной железы порой могут быть связаны с неадекватным назначением тиреостатиков, которые полностью блокируют работу щитовидной железы и вводят человека в состояние гипотиреоза. Щитовидная железа не работает, её гормоны снижаются, а ТТГ повышается, приводя к гипертрофии щитовидной железы. За несколько месяцев нерациональная консервативная терапия у пациента с болезнью Грейвса может привести к росту щитовидной железы до очень больших размеров, значительно осложнив работу хирурга.
При болезни Грейвса щитовидная железа – это мишень аутоиммунной агрессии, поэтому основное лечение направлено на подавление синтеза гормонов или удаление органа. На первом этапе лечения проводят консервативную терапию. Пациентам назначают тиреостатики – препараты, которые блокируют синтез гормонов в самой щитовидной железе. Обычно, в ходе консервативного лечения у 10-15% пациентов происходит спонтанная ремиссия. Тиреостатиками лечат не более 12-18 месяцев. Если ремиссии за это время не произошло, то переходят к радикальным мерам.
Болезнь Грейвса – это аутоиммунное заболевание, при котором можно удалить орган-мишень, сохранив достойное качество жизни. Существует два метода радикального лечения диффузного токсического зоба: хирургический и радиойодтерапия. Ключевым моментом в выборе метода является объём щитовидной железы. Терапия радиоактивным йодом, однократно может разрушить железу примерно на 50-60 мл. Если щитовидная железа значительно увеличена в размерах и требуется разрушить большой объем, то радиоактивный йод назначается ступенчато, либо выбор делается в пользу операции.
После удаления железы пациенту назначается заместительная терапия, компенсирующая возникший гормональный дефицит. Иногда после удаления щитовидной железы и начала заместительной терапии пациенты начинают прибавлять в весе. Однако, этот момент не связан с негативным влиянием гормональных препаратов. Прибавка в весе происходит потому, что на фоне тиреотоксикоза пациенты сильно теряли в весе, а в стабильном состоянии, на фоне заместительной терапии, они возвращаются к нормальной массе тела.
Важно! Если уже при первом обращении пациенту установлен диагноз «болезнь Грейвса», и у него регистрируются высокие титры антител, напряжённый аутоиммунный статус, то в данном случае ремиссия на фоне консервативной терапии маловероятна. Следует прибегнуть к оперативному лечению или терапии радиоактивным йодом в более ранние сроки.
Пациенты с болезнью Грейвса часто интересуются, можно ли с заболеваниями щитовидной железы ездить в страны с жарким климатом. В настоящее время диффузный токсический зоб, как и рак щитовидной железы, не является противопоказанием к пребыванию в жарком климате. Доказано, что факторы внешней среды никак не влияют на течение болезни. Кроме этого, определенный процент людей с болезнью Грейвса постоянно проживает в южных широтах.
Не менее частый вопрос связан с возможностью планировать беременность после терапии радиоактивным йодом. После лечения радиоактивным йодом не рекомендовано планировать беременность в течение полугода. В меньшей степени это ограничение связано с радиацией, а в большей степени с тем, что имеется высокий процент невынашивания плода в эти полгода. Точная причина невынашивания до сих пор неизвестна.
Мнение, что пациенткам, которые были прооперированы по поводу рака щитовидной железы или диффузного токсического зоба, нельзя беременеть в течении 10 лет является заблуждением. Есть пациентки, у которых заболевание выявляется на фоне уже имеющейся беременности. Операция, выполненная на фоне беременности и после родов, никак не влияет на прогноз.
Если пациентке уже была проведена резекция щитовидной железы и назначена заместительная терапия, то на период беременности врач увеличит дозу препарата, а после родов вернет его к исходной дозе.
Мужчинам не рекомендуется участвовать в зачатии в течение 120 дней с момента окончания лечения радиоактивным йодом. Это связано с периодом жизни сперматозоидов.
Лечение тиреотоксикоза
Тиреотоксикоз обусловлен избыточной секрецией тиреоидных гормонов щитовидной железой и встречается при многих клинических состояниях. Причинами развития тиреотоксикоза могут быть: диффузный токсический зоб (ДТЗ, болезнь Грейвса, болезнь Базедова); аутоим
Тиреотоксикоз обусловлен избыточной секрецией тиреоидных гормонов щитовидной железой и встречается при многих клинических состояниях. Причинами развития тиреотоксикоза могут быть: диффузный токсический зоб (ДТЗ, болезнь Грейвса, болезнь Базедова); аутоиммунный тиреоидит в фазе тиреотоксикоза; функциональная автономия (токсическая аденома, многоузловой токсический зоб); йод-индуцированный тиреотоксикоз; резистентность к тиреоидным гормонам; ТТГ-продуцирующая аденома; гестационный транзиторный тиреотоксикоз; метастазы рака, продуцирующие тиреоидные гормоны; Struma ovarii; ятрогенный тиреотоксикоз; тиреотоксическая стадия подострого тиреоидита (де Кервена).
При наличии у пациента клинических симптомов тиреотоксикоза, прежде чем приступать к лечению, очень важно точно установить причину его развития, поскольку от этого будет зависеть адекватность выбранного метода терапии.
Гормональными маркерами гиперфункции, равно как и других заболеваний щитовидной железы, являются тиреотропный гормон (ТТГ) и свободный тироксин (св.Т4). В тех случаях когда при исследовании ТТГ оказывается сниженным, а св. Т4 в пределах нормы, проводится определение свободного трийодтиронина (св.Т3) с целью диагностики Т3-тиреотоксикоза (рис.1). На следующем этапе диагностики необходимо установить причину тиреотоксикоза. В медицинской практике нам наиболее часто приходится наблюдать пациентов с аутоиммунными заболеваниями щитовидной железы — ДТЗ и аутоиммунный тиреоидит. ДТЗ обусловлен выработкой тиреостимулирующих иммуноглобулинов (ТСИ), которые связываются с рецептором ТТГ на мембранах тиреоцитов и через активацию циклического аденозинмонофосфата постоянно стимулируют повышенную секрецию тиреоидных гормонов. Исследование антител к рецептору ТТГ (АТ-рТТГ) не только позволяет подтвердить диагноз ДТЗ, но и дифференцировать его с аутоиммунным тиреоидитом (АИТ).
Показания для определения АТ-рТТГ в клинической практике
В практике врача уже стало традиционным определение антител к тиреоглобулину (АТ-ТГ) и к тиреопероксидазе (АТ-ТПО). Выявление этих антител позволяет легко решить проблему диагностики либо в пользу АИТ, либо — ДТЗ. На этот факт следует обратить особое внимание, поскольку АТ-ТГ и АТ-ТПО могут обнаруживаться в достаточно большом количестве как у больных АИТ, так и у пациентов с ДТЗ. Более того, по данным исследований, эти антитела могут выявляться у части здоровых людей и у пациентов с заболеваниями щитовидной железы неаутоиммунного генеза. И наконец, не во всех случаях при АИТ и ДТЗ антитела можно обнаружить. Следовательно, проводить диагностику на основании только одного признака и тем более решать вопрос о целесообразности назначения лечения не представляется возможным. В диагностике АИТ помимо определения АТ-ТПО большое значение имеет ультразвуковое исследование щитовидной железы (УЗИ).
Неравномерное диффузное снижение эхогенности ткани служит надежным признаком АИТ, но тем не менее не позволяет дифференцировать его с ДТЗ, для которого характерным являются те же изменения по УЗИ. Таким образом, диагноз АИТ должен основываться на комплексе клинических и лабораторно-диагностических признаков. УЗИ щитовидной железы позволяет определить объем ткани, наличие узлового образования, что очень важно, поскольку у части пациентов эти показатели могут повлиять на выбор стратегии лечения.
Сцинтиграфия щитовидной железы у больных тиреотоксикозом проводится при подозрении на наличие функциональной автономии (токсическая аденома, многоузловой токсический зоб), загрудинный зоб, нефункциональные участки более 1–1,5 см.
Лечение ДТЗ (болезни Грейвса)
В настоящее время существуют три метода лечения ДТЗ: консервативный; радиоактивным йодом ( 131 I); хирургический.
Каждый из этих методов имеет свои показания, а также противопоказания и должен назначаться каждому пациенту индивидуально.
1. Консервативное лечение
Консервативную терапию назначают больным с небольшим диффузным увеличением щитовидной железы (по объему — 35–40 мл) без симптомов сдавления.
У пациентов с большим объемом щитовидной железы и/или узловыми образованиями по размерам более 1,0-1,5 см, а также с тяжелыми осложнениями тиреотоксикоза консервативную терапию используют в качестве медикаментозной подготовки к хирургическому лечению. При планировании радиойодтерапии пациентам также предварительно назначают консервативное лечение.
На фоне тиреостатической терапии эутиреоидное состояние наступает уже через 3–5 нед от начала лечения. В течение последующих 12–24 мес поддерживающей эутиреоз терапии примерно у 20–40% пациентов развивается ремиссия заболевания.
К сожалению, у части пациентов примерно через год вновь «расцветает» клиника тиреотоксикоза. Таким больным нецелесообразно назначать повторные длительные курсы консервативной терапии. Вероятнее всего, ТСИ продолжают вырабатываться в большом количестве и стимулировать щитовидную железу к избыточной продукции тиреоидных гормонов. В подобных случаях проводят курс медикаментозной подготовки, а затем, в зависимости от размеров и морфологических изменений ткани щитовидной железы, назначают либо терапию 131 I, либо оперативное лечение. Прогноз ремиссии или возможного рецидива тиреотоксикоза после проведения курса тиреостатической терапии можно определить по уровню АТ-рТТГ. Исследование антител проводится перед полной отменой препаратов. Риск рецидива тиреотоксикоза у пациентов возрастает при повышенном уровне АТ-рТТГ, чаще рецидивы наблюдаются в течение первого года после окончания лечения.
Для лечения ДТЗ на протяжении многих лет используются препараты из группы тионамидов: тиамазол (тирозол, мерказолил, тиамазол-филофарм, метизол, метимазол) и пропилтиоурацил (пропицил). C появлением дозировки тирозола 10 мг количество принимаемых таблеток можно уменьшить в 2 раза, что создает дополнительное удобство для пациентов. Механизм тиреостатического действия заключается в подавлении синтеза тиреоидных гормонов на стадиях органификации и комплексирования. Пропилтиоурацил частично подавляет превращение Т4 в Т3 за счет ингибирования 5’-монодейодиназы. Лечение тиреостатическими препаратами начинают с относительно высоких доз: 30–40 мг тиамазола или его аналогов 2–3 приема в день в течение дня или 300 мг пропилтиоурацила — 3–4 приема в день. После достижения эутиреоза дозу постепенно снижают до поддерживающей: тиамазол до 5–10 мг в день, пропилтиоурацил до 50–100 мг 1–2 приема в день (рис). Достижение эутиреоидного состояния оценивается по исчезновению клинических симптомов тиреотоксикоза и уровню св. Т4. Определять уровень ТТГ нецелесообразно, поскольку на протяжении нескольких месяцев он может оставаться подавленным. Дополнительно в лечении ДТЗ используют β-адреноблокаторы, которые подавляют тканевое превращение Т4 в Т3. Пропранолол назначают по 60–120 мг/сут 3–4 приема в день, атенолол — 50–100 мг/сут, конкор — 5–10 мг/сут однократно. В клинической практике существует два варианта назначения тиреостатических препаратов: в виде монотерапии или в комбинации с левотироксином (эутирокс, L-тироксин, тиро-4). В последнем варианте пациенту по достижению эутиреоидного состояния (оценивается по уровню Т4) подключают левотироксин в дозе 25–50 мкг. Исследования показывают, что на фоне комбинированной поддерживающей терапии в течение 18–24 мес достигается более стойкая блокада секреции тиреоидных гормонов.
При лечении тиреостатическими препаратами у пациентов могут развиться побочные эффекты в виде аллергических реакций (зуд, крапивница и др.). Одним из наиболее серьезных осложнений является агранулоцитарная реакция. Поэтому пациентам рекомендуется проводить общий анализ крови в первые 7–10 дней после начала лечения, а в дальнейшем — 1 раз в мес. К другим крайне редким тяжелым побочным эффектам относится тромбоцитопения, острый некроз печени.
2. Терапия радиоактивным йодом
Во многих странах мира радиойодтерапия — наиболее часто рекомендуемый метод лечения как ДТЗ, так и других форм токсического зоба, в частности функциональной автономии. Необходимо отметить, что 131 I назначают больным в любом возрасте (дети, пациенты молодого, среднего и пожилого возраста). Единственным противопоказанием для радиойодтерапии является беременность и грудное вскармливание. Спорным остается вопрос о лечении 131 I пациентов ДТЗ в сочетании с эндокринной офтальмопатией. Согласно результатам рандомизированного исследования, у части больных ДТЗ терапия 131 I способствовала прогрессированию эндокринной офтальмопатии. У пациентов, получающих радиойодтерапию, ремиссия тиреотоксикоза наступает в 90–95% случаев. Рецидив заболевания возможен у 3–5% больных, что требует проведения повторного курса радиойодтерапии. Радиоактивный йод принимают перорально в виде натриевой соли 131 I в растворе или капсулах: 131 I быстро поступает в щитовидную железу, вызывая деструкцию тиреоцитов посредством β-излучения. Чаще всего возникает вопрос о выборе больших или малых доз радиойода. Как известно, большие дозы неминуемо приводят к развитию гипотиреоза, использование же малых доз сопряжено с возможностью сохранения клиники тиреотоксикоза. Многолетние исследования за пациентами показали, что однократная доза радиоактивного йода, рассчитанная на полное разрушение щитовидной железы, излечивает тиреотоксикоз у 90% больных. Применение малых доз сохраняет эутиреоидное состояние в течение 10 лет после радиойодтерапии лишь у 25–30% больных. К сожалению, из-за дефицита 131 I нам довольно редко приходится пользоваться этим методом в лечении больных с тиреотоксикозом.
3. Хирургическое лечение
Показаниями для оперативного лечения больных с тиреотоксикозом служат большие размеры зоба, непереносимость тиреостатиков, рецидив тиреотоксикоза после проведенной консервативной терапии, загрудинно расположенный зоб. При наличии показаний возможно хирургическое лечение в I и II триместрах беременности, которое заключается в проведении субтотальной резекции щитовидной железы с оставлением минимального количества (объема) ткани. Однако нередко возникает проблема с определением этого минимального объема ткани. Если оставить меньше 4 г тиреоидной ткани, то неминуемо разовьется гипотиреоз, и тогда возникает необходимость в назначении заместительной терапии левотироксином. В тех случаях когда ткани оставляют больше 4–6 г, довольно часто после операции сохраняются клинические симптомы тиреотоксикоза, возможно, не столь выраженные. Это состояние иногда называют «ложный рецидив». Большой объем оставшейся после операции тиреоидной ткани создает условия для продолжения избыточной секреции тиреоидных гормонов под стимулирующим влиянием ТСИ. Подобная хирургическая тактика, с одной стороны, повышает риск развития осложнений, в частности мерцательной аритмии, а с другой — нередко заканчивается повторной операцией. Согласно вышеизложенному, если пациенту показано оперативное лечение, то целесообразно проводить максимально субтотальную резекцию щитовидной железы, оставляя не более 3 мл ткани. Безусловно, это требует высокой квалификации хирурга, поскольку, как известно, оперативное лечение сопряжено с развитием ряда осложнений, таких как парез возвратного нерва, удаление паращитовидных желез. Операцию следует проводить на фоне эутиреоидного состояния, достигнутого с помощью тиреостатической терапии. При непереносимости тиреостатиков используют β-адреноблокаторы или йод (насыщенный раствор калия йодида или раствор Люголя — 8–10 капель в день в течение 10–12 дней до операции).
Лечение аутоиммунного тиреоидита в фазе тиреотоксикоза
Довольно часто АИТ верифицируется как ДТЗ, поскольку клинические симптомы идентичны, а АТ-ТГ и АТ-ТПО выявляются почти с одинаковой частотой при одном и другом заболевании. Определение АТ-рТТГ в настоящее время пока еще доступно не во всех городах России. Лечение тиреотоксической стадии АИТ проводится чаще консервативно (при отсутствии аргументированных показаний в пользу оперативного вмешательства), при этом в терапии используют β-адреноблокаторы или же их комбинацию с тиреостатическими препаратами. Следует заметить, что тиреотоксикоз на фоне АИТ имеет некоторые особенности: быстрый эффект при приеме тиреостатических препаратов с развитием медикаментозного гипотиреоза; в ряде случаев волнообразное течение заболевания со сменой состояний тиреотоксикоза и эутиреоза.
Лечение функциональной автономии (токсическая аденома, узловой и многоузловой токсический зоб)
Пациентам с тиреотоксической формой функциональной автономии назначают тиреостатические препараты (тирозол, мерказолил, тиамазол-филофарм, метизол, метимазол, пропицил) с целью подготовки к оперативному лечению. В нашей стране из-за дефицита лечебного 131 I больных с функциональной автономией оперируют, хотя во многих странах мира основным методом лечения этих состояний является радиойодтерапия. Автономные участки тиреоидной ткани хорошо захватывают радиойод, который разрушает только эти участки ткани щитовидной железы. Большинство пациентов в дальнейшем переходят в эутиреоидное состояние. Радиойодтерапия предпочтительна особенно у больных пожилого возраста. К операции прибегают при большом объеме автономной ткани щитовидной железы (более 3 см в диаметре).
ТТГ-индуцированный тиреотоксикоз (резистентность к тиреоидным гормонам и ТТГ-продуцирующая аденома гипофиза)
Синдром генерализованной резистентности встречается довольно редко (в литературе описаны около 600 случаев). В связи с тем что у человека чувствительность органов и тканей к тиреоидным гормонам неодинакова, у одного и того же пациента могут развиваться как эутиреоидное, гипотиреоидное, так и гипертиреоидное состояния. Резистентность периферических тканей способствует компенсаторному повышению секреции тиреоидных гормонов, сохраняя, таким образом, эутиреоидное состояние. Если гипофиз оказывается более резистентным по сравнению с периферическими тканями, то развиваются клинические симптомы тиреотоксикоза, которые очень трудно поддаются медикаментозному лечению. Исследования показали, что лечебным эффектом обладает 3,5,3’-трийодтироуксусная кислота. Особенностью этого синдрома является отсутствие подавления ТТГ даже при использовании сверхбольших доз L-Т4, поэтому снижение ТТГ с помощью тиреоидных гормонов абсолютно неэффективно. При обнаружении ТТГ-продуцирующей аденомы гипофиза показано оперативное лечение.
Подострый тиреоидит (де Кервена) развивается спустя некоторое время (4–6 нед) после перенесенной вирусной инфекции. В течении подострого тиреоидита различают тиреотоксическую стадию, которая сменяется гипотиреоидной стадией, а затем в большинстве случаев тиреоидная функция полностью восстанавливается. Назначение β-адреноблокаторов (пропранолол, атенолол, бетаметазон) снимает симптомы тиреотоксикоза, применение препаратов из группы тионамидов не требуется. Пациентам рекомендуется лечение глюкокортикоидами. Преднизолон назначают по 30–40 мг ежедневно в течение 2–3 нед с последующим постепенным снижением дозы на 5 мг в нед. Возможен и другой вариант назначения глюкокортикоидов — 30–40 мг ежедневно в течение 10–12 дней с последующим переводом на прием через день в этой же дозе на протяжении 6–8 нед. Прогноз заболевания, как правило, благоприятный.
Нередко в кардиологической практике пациентам с нарушениями ритма назначают ритмиодарон, амиодарон, кордарон, седакорон. Следует отметить, что эти лекарственные средства способны изменять уровень тиреоидных гормонов у исходно эутиреоидных пациентов. Более чем у 50% больных, принимающих постоянно амиодарон, повышен уровень Т4 (в среднем на 44% по сравнению с базальным уровнем за счет нарушения превращения Т4 в Т3). Следовательно, изолированное повышение Т4 при терапии амиодароном нельзя интерпретировать как диагностический признак тиреотоксикоза. Тем не менее примерно у 5–20% пациентов эти препараты вызывают гипертиреоз, который обычно сопровождается дальнейшим повышением уровня Т4 на фоне значительного снижения уровня ТТГ с развитием симптомов тиреотоксикоза. Наиболее информативный контроль функции щитовидной железы при длительной терапии амиодароном или кордароном оказывается при условии определения ТТГ. Пациентам с «амиодароновым» тиреотоксикозом к терапии подключают β-адреноблокаторы.
Тиреотоксикоз при беременности повышает риск выкидыша, преждевременных родов и рождения плода с малой массой тела. У женщины при этом чаще развивается токсикоз, а в ряде случаев сердечная недостаточность. Одной из наиболее распространенных причин тиреотоксикоза у беременных женщин является ДТЗ. Оптимальным вариантом при его развитии на фоне беременности является ее прерывание. Однако если женщина настаивает на сохранении беременности, то обычно назначают пропилтиоурацил в дозе 25–50 мг в два приема, поскольку при приеме мерказолила у плода иногда наблюдается дефект кожи на голове. Кроме того, пропилтиоурацил имеет более короткий период полужизни и вызывает меньше осложнений по сравнению с тионамидами. В случае использования тионамидов следует назначать минимально эффективные дозы (5–10 мг тирозола в сут) с ежемесячным контролем свободных фракций тиреоидных гормонов. Большие дозы препаратов могут привести к развитию зоба и гипотиреоза у плода. Слабое стимулирующее действие на щитовидную железу оказывает хорионический гонадотропин (ХГ), концентрация в крови которого на ранних сроках беременности возрастает.
У незначительного числа беременных женщин именно ХГ способствует развитию транзиторного тиреотоксикоза. Это состояние не требует лечения. Относительно тяжелый тиреотоксикоз может наблюдаться при пузырном заносе или хориокарциноме.
В этих случаях пузырный занос удаляют или принимают меры, направленные на хориокарциному.
Послеродовый тиреоидит развивается спустя 1–3 мес после родов. Симптомы тиреотоксикоза носят транзиторный характер, сменяясь в дальнейшем гипотиреозом со спонтанной ремиссией через 6–8 мес. Транзиторная стадия тиреотоксикоза не требует лечения, а в гипотиреоидной стадии назначают левотироксин в дозе, которая способствует нормализации ТТГ.
Л. В. Кондратьева, кандидат медицинских наук, доцент
РМАПО, Москва