болезнь лемпингтона что это
Лечение хореи Гентингтона (заболевание)

Хорея Гентингтона, что это за болезнь
Хорея Гентингтона относится по своей типологии к нейродегенеративной болезни, во время которой у человека происходит удлинение повторов гена, который отвечает за белок гентингтин. До сих пор ученые не смогли однозначно установить функцию, выполняемую белком. Однако, в медицине существуют определенные нормы, которые указывают на длину триплетов (генов) у здорового человека.
Хорея Гентингтона, что это за болезнь с точки зрения сложной генетики человека? У здоровых людей количество повторений белка гентингтина колеблется в зависимости от возраста и других особенностей в организме в пределах 11 – 34 триплетов. При диагнозе хореи Гентингтона количество повторений начинается с показателя 37 и может достигать 100 триплетов. Этот дефект генов начинает проявляться не с рождения, а только после достижения человеком возраста 30-40 лет.
Заболевание хорея Гентингтона
Учеными доказано, что более чем у 90% пациентов во всем мире заболевание хорея Гентингтона диагностируется в возрасте 40-50 лет. Именно в этот период жизни у больного начинают активно проявляться все симптомы и признаки генного заболевания, которые невозможно остановить. В настоящее время такая болезнь считается неизлечимой, поскольку проявляется на фоне нарушения генетического строения головного мозга. Лечение хореи построено на принципе облегчения жизни пациенту, и уменьшения проявления симптомов, связанных с нарушением функций опорно-двигательного аппарата.
Во всем мире заболевание имеет разную продолжительность периода дожития человека после появления диагноза. Средний срок продолжительности жизни больного хореей Гентингтона составляет 15 лет. Такой длительный срок наблюдается лишь у людей, получающих постоянное консервативное лечение. Не более 7-9 лет проживают те больные, которые не получают должного лечения и не наблюдаются у специалистов.
Симптомы хореи Гентингтона
Чаще всего начало симптоматики проявляется у взрослых людей, достигших 30 летнего возраста, но всегда есть исключения и болезнь может начать развиваться раньше. Все симптомы проявляются слабо в самом начале заболевания и начинают прогрессировать со временем. Основные симптомы хореи Гентингтона выглядят следующим образом:
Признаки хореи Гентингтона
Диагностика хореи Гентингтона
Если человек жалуется на вышеперечисленные симптомы, а родственники или близкие наблюдают у больного развитие всех признаков болезни, то диагностика хореи Гентингтона в первую очередь начинается с похода к врачу и назначения пациенту генетического исследования.
Диагностика позволит выявить у человека паталогический ген, который привел к развитию хореи Гентингтона. Только в этом случае можно говорить о подтверждении данного диагноза. Кроме генетического исследования, в качестве видов диагностики заболевания в медицинской практике применяют компьютерную и магнитно-резонансную томографию коры головного мозга.
Сложное генетическое исследование состоит анализа ДНК, по результатам которого врач может судить о наличии у человека аномального гена. Заболевание может передаваться по наследству, поскольку с вероятностью более 50% повторные гены передаются детям от одного из больных родителей.
Лечение хореи Гентингтона
Болезнь заключается в генетическом отклонении человека, поэтому в настоящее время не существует её специфического лечения. Все силы врачей могут быть направлены на поддержание психического равновесия человека, а также на устранение двигательных и поведенческих расстройств. Благодаря специальным медикаментозным препаратам, удается свести к минимуму проблемы с походкой человека или его нахождением в обществе.
Для лечения и предупреждения развития болезни хореи Гентингтона используют комплексное лечение, но только после проведенного анализа дезоксирибонуклеиновой кислоты и медицинского генетического консультирования. Мутантный ген не поддается лечению, и важно на начальных этапах развития болезни не спутать её с шизофренией, наследственной атаксией или же болезнью Альцгеймера. Именно для этого проводят анализ ДНК, поскольку при иных психических расстройствах число повторов тринуклеотидов не увеличивается.
Лекарство для лечения хореи Гентингтона
Клиника лечения хореи Гентингтона
Лечение заболевания должно проводиться только под руководством и присмотром врачей психиатрической клиники. Генетически сложная болезнь в любое время может проявляться по-разному, поэтому важно не упустить момент начала появления симптомов. Клиника лечения хореи Гентингтона должна специализироваться на неврологических отклонениях у людей.
Медленно прогрессирующее заболевание нервной системы и коры головного мозга неизлечимо, но человек с таким диагнозом должен постоянно находиться под наблюдением специалиста, который сможет в экстренной ситуации правильно рассчитать и применить медицинский препарат. За больными людьми необходим бережный уход, а также присмотр таких врачей, как психиатры, неврологи, психологи, окулисты и ортопеды.
Клинические рекомендации при хорее Гентингтона
Список основных рекомендаций должен составлять индивидуально после осмотра больного человека психиатром и неврологом. Выделяются основные клинические рекомендации при хорее Гентингтона, которым необходимо придерживаться во время нахождения в стационаре или при нахождении пациента дома. Больной должен регулярно получать препараты, снижающие активность дофаминов коры головного мозга, доза при этом увеличивается каждые 3 дня.
Родителям, у одного из которых выявлено генетическое заболевание, не рекомендуется заводить детей. Вероятность наследования хореи Гентингтона превышает 50%, при наступлении беременности требуется провести анализ ДНК будущему ребенку. По статистике, люди с хореей Гентингтона чаще всего умирают от пневмонии, сердечной деятельности или других застойных процессов в организме, поэтому важно своевременно проводить лечение любых второстепенных заболеваний.
Болезнь лемпингтона что это
Этиология и встречаемость болезни Гентингтона. Болезнь Гентингтона (MIM № 143100) — панэтническое аутосомно-доминантное прогрессирующее нейродегенеративное заболевание, вызванное мутациями в гене HD. Распространенность болезни Гентингтона колеблется от 3 до 7 на 100 000 среди западных европейцев до 0,1—0,38 на 100 000 среди японцев. Эти изменения распространенности отражают изменения в распределении аллелей болезни Гентингтона и гаплотипов, предрасполагающих к мутации.
Патогенез болезни Гентингтона
Продукт гена HD, белок генгтинтин, экспрессируется повсеместно. Функция генгтинтина остается неизвестной.
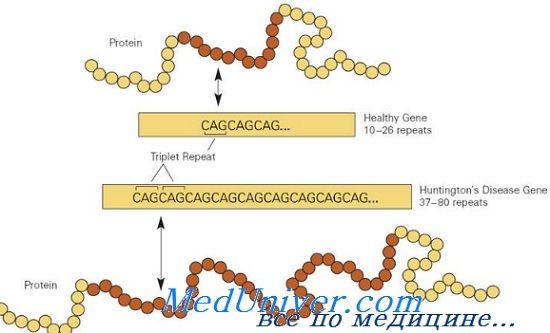
Болезнетворные мутации в гене HD обычно вызваны экспансией последовательности повторов CAG в экзоне 1, кодирующем полиглутаминовую цепочку; в норме аллели HD имеют от 10 до 26 повторов триплета CAG, тогда как мутантные аллели имеют больше 36 повторов. Приблизительно у 3% пациентов болезнь Гентингтона развивается в результате новой экспансии повторов CAG; 97% наследуют мутантный аллель HD от больного родителя.
Новые мутантные гены болезни Гентингтона возникают вследствие перехода премутации (27-35 повторов CAG) в полную мутацию. До настоящего времени все описанные пациенты наследовали новую полную мутацию от отца.
Экспансия полиглутаминового участка генгтинтина приводит к появлению у него нового свойства, и как необходима, так и достаточна для индукции болезни Гентингтона. Кроме выраженной рассеянной атрофии неостриатума, основного признака болезни Гентингтона, экспрессия мутантного генгтинтина вызывает дисфункцию нейронов, общую атрофию мозга, изменения уровней нейромедиаторов и накопление ядерных и цитоплазматических агрегатов в нейронах. В итоге экспрессия мутантного генгтинтина вызывает гибель нейронов; тем не менее похоже, что клинические симптомы и дисфункция нейронов предшествуют развитию внутриклеточных агрегатов и смерти нейронов. Механизм того, как экспрессия увеличенного числа глутаминовых остатков вызывает болезнь Гентингтона, остается неясным.
Фенотип и развитие болезни Гентингтона
Возраст начала болезни обратно пропорционален числу повторов CAG в гене HD. Пациенты с началом болезни во взрослом возрасте обычно имеют 40-55 повторов; в юношеском возрасте — обычно более 60 повторов. Пациенты с 36-41 повторами CAG имеют неполную пенетрантность, т.е. у них болезнь может не развиться в течение всей жизни. За исключением возраста начала, число повторов не влияет на другие проявления болезни Гентингтона.
Нестабильность и экспансия повторов CAG часто приводит к явлению антиципации, т.е. более раннему возрасту начала в последующих поколениях семьи. Достигнув однажды значения 36, число повторов увеличивается в ходе сперматогенеза отца; экспансия при материнской передаче мутации встречается реже. Поскольку число повторов триплета CAG обратно коррелировано с возрастом начала, индивидуумы, унаследовавшие мутацию от отца, имеют повышенный риск развития болезни с ранним началом; приблизительно 80% молодых пациентов наследуют мутантный ген болезни Гентингтона от отца.
Приблизительно треть пациентов имеют психиатрические нарушения; две трети — комбинацию познавательных и двигательных нарушений. Средний возраст пациентов на начало болезни — 35-44 года; приблизительно у четверти пациентов болезнь Гентингтона проявляется после 50 лет и у одной десятой — до 20 лет. Среднее выживание после установления диагноза — 15-18 лет, а средний возраст смерти — 54-55 лет.
Для болезни Гентингтона характерны прогрессирующие двигательные, познавательные и психиатрические расстройства. Двигательные нарушения включают как произвольные, так и непреднамеренные движения. Первоначально эти движения создают незначительные помехи ежедневной деятельности, но обычно приводят больного к нетрудоспособности по мере развития болезни.
Хорея, присутствующая у более чем 90% пациентов, — наиболее частая форма непроизвольного гиперкинеза; характеризуется неповторяющимися непериодическими толчками, которые не могут быть подавлены усилием воли. Познавательные нарушения начинаются в начале болезни и влияют на все аспекты познания; речь обычно затрагивается позднее, чем другие функции.
Поведенческие нарушения, обычно развивающиеся в ходе болезни, включают антиобщественное поведение, агрессию, взрывы гнева, апатию, сексуальные отклонения и повышенный аппетит. Психиатрические проявления, развивающиеся на любой стадии болезни, включают изменения личности, легкие психозы и шизофрению.
В конечных стадиях болезни Гентингтона обычно развиваются настолько выраженные двигательные нарушения, что больные полностью зависят от постороннего ухода. Они также теряют массу тела, у них появляются нарушения сна и мутизм. С течением болезни поведенческие нарушения уменьшаются.
Особенности фенотипических проявлений болезни Гентингтона:
• Возраст начала: от подросткового до старости
• Двигательные нарушения
• Познавательные нарушения
• Психиатрические нарушения
Лечение болезни Гентингтона
К настоящему времени никакого эффективного лечения при болезни Гентингтона нет. Помощь сводится к уходу и фармакологическому лечению поведенческих и неврологических проблем.
Риск наследования болезни Гентингтона
Каждый ребенок родителя с болезнью Гентингтона имеет 50% риск унаследовать мутантный аллель болезни Гентингтона. За исключением аллелей с неполной пенетрантностью (36-41 повтор CAG), у всех детей, унаследовавших мутантный аллель, если они имеют нормальную продолжительность жизни, развивается болезнь Гентингтона.
Дети отцов, несущих премутацию, имеют эмпирический приблизительно 3% риск унаследовать аллель болезни Гентингтона, в котором премутация перешла в полную мутацию. Тем не менее не все мужчины, несущие премутацию, равновероятно передают полную мутацию.
Доклиническое тестирование и пренатальная диагностика доступны благодаря анализу числа повторов CAG в 1 экзоне гена HD. Доклиническое тестирование и пренатальная диагностика — методики прогностические, поэтому лучше интерпретируются в случае подтверждения экспансии CAG у больного члена семьи.
Пример болезни Гентингтона. М.П., 44-летний мужчина, отметил ухудшение памяти и внимания. По мере снижения интеллектуальных функций в течение последующего года у него развились непроизвольные движения пальцев кистей и стоп, а также мимических мышц лица типа гримасничания. Он понимал свое состояние и впал в депрессию. До этого М.П. был здоров, и в его анамнезе не было аналогично больных родственников; его родители погибли в сорокалетнем возрасте в автокатастрофе. У пациента одна здоровая дочь.
После углубленного осмотра невролог диагностировал состояние больного как болезнь Гентингтона. Диагноз болезни Гентингтона подтвержден анализом ДНК, показавшим наличие 43 повторов триплета CAG в одном из аллелей гена HD (в норме не более 26). Последующее пресимптоматическое обследование дочери показало, что она также унаследовала мутантный аллель HD. Оба получили подробную консультацию.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Клинический случай выявления болезни Гентингтона
Болезнь Гентингтона — аутосомно-доминантное нейродегенеративное заболевание, которое характеризуется начинающимися в среднем возрасте прогрессирующим нарушением когнитивных функций, непроизвольными движениями и нарушением координации движений.
Джордж Гентингтон первым описал это состояние в 1872 году, изучив семейный случай заболевания у жителей Лонг-Айленда.
Хорея начинается исподволь. Первые признаки хореи Гентингтона проявляются в возрасте 25-50 лет, реже в детском возрасте. Мужчины болеют чаще, чем женщины; первыми симптомами могут быть неусидчивость, суетливость движений, что не расценивается больным и его родственниками как заболевание. Со временем, однако, двигательные нарушения нарастают и могут привести к инвалидности. Характерны частые, внезапные, неритмичные судорожные движения конечностей или туловища. Возможны спазмы лицевой мускулатуры, всхлипывания, нарушения артикуляции. Страдает координация движений при ходьбе: походка становится «танцующей» (хореической). Память остается сохранной вплоть до поздних стадий заболевания, однако внимание, мышление и исполнительные функции нарушаются уже в самом начале заболевания. Часто наблюдаются депрессия, апатия, отчужденность, раздражительность, периодическая расторможенность. В некоторых случаях развиваются бред и навязчивые состояния, в связи с чем сначала ошибочно диагностируется шизофрения.
Обычно хорея Гентингтона проявляется на 4-5-ом десятилетии жизни прогрессирующим хореоатетозом, который сопровождается выраженными психическими расстройствами ( деменцией, депрессией с нередкими суицидальными попытками, нарушениями эмоционального контроля с частыми вспышками раздражения и агрессии). Иногда проявляется в юношеском возрасте нарастающим акинетико-ригидным синдромом.
Диагноз подтверждают генетическим тестированием.
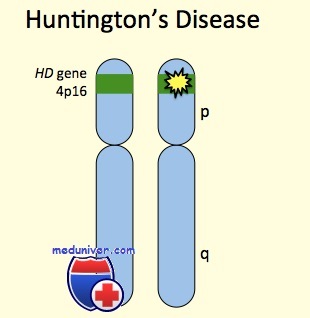
Ген болезни Гентингтона HD располагается в сегменте 4р16.3, содержит повторяющиеся тринуклеотидные повторы ЦАГ и кодирует белок, называемый гентингтином. Этот белок содержится в нейронах различных отделов головного мозга; функция его неизвестна. Инактивация гомологичного гена у мышей при гомозиготном состоянии вызывает гибель зародыша; гетерозиготные особи фенотипически не отличаются от нормы. У мышей, у которых в этом гене увеличено число тринуклеотидных повторов, развиваются прогрессирующие двигательные нарушения. Увеличение числа повторов ЦАГ приводит к тому, что в кодируемом этим геном белке появляется длинный полиглутаминовый участок, что и может быть причиной заболевания. Полагают, что длинный полиглутаминовый участок нарушает связывание белков, а также другие процессы в клетках, например активность митохондрий. Сообщалось о нарушении связывания гентингтина с глицеральдегидфосфатдегидрогеназой. Кроме того, имеются данные об усилении апоптоза нейронов при этой болезни.
Выявление увеличения числа тринуклеотидных повторов ЦАГ в гене HD лежит в основе генодиагностики болезни Гентингтона. Если число повторов ЦАГ составляет 38 или более, то заболевание с возрастом разовьется неминуемо. Вероятность наследования аномального гена и, следовательно, развития болезни Гентингтона у детей таких больных составляет 50%. Чем больше тринуклеотидных повторов содержит ген, тем раньше начинается заболевание. Однако в большинстве случаев число повторов составляет 40-49, а в этих пределах зависимости между числом повторов и возрастом начала заболевания нет. По неясным причинам риск значительного увеличения числа тринуклеотидных повторов и развития ювенильной формы болезни Гентингтона (форма антиципации) выше, если болен отец больного.
Кровным родственникам можно рекомендовать пройти генетическое тестирование. Прежде чем проводить анализ ДНК у здоровых лиц с высоким риском болезни Гентингтона, необходимо тщательное генетическое консультирование, поскольку положительные результаты анализа ДНК могут привести к тяжелой моральной травме.
Медико-генетическое консультирование и анализ ДНК используются не только при определении риска болезни Гентингтона, но и в дифференциальной диагностике этого заболевания. Так, мутантный ген HD иногда находят при спорадической «старческой» хорее. При заболеваниях, напоминающих болезнь Гентингтона, таких, как шизофрения, доброкачественная семейная хорея, наследственные атаксии, абеталипопротеидемия и семейная болезнь Альцгеймера, число тринуклеотидных повторов не увеличено.
Специфического лечения нет. Лечение преимущественно симптоматическое.
Клинический случай
Больная С., 57 лет, поступила на лечение во II неврологическое отделение 07.12.2014г. с жалобами на общую слабость, прогрессирующее снижение памяти, внимания, головокружение, шаткость при ходьбе, головные боли, неритмичные непроизвольные насильственные мышечные подергивания в туловище и во всех конечностях.
Из анамнеза известно, что в течение нескольких лет страдает гипертонической болезнью с умеренными цифрами АД, распространенным остеохондрозом позвоночника, дисциркуляторной энцефалопатией с вестибуло-атактическим синдромом.
Ухудшение состояния около 1,5 лет, когда в клинической картине появились неритмичные непроизвольные насильственные мышечные подергивания в туловище и во всех конечностях, стали отмечаться медленно прогрессирующие когнитивные нарушения.
В неврологическом статусе: В сознании, контактна, ориентирована. Эмоционально лабильна. Фон настроения снижен. Выраженно фиксирована на своих ощущениях, тревожна, ипохондрична. Менингеальных знаков нет. ЧМН: Глазные щели D=S. Зрачки D=S. Фотореакции живые. Движения глазных яблок не ограничены. Нарушений чувствительности на лице нет. Точки выхода тройничного нерва безболезненны. Лицо симметрично. Нистагма нет. Глоточный рефлекс сохранён. Глотание, фонация не нарушены. Язык по средней линии. Парезов нет. Сухожильные рефлексы оживлены, с расширенной зоной, S=D. Отмечаются маятникообразные подергивания ног при исследовании коленных рефлексов. Патологических стопных знаков не выявляется. Паравертебральные точки, остистые отростки в шейном, поясничном отделе безболезненны. Нарушений чувствительности не выявляется. В позе Ромберга пошатывается. Дисметрия при выполнении ПНП, ПКП с 2-х сторон. Мышечная дистония. Выявляются спонтанные неритмичные хореоатетоидные гиперкинезы во всех конечностях, туловище, мимических мышцах. Походка гиперкинетическая с элементами атаксии.
Учитывая жалобы больной, данные анамнеза заболевания и клиническую картину, дифференциальный диагноз проводился между дебютом болезни Гентингтона и малой хореей. Пациентке выполнена МРТ головного мозга, выявившая картину дисциркуляторной энцефалопатии, смешанной атрофической гидроцефалии; ЭЭГ: Основной ритм покоя недостаточно выражен, «уплощен», вероятно, как проявление дисфункции нижнестволовых структур мозга. Дуплексное ангиосканирование БЦА, выявившее нестенозирующий атеросклероз внечерепных отделов брахиоцефальных артерий; ревмопробы (С-реактивный белок, антистрептолизин-О, ревматоидный фактор) – в пределах нормы. На основании данных проведённого дообследования, диагноз малой хореи представлялся маловероятным.
Больная была направлена на консультацию в НИИ Неврологии РАМН. Диагноз болезни Гентингтона подтвержден результатами медико-генетического исследования.
Пациентке назначен экспериментальный препарат Придопирин, который она в настоящее время принимает с некоторым положительным эффектом (несколько улучшилась память, внимание, улучшились навыки самообслуживания – больная самостоятельно ходит в магазин, готовит пищу).
В декабре 2015г. пациентка проходила плановый курс сосудисто-метаболической терапии во II неврологическом отделении КБ № 1, выписана с улучшением, уменьшением выраженности вестибуло-атактических проявлений, стабилизацией фона настроения.
Болезнь Гентингтона
Симптомы и способы лечения
Болезнь Гентингтона (также болезнь Хантингтона) – это разрушительное аутосомно-доминантное нейродегенеративное заболевание. Шансы, что носитель передаст его кому-либо из своих детей, равны 50%.
Болезнь Гентингтона – одна из самых распространенных неврологических болезней, вызванных мутацией одного гена. Черты этого заболевания – отложения белкового агрегата в нервных клетках – присущи болезни Альцгеймера и болезни Паркинсона.

Изображение процесса болезни – нейрон, пораженный тельцами включения // wikipedia.org
Причины болезни Гентингтона
Болезнь Гентингтона вызвана экспансией тринуклеотинового CAG-повтора в гене, кодирующем белок гентингтин. У здоровых людей меньше 36 CAG-повторов, последовательность выглядит так: CCAGCAGCAGCAGCAGCAGCAGCAGCAGCAG… У людей с болезнью Гентингтона 36 таких повторов или больше. Когда CAG-повторы транслируются в аминокислоту глутамин, мутантный гентингтин получает аномально длинный полиглутаминовый тракт. Этот тип мутации наблюдается в восьми других нейродегенеративных заболеваниях.
Удлиненный полиглутаминовый тракт сообщает гентингтину токсические свойства. Они могут быть связаны со склонностью мутантного белка к агрегации или с тем, что мутантный гентингтин препятствует нормальному функционированию других белков в клетке. Это приводит к нейродегенерации, особенно заметной в хвостатом ядре, скорлупе и коре головного мозга.
Симптомы болезни Гентингтона: хорея
На клиническом уровне пациент демонстрирует ненормальные хаотические движения, снижение когнитивных способностей (форма деменции) и психиатрические отклонения. Самое очевидное двигательное нарушение, наблюдаемое при болезни Гентингтона, называется хорея – ненормальные короткие и иррегулярные неконтролируемые движения. Психиатрические симптомы болезни, такие как депрессия, отчасти связаны с биологией болезни и не всегда являются реакцией больного на ее наличие.
Болезнь Гентингтона обычно проявляется в середине жизни – к 40 годам. Однако в случаях с очень высоким количеством повторов болезнь может проявиться в раннем детстве. В некоторых случаях, когда число CAG-повторов близко к 36, болезнь проявляется ближе к концу жизни. Чем длиннее цепочка повторов тринуклеотида, тем раньше появляются признаки заболевания. Симптомы болезни похожи у всех пациентов, хотя на начальном этапе могут быть некоторые различия. Болезнь продолжается в течение 15–20 лет до смерти больного.
История исследования болезни Гентингтона
Болезнь названа по имени американского врача Джорджа Гентингтона, он детально описал ее в 1872 году. «О хорее» – первая из двух статей Гентингтона, в которой он аккуратно описал признаки болезни, которые наблюдал у семьи, живущей на Лонг-Айленде.
Однако существуют и более ранние описания болезни Гентингтона. Джеймс Гузелла впервые провел связь между геном, вызывающим болезнь, и коротким плечом четвертой хромосомы человека. Это первый классический пример того, как можно обнаружить место гена на определенном участке хромосомы, основываясь на изучении семей. Последующая идентификация Гузеллой и крупным консорциумом мутации и гена, вызывающего болезнь, позволила в дальнейшем проводить точные генетические тестирования и предоставила ключевой ресурс для моделирования болезни в клетках и у животных, что критически важно для разработки лечения.
Лечение болезни Гентингтона
В настоящее время неизвестно лечение, смягчающее нейродегенерацию человека, однако тетрабеназин может уменьшить некоторые двигательные нарушения. Считается, что тетрабеназин не уменьшает уровня нейродегенерации при болезни Гентингтона. Хорея вызвана переизбытком нейромедиатора дофамина, тетрабеназин снижает его активность и уменьшает симптом.
Сейчас разрабатываются многочисленные методы лечения болезни Гентингтона на механистическом уровне. Они включают стратегии снижения экспрессии мутантного белка с помощью антисмысловых методов (в клинических испытаниях) и активацию аутофагии. Антисмысловые стратегии задействуют нуклеиновые кислоты олигонуклеотиды. Они имеют комплементарные гену болезни Гентингтона последовательности и уменьшают количество синтезируемого гентингтина. Эта стратегия вполне рациональна, поскольку основной двигатель болезни – мутантный гентингтин.
Распространенность болезни Гентингтона
Болезнь поражает 1 из 10 000 человек в популяциях европейского происхождения. Чаще всего болезнь Гентингтона встречается в популяционных изолятах (в Венесуэле), реже – в некоторых популяциях (например, у японцев). Различия в распространенности болезни в популяциях связаны с количеством носителей гена в этих группах. Это следствие исторических событий, включая случайные увеличения или уменьшения носителей болезни Гентингтона в популяционных изолятах.
Защитная роль аутофагии
В лаборатории мы сосредоточились на защитных функциях аутофагии при болезни Гентингтона и связанных с ней нейродегенеративных состояниях. Аутофагия – процесс, при котором внутренние компоненты клетки доставляются внутрь ее лизосом или вакуолей и подвергаются в них деградации.
Мы обнаружили, что внутриклеточные белки, склонные к агрегации (подобные мутантному гентингтину), являются субстратами аутофагии. Важно отметить, что мы были первыми, кто показал, что препараты, стимулирующие аутофагию, стимулируют и удаление токсичных белков. Это мутантный гентингтин, мутантный атаксин-3 (вызывающий наиболее распространенную спиноцеребеллярную атаксию), альфа-синуклеин (в болезни Паркинсона) и тау-белки дикого и мутантного типа (связанные с болезнью Альцгеймера и разными видами лобно-височной деменции).
Мы расширили наши исследования от клеточных систем до демонстрации эффективности таких препаратов на болезнях, смоделированных у дрозофил, рыб данио-рерио и мышей. Эта концепция впоследствии была подтверждена многими исследовательскими группами на различных нейродегенеративных заболеваниях.
Наша задача заключается в том, чтобы развить эту стратегию до статуса клинической реальности. Мы провели ряд исследований, чтобы выявить новые препараты, побуждающие аутофагию. Мы с моим коллегой доктором Роджером Баркером завершили тестирование одного из идентифицированных препаратов на пациентах с болезнью Гентингтона.

Белковый агрегат в мозге мыши (отмечен стрелками) // serious-science.org
Изучение функций гентингтина и современная терапия
Есть много текущих исследовательских проектов, работа над которыми способствует изучению болезни. Во-первых, активнее всего разрабатывается вопрос, как мутантный гентингтин вызывает заболевание. Чтобы ответить на него, нужно задействовать методы структурной биологии, биофизики, генетического сканирования, клеточной биологии и животных моделей. Некоторые группы сосредотачиваются на исследовании болезни на биохимическом уровне, пытаясь понять структуру мутантного белка и его рано агрегирующих видов. Другие используют клеточные и нейронные модели, а также модели стволовых клеток, чтобы понять, что нарушает мутантный белок. Они дополняются исследованиями на животных: червях, дрозофилах, данио-рерио, мышах, крысах и даже приматах и овцах. Это нужно для разработки моделей, которые позволят понять болезнь на уровне организма. На таких моделях можно тестировать терапевтические стратегии.
Во-вторых, нужно понять, в чем заключаются функции нормального гентингтина – они плохо изучены. Чтобы пролить свет на эти функции, исследовательские группы применяют разные подходы, основанные на клеточном моделировании. Это может повлиять на терапевтические стратегии и/или наше общее понимание того, как работает клетка.
Третья цель – выявление потенциальных целей терапии для облегчения заболевания, улучшение существующих стратегий лечения. Над этим вопросом работают разные исследовательские группы; они используют методы химического и генетического сканирования, чтобы идентифицировать новые цели и потенциальные препараты.
Четвертая цель – идентифицировать и охарактеризовать биомаркеры прогрессирования болезни, чтобы облегчить клинические испытания. Это даст возможность отследить преимущества любой терапевтической стратегии. Действенно было бы иметь очень чувствительную шкалу прогрессирования болезни с коротким временным интервалом. Это важно для тех, кто является носителем гена болезни, но еще не обладает явными ее признаками и симптомами. В таком случае можно будет протестировать эффекты потенциальных терапевтических средств, которые замедляют развитие болезни.
Об авторе:
Дэвид Рубинштейн – Professor of Molecular Neurogenetics; Deputy Director, Cambridge Institute for Medical Research.