Что такое кипение в физике
Молекулярная физика. Кипение жидкости.
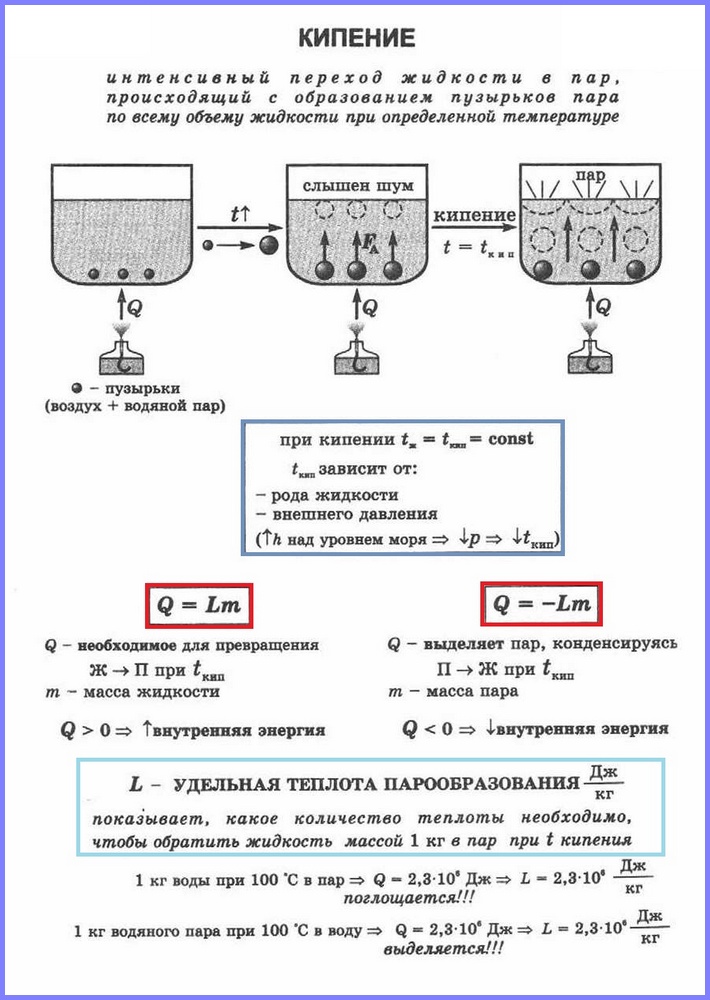
Кипение — это интенсивный переход жидкости в пар, происходящий с образованием пузырьков пара по всему объему жидкости при определенной температуре.
В отличие от испарения, которое происходит при любой температуре жидкости, другой вид парообразования — кипение — возможен лишь при совершенно определенной (при данном давлении) температуре — температуре кипения.
При нагревании воды в открытом стеклянном сосуде можно увидеть, что по мере увеличения температуры стенки и дно сосуда покрываются мелкими пузырьками. Они образуются в результате расширения мельчайших пузырьков воздуха, которые существуют в углублениях и микротрещинах не полностью смачиваемых стенок сосуда.
Пары жидкости, которые находятся внутри пузырьков, являются насыщенными. С ростом температуры давление насыщенных паров возрастает, и пузырьки увеличиваются в размерах. С увеличением объема пузырьков растет и действующая на них выталкивающая (архимедова) сила. Под действием этой силы наиболее крупные пузырьки отрываются от стенок сосуда и поднимаются вверх. Если верхние слои воды еще не успели нагреться до 100 °С, то в такой (более холодной) воде часть водяного пара внутри пузырьков конденсируется и уходит в воду; пузырьки при этом сокращаются в размерах, и сила тяжести заставляет их снова опускаться вниз. Здесь они опять увеличиваются и вновь начинают всплывать вверх. Попеременное увеличение и уменьшение пузырьков внутри воды сопровождается возникновением в ней характерных звуковых волн: закипающая вода шумит.
Когда вся вода прогреется до 100 °С, поднявшиеся вверх пузырьки уже не сокращаются в размерах, а лопаются на поверхности воды, выбрасывая пар наружу. Возникает характерное бульканье — вода кипит.
Кипение начинается после того, как давление насыщенного пара внутри пузырьков сравнивается с давлением в окружающей жидкости.
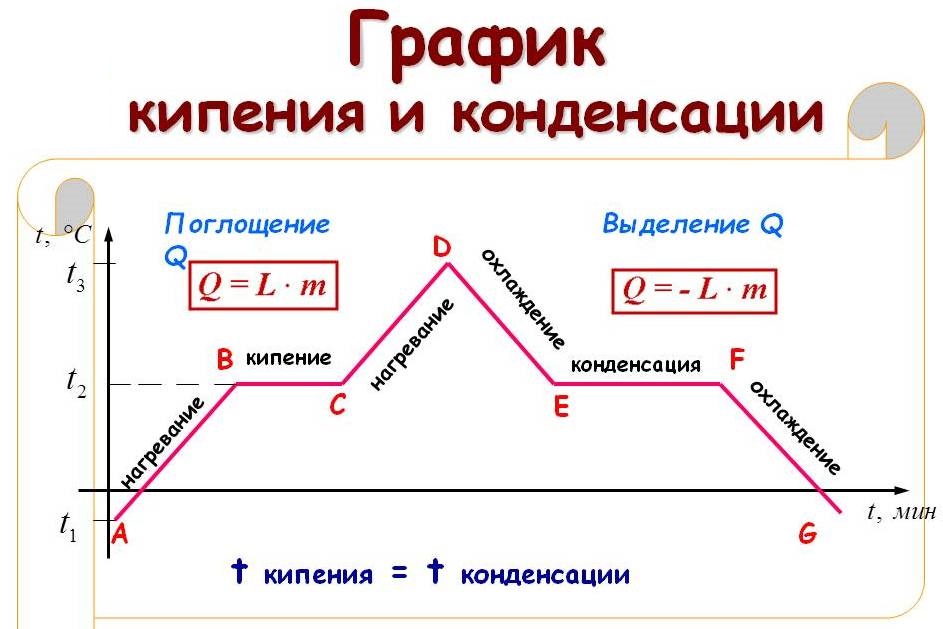
Во время кипения температура жидкости и пара над ней не меняется. Она сохраняется неизменной до тех пор, пока вся жидкость не выкипит. Это происходит потому, что вся подводимая к жидкости энергия уходит на превращение ее в пар.
Температура, при которой кипит жидкость, называется температурой кипения.
Температура кипения зависит от давления, оказываемого на свободную поверхность жидкости. Это объясняется зависимостью давления насыщенного пара от температуры. Пузырек пара растет, пока давление насыщенного пара внутри него немного превосходит давление в жидкости, которое складывается из внешнего давления и гидростатического давления столба жидкости.
Чем больше внешнее давление, тем больше температура кипения.
Всем известно, что вода кипит при температуре 100 ºC. Но не следует забывать, что это справедливо лишь при нормальном атмосферном давлении (примерно 101 кПа). При увеличении давления температура кипения воды возрастает. Так, например, в кастрюлях-скороварках пищу варят под давлением около 200 кПа. Температура кипения воды при этом достигает 120°С. В воде такой температуры процесс варки происходит значительно быстрее, чем в обычном кипятке. Этим и объясняется название «скороварка».
И наоборот, уменьшая внешнее давление, мы тем самым понижаем температуру кипения. Например, в горных районах (на высоте 3 км, где давление составляет 70 кПа) вода кипит при температуре 90 °С. Поэтому жителям этих районов, использующим такой кипяток, требуется значительно больше времени для приготовления пищи, чем жителям равнин. А сварить в этом кипятке, например, куриное яйцо вообще невозможно, так как при температуре ниже 100 °С белок не сворачивается.
У каждой жидкости своя температура кипения, которая зависит от давления насыщенного пара. Чем выше давление насыщенного пара, тем ниже температура кипения соответствующей жидкости, т. к. при меньших температурах давление насыщенного пара становится равным атмосферному. Например, при температуре кипения 100 °С давление насыщенных паров воды равно 101 325 Па (760 мм рт. ст.), а паров ртути — всего лишь 117 Па (0,88 мм рт. ст.). Кипит ртуть при 357°С при нормальном давлении.
Теплота парообразования.
Теплота парообразования (теплота испарения) — количество теплоты, которое необходимо сообщить веществу (при постоянном давлении и постоянной температуре) для полного превращения жидкого вещества в пар.
Физическая величина, показывающая, какое количество теплоты необходимо, чтобы обратить жидкость массой 1 кг в пар без изменения температуры, называется удельной теплотой парообразования.
Удельную теплоту парообразования обозначают буквой r и измеряют в джоулях на килограмм (Дж/кг).
Количество теплоты, необходимое для парообразования (или выделяющееся при конденсации). Чтобы вычислить количество теплоты Q, необходимое для превращения в пар жидкости любой массы, взятой при температуре кипения, нужно удельную теплоту парообразования r умножить на массу m:
При конденсации пара происходит выделение такого же количества теплоты:
Кипение
Содержание
Для того чтобы превратить жидкость в пар, существует два способа: испарение и кипение. В прошлых уроках мы подробно разобрали, как происходит процесс испарения. В его ходе образуется пар, который в зависимости от условий может быть насыщенным или ненасыщенным.
Явление кипения мы часто наблюдаем в повседневной жизни. Для того чтобы приготовить чай или кофе, сначала мы доводим воду до кипения. Чтобы сварить суп, мы ждем, когда закипит вода в кастрюле.
В данном уроке мы рассмотрим, как физика описывает этот процесс, изучим изменения, происходящие при кипении и установим зависимости от других величин.
Процесс кипения
Проведем опыт: будем нагревать воду в открытом стеклянном сосуде и измерять ее температуру.
Отметим, что до того, момента как мы начнем нагревать воду, с поверхности воды идет испарение. Пар при этом не виден глазу, но, тем не менее, существует.
Начнем нагревать воду. Мы заметим, что в воде начинают появляться пузырьки (рисунок 1, а). С повышением температуры они начинают увеличиваться в размерах.
В воде всегда растворено некоторое количество воздуха. При повышении температуры этот воздух выделяется из воды в виде пузырьков. Внутри них – воздух и водяной пар. Водяной пар там присутствует, потому что окружающая вода испаряется внутрь этих пузырьков воздуха.
Когда пузырьки поднимаются в верхние слои жидкости (более холодные), они уменьшаются в размерах. Происходит это из-за конденсации пара внутри пузырьков. Под действием силы тяжести они опускаются вниз в более горячую воду.
И снова начинают подниматься к поверхности. Происходит попеременное увеличение и уменьшение пузырьков, в ходе которых они двигаются в жидкости. При этом мы слышим шум. Он предшествует закипанию воды.
Кипение – это интенсивный переход жидкости в пар, происходящий с образованием пузырьков пара по всему объему жидкости при определенной температуре.
Температура кипения
Если испарение происходит при любой температуре, то кипение происходит при некоторой определенной температуре. При этом:
Температура кипения – это температура, при которой жидкость кипит.
Во время кипения температура жидкости не меняется.
Вспомните, при приготовлении того же супа после закипания воды огонь уменьшают. Теперь он просто поддерживает эту самую температуру кипения. Это дает экономию топлива.
Температура кипения зависит от давления на поверхность жидкости. Давление насыщенного пара в пузырьках при кипении всегда больше внешнего давления.
Соответственно, если мы увеличим внешнее давление, то температура кипения увеличивается. Если уменьшим – температура кипения тоже снизится.
Температура кипения некоторых веществ
В таблице 1 представлены экспериментально полученные значения температуры кипения для различных веществ.
| Вещество | $t_<кип>, \degree C$ | Вещество | $t_<кип>, \degree C$ |
| Водород | -253 | Вода | 100 |
| Кислород | -183 | Ртуть | 357 |
| Эфир | 35 | Свинец | 1740 |
| Спирт | 78 | Медь | 2567 |
| Молоко | 100 | Железо | 2750 |
Талица 1. Температура кипения некоторых веществ (при нормальном атмосферном давлении)
Графики кипения жидкостей
На рисунке видно, что горизонтальные участки графиков соответствуют процессам кипения. Они параллельны оси времени, температура на них остается постоянной. Чтобы определить, какой график соответствует каждой жидкости, нам нужно обратиться к таблице 1.
$70 \degree C$ – температура кипения спирта. Значит, 2 – график нагревания и кипения спирта.
Что такое кипение в физике
Явление превращения вещества из жидкого состояния в газообразное называется парообразованием. Парообразование может осуществляться в виде двух процессов: испарение и кипение.
Кипение
Второй процесс парообразования — кипение. Наблюдать этот процесс можно с помощью простого опыта, нагревая воду в стеклянной колбе. При нагревании воды в ней через некоторое время появляются пузырьки, в которых содержатся воздух и насыщенный водяной пар, который образуется при испарении воды внутри пузырьков. При повышении температуры давление внутри пузырьков растёт, и под действием выталкивающей силы они поднимаются вверх. Однако, поскольку температура верхних слоёв воды меньше, чем нижних, пар в пузырьках начинает конденсироваться, и они сжимаются. Когда вода прогреется по всему объёму, пузырьки с паром поднимаются до поверхности, лопаются, и пар выходит наружу. Вода кипит. Это происходит при такой температуре, при которой давление насыщенного пара в пузырьках равно атмосферному давлению.
Процесс парообразования, происходящий во всем объёме жидкости при определённой температуре, называют кипением. Температуру, при которой жидкость кипит, называют температурой кипения.
Эта температура зависит от атмосферного давления. При повышении атмосферного давления температура кипения возрастает.
Опыт показывает, что в процессе кипения температура жидкости не изменяется, несмотря на то, что извне поступает энергия. Переход жидкости в газообразное состояние при температуре кипения связан с увеличением расстояния между молекулами и соответственно с преодолением притяжения между ними. На совершение работы по преодолению сил притяжения расходуется подводимая к жидкости энергия. Так происходит до тех пор, пока вся жидкость не превратится в пар. Поскольку жидкость и пар в процессе кипения имеют одинаковую температуру, то средняя кинетическая энергия молекул не изменяется, увеличивается лишь их потенциальная энергия.
На рисунке приведён график зависимости температуры воды от времени в процессе её нагревания от комнатной температуры до температуры кипения (АВ), кипения (ВС), нагревания пара (CD), охлаждения пара (DE), конденсации (EF) и последующего охлаждения (FG).
Удельная теплота парообразования
Для превращения разных веществ из жидкого состояния в газообразное требуется разная энергия, эта энергия характеризуется величиной, называемой удельной теплотой парообразования.
Удельная теплота парообразования (L) — это величина, равная отношению количества теплоты, которое нужно сообщить веществу массой 1 кг, для превращения его из жидкого состояния в газообразное при температуре кипения.
Единица удельной теплоты парообразования — [L] = Дж/кг.
Чтобы рассчитать количество теплоты Q, которое необходимо сообщить веществу массой тп для его превращения из жидкого состояния в газообразное, необходимо удельную теплоту парообразования (L) умножить на массу вещества: Q = Lm.
При конденсации пара выделяется некоторое количество теплоты, причем его значение равно значению количества теплоты, которое необходимо затратить для превращения жидкости в пар при той же температуре.
Конспект урока «Кипение. Удельная теплота парообразования».
КИПЕНИЕ
Переход жидкости в пар (фазовый переход I рода), происходящий с образованием в объёме жидкости пузырьков пара или заполненных паром полостей на нагреваемых поверхностях. Пузырьки растут (вследствие испарения в образующуюся полость жидкости), всплывают, и содержащийся в них насыщ. пар переходит в паровую фазу над жидкостью.
Для поддержания К. к жидкости необходимо подводить теплоту, к-рая расходуется на парообразование и на работу пара против внеш. давления при увеличении объёма паровой фазы ( см. ИСПАРЕНИЕ). Темп-pa, при к-рой происходит К. жидкости, находящейся под пост. давлением, наз. температурой кипения (Tкип). Строго говоря, Ткип соответствует темп-ре насыщ. пара (темп-ре насыщения) над плоской поверхностью кипящей жидкости, т. к. сама жидкость всегда несколько перегрета относительно Ткип. С ростом давления Tкип увеличивается ( см. КЛАПЕЙРОНА — КЛАУЗИУСА УРАВНЕНИЕ). Предельной темп-рой К. явл. критическая температура в-ва. Темп-pa К. при атм. давлении приводится обычно как одна из осн. физ.-хим. хар-к химически чистого в-ва.
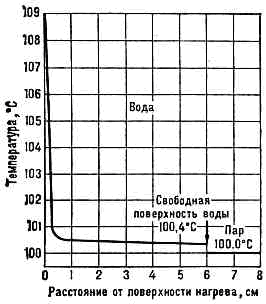
При К. в жидкости устанавливается определ. распределение температуры (рис. 1): у поверхностей нагрева (стенок сосуда, труб и т. п.) жидкость заметно перегрета. Величина перегрева зависит от ряда физ. и хим. св-в как самой жидкости, так и граничных тв. поверхностей. Опыты показывают, что тщательно очищенные жидкости, лишённые растворённых газов (воздуха),
Рис. 1. Распределение темп-ры в жидкости над горизонт. поверхностью нагрева при пузырьковом кипении.
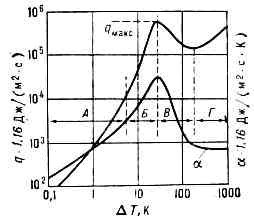
При достижении максимального (критич.) значения теплового потока (для кипящей воды =1500 кВт/м2 при T-Tкип=25—30°С) начинается второй, переходный режим К. При этом режиме теплоотдача и скорость парообразования резко снижаются, т. к. большая доля поверхности нагрева покрывается сухими пятнами из-за слияния образующихся пузырьков пара. Когда вся поверхность обволакивается тонкой паровой плёнкой, возникает третий, плёночный режим К., при к-ром теплота от раскалённой поверхности передаётся к жидкости через паровую плёнку путём теплопроводности и излучения. Все три режима К. можно наблюдать в обратном порядке, когда массивное металлич. тело погружают в воду для его закалки: вода закипает, охлаждение тела идёт вначале медленно (плёночное К.), потом скорость охлаждения начинает быстро увеличиваться (переходное К.) и достигает наибольших значений в конечной стадии охлаждения (п у з ы р ь к о в о е К.). Теплоотвод в режиме пузырькового К. явл. одним из наиболее эфф. способов охлаждения (рис. 2).
Рис. 2. Изменение плотности теплового потока q и коэфф. теплоотдачи a. при кипении воды под атм. давлением в зависимости от температурного напора DT: А — область слабого образования пузырьков; Б — пузырьковое кипение; В — плёночное кипение, постепенный переход к сплошной паровой плёнке; Г — стабильное плёночное кипение,qмакс — макс. значение q.
Растворение в жидкости нелетучего в-ва понижает давление её насыщ. пара и повышает Tкип. Это позволяет определять мол. массу растворённых в-в по вызываемому ими повышению Ткип растворителя.
К. возможно не только при нагревании жидкости в условиях пост. давления. Снижением внеш. давления при пост. темп-ре можно также вызвать перегрев жидкости и её вскипание (за счёт уменьшения темп-ры насыщения). Этим объясняется, в частности, явление кавитации — образование паровых полостей в местах пониж. давления жидкости (напр., в вихревой зоне за гребным винтом теплохода). Понижение Ткип с уменьшением внеш. давления лежит в основе определения барометрич. давления. К. при пониж. давлении применяют в холодильной технике, в физ. эксперименте ( см. ПУЗЫРЬКОВАЯ КАМЕРА).
Физика. 10 класс
§ 9-1. Кипение жидкости
В 8-м классе вы узнали, что у жидкости может быть много значений температуры кипения. Дело в том, что в жидкости всегда имеется растворённый в ней газ, с которым тесно связано кипение ( рис. 60.1 ). Если нагревать на плите сосуд с водой, то у его стенок воздух начнёт выделяться в виде пузырьков. В эти пузырьки испаряется вода, поэтому в них в воздухе находится насыщенный водяной пар. С ростом температуры давление насыщенного пара увеличивается гораздо быстрее, чем давление остального газа. Поэтому можно считать, что давление внутри пузырьков в нагретой жидкости практически равно давлению насыщенного пара. На пузырьки, кроме силы тяжести их содержимого, действуют силы гидростатического давления воды и атмосферного давления воздуха. Однако если сосуд не слишком глубокий, то гидростатическое давление значительно меньше атмосферного и им можно пренебречь.
С ростом температуры объём пузырьков быстро увеличивается, что влечёт за собой увеличение выталкивающей силы. Когда сила Архимеда, действующая на пузырёк, становится больше силы тяжести его содержимого, он начинает всплывать ( рис. 60.2 ). Достигнув поверхности жидкости, пузырьки лопаются, поскольку давление насыщенного пара, которым они заполнены, немного превышает внешнее давление. Пар выходит наружу — жидкость кипит. Таким образом, жидкость начинает кипеть при такой температуре, при которой давление насыщенного пара равно (точнее, чуть больше) внешнему давлению.
Перегретую жидкость используют в пузырьковых камерах для визуализации треков заряженных частиц, движущихся со скоростями, близкими к скорости света.
С перегретой жидкостью необходимо обращаться очень осторожно. Любое возмущение (резкое перемещение сосуда, появление источника газа или какого-либо предмета в жидкости) может привести к её немедленному взрывообразному вскипанию.
1. Чем отличается кипение от испарения?
2. При каком условии происходит кипение жидкости?
3. Почему температура кипящей при определённом внешнем давлении жидкости остаётся постоянной?