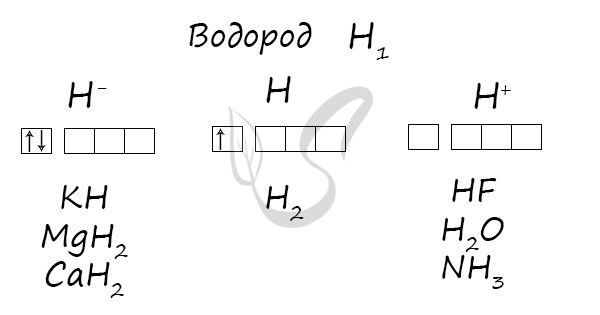
Что такое кислород и водород
Кислород
Кислород — один из самых распространенных на Земле элементов. Он составляет около половины веса земной коры, внешней оболочки планеты. В соединении с водородом он образует воду, покрывающую более двух третей земной поверхности.
Мы не можем ни увидеть кислород, ни ощутить его вкус или запах. Тем не менее, он составляет пятую часть воздуха и является жизненно необходимым. Чтобы жить, нам, так же как животным и растениям, надо дышать.
Кислород — непременный участник химических реакций, идущих внутри любой микроскопической клетки живого организма, в результате которых расщепляются питательные вещества и высвобождается энергия, необходимая для жизни. Именно поэтому кислород так необходим каждому живому существу (за исключением немногих видов микробов).
При горении вещества соединяются с кислородом, выделяя при этом энергию в виде тепла и света.
Водород
Самым распространенным элементом во Вселенной является водород. На него приходится основная масса большинства звезд. На Земле основная часть водорода (химический символ Н) связана с кислородом (О), образуя воду (Н20). Водород — простейший и самый легкий химический элемент, так как каждый его атом состоит лишь из одного протона и одного электрона.
В начале XX века водородом наполняли дирижабли, большие воздушные суда. Однако водород очень легко воспламеняется. После нескольких катастроф, вызванных пожарами, водород в дирижаблях перестали использовать. Сегодня в воздухоплавании используют другой легкий газ — негорючий гелий.
Водород соединяется с углеродом и образует вещества, которые называются углеводородами. К ним относятся продукты, получаемые из природного газа и сырой нефти, например, газообразные пропан и бутан, или жидкий бензин. Водород также соединяется с углеродом и кислородом с образованием углеводов. Крахмал в картофеле и рисе, сахар в свекле являются углеводами.
Солнце и другие звезды в основном состоят из водорода. В центре звезды чудовищные температуры и давления заставляют атомы водорода сливаться друг с другом и превращаться в другой газ – гелий. При этом выделяется огромное количество энергии в виде тепла и света.
Реакция водорода с кислородом
Реакция взаимодействия водорода с кислородом.
Уравнение реакции взаимодействия водорода с кислородом:
Водород взаимодействует с кислородом. Реакция взаимодействия водорода с кислородом представляет собой сгорание водорода на воздухе.
Реакция водорода с кислородом протекает при условии: при температуре 510 °C. Температура 510 °C является температурой самовоспламенения водорода.
В ходе реакции водорода с кислородом при стандартных условиях выделяется тепловая энергия (теплота) 483,64 кДж (агрегатное состояние воды – газ) или 571,66 кДж (агрегатное состояние воды – жидкость).
Термохимическое уравнение этой реакции имеет следующий вид:
Таким образом, реакция водорода с кислородом носит экзотермический характер.
Удельная теплота сгорания водорода составляет примерно 140 МДж/кг (верхняя) или 120 МДж/кг (нижняя), что в несколько раз превышает удельную теплоту сгорания углеводородных топлив (например, метана – 50,1 МДж/кг).
Водород
В трудах химиков XVI-XVIII вв. упоминался «горючий» или «воспламеняемый воздух», который в сочетании с обычным давал взрывчатые смеси. Получали его, действуя на некоторые металлы (железо, цинк, олово) разбавленными растворами кислот – серной и соляной. Первым ученым, описавшим свойства этого газа, был Г.Кавендиш. Он определил его плотность и изучил горение на воздухе, однако приверженность теории флогистона помешала исследователю разобраться в сути происходящих процессов. Кавендиш принял «горючий воздух» (водород) за чистый флогистон – невидимую субстанцию, которую тела теряют при горении или при растворении в кислотах. Тогда металлы считали сложными веществами, содержащими флогистон, его-то они якобы и выделяют под действием кислоты.
Дальнейшее развитие химии показало ошибочность этой теории. Теперь общеизвестно, что водород входит в состав кислот, а металлы являются простыми веществами. Однако способ получения водорода, открытый в те времена, используется в лабораториях до сих пор. Для этого в аппарат Киппа загружают палочки, отлитые из цинка, и заливают 20-процентную серную кислоту:
А.Л.Лавуазье в 1779 г. получил водород при разложении воды, пропуская ее пары через раскаленную докрасна железную трубку с железными опилками. При температуре красного каления железо вступает в реакцию с водяным паром, и выделяется водород: 3Fe + 4H2O = Fe3O4 + 4H2↑

Лавуазье также доказал, что при взаимодействии «горючего воздуха» с кислородом образуется вода, причем газы реагируют в объемном соотношении 2:1. Это позволило ученому определить состав воды – Н2О. Название элемента – Hydrogenium – Лавуазье и его коллеги образовали от греческих слов «гидор» — «вода» и «геннао» — «рождаю». Русское слово «водород», т.е. «рождающий воду», является точным переводом латинского названия.
Водород относится к числу наиболее распространенных химических элементов. В земной коре он встречается почти исключительно в виде соединений: входит в состав нефти, природного газа, каменного угля, некоторых минералов. В свободном состоянии он обнаружен в незначительном количестве в вулканических газах, а также среди продуктов разложения органических веществ микроорганизмами. Но конечно, самое известное соединение водорода – это его оксид, вода. По оценкам ученых, на Земле 1,4∙10 18 т поверхностных вод, и еще около 1,3∙10 13 т – в виде пара в атмосфере. Обширны также запасы подземных вод.
Кроме того, водород самый распространенный элемент во Вселенной. Энергия, излучаемая Солнцем и другими звездами, выделяется в результате ядерных реакций с участием его ядер.
Элемент образует несколько изотопов: наряду с обычным водородом с относительной атомной массой 1 (его называют протием, 1 Н), на Земле встречаются два тяжелых изотопа – дейтерий( 2 Н или D) и тритий ( 3 Н или Т). Содержание дейтерия в природном водороде очень незначительно: лишь один из 100 тыс. атомов водорода является атом дейтерия. Этот изотоп был выделен в 1931 г. при испарении жидкого водорода. Радиоактивного трития еще меньше – примерно один атом на каждые 10 18 атомов 1 Н. Недавно зафиксировано образование сверхтяжелых изотопов водорода – 4 Н и 5 Н.
Водород – бесцветный газ без вкуса и запаха, слаборастворимый в воде. Он в 14,5 раз легче воздуха – самый легкий из газов. Поэтому водородом раньше наполняли аэростаты и дирижабли.
Молекулы Н2 настолько малы, что способны легко проходить не только через мелкие поры, но и сквозь металлы. Некоторые из них, например никель и палладий, могут поглощать большое количество водорода и удерживать его в атомарном виде в пустотах кристаллической решетки. Нагретая до 250 о С палладиевая фольга свободно пропускает водород: этим пользуются для тщательной очистки его от других газов.
Подобно Н2, дейтерий при нормальных условиях – газ, состоящий из молекул D2. Однако по сравнению с обычным водородом он имеет более высокую температуру кипения (-249 о С ).
Химические свойства водорода
В химических реакциях водород может быть как восстановителем (что для него более характерно), так и окислителем.
Водород взаимодействует как восстановитель:
Смесь 2 объемов Н2 и 1 объема О2 при поджигании взрывается (так называемый «гремучий газ»);
б) с серой при нагревании:
в) с хлором при поджигании и облучении смеси газов УФ-светом:
г) с фтором при обычных условиях:
д) с азотом при повышенном давлении и нагревании в присутствии катализаторов(реакция необратима):
Как окислитель водород взаимодействует только с активными (щелочными и щелочноземельными) металлами. В результате образуются гидриды металлов, представляющие собой солеобразные ионные соединения, которые содержат гидрид-ионы Н — :
Гидриды металлов – нестойкие кристаллические вещества белого цвета. Они являются сильными восстановителями, так как степень окисления – 1 малохарактерна для водорода. Так, при действии воды гидриды разлагаются, восстанавливая при этом воду до водорода:
а) При высокой температуре водород может восстанавливать большинство оксидов металлов; например:
в) Водород способен присоединяться ко многим органическим молекулам. Такие реакции называются гидрированием и будут подробно рассмотрены в разделе «Органическая химия».
Получение водорода
Существует достаточно много способов получения водорода. Рассмотрим наиболее широко используемые лабораторные (первые три) и промышленные способы.
Применение водорода
В химической промышленности водород служит сырьем для получения аммиака NH3, хлороводорода НСl, метанола СН3ОН и других органических веществ. В пищевой промышленности водород используют для выработки твердых жиров путем гидрогенизации растительных масел. В металлургии водород используется для восстановления некоторых цветных металлов из их оксидов. Как уже отмечалось выше, водород – очень легкий газ, поэтому им заполняют воздушные шары, зонды и другие летательные аппараты. Высокая экзотермичность реакции горения водорода в кислороде обусловливает использование «водородной» горелки для сварки и резки металлов (температура водородного пламени достигает 2600 о С ). Жидкий водород является одним из наиболее эффективных видов ракетного топлива.
В последние годы все больше внимание уделяется водородной энергетике, т.е. использованию водорода в качестве топлива, в частности для двигателей внутреннего сгорания. Это представляет особый интерес с экологической точки зрения, так как при горении водорода в выделяющихся газах не содержится вредных веществ (продукт горения – вода!).
Пероксид водорода (Н2О2)
Раствор пероксида водорода имеет кислую реакцию среды, что обусловлено диссоциацией его молекул по типу слабой кислоты:
Как кислота пероксид водорода взаимодействует с основаниями:
Некоторые пероксиды металлов, например Na2O2, BaO2, можно рассматривать как соли слабой кислоты пероксида водорода. Из них можно получать Н2О2 действием более сильных кислот:
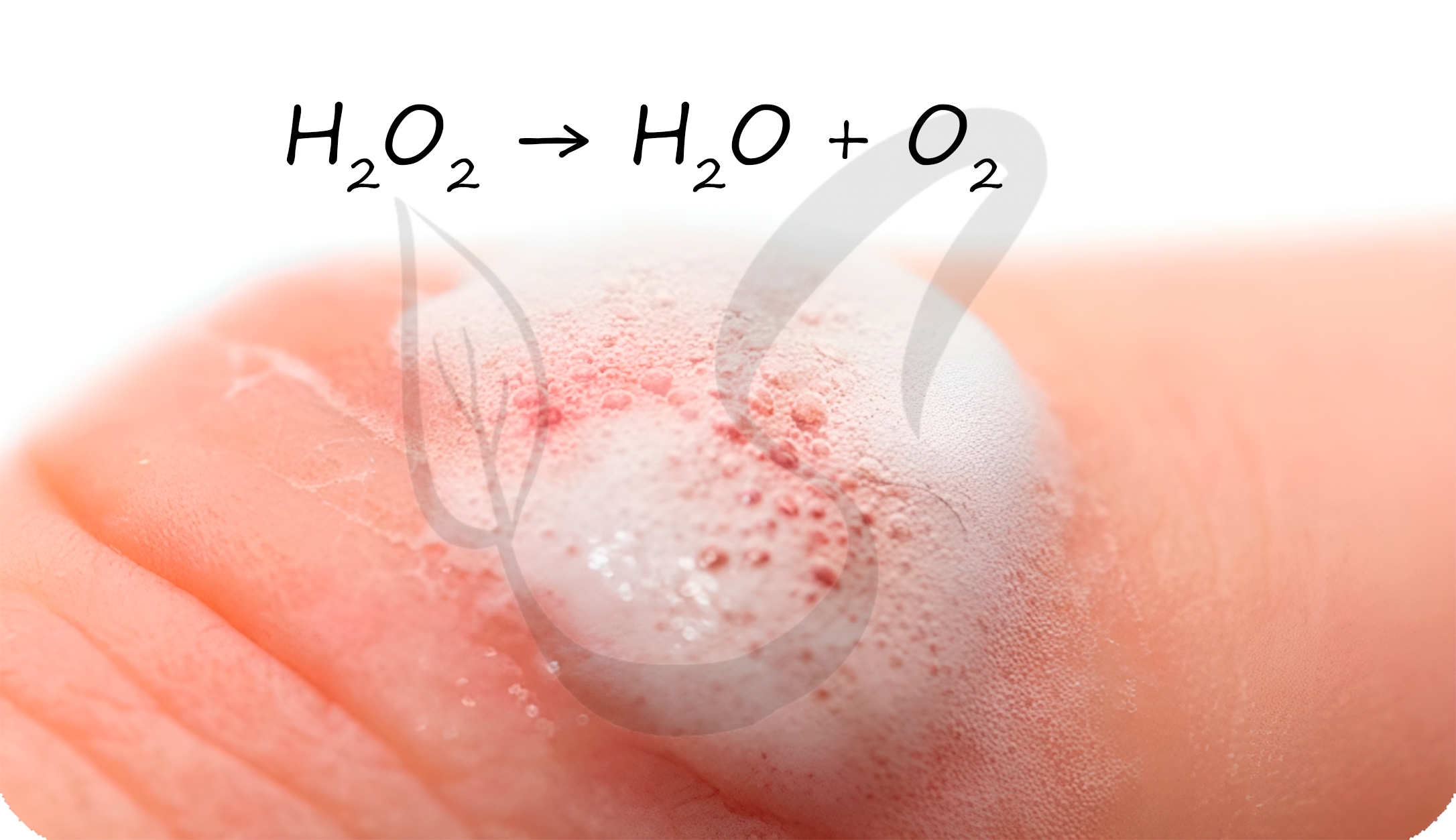
Графическая формула пероксида водорода: Н – О – О – Н. «Пероксидный мостик» из двух атомов кислорода обусловливает неустойчивость молекулы. При хранении на свету, нагревании, в присутствии катализатора пероксид водорода разлагается на воду и кислород:
Данная реакция относится к типу реакций диспропорционирования. Способность пероксида водорода к самоокислению-самовосстановлению объясняется тем, что атомы кислорода в его молекуле находятся в промежуточной степени окисления – 1. Этим же обусловлено участие Н2О2 в различных реакциях в роли окислителя или в роли восстановителя. В реакциях с типичными восстановителями пероксид водорода проявляет свойства окислителя и восстанавливается до воды или гидроксид-ионов; например:
При взаимодействии с сильными окислителями Н2О2 проявляет восстановительные свойства и окисляется до свободного кислорода; например:
Пероксид водорода применяют как дезинфицирующее средство в медицине для полосканий, промываний и как кровоостанавливающее средство в виде 3%-ного раствора.
Скачать:
Скачать бесплатно реферат на тему: «Водород» Водород.docx (236 Загрузок)
Скачать бесплатно реферат на тему: «Водород и Вселенная» Водород-и-Вселенная.docx (220 Загрузок)
Скачать бесплатно реферат на тему: «Вода» Вода.docx (227 Загрузок)
Скачать бесплатно реферат на тему: «Водородная связь» Водородная-связь.docx (250 Загрузок)
Скачать бесплатно реферат на тему: «Вода и ее свойства» Вода-и-её-свойства.docx (217 Загрузок)
Скачать бесплатно реферат на тему: «Водные ресурсы» ВОДНЫЕ-РЕСУРСЫ.docx (213 Загрузок)
Скачать рефераты по другим темам можно здесь
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Водород
Степени окисления
Получение
Химические свойства
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых выше, чем у водорода:
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)
Na + H2 → NaH (гидрид натрия)
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
Кристаллогидраты
В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует вычесть кристаллизационную воду и найти массу безводного сульфата калия.
Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
В разбавленных растворах пероксид водорода легко разлагается:
Также перекись проявляет окислительные свойства:
Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки, предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Что такое кислород и водород
Название «водород»относится и к химическому элементу, и к простому веществу. Элемент водород состоит из атомов водорода. Простое вещество водород состоит из молекул водорода.
а) Химический элемент водород
В естественном ряду элементов порядковый номер водорода – 1. В системе элементов водород находится в первом периоде в IA или VIIA группе.
Водород – один из самых распространенных элементов на Земле. Молярная доля атомов водорода в атмосфере, гидросфере и литосфере Земли (все вместе это называется земной корой) равна 0,17. Он входит в состав воды, многих минералов, нефти, природного газа, растений и животных. В теле человека в среднем содержится около 7 килограммов водорода.
Существуют три изотопа водорода:
а) легкий водород 
б) тяжелый водород 
в) сверхтяжелый водород 
Тритий неустойчивый (радиоактивный) изотоп, поэтому в природе он практически не встречается. Дейтерий устойчив, но его очень мало: wD = 0,015% (от массы всего земного водорода). Поэтому атомная масса водорода очень мало отличается от 1 Дн (1,00794 Дн).
Из предыдущих разделов курса химии вам уже известны следующие характеристики атома водорода:
Атомный номер
Заряд ядра
Число протонов в ядре
Электронная формула атома
Форма граничной поверхности ЭО
Орбитальный радиус атома
Молярная энергия ионизации
Z = +1e
Z = 1
1s 1
Сфера
ro(H) = 0,53 A = 0,053 нм
E m и(H) = 1312 кДж/моль
 = 2,10
= 2,10Валентные возможности атома водорода определяются наличием одного электрона на единственной валентной орбитали. Большая энергия ионизации делает атом водорода не склонным к отдаче электрона, а не слишком высокая энергия сродства к электрону приводит к незначительной склонности его принимать. Следовательно, в химических системах образование катиона Н 

В простом веществе степень окисления атомов водорода равна нулю, в большинстве соединений водород проявляет степень окисления +I, и только в гидридах наименее электроотрицательных элементов у водорода степень окисления –I.
Сведения о валентных возможностях атома водорода приведены в таблице 28. Валентное состояние атома водорода, связанного одной ковалентной связью с каким-либо атомом, в таблице обозначено символом «H—».
Валентное состояние
Примеры химических веществ
HCl, H2O, H2S, NH3, CH4, C2H6, NH4Cl, H2SO4, NaHCO3, KOH
H2
B2H6, SiH4, GeH4
в) Молекула водорода
Двухатомная молекула водорода Н2 образуется при связывании атомов водорода единственной возможной для них ковалентной связью. Связь образуется по обменному механизму. По способу перекрывания электронных облаков это s-связь (рис. 10.1 а). Так как атомы одинаковы, связь неполярная.
Межатомное расстояние (точнее равновесное межатомное расстояние, ведь атомы-то колеблются) в молекуле водорода r(H–H) = 0,74 A (рис.10.1 в), что значительно меньше суммы орбитальных радиусов (1,06 A). Следовательно, электронные облака связываемых атомов перекрываются глубоко (рис. 10.1 б), и связь в молекуле водорода прочная. Об этом же говорит и довольно большое значение энергии связи (454 кДж/моль).
Если охарактеризовать форму молекулы граничной поверхностью (аналогичной граничной поверхности электронного облака), то можно сказать, что молекула водорода имеет форму слегка деформированного (вытянутого) шара (рис. 10.1 г).
г) Водород (вещество)
Zn + H2SO4 = ZnSO4 + H2.
Вместо цинка можно использовать железо, алюминий и некоторые другие металлы, а вместо серной кислоты – некоторые другие разбавленные кислоты. Образующийся водород собирают в пробирку методом вытеснения воды (см. рис. 10.2 б) или просто в перевернутую колбу (рис. 10.2 а).
В промышленности в больших количествах водород получают из природного газа (в основном это метан) при взаимодействии его с парами воды при 800 °С в присутствии никелевого катализатора:
или обрабатывают при высокой температуре парами воды уголь:
Чистый водород получают из воды, разлагая ее электрическим током (подвергая электролизу):
2H2O = 2H2+ O2
(электролиз).
д) Соединения водорода
Гидриды (бинарные соединения, содержащие водород) делятся на два основных типа:
а) летучие (молекулярные) гидриды,
б) солеобразные (ионные) гидриды.
Элементы IVА – VIIA групп и бор образуют молекулярные гидриды. Из них устойчивы только гидриды элементов, образующих неметаллы:
И ионные, и почти все молекулярные гидриды (кроме Н2О и НF) являются восстановителями, но ионные гидриды проявляют восстановительные свойства значительно сильнее, чем молекулярные.
Кроме гидридов, водород входит в состав гидроксидов и некоторых солей. Со свойствами этих, более сложных, соединений водорода вы познакомитесь в следующих главах.
Главными потребителями получаемого в промышленности водорода являются заводы по производству аммиака и азотных удобрений, где аммиак получают непосредственно из азота и водорода:
N2 +3H2 
В больших количествах водород используют для получения метилового спирта (метанола) по реакции 2Н2 + СО = СН3ОН (t, ZnO – катализатор), а также в производстве хлороводорода, который получают непосредственно из хлора и водорода:
Иногда водород используют в металлургии в качестве восстановителя при получении чистых металлов, например: Fe2O3 + 3H2= 2Fe + 3H2O.
а) MH + O2 MOH (t); б) MH + Cl2
MCl + HCl (t);
в) MH + H2O MOH + H2; г) MH + HCl(p)
MCl + H2
Здесь М – это литий, натрий, калий, рубидий или цезий. Составьте уравнения соответствующих реакций в случае, если М – натрий. Проиллюстрируйте уравнениями реакций химические свойства гидрида кальция.
14.Используя метод электронного баланса, составьте уравнения следующих реакций, иллюстрирующих восстановительные свойства некоторых молекулярных гидридов:
а) HI + Cl2 HCl + I2 (t); б) NH3 + O2
H2O + N2 (t); в) CH4 + O2
H2O + CO2 (t).
Как и в случае водорода, слово «кислород» является названием и химического элемента, и простого вещества. Кроме простого вещества «кислород» (дикислород) химический элемент кислородобразует еще одно простое вещество, называемое » озон»(трикислород). Это аллотропные модификации кислорода. Вещество кислород состоит из молекул кислорода O2, а вещество озон состоит из молекул озона O3.
а) Химический элемент кислород
В естественном ряду элементов порядковый номер кислорода – 8. В системе элементов кислород находится во втором периоде в VIA группе.
Кислород – самый распространенный элемент на Земле. В земной коре каждый второй атом – атом кислорода, то есть молярная доля кислорода в атмосфере, гидросфере и литосфереЗемли – около 50 %. Кислород (вещество) – составная часть воздуха. Объемная доля кислорода в воздухе –21 %. Кислород (элемент) входит в состав воды, многих минералов, а также растений и животных. В теле человека содержится в среднем 43 кг кислорода.
Природный кислород состоит из трех изотопов ( 16 О, 17 О и 18 О), из которых наиболее распространен самый легкий изотоп 16 О. Поэтому атомная масса кислорода близка к 16 Дн (15,9994 Дн).
Вам известны следующие характеристики атома кислорода.
Атомный номер
Заряд ядра
Число протонов в ядре
Электронная формула атома
Орбитальный радиус атома
Молярная энергия ионизации
Молярная энергия сродства к электрону
Z = 8
Z = +8 e
Z = 8
1s 2 2s 2 2p 4
ro(O) = 0,45 A = 0,045 нм
E m и(O) = 1314 кДж/моль
Ес m (O) = 141 кДж/моль
 = 3,50
= 3,50Таблица 29. Валентные возможности атома кислорода
Валентное состояние
Примеры химических веществ
H2O, SO2, SO3, CO2, SiO2, H2SO4, HNO2, HClO4, COCl2, H2O2
O2**
O2F2
OF2
NaOH, KOH, Ca(OH)2, Ba(OH)2
Na2O2, K2O2, CaO2, BaO2
Li2O, Na2O, MgO, CaO, BaO, FeO, La2O3
в) Молекула кислорода
Экспериментально установлено, что двухатомная молекула кислорода О2 содержит два неспаренных электрона. Используя метод валентных связей, такое электронное строение этой молекулы объяснить невозможно. Тем не менее, связь в молекуле кислорода близка по свойствам к ковалентной. Молекула кислорода неполярна. Межатомное расстояние (ro–o = 1,21 A = 121 нм) меньше, чем расстояние между атомами, связанными простой связью. Молярная энергия связи довольно велика и составляет 498 кДж/моль.
г) Кислород (вещество)
При обычных условиях кислород – газ без цвета и запаха. Твердый кислород плавится при 55 К (–218 °С), а жидкий кислород кипит при 90 К (–183 °С).
Межмолекулярные связи в твердом и жидком кислороде несколько более прочные, чем в водороде, о чем свидетельствует больший температурный интервал существования жидкого кислорода (36 °С) и большие, чем у водорода, молярные теплоты плавления (0,446 кДж/моль) и парообразования (6,83 кДж/моль).
Кислород незначительно растворим в воде: при 0 °С в 100 объемах воды (жидкой!) растворяется всего 5 объемов кислорода (газа!).
Высокая склонность атомов кислорода к присоединению электронов и высокая электроотрицательность приводят к тому, что кислород проявляет только окислительные свойства. Эти свойства особенно ярко проявляются при высокой температуре.
Кислород реагирует со многими металлами: 2Ca + O2 = 2CaO, 3Fe + 2O2 = Fe3O4 (t);
неметаллами: C + O2 = CO2, P4 + 5O2 = P4O10,
и сложными веществами: CH4 + 2O2 = CO2 + 2H2O, 2H2S + 3O2 = 2H2O + 2SO2.
Чаще всего в результате таких реакций получаются различные оксиды (см. гл. II § 5), но активные щелочные металлы, например натрий, сгорая, превращаются в пероксиды:
Структурная формула получившегося пероксида натрия (Na 


Тлеющая лучинка, помещенная в кислород, вспыхивает. Это удобный и простой способ обнаружения чистого кислорода.
В промышленности кислород получают из воздуха путем ректификации (сложной разгонки), а в лаборатории – подвергая термическому разложению некоторые кислородсодержащие соединения, например:
2KMnO4 = K2MnO4 + MnO2 + O2(200 °С);
2KClO3 = 2KCl + 3O2 (150 °С, MnO2 – катализатор);
2KNO3 = 2KNO2 + 3O2 (400 °С)
и, кроме того, путем каталитического разложения пероксида водорода при комнатной температуре: 2H2O2 = 2H2O + O2 (MnO2–катализатор).
Чистый кислород используют в промышленности для интенсификации тех процессов, в которых происходит окисление, и для создания высокотемпературного пламени. В ракетной технике в качестве окислителя используется жидкий кислород.
Огромное значение имеет кислород для поддержания жизнедеятельности растений, животных и человека. В обычных условиях человеку достаточно для дыхания кислорода воздуха. Но в условиях, когда воздуха не хватает, или он вообще отсутствует (в самолетах, при водолазных работах, в космических кораблях и т. п.), для дыхания готовят специальные газовые смеси, содержащие кислород. Применяют кислород и в медицине при заболеваниях, вызывающих затруднение дыхания.
д) Озон и его молекулы
Озон O3 – вторая аллотропная модификация кислорода.
Трехатомная молекула озона имеет уголковую структуру, среднюю между двумя структурами, отображаемыми следующими формулами:
Озон – темно-синий газ с резким запахом. Из-за своей сильной окислительной активности он ядовит. Озон в полтора раза «тяжелее» кислорода и несколько больше, чем кислород, растворим в воде.
Озон образуется в атмосфере из кислорода при грозовых электрических разрядах:
3О2 = 2О3 (
При обычной температуре озон медленно превращается в кислород, а при нагревании этот процесс протекает со взрывом.
Озон содержится в так называемом «озоновом слое» земной атмосферы, предохраняя все живое на Земле от вредного воздействия солнечного излучения.
В некоторых городах озон используется вместо хлора для дезинфекции (обеззараживания) питьевой воды.

Определите валентность и степень окисления каждого из атомов кислорода.
2.Составьте уравнения реакций сгорания в кислороде лития, магния, алюминия, кремния, красного фосфора и селена (атомы селена окисляются до степени окисления +IV, атомы остальных элементов – до высшей степени окисления). К каким классам оксидов относятся продукты этих реакций?
3.Сколько литров озона можно получить (при нормальных условиях) а) из 9 л кислорода, б) из 8 г кислорода?
Вода – самое распространенное в земной коре вещество. Масса земной воды оценивается в 10 18 тонн. Вода – основа гидросферы нашей планеты, кроме того, она содержится в атмосфере, в виде льда образует полярные шапки Земли и высокогорные ледники, а также входит в состав различных горных пород. Массовая доля воды в человеческом организме составляет около 70 %.
Вода – единственное вещество, у которого во всех трех агрегатных состояниях есть свои особые названия.
Электронное строение молекулы воды (рис. 10.4 а) нами было подробно изучено ранее (см. § 7.10).
Из-за полярности связей О–Н и уголковой формы молекула воды представляет собой электрический диполь.
| Электрический диполь – частица (или тело), несущая равные по модулю положительный и отрицательный заряды, не совпадающие в пространстве. |
Для характеристики полярности электрического диполя используется физическая величина, называемая «электрический момент электрического диполя» или просто «дипольный момент»
| Электрический момент электрического диполя (дипольный момент) – произведение положительного заряда диполя на вектор расстояния между заряженными концами диполя. |
В молекуле воды – две полярные ковалентные связи, то есть два электрических диполя, каждый из которых обладает своим дипольным моментом (



где q1 и q2 – частичные заряды ( +) на атомах водорода, а 


Экспериментально определенные дипольные моменты молекулы воды и некоторых других молекул приведены в таблице.
Зная дипольные моменты, можно рассчитать частичные заряды на атомах. Так частичный заряд на атоме водорода равен 0,33 е, а частичный заряд на атоме кислорода равен –0,66 е.
Учитывая дипольный характер молекулы воды, ее часто схематически изображают следующим образом: 
Чистая вода – бесцветная жидкость без вкуса и запаха. Некоторые основные физические характеристики воды приведены в таблице.
Физические величины
Молярный объем при 4 °С
18 мл
0 ° С
100 ° С
6,01 кДж/моль
40,7 кДж/моль
Большие значения молярных теплот плавления и парообразования (на порядок больше, чем у водорода и кислорода) свидетельствуют о том, что молекулы воды, как в твердом, так и в жидком веществе, довольно прочно связаны между собой. Эти связи называют «водородными связями».


2.При перекрывании каких орбиталей образуются связи между водородом и кислородом в молекуле воды?
3.Составьте схему образования связей в молекуле пероксида водорода H2O2. Что вы можете сказать о пространственном строении этой молекулы?
4.Межатомные расстояния в молекулах HF, HCl и HBr равны, соответственно, 0,92; 1,28 и 1,41
5.Межатомные расстояния S – H в молекуле сероводорода равны 1,34 
В последней структурной формуле тремя точками (пунктирный штрих, а не электроны!) показана водородная связь.
| Водородная связь – межмолекулярная связь, образованная за счет частичного акцептирования неподеленной пары электронов атома не связанным с ним химической связью атомом водорода. |
Водородная связь существует не только между молекулами воды. Она образуется, если соблюдаются два условия:
1) в молекуле есть сильно полярная связь Н–Э (Э – символ атома достаточно электроотрицательного элемента),
2) в молекуле есть атом Э с большим отрицательным частичным зарядом и неподеленной парой электронов.
В качестве элемента Э может быть фтор, кислород и азот. Существенно слабее водородные связи, если Э – хлор или сера.
Примеры веществ с водородной связью между молекулами: фтороводород, твердый или жидкий аммиак, этиловый спирт и многие другие.
В жидком фтороводороде его молекулы связаны водородными связями в довольно длинные цепи, а в жидком и твердом аммиаке образуются трехмерные сетки.
По прочности водородная связь – промежуточная между химической связью и остальными видами межмолекулярных связей. Молярная энергия водородной связи обычно лежит в пределах от 5 до 50 кДж/моль.
В твердой воде (то есть в кристаллах льда) все атомы водорода связаны водородными связями с атомами кислорода, при этом каждый атом кислорода образует по две водородные связи (используя обе неподеленные пары электронов). Такая структура делает лед более » рыхлым»по сравнению с жидкой водой, где часть водородных связей оказывается разорванной, и молекулы получают возможность несколько плотнее » упаковаться». Эта особенность структуры льда объясняет, почему, в отличие от большинства других веществ, вода в твердом состоянии имеет меньшую плотность, чем в жидком. Максимальной плотности вода достигает при 4 °С –при этой температуре рвется достаточно много водородных связей, а тепловое расширение еще не очень сильно сказывается на плотности.
Водородные связи имеют очень большое значение в нашей жизни. Представим себе на минуту, что водородные связи перестали образовываться. Вот некоторые последствия:
Приведенных примеров достаточно, чтобы понять, что в этом случае природа на нашей планете стала бы совсем иной.


2.Водородные связи существуют не только в индивидуальных веществах, но и в растворах. Покажите с помощью структурных формул, как образуются водородные связи в водном растворе а) аммиака, б) фтороводорода, в) этанола (этилового спирта).
Наличие водородных связей в жидкой воде объясняет еще одно интересное и важное свойство этого вещества – ее автопротолиз.
Рассмотрим, что происходит с двумя молекулами воды, связанными водородной связью.
За счет тепловых колебаний атом водорода, образующий водородную связь, может на мгновение занять промежуточное положение между атомами кислорода. Из частицы с таким атомом водорода с равной вероятностью могут образоваться как исходные молекулы воды, связанные водородными связями, так и два иона: гидроксид-ион и ион оксония:
То есть, в воде протекает реакция 2Н2О = Н3О 

Также легко происходит и обратный процесс – образование двух молекул воды при столкновении иона оксония с гидроксид-ионом: Н3О 

Обе эти реакции протекают в воде постоянно и с равной скоростью, следовательно, в воде существует равновесие: 2Н2О AН3О 

Это равновесие называется равновесием автопротолиза воды.
| Автопротолиз –обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого индивидуального вещества за счет передачи протона от одной молекулы к другой. |
Прямая реакция этого обратимого процесса эндотермична, поэтому при нагревании автопротолиз усиливается, при комнатной же температуре равновесие сдвинуто влево, то есть концентрация ионов Н3О 

По закону действующих масс
Но из-за того, что число прореагировавших молекул воды по сравнению с общим числом молекул воды незначительно, можно считать, что концентрация воды при автопротолизе практически не изменяется, и [H2O] 2 = const. Тогда
Произведение KC· [H2O] 2 – величина постоянная. Она называется константой автопротолиза воды (устаревшее название – ионное произведение воды) и обозначается 



Как и константа равновесия, константа автопротолиза воды зависит от температуры. Экспериментально установлено, что при 25 °С константа автопротолиза воды
Отсюда следует, что при этих условиях в чистой воде
с(Н3О 

При увеличении температуры значение константы автопротолиза воды несколько возрастает.
Такая низкая концентрация разноименно заряженных ионов в чистой воде объясняет, почему эта жидкость, хоть и плохо, но все же проводит электрический ток.

2. Получение кислорода и горение веществ в нем (окислительные свойства).


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору