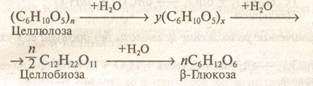Что такое кислота с точки зрения тэд
Урок по химии на тему: «Кислоты с точки зрения ТЭД»
МИНИСТЕРСТВО ОБРАЗОВАНИЯ МОСКОВСКОЙ ОБЛАСТИ
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ МОСКОВСКОЙ ОБЛАСТИ «ЧЕХОВСКИЙ ТЕХНИКУМ»
«Кислоты в свете теории электролитической диссоциации»
Подготовила преподаватель химии
Урок по теме «Кислоты в свете теории электролитической диссоциации»
Тема: Кислоты в свете теории электрической диссоциации
Цель: и зучить химические свойства кислот, выявить причину этих свойств.
актуализировать знания о кислотах (состав, номенклатура, классификация, диссоциация);
научить объяснять свойства кислот в свете ТЭД;
составлять уравнения реакции в молекулярном и ионном виде;
развивать логическое мышление, умение анализировать, делать выводы;
развивать общеучебные компетенции: умение слушать, делать записи, применять полученные знания в практической деятельности.
формировать естественно-научное мировоззрение учащихся;
поддерживать интерес к науке «химия».
Тип урока: комбинированный.
Формы и методы работы на уроке: фронтальный, объяснительно – иллюстративный, наглядный, работа с дидактическим материалом, лабораторный практикум.
ТСО – компьютер, проектор, экран, колонки;
Таблица растворимости, ПСХЭ Д. И. Менделеева;
Карточки с заданиями.
I. Организационный момент (2 мин)
Подготовка учащихся к уроку.
II. Актуализация знаний
Проверка домашнего задания (5 мин)
Самостоятельная работа (10 мин)
Закончите уравнения реакций. Запишите уравнения в молекулярном, полном ионном и сокращенном ионном виде:
III. Изучение нового материала (25 мин)
Состав, номенклатура, классификация, диссоциация кислот
Химические свойства кислот в свете ТЭД
— Из предложенного списка выберете формулы кислот: HNO3, BaCl2, HBr, CuO,NaOH, H2SO4, Fe(OH)3, H3PO4 (HNO3, HBr, H2SO4, H3PO4 – т.к. они состоят из атомов водорода и кислотного остатка.)
Катион водорода обуславливает общие свойства всех кислот: растворы кислот кислые на вкус. Индикаторы в растворах кислот изменяют свой цвет.
Кислоты классифицируются по следующим признакам:
Наличие кислорода в кислотном остатке – кислородсодержащие и бескислородные кислоты.
Основность (количество атомов водорода в молекуле кислоты) – одноосновные, двухосновные, трехосновные.
Степень электролитической диссоциации – сильные и слабые (как электролиты).
Стабильность – стабильные и нестабильные.
В свете ТЭД катионы водорода обусловливают общие химические свойства всех кислот:
а) Взаимодействие кислот с растворимыми основаниями
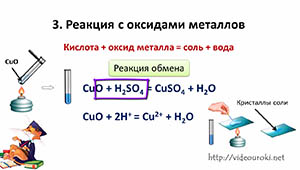
б) Взаимодействие кислот с оксидами металлов (реакция обмена)
в) Взаимодействие кислот с нерастворимыми основаниями
г) Взаимодействие металлов с растворами кислот (реакция замещения)
Убучающиеся работают в четырех группах:1 группа определяет взаимодействие кислот с металлами, 2 группа-с оксидами металлов, 3 группа – с основаниями, 4 группа- с солями.
Перед учащимися стоят реактивы, и лежит карточка с инструкцией. Следуя всем инструкциям и соблюдая правила безопасности, ребята выполняют задание. Затем оформляют результаты в тетрадь, составляя уравнение химической реакции в молекулярном и ионном виде. Цель исследования – провести опыт, оформите результат, сделать вывод, представить результат другим группам. По истечении 10 минут к доске приглашаются по одному ученику от группы, который рассказывает результаты своей работы. Все остальные записывают себе в тетрадь
NaOH + фенолфтолеин + HCl = NaCl + H2O – реакций обмена, реакция нейтрализации
Наблюдаем обесцвечивание раствора
Вывод: кислоты взаимодействуют с основаниями. Тип реакции – реакция обмена.
H2SO4 + CuO=CuSO4+ H2O
2H + +SO4 2- + CuO =Cu 2+ +SO4 2- +H2O
Вывод: кислоты взаимодействуют с оксидами металлов. Тип реакции – реакция обмена.
Открываем ряд напряжений металлов (форзац учебника). Все металлы, расположенные в ряду напряжений левее водорода, вытесняют его из растворов кислот.
Вывод: кислоты взаимодействуют с металлами стоящими до водорода. Тип реакции – реакция замещения.
Следует запомнить! Большинство тяжелых металлов практически не взаимодействуют с растворами серной, фосфорной, угольной и сероводородной кислот, так как образовавшаяся соль вызывает пассивацию металла.
Концентрированные серная и азотная кислоты, а также разбавленная азотная кислота взаимодействуют с металлами иначе: водород не выделяется.
Na2CO3 + 2HCl = 2NaCl + H2O+CO2
CO3 2- + 2H + = H2O+CO2
Вывод: кислоты взаимодействуют с солями. Тип реакции – реакция обмена.
Изучите химическое свойство кислот – взаимодействие с основаниями по плану:
Налейте в пробирку 1 мл гидроксида натрия.
Добавьте с помощью пипетки 1-2 капли фенолфтолеина.
Отметьте окраску раствора после добавления фенолфтолеина.
К раствору гидроксида натрия аккуратно понемногу добавляйте соляной кислоты. Кислоту добавляйте до тех пор, пока не исчезнет окраска индикатора.
Запишите в тетради полное ионное и сокращенное ионное уравнение химической реакции взаимодействия гидроксида натрия с соляной кислотой.
Укажите название реакции.
Сделайте вывод о взаимодействии кислот с основаниями и укажите тип химической реакции.
Изучите химическое свойство кислот – взаимодействие с оксидами металлов по плану:
Насыпьте в пробирку небольшое количество оксида меди.
Аккуратно понемногу добавляйте серной кислоты. Примерно 1мл.
Для того, чтобы реакция началась необходимо нагреть пробирку. Аккуратно нагреваем. Какого цвета образуется раствор?
Запишите в тетради полное ионное и сокращенное ионное уравнение химической реакции взаимодействия оксида меди с соляной кислотой.
Сделайте вывод о взаимодействии кислот с оксидами металлов и укажите тип химической реакции.
Изучите химическое свойство кислот – взаимодействие с металлами по плану:
Возьмите 2 пробирки. В 1-ю положите кусочек цинка, во 2-ю кусочек меди.
Налейте в каждую пробирку по 1 мл соляной кислоты.
Запишите в тетради полное ионное и сокращенное ионное уравнение химической реакции взаимодействия меди с соляной кислотой и цинка с соляной кислотой.
Сделайте вывод о взаимодействии кислот с металлами и укажите тип химической реакции
Изучите химическое свойство кислот – взаимодействие с основаниями по плану:
Налейте в пробирку 1 мл соляной кислоты.
Добавьте 1мл карбоната натрия.
Наблюдайте за происходящим.
Запишите в тетради полное ионное и сокращенное ионное уравнение химической реакции взаимодействия карбоната натрия с соляной кислотой.
Укажите название реакции.
Сделайте вывод о взаимодействии кислот с солями и укажите тип химической реакции
IV.Закрепление изученного материала (8 мин)
(Убучающиеся выполняют задание №16 с. 76 (в сборнике Ю.М. Ерохина «Химия»)
Свойства кислот в свете ТЭД
Урок 39. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Свойства кислот в свете ТЭД»
Она жжётся и кусается,
Если к нам на руки проливается.
Дырки в брюках оставляет
И бумагу прожигает.
Кислоты – это электролиты, при диссоциации которых в водных растворах в качестве катионов образуются ионы водорода. Именно наличие ионов водорода обуславливает общие свойства всех кислот.
Рассмотрим свойства, характерные для всех кислот.
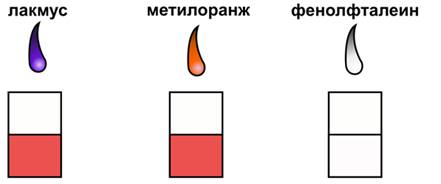
Все растворы кислот изменяют окраску индикаторов. Изменение окраски индикаторов связано с наличием у кислот ионов водорода, образующихся при диссоциации кислот.
Если мы в раствор кислоты добавим несколько капель лакмуса, то раствор окрасится в красный цвет, т.е. в кислотах лакмус изменяет окраску с фиолетовой на красную, если мы в раствор кислоты добавим несколько капель метилового оранжевого, то раствор кислоты станет тоже красного цвета, т.е. и метиловый оранжевый в кислотах изменяет свою окраску с оранжевой на красную. Фенолфталеин не изменяет свою окраску в присутствии кислот.
Действие кислот на индикаторы
Кислоты реагируют с основаниями: как с растворимыми, так и с нерастворимыми. При этом образуется соль и вода. Этот тип реакций относится к реакциям обмена.
Кислота + основание = соль + вода
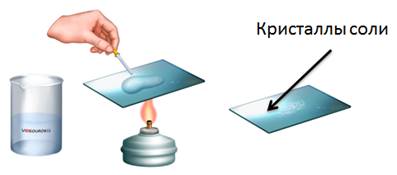
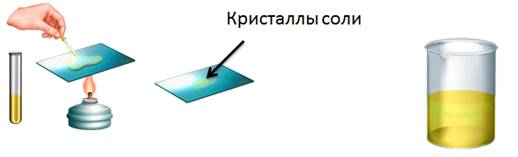
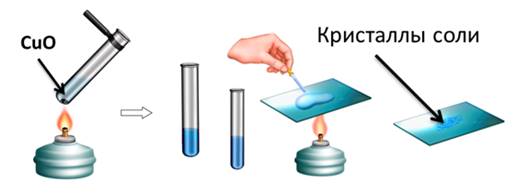
Например, если мы в пробирку с гидроксидом натрия добавим несколько капель фенолфталеина, то раствор щёлочи окрасится в малиновый цвет, а затем сюда же добавим раствор соляной кислоты, то малиновая окраска исчезает. Окраска исчезает, т.к. в результате этой реакции образуется соль и вода. Образование соли можно легко подтвердить: если мы на предметное стекло капнем несколько капель раствора и выпарим, то на стекле появятся кристаллы соли.
Аналогично кислоты реагируют с нерастворимыми основаниями. Получим, например, нерастворимое основание – гидроксид железа (III). Для этого, в раствор сульфата железа (III) добавим несколько капель гидроксида калия, при этом образуется осадок бурого цвета – это гидроксид железа (III). К этому нерастворимому основанию добавим соляной кислоты, осадок растворяется, т.к. образуется соль и вода. Если мы этот раствор соли поместим на предметное стекло и выпарим, то на стекле появятся кристаллы жёлтого цвета – это кристаллы соли хлорида железа (III).
Кислоты также вступают в реакцию обмена с оксидами металлов. В результате реакции образуется соль и вода.
Кислота + оксид металла = соль + вода
Поместим в пробирку оксид металла – оксид меди (II), он чёрного цвета, нальём в эту же пробирку раствор серной кислоты и слегка нагреем содержимое пробирки. У нас протекает реакция, в результате которой образуется соль – сульфат меди (II) и вода. Доказать, что в реакции образовалась соль можно так же, как и в предыдущих опытах, для этого следует несколько капель раствора поместить на предметное стекло и выпарить.
Кислоты реагируют с металлами, эти реакции относятся к реакциям замещения, при этом образуется соль и выделяется водород.
Кислота + металл = соль + водород
Для того чтобы реакция между кислотой и металлом прошла, необходимы следующие условия:
· Металл должен находиться в ряду напряжений до водорода.
· Должна получиться растворимая соль.
· Нерастворимые кислоты не вступают в реакцию с металлами.
· Концентрированный раствор серной и растворы азотной кислоты иначе реагируют с металлами.
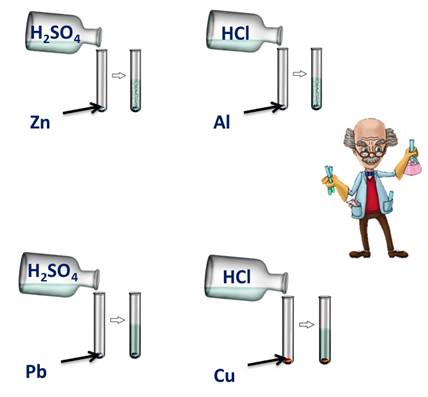
Для этого подтверждения поместим в четыре пробирки металлы: в первую пробирку – цинк, во вторую – алюминий, в третью – свинец, четвёртую – медь. В первую и третью пробирку нальём раствора серной кислоты, во вторую и четвёртую – раствора соляной кислоты. Понаблюдаем за изменениями. В первой и второй пробирке наблюдается выделение водорода, в третьей и четвёртой – нет. В пробирке со свинцом и серной кислотой реакция не пошла, т.к. в результате образуется нерастворимая соль, которая покрывает всю поверхность металла защитной плёнкой. В четвёртой пробирке также изменений нет, т.к. медь стоит в ряду напряжений металлов после водорода.
Zn 0 + 2H + = Zn 2+ + H2 0 ↑
2Al 0 + 6H + = 2Al 3+ + 3H2 0 ↑
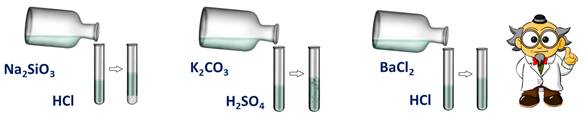
Реакция кислот с солями относится к реакциям обмена, при этом образуется новая кислота и новая соль. Эти реакции протекают в том случае, если образуется осадок или газ.
Кислота + соль = новая кислота + новая соль
Проведём опыт: для этого в первую пробирку нальём соляной кислоты и силиката натрия, во вторую – серной кислоты и карбоната калия, в третью – соляной кислоты и хлорида бария. Посмотрим за изменениями: в первой пробирке мы наблюдаем образование студенистого осадка, во второй – выделение газа, а в третьей – изменений нет. В двух пробирках реакции прошли, т.к. выполнялись следующие условия: в первой – образование осадка, во второй – выделение газа.
Подведем итог. Кислоты изменяют окраску индикаторов, реагируют с основаниями, оксидами металлов, при определённых условиях реагируют с металлами и солями.
Кислоты, основания, соли с точки зрения ТЭД.
Основания-это электролиты, расп-ся в водных растворах с образ-м гидротиров-х гидроксид- ионов.
Соли-это электролиты,расп-ся на катионы Мет.(илиNH4 + ) и анионы кислотных остатков.Соли: средние K2SO3→ H 2 O 2K + +SO3 2- двойные: KAl(SO4)2→ H 2 O K + +Al 3+ +2SO4 2-
Кислотный, основный и амфотерный тип ионизации гидроксидов.
(НО)nЭ-очень слабая кислота
(НО)n ЭО- слабая кислота
(НО)nЭО2— сильная кислота
(НО)nЭО3— очень сильная кислота
С увелич-м степени окисления центр.атома увелич-ся m, а значит и возрастает сила кислот.
осн. слаб.осн. амф. к-та очень
Протонная теория кислот и оснований:или теория Бренстеда и Лоури.
Определение к-т и оснований с точки зрения ТЭД ограниченно только водными р-ми и только гидроксидсодержащими основаниями.Но ряд осн-й(NH3) не подходят под определение основания с точки зрения ТЭД.
к-та осн-е осн-е к-та к-та осн-е осн-е к-та
Еще более общее опред-е кислот и оснований было дано Льюисом, основанное на участии электронных пар.
Кислота Льюиса – это катионы, анионы или нейтральные молекулы, способные принять одну или несколько электронных пар, или это акцептор электр-х пар.
Основание Льюиса— это катионы, анионы или нейтральные молекулы,способные отдаватьэлектронные пары, или это доноры электр-х пар.
32. Полисахариды. Высокомолекулярные несахароподобные углеводы, содержащие от 10 до сотен тысяч остатков моносахаридов, связанных гликозидными связями. Важнейшие представители: крахмал, целлюлоза, гликоген. Это природные полимеры (ВМС), мономером которых является глюкоза. Их общая формула (С6Н10О5)nЗначение nцел >>nкр и достигает в некоторых видах до 40 тысяч, а молекулярная масса доходит до нескольких миллионов.
Крахмал. Аморфный порошок белокго цвета, без вкуса и запаха, плохо растворим в воде, в горячей воде образует коллоидный раствор. Макромолекулы крахмала построены из большого числа остатков α-глюкозы. Крахмал состоит из двух фракций: амилозы и амилопектина. Соотношение между ними в крахмалах разных растений различно. В среднем содержание амилозы – 20-30%, амилопектина – 70-80%..
Гликоген – это эквивалент крахмала, синтезируемый в животных орагнизмах,т.е.это тоже резервный полисахарид, молекулы которого построены из большого числа остатков α-глюкозы. Содержится гликоген главным образом в печени и мышцах. По своему строению он очень близок амилопектину.
Гликоген – белый аморфный порошок, хорошо растворимый даже в холодной воде, легко гидролизуется под действием кислот и ферментов, образуя в качестве промежуточных веществ декстрины, мальтозу и при полном гидролизе – глюкозу.
Молекулы целлюлозы имеют линейное (неразветвленное) строение, вследствие чего целлюлоза образует волокна.
Макромолекулы целлюлозы построены из остатков β-глюкозы. В этом заключается главное отличие целлюлозы от крахмала.
Следует особо отметить, что в молекуле целлюлозы каждое второе кольцо остатка глюкозы повернуто на 180° относительно первого. Это обеспечивает плотную упаковку макромолекул целлюлозы. Вы видите, что каждый остаток глюкозы содержит три гидроксильные группы. Поэтому между цепями макромолекул могут образовываться межмолекулярные водородные связи. Это увеличивает механическую прочность целлюлозы. Поэтому целлюлоза образует каркас растительной клетки.
Чистая целлюлоза – белое твердое вещество, нерастворимое в воде и обычных органических растворителях, но хорошо растворимое в аммиачном растворе гидроксида меди (II) – реактив Швейцера. Из этого раствора кислоты осаждают целлюлозу в виде волокон (гидрат целлюлозы).
Небольшие различия в строении молекул крахмала и целлюлозы обуславливают значительные различия в свойствах полимеров: целлюлоза не дает реакции серебряного зеркала (нет альдегидной группы), но с кислотами вступает в реакции этерификации. Это дает основание рассматривать каждое звено С6Н10О5 как остаток глюкозы, содержащий три гидроксильные группы:

За счет них целлюлоза может образовывать простые и сложные эфиры.
При взаимодействии целлюлозы с концентрированной азотной кислотой в присутствии концентрированной серной в качестве водоотнимающего средства образуется сложный эфир – тринитрат целлюлозы
При обычной температуре целлюлоза взаимодействует только с концентрированными кислотами.
Подобно крахмалу, целлюлоза при нагревании с разбавленными кислотами подвергается гидролизу:
Для целлюлозы характерно горение:
Без доступа воздуха – термическое разложение целлюлозы приводит к образованию СН3ОН, СН3СООН, (СН3)2СО и др.
Сырая глюкоза, полученная из древесины, может служить кормом для скота.
Гидролизный спирт (см. выше)
Целлюлоза в виде хлопка, льна и пеньки идет на изготовление тканей – хлопчатобумажных и льняных.
Большое количество расходуется на производство бумаги. Дешевые сорта изготавливают из древесины хвойных пород, лучшие – из льняного и хлопчатобумажного тряпья.
Принципы обучения химии.
Содержание курса химии опр-ся общими целями обучения, содержанием самой хим. науки, значением и местом данного учебного предмета в общей с-ме образования. Химия явл-ся предметом естеств-научн. цикла, её основная задача – форм-е научного мировоззрения. Принципы обучения – это основные дидактические положения как ко всей с-ме обучения, так и по отдельным учебным дисциплинам. Дидактические принципы определяют требования к содержанию, методам, средствам, орг. формам учебной работы в соотв. с общими целями и закон-стями процесса обучения. Выделют след. дидак. Принципы: научности и посильной трудности, сознательности и творч. актив-сти уч-ся при руководящей роли у-ля, наглядности обучения и развития теор. мышления, систематичности и прочности знаний, связи обучения с реальной жизнью, фор-ние положит. эмоций у уч-ся к обучению, коллективного хар-ра обучения и учета индивид. особ-стей уч-ся.
Выдел-ют след. принципы обучения химии: 1) принцип соответствия учебного мат-ла уровню современной науки. Этот принцип реализуется через: приближение содержания курса к уровню современ. науки; путем повышения системности курса; путем определения ведущей роли теории в курсе; путем определ-я оптим. соотнош-ния фактов и теории; 2) Принцип развития понятий. Совр. курс химии в школе построен с учетом принципов концентризма (по спиралеобр. х-ру). Любое хим. понятие проходит свое форм-е и развитие на разных уровнях теории строения в-ва; 3) Принцип разделения трудностей теории школьного курса, понятия изучаются на разных возр. уровнях. 4) Принцип историзма. Всё изучаемое в курсе химии должно рассматр-ся с точки зр. истор. событий. Стр-ра школьного курса опр-ся: четким выделением осн. теор. знаний, дидактич. обоснованной последоват-стью учебного мат-ла, оптимальностью содержания учебн. мат-ла для сознательного и системного усвоения умений и знаний.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Techemy
ЗНАНИЯ КОТОРЫЕ ПРИНЕСУТ ДЕНЬГИ
Bitcoin кошелек за 5 минут
Переходи по ссылке!
Спрашивай, узнавай, общайся.
Кобальтовое стекло
Топливный элемент
Радиус протона меньше чем считали ранее
Твердотельные и электрохимические солнечные батареи
Коды биологической регуляции
Твердое, жидкое, газообразное
Тайны химических превращений
Необыкновенное поведение обыкновенного железа
Новый вид ракетного топлива — алюминий водное ракетное топливо позволит путешествовать в космосе.
На пути к высокотемпературной сверхпроводимости.
Основания, кислоты, соли с точки зрения ТЭД
Основания с точки зрения теории электролитической диссоциации
Название “ основания ” первоначально было отнесено к веществам, которые в реакциях с кислотами образуют соли. К основаниям принадлежат гидроксиды многих металлов.
NaOH — гидроксид натрия
KOH — гидроксид калия
Ca(OH)2 — гидроксид кальция
С точки зрения теории электролитической диссоциации (есть и другие точки зрения на то, что такое основания, кислоты, соли)
Основания — это вещества, диссоциирующие в водном растворе с образованием анионов одного вида — гидроксид-ионов OH —
Основание ⇄ катион основания + OH —
Гидроксиды металлов типа NaOH и Ba(OH)2, представляющие собой ионные кристаллы, являются сильными электролитами, а гидрат аммиака (ковалентное соединение) — это слабое основание.
Некоторые из щелочей при плавлении распадаются на ионы подобно диссоциации в водном растворе:
Большинство же основных гидроксидов разлагаются при нагревании на оксиды и воду еще до плавления:
Основания — гидроксиды металлов — могут быть получены при взаимодействии неблагородных металлов с водой или основных оксидов с водой.
Оксиды металлов, которые подобным путем образуют основания, раньше называли основные ангидриды.
Кислоты с точки зрения теории электролитической диссоциации
Кислоты исторически получили такое название из-за кислого вкуса водных растворов таких веществ, как уксусная кислота, муравьиная кислота, щавелевая кислота.
С точки зрения теории электролитической диссоциации
Кислоты — это вещества, диссоциирующие в водном растворе с образованием катионов одного вида — катионов водорода H +
Кислота ⇄ Катион водорода + Анион кислотного остатка
Таким образом, характеристической составной частью всех кислот является водород, способный диссоциировать в водном растворе.
Первое определение кислот как класса неорганических соединений было дано немецким химиком Либихом в 1839 г.; это определение справедливо и сегодня:
Кислота — это водородсодержащее соединение, водород которого может быть замещен на металл с образованием соли
Кислоты делят на кислородсодержащие кислоты (H2SO4, HNO3) и беcкислородные кислоты (HCl, H2S).
Примеры потенциальных электролитов — кислот.
Хлороводород HCl — газ при комнатной температуре. При растворении в воде и электролитической диссоциации образует кислый раствор, называемый хлороводородной кислотой (при массовой доле 36% эту кислоту называют соляная кислота).
Серная кислота H2SO4 в безводном (100%) состоянии при комнатной температуре — вязкая жидкость, которая практически не содержит ионов и поэтому не проводит электрический ток. При растворении кислоты в большом количестве воды протекает полная электролитическая диссоциация.
Кислородсодержащие кислоты могут быть получены взаимодействием кислотных оксидов с водой.
Ранее такие оксиды неметаллов называли кислотными ангидридами. Многим неметаллам, ввиду многообразия их степеней окисления, отвечает несколько кислородсодержащих кислот.
Например для хлора известны:
HClO4 — хлорная кислота
HClO3 — хлорноватая кислота
HClO2 — хлористая кислота
HClO — хлорноватистая кислота
Металлы, которые проявляют несколько степеней окисления, также могут образовывать кислотные оксиды и кислоты.
Марганец в степени окисления (+II) образует основной оксид MnO и основание Mn(OH)2, а в степени окисления (+VII) — кислотный оксид Mn2O7, который при взаимодействии с водой дает марганцевую кислоту:
Как правило, всем металлам атомы которых находятся в степени окисления от (+V) до (+VII) отвечают кислотные оксиды и кислоты.
Типичные свойства кислот по Аррениусу связаны с тем, что они поставляют в водный раствор катионы водорода H + (H3O + ). На этом основано обнаружение кислот с помощью индикаторов. Так, самый распространенный в лаборатории индикатор — лакмус окрашивается растворами кислот в красный цвет.
Соли с точки зрения теории электролитической диссоциации
Соли — это вещества, которые в водном растворе диссоциируют с образованием катионов основания и анионов кислотного остатка
Соль ⇄ Катион основания + Анион кислотного остатка
Все соли — истинные электролиты; реакции их диссоциации проходят полностью и не являются ступенчатыми, в отличие от оснований и кислот.
Важнейший способ получения солей — взаимодействие оснований с кислотами ( реакция нейтрализации ).
Основание + Кислота = Соль + Вода