Что такое коэффициент растворимости
Растворимость
Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:
здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
Растворимость веществ в различных растворителях меняется в широких пределах.
В таблице приведена растворимость некоторых веществ в воде при 20 o С:
Растворимость, г на 100 г H2O
Растворимость, г на 100 г H2O
От чего же зависит растворимость веществ? От ряда факторов: от природы растворенного вещества и растворителя, от температуры и давления. В справочных таблицах предлагается вещества делят на хорошо растворимые, малорастворимые и нерастворимые. Такое деление очень условное, поскольку абсолютно нерастворимых веществ нет. Даже серебро и золото растворимы в воде, однако их растворимость настолько мала, что можно пренебречь ей.
Зависимость растворимости от природы растворенного вещества и растворителя*
Большинство солей щелочных металлов и аммония хорошо растворимы в воде. Хорошо растворимы почти все нитраты, нитриты и многие галогениды (кроме галогенидов серебра, ртути, свинца и таллия) и сульфаты (кроме сульфатов щелочноземельных металлов, серебра и свинца). Для переходных металлов характерна небольшая растворимость их сульфидов, фосфатов, карбонатов и некоторых других солей.
Растворимость газов в жидкостях также зависит от их природы. Например, в 100 объемах воды при 20 o С растворяется 2 объема водорода, 3 объема кислорода. В тех же условиях в 1 объеме Н2О растворяется 700 объемов аммиака.
Влияние температуры на растворимость газов, твердых веществ и жидкостей*
Растворение газов в воде вследствие гидратации молекул растворяемого газа сопровождается выделением теплоты. Поэтому при повышении температуры растворимость газов понижается.
Влияние давления на растворимость газов, твердых веществ и жидкостей*
На растворимость твердых и жидких веществ в жидкостях давление практически не оказывает влияния, так как изменение объема при растворении невелико. При растворении газообразных веществ в жидкости происходит уменьшение объема системы, поэтому повышение давления приводит к увеличению растворимости газов. В общем виде зависимость растворимости газов от давления подчиняется закону У. Генри (Англия, 1803 г.): растворимость газа при постоянной температуре прямо пропорциональна его давлению над жидкостью.
Закон Генри справедлив лишь при небольших давлениях для газов, растворимость которых сравнительно невелика и при условии отсутствия химического взаимодействия между молекулами растворяемого газа и растворителем.
Влияние посторонних веществ на растворимость*
В присутствии в воде других веществ (солей, кислот и щелочей) растворимость газов уменьшается. Растворимость газообразного хлора в насыщенном водном растворе поваренной соли в 10 раз меньше. Чем в чистой воде.
Эффект понижения растворимости в присутствии солей называется высаливанием. Понижение растворимости обусловлено гидратацией солей, что вызывает уменьшение числа свободных молекул воды. Молекулы воды, связанные с ионами электролита, уже не являются растворителем для других веществ.
Примеры задач на растворимость
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения растворимости вещества примем массу раствора равной 100 г. Тогда масса соли равна:
mводы = mр-ра – mр.в. = 100 — 24 = 76 г
χ = mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9г соли в 100г воды?
Ответ: 194,95 г
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36г соли в 100г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при 100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
Понятие о растворах. Растворимость веществ
Растворы — гомогенные (однородные) системы переменного состава, которые содержат два или несколько компонентов.
Наиболее распространены жидкие растворы. Они состоят из растворителя (жидкости) и растворенных веществ (газообразных, жидких, твердых):
Жидкие растворы могут быть водные и неводные. Водные растворы — это растворы, в которых растворителем является вода. Неводные растворы — это растворы, в которых растворителями являются другие жидкости (бензол, спирт, эфир и т. д.). На практике чаще применяются водные растворы.
Растворение веществ
Растворение — сложный физико-химический процесс. Разрушение структуры растворяемого вещества и распределение его частиц между молекулами растворителя — это физический процесс. Одновременно происходит взаимодействие молекул растворителя с частицами растворенного вещества, т.е. химический процесс. В результате этого взаимодействия образуются сольваты.
Сольваты — продукты переменного состава, которые образуются при химическом взаимодействии частиц растворенного вещества с молекулами растворителя.
Если растворителем является вода, то образующиеся сольваты называются гидратами. Процесс образования сольватов называется сольватацией. Процесс образования гидратов называется гидратацией. Гидраты некоторых веществ можно выделить в кристаллическом виде при выпаривании растворов. Например:
Что представляет собой и как образуется кристаллическое вещество синего цвета? При растворении в воде сульфата меди (II) происходит его диссоциация на ионы:
Образующиеся ионы взаимодействуют с молекулами воды:
При выпаривании раствора образуется кристаллогидрат сульфата меди (II) — CuSО4 • 5Н2О.
Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами. Вода, входящая в их состав, называется кристаллизационной водой. Примеры кристаллогидратов:
Впервые идею о химическом характере процесса растворения высказал Д. И. Менделеев в разработанной им химической (гидратной) теории растворов (1887 г.). Доказательством физико-химического характера процесса растворения являются тепловые эффекты при растворении, т. е. выделение или поглощение теплоты.
Тепловой эффект растворения равен сумме тепловых эффектов физического и химического процессов. Физический процесс протекает с поглощением теплоты, химический — с выделением.
Если в результате гидратации (сольватации) выделяется больше теплоты, чем ее поглощается при разрушении структуры вещества, то растворение — экзотермический процесс. Выделение теплоты наблюдается, например, при растворении в воде таких веществ, как NaOH, AgNО3, H2SО4, ZnSО4 и др.
Если для разрушения структуры вещества необходимо больше теплоты, чем ее образуется при гидратации, то растворение — эндотермический процесс. Это происходит, например, при растворении в воде NaNО3, KCl, K2SO4, KNO2, NH4Cl и др.
Растворимость веществ
Мы знаем, что одни вещества хорошо растворяются, другие — плохо. При растворении веществ образуются насыщенные и ненасыщенные растворы.
Насыщенный раствор — это раствор, который содержит максимальное количество растворяемого вещества при данной температуре.
Ненасыщенный раствор — это раствор, который содержит меньше растворяемого вещества, чем насыщенный при данной температуре.
Количественной характеристикой растворимости является коэффициент растворимости. Коэффициент растворимости показывает, какая максимальная масса вещества может раствориться в 1000 мл растворителя при данной температуре.
Растворимость выражают в граммах на литр (г/л).
По растворимости в воде вещества делят на 3 группы:
Таблица растворимости солей, кислот и оснований в воде:
Растворимость веществ зависит от природы растворителя, от природы растворенного вещества, температуры, давления (для газов). Растворимость газов при повышении температуры уменьшается, при повышении давления — увеличивается.
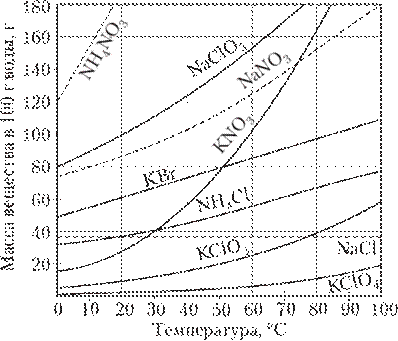
Зависимость растворимости твердых веществ от температуры показывают кривые растворимости. Растворимость многих твердых веществ увеличивается при повышении температуры.
По кривым растворимости можно определить: 1) коэффициент растворимости веществ при различных температурах; 2) массу растворенного вещества, которое выпадает в осадок при охлаждении раствора от t1 o C до t2 o C.
Процесс выделения вещества путем испарения или охлаждения его насыщенного раствора называется перекристаллизацией. Перекристаллизация используется для очистки веществ.
Урок №32. Вода — растворитель. Растворы.
Растворы – это однородные гомогенные системы, состоящие из частиц растворенного вещества, растворителя и продуктов их взаимодействия. Растворенное вещество равномерно распределено в растворителе. Раствор может состоять из двух и более компонентов.
Растворы по агрегатному состоянию бывают жидкие (раствор соли, кровь), твердые (сплавы металлов) и газообразные (воздух).
Растворитель – это то вещество, которое не изменяет агрегатное состояние при растворении. В случае смешения веществ с одинаковым агрегатным состоянием (жидкость-жидкость, газ-газ, твердое-твердое) растворителем считается тот компонент, содержание которого больше.
Образование раствора зависит от характера взаимодействия частиц растворителя и растворенного вещества, и их природы.
В школьном курсе рассматриваются преимущественно растворы электролитов (растворы с электропроводимостью). В курсе ВУЗов рассматриваются также истинные и коллоидные растворы, золи и другие системы.
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворенного вещества, и раствор становится насыщенным.
Насыщенный раствор – это раствор, в котором данное вещество при данной температуре больше не растворяется.
Суспензией называют взвесь, в которой мелкие частицы твёрдого вещества равномерно распределены между молекулами воды.
Эмульсией называют взвесь, в которой мелкие капельки какой-либо жидкости распределены между молекулами другой жидкости.
По способности растворяться вещества условно делят на:
малорастворимые (от 0,001 до 1 грамма растворенного вещества на 100 грамм растворителя);
растворимые (больше 1 г растворенного вещества на 100 г растворителя);
нерастворимые (менее 0,001 г растворенного вещества на 100 г растворителя).
При попадании в воду вещество может:
1. раствориться в воде, то есть перемешаться с ней на атомно-молекулярном уровне;
2. химически прореагировать с водой;
3. не раствориться в воде и химически не прореагировать.
Одни вещества хорошо растворяются в воде, другие мало, а третьи – не растворяются совсем.
Физический – разрушение структуры растворяемого вещества
Химический – образование гидратов (сольватов, если растворитель не вода), вследствие взаимодействия молекул растворителя с частицами растворённого вещества).
Если на разрушение кристаллической решётки затрачивается больше энергии, чем выделяется при образовании гидратов, то растворение сопровождается охлаждением раствора (NH 4 NO 3 ; KNO 3 ), а если меньше – нагреванием (приготовление растворов щелочей, кислот).
Растворение газов и жидкостей не сопровождается разрушением кристаллической решётки, поэтому такие процессы растворения всегда экзотермические.
Тепловые эффекты растворения подавляющего большинства веществ незначительны, потому не заметны.
Растворимость увеличивается с ростом температуры (бывают исключения). Вы прекрасно знаете, что удобнее и быстрее растворять сахар в горячей, а не в холодной воде.
Попробуйте сами определить растворимость веществ (см. Таблица растворимости солей, кислот и оснований в воде).
Растворимость веществ
По растворимости в воде все вещества делятся на три группы:
1) хорошо растворимые, 2) малорастворимые и 3) практически нерастворимые.
Многие вещества в воде растворяются весьма хорошо. Примером таких веществ могут служить сахар, медный купорос, гидроксид натрия (твердые вещества), спирт, ацетон (жидкие вещества), хлороводород, аммиак (газообразные вещества).
Из приведенных примеров следует, что растворимость прежде всего зависит от природы веществ. Кроме того, она зависит также от температуры и давления. Сам процесс растворения обусловлен взаимодействием частиц растворимого вещества и растворителя; это самопроизвольный процесс.
По соотношению преобладания числа частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. С другой стороны, по относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т. е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества, — ненасыщенным.
Растворимость. Коэффициент растворимости
Растворение – процесс образования раствора из компонентов. Растворение представляет собой обратимый процесс, который при неизменности внешних условий достигает состояния равновесия.
Раствор, находящийся в состоянии равновесия с избытком растворенного вещества, называется насыщенным.
Концентрация насыщенного раствора – это равновесная концентрация, зависящая от природы растворителя, растворенного вещества и не зависящая от того, как раствор был приготовлен.
Способность вещества растворяться в определенном растворителе называется растворимостью этого вещества в данном растворителе.
Чаще всего характеризуют способность вещества растворяться в воде и под растворимостью вещества понимают растворимость в воде. Количесвенно растворимость вещества при определенных условиях может быть связана с концентрацией его насыщенного при данных условиях раствора, т.к. это – воспроизводящаяся величина. Принятыми способами выражения растворимости вещества в воде (или другом растворителе) является коэффициент растворимости.
Коэффициент растворимости показывает, какую массу вещества надо растворить при определенных условиях в 100 г воды (или в 1 литре воды), чтобы получить насыщенный при данных условиях раствор. При записи коэффициента растворимости обязательно указывается вещество, растворитель и внешние условия (для веществ в твердом состоянии обычно в качестве внешних условий указывают только температуру), например:
растворимость KNO3при 20 o С равна 25 г в 100 г воды, или
растворимость KNO3 в воде при 20 o С равна 250 г/ л.
По электропроводности растворов их делят на растворы электролитов – эти растворы проводят электрический ток – и растворы неэлектролитов, не обладающие электропроводностью.
Ненасыщенный раствор — раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое его количество.
Насыщенный раствор — раствор, в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется. Осадок данного вещества находится в равновесном состоянии с веществом в растворе.
Перекристаллиза́ция — метод очистки вещества, основанный на различии растворимости вещества в растворителе при различных температурах (обычно интервал температур от комнатной до температуры кипения растворителя, если растворитель — вода, или до какой-то более высокой температуры). [1]
Перекристаллизация подразумевает плохую растворимость вещества в растворителе при низких температурах, и хорошо — при высоких. При нагревании колбы вещество растворяется. После стадии адсорбции примесей (если это необходимо) активированным углём, охлаждении образуется перенасыщенный раствор, из которого растворённое вещество выпадает в виде осадка. После пропуска смеси через колбу Бунзена и воронку Бюхнера получаем очищенное растворённое вещество. [1]
Растворителем могут быть вода, уксусная кислота, этанол (95 %), метанол, ацетон, гексан, пентан — в зависимости от условий. [1]
Если растворителем является вода, то нагревание проводят в водяной бане. Охлаждение перенасыщенного раствора проводят с помощью водяного холодильника, если температура кипения растворителя ниже 130 градусов, если выше — с помощью воздушного холодильника. [1]
Концентрацию веществ в растворах можно выразить разными способами. На этой страничке вы с ними познакомитесь. Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию.
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) · V),
Растворимость, коэффициент растворимости. Факторы, от которых зависит растворимость веществ
Растворимость веществ, т.е. способность растворяться в том или ином растворителе, различается; качественно по способности растворяться вещества можно разделить:
· на хорошо растворимые (больше 1 г вещества в 100 г растворителя);
· малорастворимые (0,1–1,0 г вещества в 100 г растворителя);
· нерастворимые (меньше 0,1 г вещества в 100 г растворителя).
Количественно растворимость характеризуют содержанием растворенного вещества в насыщенном растворе. Это содержание выражают с помощью коэффициента растворимости или массовой доли насыщенного раствора.
При записи коэффициента растворимости обязательно указывается вещество, растворитель и внешние условия (для веществ в твердом состоянии обычно в качестве внешних условий указывают только температуру), например:
растворимость KNO3при 20 o С равна 25 г в 100 г воды, или
растворимость KNO3 в воде при 20 o С равна 250 г/ л.
Рассмотрим факторы, влияющие на растворимость веществ.
1. Природа растворяемого вещества и растворителя. Подобное растворяется в подобном. Это означает, что энергия взаимодействия между частицами растворяемого вещества должна быть близка к энергии межмолекулярных сил в растворителе. Вода как полярный растворитель лучше растворяет ионные вещества или вещества молекулярного строения с полярными молекулами: соли, щелочи, галогеноводороды, серная кислота и др.; в то же время неполярные алканы, бензол в воде плохо растворимы. Напротив, хорошими растворителями неполярных веществ являются керосин, бензин, состоящие из неполярных молекул углеводородов; имеющий неполярные молекулы йод лучше растворим в бензоле, чем в воде. Растворимость веществ в воде возрастает, если они химически взаимодействуют с водой (SO3, P2O5, Na2O и др.) или образуют с ней водородные связи (спирты, аммиак, фтороводород, пероксид водорода).
2. Температура (принцип Ле Шателье).
По этой причине реки в северных широтах содержат больше кислорода и, следовательно, более богаты рыбой.
Повышение температуры на растворимость жидкостей влияет по-разному: иногда при нагревании жидкости смешиваются неограниченно, а иногда расслаиваются. В большинстве же случаев при повышении температуры взаимная растворимость жидкостей возрастает, вплоть до неограниченного по массе смешивания.
В случае твердых веществ влияние температуры на растворимость может быть различным (рис. 5); в большинстве случаев с ростом
Рис. 5. Кривые растворимости некоторых солей в вод
температуры раствормость твердых веществ возрастает, однако растворимость Ca(OH)2, CaCO3, CaSO4 уменьшается. Растворимость NaCl от температуры зависит слабо.
3. Давление. При растворении твердых веществ в жидкостях (или жидкости в жидкости) объем существенно не изменяется, поэтому изменение давления на растворимость в этом случае практически не влияет. Растворение газа в жидкости всегда сопровождается уменьшением объема, поэтому в случае газов повышение давления увеличивает их растворимость в жидкостях, а понижение давления, наоборот, уменьшает.
Растворимость не следует путать со скоростью растворения. Например, растворимость кускового сахара и сахарного песка одинаковые, однако насыщенный раствор сахара в воде быстрее образуется в случае сахара-песка (сахар-песок растворяется быстрее, так как в этом случае больше поверхность соприкосновения растворителя и растворяемого вещества). Повышению скорости растворения твердого вещества в жидкости способствует перемешивание, однако на растворимость оно не влияет.
Отметим, что не для всяких веществ можно получить насыщенные растворы. Есть вещества, растворимость которых в воде неограниченна: метанол, этанол, пропанол-1 и пропанол-2, уксусная, серная, муравьиная, пропановая и азотная кислоты, этаналь, этиленгликоль, глицерин.
Для растворов веществ, неограниченно смешивающихся с водой, понятия «насыщенный» и «ненасыщенный» не применимы (нельзя, например, говорить: насыщенный раствор серной кислоты). Очевидно, понятия «разбавленный» и «концентрированный» для веществ, неограниченно растворяющихся в воде, применимы
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.