Что такое кофермент приведите примеры
Коферменты
Полезное
Смотреть что такое «Коферменты» в других словарях:
Коферменты — Коферменты, или коэнзимы малые молекулы небелковой природы, специфически соединяющиеся с соответствующими белками, называемыми апоферментами, и играющие роль активного центра или простетической группы молекулы фермента. Комплекс кофермента и… … Википедия
КОФЕРМЕНТЫ — органические соединения небелковой природы, входящие в состав некоторых ферментов. Соединяясь с апоферментом, коферменты образуют каталитически активные комплексы. Многие коферменты производные витаминов (В1, В2, В6 РР и др.) … Большой Энциклопедический словарь
КОФЕРМЕНТЫ — (от лат. со – вместе и ферменты), коэнзимы, органические соединения небелковой природы, входящие в состав активного центра нек рых ферментов. Соединяясь с апоферментом, К. образуют каталитически активный комплекс т. н. холофермент. Мн. К. легко… … Биологический энциклопедический словарь
коферменты — органические соединения небелковой природы, входящие в состав активного центра некоторых ферментов. Соединяясь с апоферментом, К. образует каталитически активный комплекс. Многие К. легко отделяются от белковой молекулы и служат переносчиками… … Словарь микробиологии
коферменты — – кофакторы органической природы … Краткий словарь биохимических терминов
КОФЕРМЕНТЫ — КОФЕРМЕНТЫ, специфические активаторы, образующие необходимую составн. часть действующей системы некоторых ферментов. К. не представляют принципиального отличия от киназ, и применение того или другого обозначения определяется в сущности практикой … Большая медицинская энциклопедия
коферменты — Органические соединения небелковой природы, входящие в состав активных центров некоторых ферментов с образованием активного комплекса (холофермента); большинство К. являются производными витаминов. [Арефьев В.А., Лисовенко Л.А. Англо русский… … Справочник технического переводчика
коферменты — органические соединения небелковой природы, входящие в состав некоторых ферментов. Соединяясь с апоферментом, коферменты образуют каталитически активные комплексы. Многие коферменты производные витаминов (В1, В2, B6, РР и др.). * * * КОФЕРМЕНТЫ… … Энциклопедический словарь
коферменты — coenzymes коферменты. Oрганические соединения небелковой природы, входящие в состав активных центров некоторых ферментов с образованием активного комплекса (холофермента ); большинство К. являются производными витаминов… … Молекулярная биология и генетика. Толковый словарь.
Коферменты — [от лат. co (cum) вместе и Ферменты], органические соединения небелковой природы, участвующие в ферментативной реакции в качестве акцепторов отдельных атомов или атомных групп, отщепляемых ферментом от молекулы субстрата. К. соединён с… … Большая советская энциклопедия
КОФЕРМЕНТЫ — органич. соед. небелковой природы, входящие в состав нек рых ферментов. Соединяясь с апоферментом, К. образуют каталитически активные комплексы. Мн. К. производные витаминов (B1, В2, B6, РР и др.) … Естествознание. Энциклопедический словарь
Коферменты: что это такое, польза, применение в спорте
Коферменты представляют собой органические соединения небелковой природы, которые необходимы для функционирования многих ферментов. Большинство из них являются производными витаминов.
Причиной нарушения метаболизма и снижения синтеза полезных веществ в организме часто является снижение активности некоторых видов ферментов. Поэтому то коэнзимы столь нам необходимы.
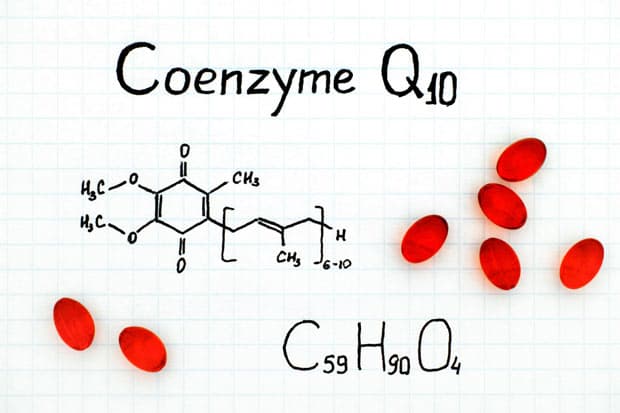
В узком смысле, кофермент – это коэнзим Q10, производная фолиевой кислоты и некоторых других витаминов. Важное значение для организма человека имеют те коферменты, которые продуцируются витаминами группы B.
Кофермент нужен для того, чтобы повысить производительность клеточной энергии, которая нужна для поддержания жизнедеятельности. Любой процесс, который протекает в организме человека, требует колоссального энергетического ресурса, будь то умственная деятельность, работа сердечно-сосудистой или пищеварительной системы, физическая активность при нагрузке на опорно-двигательный аппарат. Благодаря реакции, в которую коферменты вступают с ферментами, продуцируется необходимая энергия.
Функции коферментов
Коферменты представляют собой небелковые соединения, которые способствуют активации потенциала ферментов. Они выполняют 2 основные функции:
Все коферменты объединяет одно важное свойство – они являются термически устойчивыми соединениями, но свойственные им химические реакции довольно сильно разнятся.
Классификация коферментов
По способам взаимодействия с апоферментом коферменты делятся на:
По химической структуре коферменты делятся на три группы:
По функциональному признаку выделяют две группы коферментов:
Коферменты в спортивной фармакологии
При интенсивных физических нагрузках расходуется большое количество энергии, ее запас в организме истощается, а многие витамины и питательные вещества потребляются гораздо быстрее, чем вырабатываются. Спортсмены испытывают физическую слабость, нервное истощение, нехватку сил. Для того чтобы помочь избежать многих симптомов были разработаны специальные препараты с коферментами в составе. Их спектр действия очень широк, назначаются они не только спортсменам, но и людям с достаточно серьезными заболеваниями.
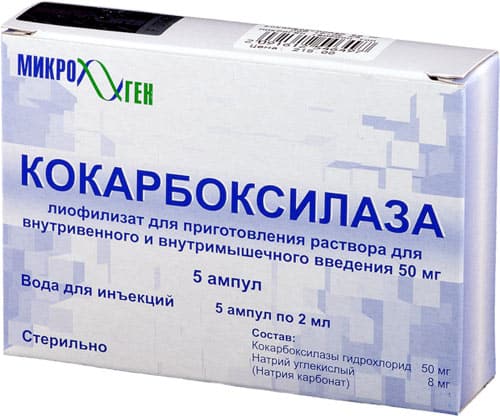
Кокарбоксилаза
Кофермент, который образуется только из поступающего в организм тиамина. У спортсменов он служит средством профилактики перенапряжения миокарда, расстройств нервной системы. Препарат назначается при радикулитах, невритах, а также острой печеночной недостаточности. Вводится внутривенно, разовая доза не должна быть менее 100 мг.
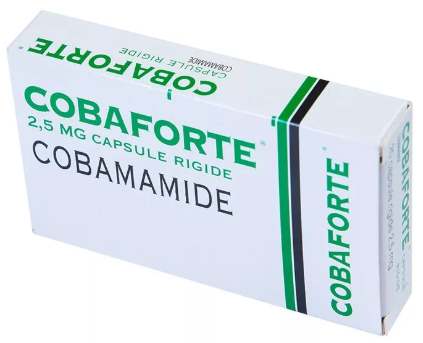
Кобамамид
Заменяет по действию функционал витамина B12, является анаболиком. Помогает спортсменам нарастить мышечную массу, увеличивает выносливость, способствует быстрому восстановлению после занятий. Выпускается в форме таблеток и растворов для внутривенного введения, суточная норма составляет 3 таблетки или 1000 мкг. Длительность курса – не более 20 дней.
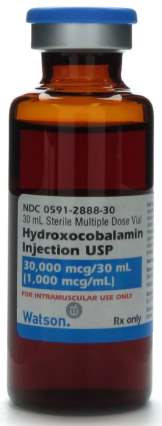
Оксикобаламин
По своему действию схож с витамином B12, но намного дольше держится в крови и гораздо оперативнее преобразуется в коферментную формулу благодаря прочному соединению с плазменными белками.
Пиридоксальфосфат
Для препарата характерны все свойства витамина B6. От него он отличается быстрым терапевтическим эффектом, назначается к приему даже при нарушении фосфорилирования пиридоксина. Принимается три раза в день, суточная доза составляет не более 0,06 гр, а курс – не дольше месяца.
Пиридитол
Активизирует метаболические процессы центральной нервной системы, повышает проходимость глюкозы, препятствует избыточному образованию молочной кислоты, повышает защитные свойства тканей, в том числе устойчивость к гипоксии, которая возникает во время интенсивных спортивных тренировок. Принимают препарат три раза в день по 0,1 гр. после завтрака в течение месяца
Пантогам
Является гомологом пантотеновой кислоты, ускоряет обменные процессы, снижает проявление болевых реакций, повышает устойчивость клеток к гипоксии. Действие препарата направлено на активацию работы головного мозга, повышение выносливости, показан к применению при черепно-мозговых травмах различного типа. Таблетки принимаются в течение месяца по 0,5 гр не чаще трех раз в день.
Карнитин
Выпускается в форме препарата для инъекций, действие которых направлено на активацию жирового обмена, ускорение регенерации клеток. Оказывает анаболическое, антигипоксическое и антитиреоидное действие. Является синтетическим заменителем витамина B6. Эффективен в виде внутривенной капельницы.
Флавинат
Образуется в организме из рибофлавина, активно участвует в углеводном, липидном и аминокислотном обмене. Выпускается в виде раствора для внутримышечных инъекций, так как его усвоение в желудке неэффективно при нарушении всасывания рибофлавина.
Липоевая кислота
Нормализует углеводный обмен. Повышает скорость окисления углеводов и жирных кислот, что способствует повышению энергетического запаса.
Кофермент A
| Кофермент A | |
 | |
 | |
| Общие | |
|---|---|
| Традиционные названия | Коэнзим-А |
| Эмпирическая формула | C21H36N7O16P3S |
| Физические свойства | |
| Отн. молек. масса | 767,535 а. е. м. |
| Молярная масса | 767,535 г/моль |
| Термические свойства | |
| Классификация | |
| Рег. номер CAS | 85-61-0 |
| SMILES | O=C(NCCS)CCNC(=O)C(O)C(C)(C)COP(=O)(O)OP(=O)(O)OC[C@H]3O[C@@H](n2cnc1c(ncnc12)N)[C@H](O)[C@@H]3OP(=O)(O)O |
Кофермент А (коэнзим А, КоА, СоА, HSKoA) — кофермент ацетилирования; один из важнейших коферментов, принимающий участие в реакциях переноса ацильных групп при синтезе и окислении жирных кислот и окислении пирувата в цикле лимонной кислоты. [1]
Содержание
Строение
Молекула КоА состоит из остатка адениловой кислоты (1), связанной пирофосфатной группой (2) с остатком пантотеновой кислоты (3), которая в свою очередь связанна пептидной связью с аминокислотой β-аланином (4) (эти две группы представляют собой остаток пантотеновой кислоты), соединённой пептидной связью с остатком β-меркаптоэтаноламина (5).
Биосинтез
Кофермент А синтезируется в пять этапов из пантотеновой кислоты (витамина B5) и цистеина:
Биохимическая роль
С КоА связан ряд биохимических реакций, лежащих в основе окисления и синтеза жирных кислот, биосинтеза жиров, окислительных превращений продуктов распада углеводов. Во всех случаях КоА действует в качестве промежуточного звена, связывающего и переносящего кислотные остатки на другие вещества. При этом кислотные остатки в составе соединения с КоА подвергаются тем или иным превращениям, либо передаются без изменений на определённые метаболиты.
История открытия
Впервые кофермент был выделен из печени голубя в 1947 году Ф. Липманом. [2] Структура кофермента А была определена в начале 1950-х годов Ф. Линеном в Институте Листера в Лондоне. Полный синтез КоА осуществил в 1961 году X. Корана.
Список ацил-КоА
Из природных соединений выделены и идентифицированы различные ацильные производные кофермента А:
Ацил-КоА из карбоновых кислот:
Ацил-КоА из дикарбоновых кислот:
Ацил-КоА из карбоциклических кислот:
Существуют также разнообразные ацил-КоА жирных кислот, которые играют большое значение в качестве субстратов для реакций синтеза липидов.
См. также
Примечания
Литература
невитамины: Кофактор F430 · ATP · CTP · S-Аденозилметионин · PAPS · Глутатион · Кофермент B · Кофермент М · Убихинон (Кофермент Q) · Метанофуран · BH4 · H4MPT
простетические группы
Полезное
Смотреть что такое «Кофермент A» в других словарях:
Кофермент Q — (Coenzyme Q10) Химическое соединение … Википедия
Кофермент М — Общие … Википедия
Кофермент В — Кофермент В, Coenzyme B (2 [(7 меркапто 1 оксогептил)амино] 3 фосфонооксибутановая кислота) это кофермент, принимающий участие в окислительно восстановительных реакциях у метаногенов.[1] Молекула кофермента В содержит тиол, который принимает… … Википедия
Кофермент B — Общие … Википедия
КОФЕРМЕНТ А — (КоА) сложное природное соединение, один из важнейших коферментов. В живых клетках участвует в реакциях окисления, синтеза жирных кислот, липидов и др … Большой Энциклопедический словарь
кофермент — сущ., кол во синонимов: 14 • кодегидрогеназа (2) • козимаза (1) • … Словарь синонимов
кофермент Q — кофермент Q. См. убихинон. (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А., Лисовенко Л.А., Москва: Изд во ВНИРО, 1995 г.) … Молекулярная биология и генетика. Толковый словарь.
КОФЕРМЕНТЫ
Смотреть что такое «КОФЕРМЕНТЫ» в других словарях:
Коферменты — Коферменты, или коэнзимы малые молекулы небелковой природы, специфически соединяющиеся с соответствующими белками, называемыми апоферментами, и играющие роль активного центра или простетической группы молекулы фермента. Комплекс кофермента и… … Википедия
КОФЕРМЕНТЫ — органические соединения небелковой природы, входящие в состав некоторых ферментов. Соединяясь с апоферментом, коферменты образуют каталитически активные комплексы. Многие коферменты производные витаминов (В1, В2, В6 РР и др.) … Большой Энциклопедический словарь
коферменты — органические соединения небелковой природы, входящие в состав активного центра некоторых ферментов. Соединяясь с апоферментом, К. образует каталитически активный комплекс. Многие К. легко отделяются от белковой молекулы и служат переносчиками… … Словарь микробиологии
коферменты — – кофакторы органической природы … Краткий словарь биохимических терминов
КОФЕРМЕНТЫ — КОФЕРМЕНТЫ, специфические активаторы, образующие необходимую составн. часть действующей системы некоторых ферментов. К. не представляют принципиального отличия от киназ, и применение того или другого обозначения определяется в сущности практикой … Большая медицинская энциклопедия
коферменты — Органические соединения небелковой природы, входящие в состав активных центров некоторых ферментов с образованием активного комплекса (холофермента); большинство К. являются производными витаминов. [Арефьев В.А., Лисовенко Л.А. Англо русский… … Справочник технического переводчика
коферменты — органические соединения небелковой природы, входящие в состав некоторых ферментов. Соединяясь с апоферментом, коферменты образуют каталитически активные комплексы. Многие коферменты производные витаминов (В1, В2, B6, РР и др.). * * * КОФЕРМЕНТЫ… … Энциклопедический словарь
коферменты — coenzymes коферменты. Oрганические соединения небелковой природы, входящие в состав активных центров некоторых ферментов с образованием активного комплекса (холофермента ); большинство К. являются производными витаминов… … Молекулярная биология и генетика. Толковый словарь.
Коферменты — [от лат. co (cum) вместе и Ферменты], органические соединения небелковой природы, участвующие в ферментативной реакции в качестве акцепторов отдельных атомов или атомных групп, отщепляемых ферментом от молекулы субстрата. К. соединён с… … Большая советская энциклопедия
КОФЕРМЕНТЫ — органич. соед. небелковой природы, входящие в состав нек рых ферментов. Соединяясь с апоферментом, К. образуют каталитически активные комплексы. Мн. К. производные витаминов (B1, В2, B6, РР и др.) … Естествознание. Энциклопедический словарь
РАЗДЕЛ 2. ЭНЗИМОЛОГИЯ
III. Кофакторы и коферменты
Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в ионах металлов (кофакторах).
Термин «кофермент» был введён в начале XX века и обозначал часть некоторых ферментов, которая легко отделялась от белковой молекулы фермента и удалялась через полупроницаемую мембрану при диализе. Несколько позже было выяснено, что большинство ферментов состоит из термолабильной белковой части и термостабильного небелкового фактора — кофермента. Белковая часть получила название «апофермент», который в отсутствие кофермента не обладает каталитической активностью. Кофермент с белковой молекулой (апоферментом) формируют молекулу холофермента, обладающую каталитической активностью.
Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Рассмотрим роль кофакторов в ферментативном катализе.
1. Роль металлов в присоединении субстрата в активном центре фермента
Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур.
Ионы металлов — стабилизаторы молекулы субстрата
Схематично роль кофактора при взаимодействии фермента и субстрата можно представить, как комплекс Е-S-Ме, где Е — фермент, S — субстрат, Ме — ион металла.
В качестве примера можно привести расположение субстратов в активном центре гексокиназы (рис. 2-3).
Гексокиназа катализирует перенос концевого, y-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата:
Ион Мg 2+ участвует в присоединении и «правильной» ориентации молекулы АТФ в активном центре фермента, ослабляя фосфоэфирную связь и облегчая перенос фосфата на глюкозу.
Ионы металла — стабилизаторы активного центра фермента
К металлоэнзимам относят, например, фермент пируват киназу (рис. 2-4), катализирующий реакцию:
Рис. 2-4. Участие ионов магния в присоединении субстрата в активном центре пируваткиназы. Активный центр пируваткиназы имеет участки связывания для фосфоеноппирувата и АДФ. Мg 2+ участвует в стабилизации активного центра, что облегчает присоединение фосфоеноппирувата. В ходе ферментативной реакции образуется пируват и АТФ.
2. Роль металлов в стабилизации третичной и четвертичной структуры фермента
Ионы металлов обеспечивают сохранение вторичной, третичной, четвертичной структуры молекулы фермента. Такие ферменты в отсутствие ионов металлов способны к химическому катализу, однако они нестабильны. Их активность снижается и даже полностью исчезает при небольших изменениях pH, температуры и других незначительных изменениях внешнего окружения. Таким образом, ионы металлов выполняют функцию стабилизаторов оптимальной конформации белковой молекулы.
Рис. 2-5. Роль ионов цинка в стабилизации четвертичной структуры алкогольдегидрогеназы.
3. Роль металлов в ферментативном катализе
Не менее важную роль отводят ионам металлов в осуществлении ферментативного катализа.
Участие в электрофильном катализе
Протон и гидроксильная группа последовательно присоединяются к диоксиду углерода с образованием угольной кислоты (см. схему А).
В ходе электрофильного катализа ионы металлов часто участвуют в стабилизации промежуточных соединений.
Участие в окислительно-восстановительных реакциях
Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон:
Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях.
Другой пример участия ионов металлов в окислительно-восстановительных реакциях — работа фермента дофамингидроксилазы, катализирующего реакцию образования норадреналина при участии витамина С (см. схему Б).
За окислительно-восстановительные свойства у дофамингидроксилазы отвечает ион меди (рис. 2-6).
4. Роль металлов в регуляции активности ферментов
Иногда ионы металлов выступают в роли регуляторных молекул. Например, ионы Са 2+ служат активаторами фермента протеинкиназы С, катализирующего реакции фосфорилирования белков (см. раздел 5). Ионы Са 2+ также изменяют активность ряда кальций-кальмодулинзависимых ферментов (см. подраздел V).
Как уже было сказано, для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические ферменты (например, протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента.
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например, тиаминдифосфат.
Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.
К коферментам относят следующие соединения:
✵ гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO- синтазы и являющиеся простетической группой ферментов;
✵ нуклеотиды — доноры и акцепторы остатка фосфорной кислоты;
✵ убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
✵ фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
✵ S-аденозилметионин (SAM) — донор метальной группы;
✵ глутатион, участвующий в окислительновосстановительных реакциях.
Строение и функции этих коферментов подробно рассмотрены в соответствующих разделах учебника.
В. Мультисубстратные реакции
Большинство ферментов катализирует реакции, в которых участвует более чем один субстрат. В случае если кофермент не является простетической группой, его также можно рассматривать как ещё один субстрат. Следовательно, участников ферментативной реакции может быть несколько: непосредственно фермент, несколько субстратов и кофермент.
В этих случаях механизм ферментативной реакции, как правило, может идти по одному из двух путей: по механизму «пинг-понг» (механизму двойного замещения) или последовательному. Рассмотрим оба механизма.
1. Механизм «пинг-понг»
Схематично механизм «пинг-понг» может быть представлен следующим образом:
Субстрат А, взаимодействуя с ферментом (Е), превращается в продукт (Р1). Фермент остаётся в результате этого преобразования не в нативной форме, а в изменённой (Е’) в результате модификации кофермента. Далее к активному центру Е’ присоединяется субстрат В, подвергающийся преобразованию в продукт (Р2) с высвобождением нативной формы фермента (Е).
Хороший пример механизма «пинг-понг» — реакции трансаминирования с участием ферментов аминотрансфераз (кофермент пиридоксальфосфат). Аминотрансферазы, открытые отечественным учёным А. Е. Браунштейном, катализируют обратимые реакции переноса аминогруппы с аминокислоты на кетокислоту. Механизм «пинг-понг» данной реакции схематично представлен на рис. 2-7.
Рис. 2-7. События в активном центре аминотрансферазы как пример механизма «пинг-понг». Кофермент пиридоксальфосфат (ПФ), связанный с ферментом, принимает α-аминогруппу от первой аминокислоты (АК1) которая при этом превращается в α-кетокислоту 1 (КК1) и высвобождается из активного центра фермента. Далее в активный центр фермента присоединяется α-кетокислота 2 (КК2), которая забирает аминогруппу от кофермента и превращается в α-аминокислоту (АК2).
Другой пример механизма «пинг-понг» — реакции дегидрирования с участием кофермента FAD (флавинадениндинуклеотид) или FMN (флавинмононуклеотид), которые прочно связаны с ферментом и, следовательно, не могут рассматриваться в качестве второго субстрата.
Схематично структура этих коферментов и соответствующие им химические формулы представлены на рис. 2-8.
Рис. 2-8. Структура (А) и химическое строение (Б) коферментов FMN и FAD.
Схему реакции дегидрирования (как пример механизма «пинг-понг» с участием коферментов FMN и FAD) можно представить в следующем виде:
где АН2 — донор водорода, окисляемый субстрат 1; А — окисленная форма субстрата 1; В — акцептор водорода — субстрат 2; ВН2 — восстановленная форма субстрата 2; Е (FAD), Е (FADH2) — окисленная и восстановленная формы кофермента FAD, входящего в состав фермента Е.
В качестве примера FAD-зависимой реакции можно привести сукцинатдегидрогеназную реакцию. В этой реакции в качестве второго субстрата участвует убихинон — один из посредников ЦПЭ (см. схему).
2. Последовательный механизм
В случае последовательного механизма для протекания ферментной реакции требуется одновременно взаимодействие двух субстратов. В этом случае возможно присоединение субстратов двумя различными путями:
Механизм упорядоченного взаимодействия субстрата с активным центром фермента:
Первым в активный центр фермента присоединяется субстрат А, облегчая присоединение субстрата В. После химической модификации также наблюдают определённый порядок высвобождения продуктов реакции.
Механизм случайного взаимодействия субстрата с активным центром фермента:
Приоритетности за взаимодействие субстратов А и В в активном центре фермента нет (каждый субстрат имеет свой центр связывания в активном центре). Также нет строгой закономерности высвобождения продуктов реакции.
Схематично структура и химические формулы этих коферментов представлены на рис. 2-9.
Оба кофермента функционируют как посредники переноса двух электронов и одного протона от донора к акцептору, другого протона — в среду (см. схему А).
Донор и акцептор не обязательно участвуют в одном метаболическом пути. Другими словами, восстановленная форма этих нуклеотидов действует как общий пул электронов, образованный в результате окислительных реакций, и может быть использована в различных восстановительных реакциях. Такие реакции называют сопряжёнными (см. схему Б).
В качестве примера можно рассмотреть следующие сопряжённые реакции (см. схему), где Е1 — глицеральдегидфосфат дегидрогеназа; Е2 — лактатдегцдрогеназа.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
© 2018-2021 Все права на дизайн сайта принадлежат С.Є.А.