Что такое макросомия плода
Что такое макросомия плода
1. Синонимы:
• Большой для ГВ
2. Определения:
• Масса плода при рождении >4000 или 4500 г:
о Американское общество акушеров и гинекологов (American College of Obstetrics and Gynecology, ACOG) рекомендует использовать пороговое значение 4500 г. Выше него резко увеличивается частота осложнений для матери и плода
• Большой для ГВ плод: ПМП либо масса плода при рождении >90-го процентиля
б) Лучевая диагностика:
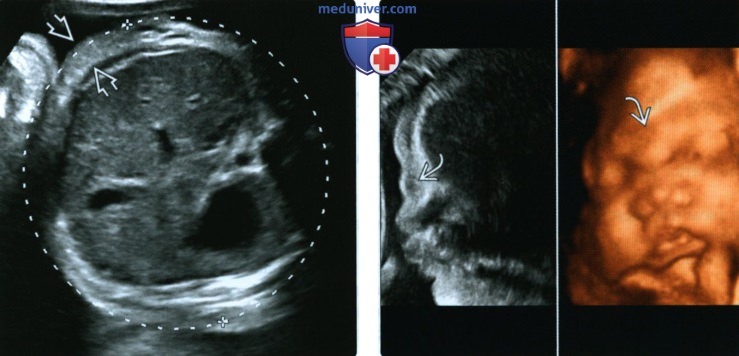
(Справа) Макросомия плода. Подкожная жировая клетчатка лица нависает над переносицей Подобную картину не следует путать с водянкой, при которой эхогенность ниже.
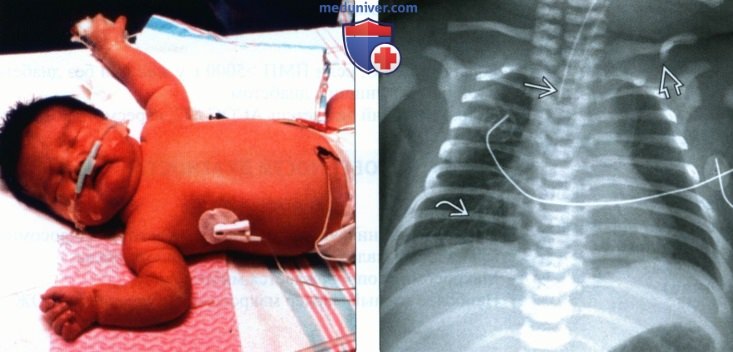
(Справа) Интубация новорожденного после аспирации мекония и гипоксии. Перелом левой ключицы. Диагностика макросомии плода принципиально важна, поскольку позволяет снизить риск осложнений как для матери, так и для новорожденного.
в) Дифференциальная диагностика макросомии плода:
1. Синдром Беквита-Видемана:
• Опережающий рост плода на ранних сроках
• Сопровождается макросомией и врожденными пороками:
о Макроглоссия, омфалоцеле, увеличенные почки
2. Водянка плода (иммунная и неиммунная):
• Избыточное накопление жидкости:
о Отек подкожной жировой клетчатки по сравнению с жировой тканью более гипоэхогенный
о Плевральный и перикардиальный выпот, асцит
г) Клинические особенности:
1. Клиническая картина:
• Самые частые субъективные и объективные симптомы:
о Высота стояния дна матки больше ожидаемой для данного срока
о Сопутствующие заболевания, повышающие риск макросомии:
— СД (при контролируемой гликемии риск снижается)
— Ожирение матери
— Переношенная беременность (>42 нед.)
— Крупный плод в анамнезе
2. Демографические особенности:
• Эпидемиология:
о >4000 г: показатель заболеваемости во всем мире 9%
о >5000 г: показатель заболеваемости во всем мире 0,1%
о Доля больших для ГВ детей, чьи матери не страдают СД (США):
— При нормальном ИМТ матери: 7,7%
— При ожирении матери: 12,7%
о Доля больших для ГВ детей, чьи матери страдают СД (США):
— При нормальном ИМТ матери: 13,6%
— При ожирении матери: 22,3%
3. Естественное течение и прогноз:
• Осложнения для матери:
о Затяжные роды, клинически узкий таз
о Роды путем КС
о Разрывы мягких тканей половых путей
о Послеоперационное кровотечение
о Разрыв матки
• Осложнения для плода:
о Родовая травма:
— Дистоция плечиков в 10% случаев:
>50% при массе плода >4500 г и наложении акушерских щипцов
— Травма плечевого сплетения, паралич лицевого нерва
— Перелом ключицы, плечевой кости
— Асфиксия
о Неонатальная гипогликемия, гипокальциемия
• Высокий риск отсроченных заболеваний:
о Ожирение, метаболический синдром, сердечно-сосудистые заболевания
4. Лечение макросомии плода:
• Роды путем КС, если ПМП >5000 г у женщин без диабета и >4500 г у женщин с диабетом:
о Практический бюллетень ACOG #22, пересмотр от 2015 г.
д) Особенности диагностики:
2. Информация, отражаемая в заключении:
• Если при скрининговом УЗИ во II триместре выявлена увеличенная ОЖ, рекомендовано повторное исследование
• О предполагаемой макросомии плода необходимо проинформировать акушера-гинеколога, ведущего беременность
е) Список использованной литературы:
1. Black МН et al: The relative contribution of prepregnancy overweight and obesity, gestational weight gain, and IADPSG-defined gestational diabetes mellitus to fetal overgrowth. Diabetes Care. 36(1):56-62, 2013
2. Dennedy MC et al: Macrosomia: defining the problem worldwide. Lancet. 381(9865):435-6, 2013
Редактор: Искандер Милевски. Дата обновления публикации: 24.11.2021
Что такое макросомия плода
Проблема макросомии плода представляет интерес для акушеров-гинекологов в связи с частым развитием, по сравнению с гестацией со средней массой плода, различных осложнений беременности, трудностями родоразрешения, обусловленными высоким процентом родового травматизма матери и плода, перинатальной заболеваемости и смертности, оперативных родов.
По данным разных источников количество младенцев, имеющих при рождении массу тела 4000 г и более, составляет от 5–8 % до 15–28 % [1, 2, 4, 6, 7, 9, 10, 11]. Крупные дети чаще рождаются у повторнородящих, многорожавших, возрастных первородящих женщин [2, 3, 9]. Имеют значение конституциональные особенности родителей, наследственная предрасположенность, возраст отца. У большинства пациенток в анамнезе есть указание на рождение крупного ребенка [8]. Огромную роль в развитии макросомии плода играют алиментарные факторы, чрезмерная прибавка массы тела во время беременности [3, 8]. Этиологическим фактором макросомии может послужить фармакологическая поддержка беременности: витамины и микроэлементы (фолиевая кислота, витамин Е, препараты железа, препараты калия и магния, витаминно-минеральные комплексы (ВМК)), гормональные препараты (гестагены, глюкокортикостероиды (ГКС)), средства, действующие на ССС (спазмолитики, актовегин, курантил, пентоксифиллин), плазмозамещающие средства (гидроксиэтилированный крахмал, декстраны), бронхолитические средства (эуфиллин) [5].
В течение последних лет наблюдается увеличение количества новорожденных крупных к сроку гестации, что, безусловно, определяет актуальность темы и цель исследования.
Цель исследования – изучение структуры осложнений беременности и родов, перинатальных исходов при макросомии плода.
Материалы и методы. Проведено ретроспективное сравнительное исследование с анализом 115 обменных карт, историй родов и историй развития новорожденных на базе ГБУЗ РМ «Родильный дом» г. Саранска за 2015 г. пациенток, родоразрешенных при доношенном сроке беременности. На основании массы тела плода при рождении были сформированы две группы: 1 группа (основная группа) – 85 пациенток, у которых масса плода при рождении была 4000,0 – 5200,0 г; 2 группа (группа сравнения) – 30 пациенток, у которых масса плода при рождении составляла 3020,0 – 3820,0 г.
С помощью разработанной нами индивидуальной регистрационной карты проведен сбор информации из медицинской документации, включающей в себя данные анамнеза, объективного соматического и акушерского статуса, особенности течения беременности, родов и послеродового периода, оценку состояния и заболеваемости новорожденного, лабораторных и инструментальных исследований. Изучены показатели клинического анализа крови, биохимического анализа крови с оценкой показателей углеводного обмена, функций печени, почек, системы гемостаза. Проанализированы данные ультразвукового исследования (УЗИ) внеплодовых структур, матки в послеродовом периоде, допплерометрии маточно-плацентарного (МПК) плодового-плацентарного кровотока (ППК), кардиотокограмм (КТГ).
Статистическая обработка и окончательная оценка данных проводилась с использованием программы Microsoft Excel.
Результаты исследования. За 2015 г в ГБУЗ РМ «Родильный дом» были родоразрешены 3641 пациентки, из них родов крупным плодом – 256 (7,0 %). Масса плода при рождении в основной группе в среднем составила 4237,00±215,99 г и оказалась на 23,4 % (p 0,05).
Отягощенный акушерско-гинекологический анамнез (ОАГА) имели 41 (48,2 %) женщин 1-ой группы и 16 (53,3 %) женщин 2-ой группы, что статистически сопоставимо. Артифициальные аборты в анамнезе произведены у 26 (30,6 %) женщин, беременных крупным плодом, и у 8 (26,7 %) женщин группы сравнения. Самопроизвольные аборты в анамнезе зарегистрированы только у женщин основной группы – 8 (9, 4 %) пациенток.
Изучение структуры гинекологических заболеваний показало, что в основной группе хроническое воспаление матки и придатков встретилось у 11 (12,9 %) пациенток, инфекции, передающиеся половым путем у 22 (25,9 %) пациенток. Среди женщин из группы сравнения данные заболевания выявлены в 3 (10,0 %) и 7 (23,3 %) случаях соответственно.
В нашем исследовании уровень гликемии во время беременности был сопоставим в обеих группах: в основной он составил в среднем 5,07±1,02 ммоль/л, во 2-ой группе – 4,67±0,57 ммоль/л. Т.е. гликемия как фактор увеличения массы тела плода в нашем исследовании не играла решающей роли.
Анализ структуры осложнений беременности показал, что гестационный сахарный диабет отягощал гестацию у 3 (3,5 %) женщин с крупным плодом и не диагностировался ни у одной женщины с нормальной массой плода.
Истмико-цервикальная недостаточность (ИЦН) больше распространена у беременных крупным плодом, чем средним: 6 (7,1 %) случаев в 1-ой группе и 1 (3,3 %) случай во 2-ой группе. Макросомия плода чаще сочеталась с многоводием – в 15 (17,7 %) наблюдениях в первой группе, и лишь в 1 (3,3 %) – в группе сравнения. Однако достоверной разницы при измерении индекса амниотической жидкости во время ультразвукового исследования не отмечалось.
Анемия беременных диагностирована у 63 (74,1 %) пациенток из основной группы, в группе сравнения у 24 (80,0 %) пациенток, т.е. встречалась примерно с одинаковой частотой.
Плацентарные нарушения сформировались примерно у трети обеих групп: при крупном плоде – у 27 (31,8 %), а при нормосомии плода – у 11 (36,7 %) беременных. Нарушения маточно-плацентарного кровотока были выявлены у 2 (2,3 %) пациенток из основной группы и у 1 (3,3 %) женщины из группы сравнения. Значительно чаще были обнаружены нарушения плодово-плацентарного кровотока: у 7 (8,24 %) беременных с макросомией плода и в 2 раза чаще, у 5 (16,7 %) пациенток с нормальной массой новорожденного.
Диагноз «внутриутробная гипоксия плода» выставлен только беременным крупным плодом – в 5 (5,9 %) наблюдениях.
Ранний токсикоз – рвота беременных – чаще развивался у пациенток 1-ой группы – в 31 (36,5 %) случае и у 8 (26,6 %) беременных группы сравнения. У женщин с крупным плодом также чаще возникали отеки, вызванные беременностью – 36 (42,4 %) эпизодов, в группе сравнения данная патология была установлена у 8 (26,7 %) беременных. Преэклампсия также с несколько большей частотой развивалась у беременных с макросомией плода – у 7 (8,2 %) женщин, в группе сравнения – у 2 (6,7 %).
Лечение осложнений беременности получали в стационаре 46 (54,1 %) пациенток из основной группы и 15 (50 %) из группы сравнения.
Беременные обеих групп получали во время беременности медикаментозную терапию. Поэтому целесообразно было оценить степень влияния тех или иных лекарственных препаратов на формирование макросомии плода (таблица 1).
Анализ приема беременными лекарственных препаратов
Что такое макросомия плода
Одной из значимых медико-социальных проблем является беременность и роды при наличии крупного плода. Макросомия плода (МП) – состояние, при котором (в зависимости от используемого способа определения) вес ребенка составляет более 4000–4500 г, или отмечается превышение 90-го перцентиля по его размерам по перцентильной шкале, разработанной для конкретной популяции. Дети с массой тела более 4000 г чаще рождаются у многорожавших женщин, при наличии ожирения, сахарного диабета [2]. По данным I. Kahyaoglu и соавт. [24], высокие риски развития МП имеют женщины с преимущественно сидячим образом жизни и пониженной физической активностью в третьем триместре беременности. Проблема крупного плода заслуживает пристального внимания врачей разных специальностей – акушеров, неонатологов, невропатологов, так как беременность и роды при крупном плоде часто носят осложненный характер. Перинатальная заболеваемость и смертность при МП в 5–10 раз превышает таковую у детей, рождённых с нормальной массой тела [4].
Большинство авторов отмечают, что при МП осложнения начинают развиваться еще на этапе беременности. По данным ряда авторов [6, 8], среди осложнений гестационного периода у пациенток с МП достоверно чаще, чем в популяции, выявляются гестоз, анемия, ранний токсикоз; многоводие.
Роды при массе плода 4000 г и более часто протекают с осложнениями: наблюдается первичная и вторичная слабость родовой деятельности, несвоевременное излитие околоплодных вод; тазово-головная диспропорция плодового генеза встречается в 5 раз чаще, чем при нормальных размерах плода; достоверно чаще в потужном периоде формируется дистоция плечиков. Поэтому при диагностировании крупного плода увеличивается число плановых операций кесарева сечения, оперативных вагинальных родов [25]. При МП значительно возрастает риск синдрома аспирации околоплодных вод, родовой травмы у матери и ребенка, регистрируется более высокая частота асфиксии при рождении [1]. В последовом и раннем послеродовом периодах ввиду перерастяжения матки из-за крупного плода чаще возникают гипотонические кровотечения [27].
Z. Gyurkovits и соавт. [20], проанализировав перинатальные исходы, выявили высокую частоту кровоизлияния в надпочечник новорожденных с массой 4500 и более после естественных родов. Теми же авторами при МП отмечены высокие риски переломов ключицы, низкой оценки состояния новорожденных по шкале Апгар на 5 минуте, рождение в состоянии гипогликемии. Согласно данным С.И. Ёлгиной и соавт. [2], последствия перенесенного хронического страдания крупного плода в антенатальном периоде приводят к нарушению адаптационных процессов, снижению сопротивляемости к действию неблагоприятных факторов внешней среды, отклонениям в физическом, соматическом и нервно-психическом развитии в постнатальном периоде онтогенеза. Известно, что макросомия у девочек при рождении в пубертатном периоде проявляется опережением физического развития при относительной задержке полового развития; менструальная функция характеризуется гиперменструальным синдромом и нерегулярным менструальным циклом (15,7 %), высокой частотой дисменореи (52,8 %) и маточных кровотечений пубертатного периода (39,3 %); дисгормональными измененениями молочных желез (64 %) и синдром гиперандрогении (53,9 %); эхографическими признаками периферического типа поликистозных яичников и персистирующих ретенционных образований яичников.
Таким образом, актуальность своевременной диагностики МП, влияющей на выбор оптимальной тактики родоразрешения, не вызывает сомнений. Идеальной моделью профилактики возможных перинатальных осложнений является устранение причин возникновения МП. Однако до сих пор поиск окончательного ответа на вопрос об истинных причинах формирования МП далёк от своего завершения. Имеющиеся данные в современной литературе противоречивы.
Ведущими факторами риска МП являются сахарный диабет, ожирение; заболевания сердечно-сосудистой системы, позднее менархе, повторные роды, крупный плод в анамнезе, перенесенные аборты, перенашивание беременности, прибавка массы тела беременной более 20 кг, прием вазоактивных препаратов во II и III триместре беременности (пентоксифиллин, курантил) [9, 26]. Л.А. Черепнина [8] отметила, что антенатальными факторами риска развития МП являются прием гестагенов (дюфастон, утрожестан) в 1 триместре, вазоактивных препаратов (трентал, курантил, актовегин), витамина Е во 2–3 триместрах.
В последние годы большое внимание уделяется нарушениям углеводного и липидного обменов у матери, как основным причинам формирования МП [3, 5]. Одними из ключевых регуляторов углеводно-липидного метаболизма являются эндокринные факторы – адипокины (лептин, адипонектин, резистин), инсулин и компоненты оси грелина (грелин – гормон роста – инсулиноподобные факторы роста) [12]. Во время беременности происходят значительные изменения в этих метаболических процессах, влияющих на росто-весовые параметры плода, что обусловливает актуальность изучения данного вопроса. Беременность является уникальным состоянием, сопровождающимся физиологическим увеличением резистентности к инсулину. Это позволяет рассматривать даже физиологически протекающую беременность в качестве «диабетогенного состояния». При беременности развивается состояние относительного гиперинсулинизма с периферической инсулиновой резистентностью за счет увеличения концентрации контринсулярных гормонов, а также действия адипокинов жировой ткани. Известно, что эндокринная активность жировой ткани при беременности возрастает, что выражается в изменении концентраций адипокинов в материнской крови [10]. Именно адипокины рассматриваются в качестве недостающего звена в патогенезе нарушений углеводного и липидного обменов, которые, в свою очередь, приводят к развитию наиболее актуальных проблем современной медицины: кардиоваскулярных заболеваний, инсулинорезистентности, ожирения.
Термин «адипоцитокины» (adipo – жир, cyto – клетка, kinos – движение) некоторыми учеными оспаривается, поскольку цитокинами назван класс медиаторов межклекточного взаимодействия, принимающих участие в иммуновоспалительных реакциях. С этой точки зрения неуместно рассматривать резистин, лептин и адипонектин в качестве цитокинов, так как не доказано их иммуномодулирующее влияние. Поэтому коллизия заключается в том, что на сегодняшний день необходимы дальнейшие исследования в этой области для разграничения гормоноподобных субстанций и цитокинов. В связи с этим был предложен более широкий термин «adipose derived hormones» – адипопродуцируемые гормоны, хотя в настоящее время чаще всего применяют название «адипокины». Эра адипокинов началась с открытия в 1994 году лептина, когда были представлены данные о роли мутации гена лептина в развитии ожирения у мышей. Позднее были открыты и другие гормоноподобные вещества, продуцируемые адипоцитами.
Лептин (от гр. leptos – тонкий), так называемый гормон голода, был первым открытым адипокином. В 1994 году ученые Рокфеллеровского университета обнаружили у мышей с ожирением мутацию ob/ob-гена, контролировавшего экспрессию лептина. Исследователи полагают, что при ожирении возникает компенсаторная резистентность гипоталамуса к центральному действию лептина, что в последующем по механизму отрицательной обратной связи приводит к гиперлептинемии [29]. Результаты исследований влияния лептина на секрецию инсулина и инсулинорезистентность противоречивы. L.M. Berstein [16] выявил также прямую зависимость между уровнем лептина и степенью инсулинорезистентности с учетом изменений объема жировой ткани у женщин в постменопаузе. Они предположили, что лептин является связующим звеном между адипоцитами и β-клетками поджелудочной железы и стимулирует секрецию инсулина при снижении чувствительности к нему. В исследованиях как in vitro, так и in vivo было обнаружено, что лептин обладает свойствами фактора роста, а именно, стимулирует ангиогенез, пролиферацию гемопоэтических клеток и β-клеток поджелудочной железы. Кроме того, подавляя синтез нейропептида Y в гипоталамусе, лептин стимулирует секрецию гормона роста гипофизом. Существует гипотеза, что уровень лептина является сигнальным маркером, отражающим достаточное накопление жировой ткани, необходимое для начала полового созревания, которое обеспечит регулярность менструальных циклов и способность к репродукции [21].
В настоящее время установлено, что лептин стимулирует активацию симпатоадреналовой системы, а катехоламины, в свою очередь, подавляют продукцию лептина, однако при развитии метаболического синдрома эти взаимодействия нарушаются, и повышенный уровень лептина в сочетании с хронической гиперактивацией нейрогуморальных систем способствует возникновению артериальной гипертензии [13]. Лептин вместе с тем играет важную роль во время беременности, являясь митогенным фактором для клеток трофобласта [11]. Повышение концентрации лептина в группе беременных с гестозом можно рассматривать и как компонент патогенеза преэклампсии и, с другой стороны, как адаптивный механизм, направленный на компенсацию формирующихся нарушений в системе: мать – плацента – плод [11]. G. Angelidis и соавт. показали важную роль лептина и грелина в регуляции полового созревания, фертильности и имплантации плодного яйца в эндометрий. В то же самое время остаётся не изученным вопрос о роли лептина при МП [14].
Во время беременности плацента является дополнительным источником образования таких адипокинов, как лептин и резистин, что подтверждает их потенциальную роль в поддержании беременности [11]. На современном этапе биологические и патофизиологические эффекты резистина в организме человека до конца не изучены, и данная проблематика остается темой научных дискуссий.
Адипонектин обладает также антиатерогенными свойствами. Он угнетает адгезию моноцитов, снижает их фагоцитарную активность и уменьшает накопление измененных липопротеинов в стенке сосудов. Кроме того, адипонектин уменьшает повреждение эндотелия сосудов и стимулирует выработку оксида азота. Исходя из этих данных, становится очевидным, что гипоадипонектинемия является фактором риска нарушений сосудисто-тромбоцитарного и коагуляционного гемостаза, что приводит к усилению процессов тромбообразования. Влияние адипонектина на риск сердечно-сосудистых заболеваний требует дальнейшего изучения.
Грелин повышает уровень соматотропного гормона. Этот пептид играет важную роль в регуляции голода и энергетического метаболизма, стимулируя прием пищи и провоцируя развитие ожирения. Его уровень увеличивается при голодании, снижении массы тела, калорийности пищи и при гипогликемии. Повышение уровня грелина в плазме крови после снижения веса, вызванного диетой, согласуется с гипотезой, что грелин играет роль в долгосрочной регуляции массы тела. Уровень грелина снижен у лиц с ожирением, сахарного диабета 2-го типа и артериальной гипертензией.
H. Kahveci и соавт. [23] выявили положительную корреляция между уровнями инсулина, лептина, грелина с гестационным возрастом и антропометрическими величинами плодов, рожденных преждевременно (на 24–37 неделях беременности), что еще раз доказывает важную роль грелина и лептина для роста и развития детей на антенатальном этапе. Однако недостаточно данных о влиянии концентраций лептина и грелина на формирование МП.
Таким образом, вышеизложенное позволяет считать, что МП является одной из актуальных проблем современного акушерства, обусловленной высоким процентом осложненного течения беременности и родов, приводящих к серьезным медицинским, социальным и экономическим последствиям. Идеальной моделью профилактики формирования МП является устранение причин ее возникновения. В настоящее время отсутствует однозначное понимание причин и процессов, приводящих к МП. Тем не менее появились работы, в которых основными причинами формирования МП плода являются нарушения углеводного и липидного обменов у матери. Расширение представлений о патогенезе МП с помощью уточнения роли грелина и лептина в обменных процессах позволит сформулировать научно обоснованное заключение о возможностях и путях оптимизации перинатальных исходов при МП.
Что такое макросомия плода
Среди факторов риска развития макросомии лидирует метаболический синдром у матери, включающий ожирение, инсулинорезистентность, СД 2-го типа и гестационный сахарный диабет (ГСД) [9].
Очевидно, что профилактика и лечение метаболического синдрома должны проводиться задолго до начала беременности и обязательно включать коррекцию гормональных нарушений, рекомендации о правильном питании и физической активности, исключении алкоголя и грамотной микронутриентной поддержке.
В настоящей статье подробно будут рассмотрены наиболее частые причины макросомии и пути их коррекции.
Макросомия и гестационный сахарный диабет
Гестационный сахарный диабет выявляется только в ходе беременности (около 7% беременных в мире) и характеризуется нарушенной толерантностью к глюкозе. Рост частоты ГСД обусловлен хроническим стрессом, гиподинамией и неполноценным питанием (фастфуд). Обычно он развивается во второй половине беременности и является самым значимым фактором риска развития макросомии плода [13].
Патогенез макросомии при наличии метаболических нарушений у беременной связан в первую очередь с чрезмерным переносом глюкозы от матери к плоду, что приводит к гипергликемии и гипертрофии клеток поджелудочной железы плода, повышению секреции инсулина [14].
Терапия ГСД включает инъекции инсулина, диету и умеренную физическую нагрузку.
Макросомия и ожирение
К особенностям питания российских женщин относится недостаточное потребление необходимых микронутриентов при избыточном потреблении углеводов и насыщенных жиров. Такого рода питание во время беременности не способствует ни здоровью матери, ни рождению здорового ребенка.
Ятрогенные причины макросомии
Назначение кортикостероидов во время беременности также может осложняться формированием толерантности к глюкозе и ГСД [5].
Таким образом, при беременности необходим дополнительный прием витаминов и микроэлементов в физиологических дозах в виде сбалансированных витаминно-минеральных комплексов, например, Витрум Пренатал Форте.
Витамины, микроэлементы и беременность
Витамин D. Витамин D3 (холекальциферол) наиболее известен как гормоноподобный витамин, участвующий в абсорбции кальция в костной ткани. В последнее время представления о роли витамина D3 в организме значительно расширились. Рецептор витамина D активирует многие гены человека, с которыми связаны не только метаболизм кальция, но и модуляция обменных процессов, атеросклероза, артериального давления, иммунитет и пр. [6]. Дефицит витамина D во время беременности не только ухудшает состояние костной ткани матери и плода, но также способствует развитию атеросклероза, вызывает инсулинорезистентность, ГСД, макросомию и повышает риск развития преэклампсии [7, 12].
Магний является наиболее важным микроэлементом для лечения и профилактики сахарного диабета, а также обязательным кофактором ряда гликолитических ферментов. Практически у всех пациентов с СД отмечается гипомагниемия; потери усиливаются из-за нарушения обратной резорбции в почечных канальцах и снижения уровня магния в крови пропорционально повышению уровня глюкозы в моче.
Повышение уровня внутриклеточного кальция и снижение магния являются маркерами инсулинорезистентности, в то время как восстановление уровня магния в клетках сопровождается восстановлением чувствительности периферических тканей к инсулину и снижением гликемии [16].
Цинк необходим для реализации эффектов инсулина и активации транскрипции генов углеводного обмена, а также способствует снижению холестерина. Симптомы дефицита цинка во многом схожи с симптомами СД [4]. Дефицит цинка на фоне повышения уровня меди способствует системному воспалению, которое затрагивает и клетки поджелудочной железы. У беременных с ГСД концентрация цинка снижена, а концентрация меди повышена [17].
Для профилактики макросомии следует внимательно относиться к назначению фармакологических средств во время беременности (токолитики, кортикостероиды), уделять достаточное время физической активности, ограничить потребление углеводов и насыщенных жиров, а также дополнять диету сбалансированными витаминно-минеральными комплексами, характеризующимися высоким уровнем доказательности в акушерстве (препарат Витрум Пренатал Форте).
В заключение следует отметить, что полное обследование женщин до и во время беременности, своевременная и патогенетически обоснованная комплексная терапия, включающая назначение витаминно-минеральных комплексов, содержащих фолиевую кислоту, хром, цинк, магний, витамины В12, С и D, которые содержатся в препарате Витрум Пренатал Форте, способствуют значительному снижению риска рождения крупного плода.
