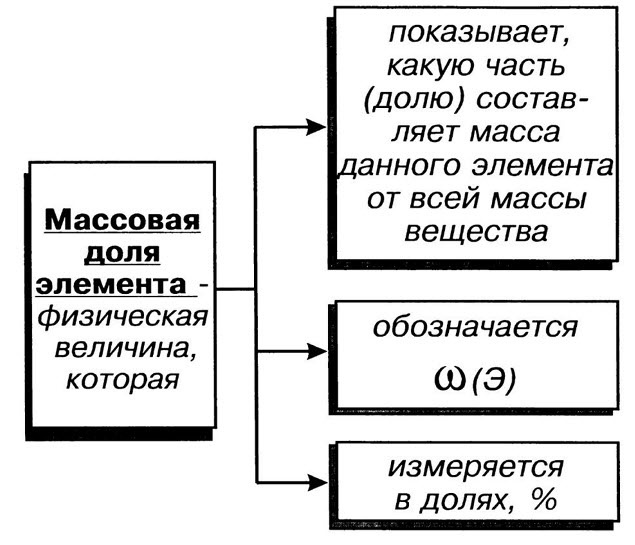
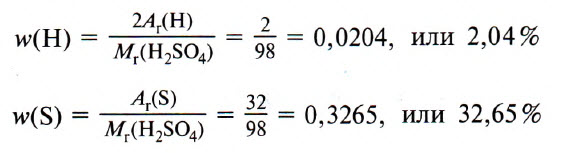Что такое массовые доли элементов
Урок №13. Массовая доля химического элемента в соединении
Массовая для элемента в данном веществе (w) – отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества.
w – массовая доля элемента в веществе,
n – индекс в химической формуле,
Ar – относительная атомная масса,
Mr – относительная молекулярная масса молекулы вещества.
Массовые доли выражают в процентах или в долях:
w (элемента) = 20% или 0,2.
Вычислите массовые доли элементов в фосфорной кислоте, имеющей простейшую химическую формулу H 3 PO 4 , с точностью до сотых.
Дано :
Найти :
Решение :
1. Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав фосфорной кислоты
2. Вычисляем относительную молекулярную массу соединения
Mr(H 3 PO 4 ) = 3·Ar(H) + Ar(P) + 4·Ar(O) = 3·1 + 31 + 4·16 = 98
3. Вычисляем массовые доли элементов по формуле:
w (элемента) = (n· Ar(элемента) · 100%) / Mr( молекулы )
w(H) = n(H)·Ar(H)·100% / Mr(H 3 PO 4 ) = 3·1·100% / 98 = 3,06%
w(P) = n(P)·Ar(P)·100% / Mr(H 3 PO 4 ) = 1·31·100% / 98 = 31,63%
w(O) = n(O)·Ar(O)·100% / Mr(H 3 PO 4 ) = 4·16·100% / 98 = 65,31%
Сумма значений массовых долей всех элементов должна составить 100% w(H) + w(P) + w(O) = 100%
3,06% + 31,63% + 65,31% = 100%
Таким образом, массовые доли элементов в фосфорной кислоте вычислены правильно.
Массовая доля вещества
Но все становится намного веселее, если поискать примеры химических реакций вокруг нас.
Костер в летнем походе, сквашивание овощей, изменение вкуса любимых блюд с помощью соли или сахара — это все химия.
Сегодня мы разберем одну из базовых тем «Массовая доля вещества в растворе».
Если хорошо изучить тему и научиться быстро решать задачи, можно не только определить, сколько ложек сахара бабушка добавила в свой чай, но и находить ответы на сложные криминалистические задачи.
Но перед тем, как приступить к практической части, стоит разобраться с теорией.
ОСНОВНЫЕ ТЕРМИНЫ
Основными терминами в этой теме будут:
Раствор — однородная смесь различных веществ в жидком виде.
Компоненты — вещества, которые подлежат смешиванию для получения раствора.
Растворитель — жидкий компонент, к которому добавляют субстанции для получения раствора.
Растворенное вещество — твердые или жидкие вещества, которые добавляют к растворителю для получения раствора.
Массовая доля — отношение массы вещества к массе раствора, в котором оно содержится.
Концентрация — отношение количества растворенного вещества к растворителю, выраженное в процентах.
Когда мы смешиваем между собой жидкости, которые идеально растворяются друг в друге, например воду и спирт, то можем любой из этих компонентов считать растворителем. Однако традиционно в водных растворах вода является растворителем, а второй ингредиент — растворенным веществом.
Массовая доля вещества обозначается буквой греческого алфавита ω — омега. Чтобы ее определить, используется формула для вычисления массовой доли вещества.
ω (в-ва)= m (в-ва)/ m (р-ра) (1)
В этом равенстве массовая доля принимает значение от 0 до 1.
Однако в задачах чаще используется процентное соотношение, которое получается по следующей формуле:
ω (в-ва)= m (в-ва)/ m (р-ра)*100% (2)
Масса раствора равна сумме его компонентов.
В случае двухкомпонентного раствора массовая доля растворенного вещества и массовая доля растворителя в сумме дают 100%
Масса раствора находится сложением масс компонентов, входящих в раствор
Для успешного решения задачи на определение массовой доли вещества в растворе следует вспомнить еще одну формулу, которая связывает массу вещества, его объем и плотность.
Напомним, что плотность воды составляет 1 г/мл. Это значит, что 100 мл воды весит ровно 100 гр.
Электронная форма учебника (ЭФУ) Химия. 8 класс включена в состав учебно-методического комплекта (УМК) по предмету Химия 8 класса Габриелян О. С. Химия. 8 класс соответствует требованиям Федерального государственного образовательного стандарта. ЭФУ рекомендована Министерством образования и науки Российской Федерации.
Итак, с теорией разобрались. Переходим к практике.
Дано: Директор школы подозревает, что один из его поваров нечист на руку и ворует сахарозу, которая предназначена для школьных завтраков. Вы работаете экспертами-криминалистами в лаборатории и для исследования вам доставили три стакана с растворами, выданными школьникам в три разных дня.
1. Сначала определяем растворитель и растворенное вещество.
В нашем случае это вода и сахароза соответственно.
2. Используя формулу (2) составляем уравнение для первого раствора.
ω (сахарозы)= m (сахарозы)/m (р-ра)*100%
х=20 (г) — сахарозы содержится в первом стакане.
3. Аналогично находим содержание сахарозы в остальных стаканах.
Ответ : В первом растворе содержится 20 граммов сахарозы, во втором 16 граммов, а в третьем всего 10 граммов. Учитывая это, можно предположить, что третий повар ворует больше всех. А вот словить его за руку – задача специалистов другого профиля.
На ферме по выращиванию крокодилов опытным путем установили, что лучше всего крокодилы развиваются в 7% растворе NaСl. Работник фермы оставил на подоконнике склянку со 100 граммами 2% раствора и склянку с 200 граммами 4% раствора. Уборщице тете Мане нужна была пустая склянка, чтобы полить цветы, и она слила растворы в одну емкость. Необходимо определить, сколько граммов NaСl нужно добавить к полученному раствору, чтобы получить 7% раствор.
Задачу лучше решать с помощью таблицы.
| 2% р-р | 4% р-р | х%р-р | 7%р-р |
| m (в-ва) | |||
| m (р-ра) | |||
| ω (в-ва) |
1. Заполняем известные данные.
100+200 = 300 г ( масса полученного раствора и масса нужного 7% раствора)
| 2% р-р | 4% р-р | х%р-р | 7%р-р | |
| m (в-ва) | ||||
| m (р-ра) | 100 | 200 | 300 | 300 |
| ω (в-ва) | 2% | 4% | Х | 7% |
2. Используя формулу (2), рассчитываем массу вещества в 2% и 4% растворах.
ω (в-ва)= m (в-ва)/ m (р-ра)*100% (2)
математически преобразовываем формулу, чтобы найти неизвестное.
m (в-ва)=ω (в-ва)/100%* m (р-ра)
х=2 (г) — содержалось в первом растворе
х=8 (г) — содержалось во втором растворе
3. Определяем, сколько граммов содержится в третьем растворе
2+8=10 (г) — содержится в третьем растворе.
4. Определяем, сколько граммов NaСl должно быть в четвертом растворе.
х=21 (г) — должно содержаться в третьем растворе
| 2% р-р | 4% р-р | х%р-р | 7%р-р | |
| m (в-ва) | 2 | 8 | 10 | 21 |
| m (р-ра) | 100 | 200 | 300 | 300 |
| ω (в-ва) | 2% | 4% | Х | 7% |
5. Определяем, сколько граммов NaСl нужно добавить в третий раствор, чтобы получить нужную концентрацию.
Ответ: 11 граммов NaСl нужно добавить в третий раствор, чтобы получить 7% концентрацию.
Массовая доля элемента
На странице «Масса атомов и молекул» мы познакомились с атомной единицей массы (а.е.м.), относительной атомной (Ar) и молекулярной (Mr) массой.
Напомним, что относительная атомная и молекулярная массы являются безразмерными величинами.
Зная относительную атомную масса элемента, относительную молекулярную массу вещества, в которое входит данный элемент, а также количество атомов этого элемента, мы можем определить массовую долю элемента в веществе.
| Массовая доля элемента ω показывает какую часть масса этого элемента составляет от всей массы вещества, в которое он входит |
Единицей измерения массовой доли элемента являются доли единиц или проценты.
Формула для определения массовой доли элемента:
В качестве примера найдём массовые доли азота и водорода в молекуле аммиака NH3.
Делаем проверку: 82,35+17,65=100%
Определение химической формулы по массовой доле
Зная массовые доли всех элементов, входящих в конкретное вещество, можно вывести химическую формулу этого вещества.
В качестве примера определим химическую формулу вещества, в котором присутствует O (48%), Ca (40%), C (12%).
Собственно, задача сводится к определению стехиометрических индексов, поскольку все элементы, входящие в вещество, нам известны.
На первом этапе записываем формулу незнакомого вещества с числовыми индексами, которые необходимо будет определить.
На втором этапе через массовые доли элементов рассчитаем соотношение числовых индексов.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Как найти массовую долю вещества по формуле
В химии она рассчитывается:
Формула для нахождения такая:
Нахождение массовой доли химического элемента
Массовая доля химического элемента в веществе находится по отношению атомной массы химического элемента, умноженной на количество его атомов в этом соединении, к молекулярной массе вещества.
Например, для определения w кислорода (оксигена) в молекуле углекислого газа СО2 вначале найдем молекулярную массу всего соединения. Она составляет 44. В молекуле содержится 2 атома кислорода. Значит w кислорода рассчитываем так:
w(O) = (Ar(O) · 2 ) / Mr(СО2)) х 100%,
w(O) = ((16 · 2) / 44) х 100% = 72,73%.
w( H2O ) = ((18 · 5) / 250 ) · 100% = 36%
Нахождение массовой доли вещества в смесях и растворах
Например, растворили 10 г поваренной соли в 200 г воды. Нужно найти процентную концентрацию соли в полученном растворе.
Для определения концентрации соли нам нужна m раствора. Она составляет:
m (р-ра) = m (соли) + m (воды) = 10 + 200 = 210 (г).
Находим массовую долю соли в растворе:
Таким образом, концентрация поваренной соли в растворе составит 4,76%.
Если в условии задачи дается не m, а объем раствора, то его нужно перевести в массу. Делается это обычно через формулу для нахождения плотности:
Такую концентрацию используют чаще всего. Именно ее имеют в виду (если нет отдельных указаний), когда пишут о процентном содержании веществ в растворах и смесях.
Массовая доля примесей
В задачах часто дается концентрация примесей в веществе или вещества в его минералах. Следует обратить внимание на то, что концентрация (массовая доля) чистого соединения будет определяться путем вычитания из 100% доли примеси.
Соответственно, если написано, что в минерале содержится только 20% железа, то во все химические реакции и в химическом производстве будут участвовать именно эти 20%.
Например, для реакции с соляной кислотой взяли 200 г природного минерала, в котором содержание цинка 5%. Для определения массы взятого цинка пользуемся той же формулой:
из которой находим неизвестную m раствора:
m (Zn) = ( w · 100% ) / m (минер.)
m (Zn) = (5 · 100) / 200 = 10 (г)
То есть, в 200 г взятого для реакции минерала содержится 5% цинка.
Задача. Образец медной руды массой 150 г содержит сульфид меди одновалентной и примеси, массовая доля которых составляет 15%. Вычислите массу сульфида меди в образце.
Вначале найдем m примесей в образце руды. Для этого воспользуемся уже известной формулой:
m(примес.) = (15 · 150) / 100% = 22,5 (г).
Теперь по разности найдем количество сульфида в образце:
Вначале находим w соединения:
А теперь по ней, воспользовавшись той же формулой, что и в первом способе (формула А), найдем m сульфида меди:
m(Cu2S) = (85 · 150) / 100% = 127,5 (г).
Ответ: масса сульфида меди одновалентного в образце составляет 127,5 г.
Видео
Из видео вы узнаете, как правильно производить рассчеты по химическим формулам и как найти массовую долю.
Что такое массовые доли элементов
Ключевые слова конспекта: массовая доля элемента в соединении, вычисления по химическим формулам.
Относительная атомная масса элемента ( Аr ) показывает, во сколько раз масса его атома больше 1/12 массы атома углерода, масса которого равна 12 а.е.м. Относительная молекулярная масса ( Мr ) вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода. Она складывается из относительных атомных масс элементов, составляющих молекулу:
Массовая доля химического элемента ( ω ) в сложном веществе показывает, какая доля от всей массы сложного вещества приходится на массу этого элемента.
Массовая доля элемента в соединении равна отношению его массы в данном веществе к относительной молекулярной массе этого вещества
Вывод химических формул,
если известны массовые доли химических элементов,
входящих в состав данного вещества
Задача. Известно, что массовые доли натрия, серы и кислорода в данном веществе соответственно составляют 29,1 %, 40,51 % и 30,38 %. Вычислите индексы в химической формуле вещества NaxSyOz
Решение. Прежде всего из условия задачи следует, что в 100 единицах массы вещества: 29,1 единицы натрия, 40,51 единицы серы и 30,38 единицы кислорода. Если каждое из этих чисел разделить на относительные атомные массы соответствующих элементов; то в таком случае находим число атомов каждого элемента в 100 единицах вещества:
29,1 : 23 = 1,265 атома Na
40,51 : 32 = 1,266 атома S
30,38 : 16 = 1,899 атома О
В результате можно определить соотношение чисел атомов в формуле вещества:
х : у : z = 1,265 : 1,266 : 1,899
Чтобы получить соотношения целых чисел; разделим все числа атомов на наименьшее из них (на 1,265):
1 : 1 : 1,5
Для того чтобы количество атомов кислорода было выражено целым числом; полученные числа атомов умножаем на два:
х : у : z = (1 • 2) : (1 • 2) : (1,5 • 2) = 2 : 2 : 3
Эти числа принимаются в качестве индексов в простейшей формуле данного вещества — Na2S203.
Конспект урока «Массовая доля элемента в соединении».