Что такое мэл при целиакии
Что такое мэл при целиакии
Целиакия (глютеновая энтеропатия, болезнь Ги-Гертера — Гейбнера, нетропическое спру, целиакия-спру, идиопатическая стеаторея) — хроническая генетически детерминированная аутоиммунная Т — клеточно-опосредованная энтеропатия, характеризующаяся стойкой непереносимостью специфических белков эндосперма зерна некоторых злаковых культур с развитием гиперрегенераторной атрофии слизистой оболочки тонкой кишки и связанного с ней синдрома мальабсорбции.
Частота целиакии значительно варьирует в различных регионах. Популяционные исследования в Европе и США свидетельствуют о том, что распространенность целиакии колеблется в пределах от 0,5 % до 1 %. Среди детей в группах риска частота достигает 1:33. В российских популяциях и странах ближнего зарубежья распространенность целиакии находится в стадии изучения, однако высокой частоты заболевания не зарегистрировано.
Целиакия относится к заболеваниям с признаваемым большинством авторов аутосомно-доминантным типом наследования. Среди ближайших родственников больного по данным гистологического исследования частота заболевания варьирует от 2 до 12 %. В среднем, 14 % родителей пациентов сами страдают целиакией в скрытой форме.
Клиническая картина заболевания характеризуется значительным полиморфизмом. Симптомы целиакии можно разделить на две условные группы, исходя из патогенеза:
Симптомы второй группы (внекишечные) обусловлены метаболическими расстройствами, а также аутоиммунными процессами.
Выделяют 3 формы заболевания:
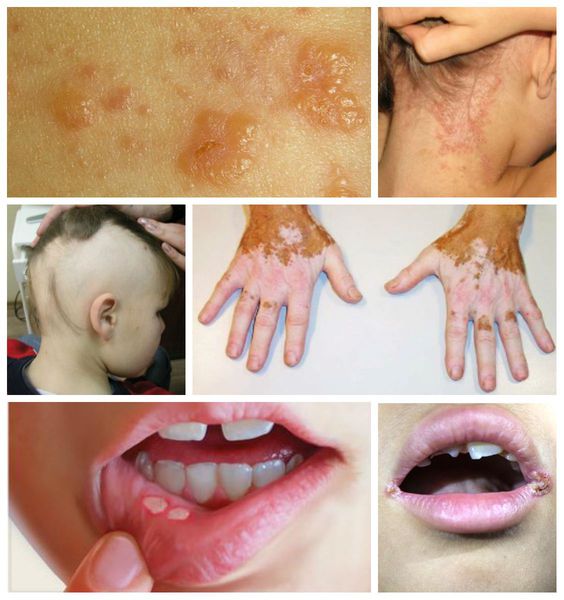
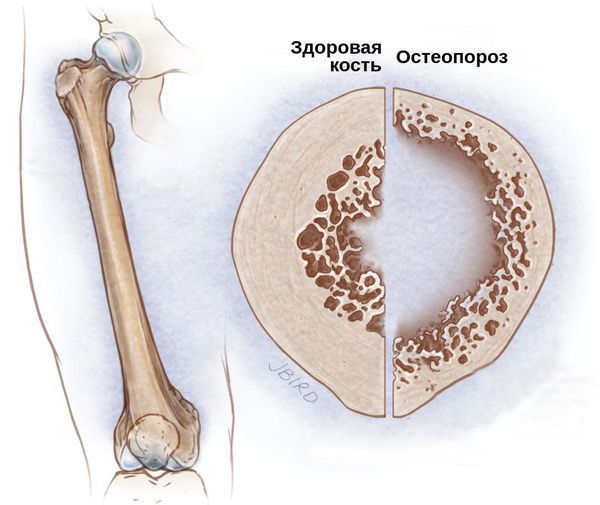
Атипичная целиакия характеризуется минимальной выраженностью (или полным отсутствием) кишечного синдрома и выходом на первый план внекишечных проявлений заболевания, которые «маскируют» типичные проявления со стороны ЖКТ. Это — отставание в росте у детей, остеопения, остеопороз, дефицит массы тела, задержка роста и полового развития, бесплодие, невынашивание беременности, гипоплазия зубной эмали, облысение, рефрактерная к терапии препаратами железа анемия, заболевания печени и ЖВП, герпетиформный дерматит Дюринга, артрит, артралгия, изъязвления полости рта, неврологические проблемы (перефирическая нейропатия, миопатия, атаксия, парастезии, тризм), психиатрические отклонения (тревожность, депрессия).
Традиционно глютеновая болезнь диагностируется с помощью биопсии двенадцатиперстной кишки в сочетании с сывороточными аутоантителами (1).
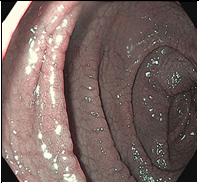
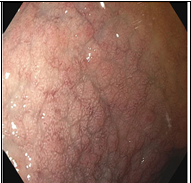
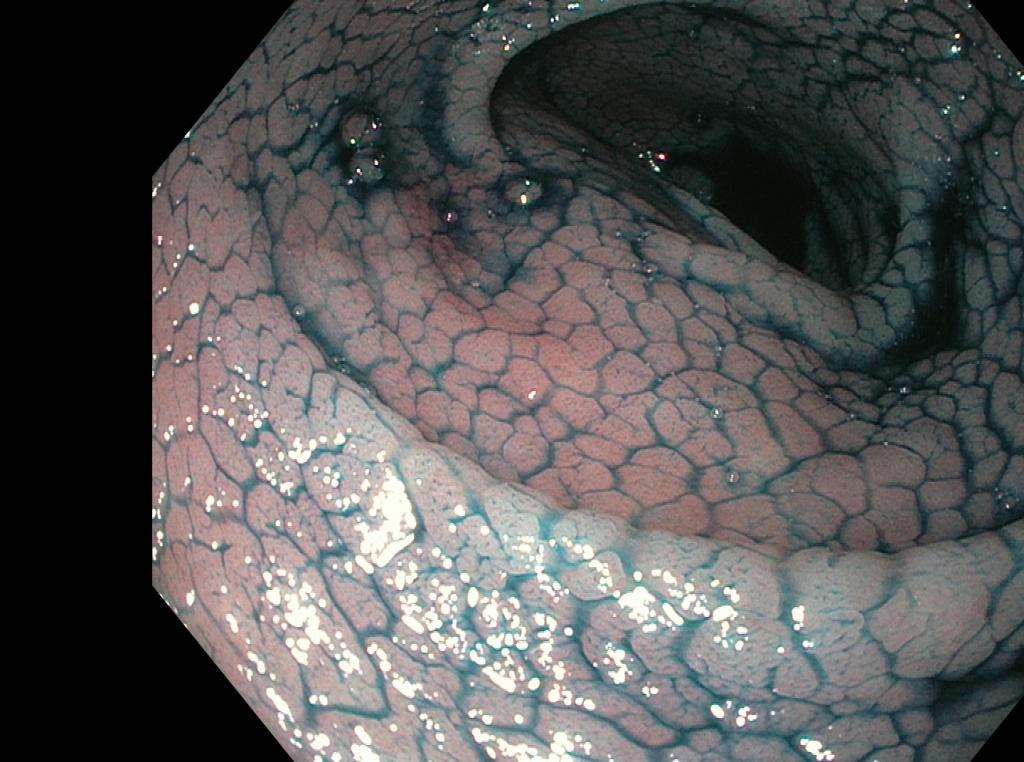
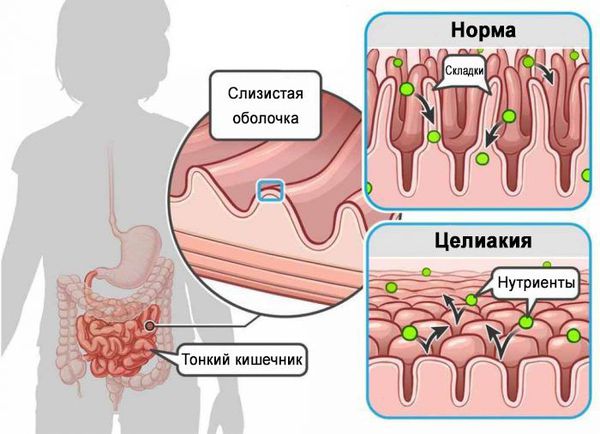
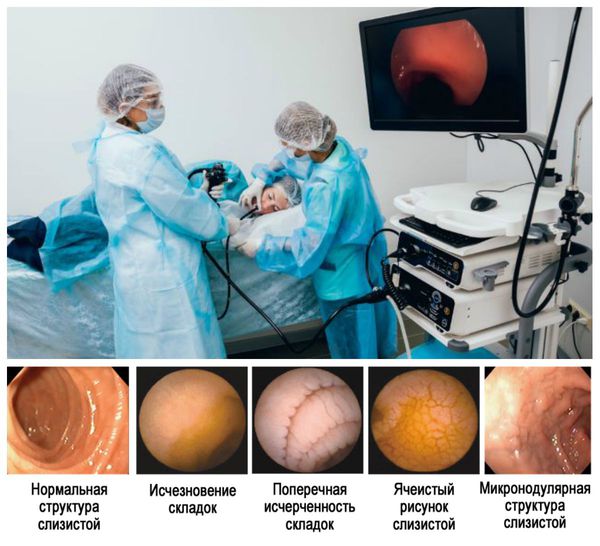
Благодаря усовершенствованию видеоэндоскопов, которые используются в повседневной практике, включая внедрение узкополосной визуализации (NBI) и ближнего фокуса, подробное исследование слизистой оболочки двенадцатиперстной кишки дает точный метод оптической диагностики (2–4). Эндоскопически видимыми признаками целиакии являются зубчатые дуоденальные складки, бороздки и трещины (см Таблица ниже). Это контрастирует со здоровой тканью, которая покрыта ворсинками, похожими на пальцы, которые обеспечивают большую площадь поверхности для поглощения питательных веществ. При целиакии ворсинки обычно намного короче и менее выражены, чем на здоровой слизистой оболочке.
Под эндоскопией, рисунок ворсинок может быть дополнительно улучшен закапыванием воды, и этот подход регулярно используется при оценке заболеваний как двенадцатиперстной, так и тощей кишки. Водная иммерсия проста, включает удаление воздуха из просвета двенадцатиперстной кишки с последующей инъекцией 90–150 мл воды. После этого признаки целиакии, такие как зубчатые дуоденальные складки, бороздки и трещины, могут быть легко визуализированы. Таким образом, этот метод позволяет с высокой точностью диагностировать участки повреждения ворсинок двенадцатиперстной кишки (5,6).
Тем не менее, хотя этот подход способствует сокращению количества требуемых биопсий, все же необходимо подтвердить диагноз с помощью гистопатологического анализа ex vivo, особенно для исключения заболеваний, которые могут имитировать такой внешний вид (7).
Эндоскопические маркеры целиакии включают в себя полное отсутствие или снижение высоты складок слизистой оболочки двенадцатиперстной кишки, хаотичность складок, вид «микроузелков» по типу «крупы», изъязвления и фиссуры слизистой у взрослых больных, видимый сосудистый рисунок. Однако, специфичность этих признаков неоднозначна, они лишь указывают на возможность атрофических процессов в слизистой оболочке тонкой кишки и такие же изменения могут отмечаться при болезни
Таблица: Эндоскопически видимые признаки целиакии по сравнению с нормальной слизистой оболочкой
Классификация разработана в 1992 году, модифицирована в 1999 году- 3я стадия была разделена на 3 подстадии, что не имеет большого клинического значения
Классическая классификация Целиакии Марш
Марш стадия 0: нормальная слизистая
Марш стадии 1: увеличение числа лимфоцитов в подслизистом слое, как правило, превышает 20 на 100 энтероцитов
Марш стадия 2: инфильтрация лейкоцитами ворсинок и крипт Либеркюна
Марш стадия 3: частичная или полная атрофия ворсинок
Марш стадия 4: гипоплазия и сглаживание складок слизистой кишки
Целиакия (K90.0)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
В зависимости от клинической картины выделяют следующие формы:
3. Молчаливая (бессимптомная) целиакия устанавливается у пациентов с отсутствием симптомов, при наличии положительных серологических тестов и атрофии ворсинок в биоптатах. Больные выявляются при скрининге групп высокого роста. Атрофия ворсинок может быть случайно обнаруживаться при эндоскопии или биопсии, проводимой по другому поводу.
4. Латентная целиакия определяется при положительных серологических тестах и отсутствии атрофии ворсинок в биоптатах. У пациентов отсутствуют клинические проявления, но они могут появиться в сочетании с гистологическими изменениями или без них.
Сводная таблица классификации целиакии по клиническим признакам
Явная/классическая
(overt, classical, typical)
— положительные серологические тесты
— гиперрегенераторная атрофия (Marsh II-III)
Атипичная
— проявления энтеропатии отсутствуют или минимальны
— преобладают атипичные проявления
— положительные серологические тесты
— гиперрегенераторная атрофия (Marsh II-III)
Стертая/асимптоматическая (silent, asymptomatic)
— клинические проявления отсутствуют
— положительные серологические тесты
— гиперрегенераторная атрофия (Marsh II-III)
Латентная/потенциальная (latent, potential)
— клинические проявления отсутствуют
— положительные серологические тесты
— положительные генетические маркеры (HLA DO2/DQ8)
— архитектоника слизистой не нарушена
— увеличено число МЭЛ (Marsh I)
— имеются убедительные клинические, серологические и гистологические признаки целиакии
— нет ответа на аглютеновую диету
Этиология и патогенез
Этиопатогенез окончательно не изучен.
Эпидемиология
Клиническая картина
Cимптомы, течение
Могут наблюдаться гипоплазия зубной эмали, мигренозные головные боли, в крови повышено содержание трансаминаз. Отмечена ассоциация целиакии с аутоимунными эндокринопатиями, например тиреоидитом.
Диагностика
Рентгеноконтрастное исследование
Пероральное конрастирование малоинформативно, поскольку в силу известных причин не позволяет добиться тугого наполнения кишечника. Основываясь на данном методе, можно сделать общие выводы о моторике тонкой кишки и, иногда, о рельефе слизистой.
Рентгеноконтрастное исследование с использованием малого и тугого наполнения тонкого кишечника требует применения зондового или ретроградного наполнения тонкого кишечника через подвздошную кишку. При использовании тугого контрастирования у ряда больных выявляются расширенные, гипотоничные петли тонкой кишки. Контуры петель становятся гладкими, уплощаются. Перистальтика резко ослабевает или отсутствует, изображение становится статичным.
Биопсия проксимальных отделов тонкой кишки
Показания: позитивный тест с антителами (см. серологическую диагностику), кроме лиц с доказанным на биопсии гепертиформным дерматитом.
Биопсия ДПК проводится кроме того при:
— отчетливых клинических признаках мальабсорбции;
— хронической диарее;
— подозрении на целиакию;
— подозрении на опухоли тонкой кишки;
— подозрении на болезнь Крона с преимущественным поражением тонкого кишечника;
— подозрении на болезнь Уиппла;
— подозрении на лямблиоз;
— подозрении на синдром бактериальной контаминации тонкого кишечника.
Морфологическая диагностика целиакии
Основана на обнаружении признаков двух параллельно происходящих в слизистой оболочке тонкой кишки процессов: атрофии и воспаления.
Атрофия слизистой оболочки при целиакии носит гиперрегенераторный характер. Проявления атрофии: укорочение и утолщение ворсинок, удлинение (гиперплазия) крипт. Важное значение для диагностики целиакии имеет изменение отношения высоты ворсинки к глубине крипты. В норме данное отношение составляет не менее 2:1. Его оценка возможна только при правильной ориентации гистологического препарата, критерием репрезентативности которого является наличие как минимум трех рядом расположенных срезанных продольно ворсинок и крипт.
Для стандартизации патологических заключений при целиакии применяют критерии Marsh (1999).
Классификация гистологической картины целиакии в зависимости от наличия и сочетания признаков в соответствии с модифицированной системой Marsh
Стадия
Гистологические изменения
Повышенная инфильтрация эпителия ворсинок межэпителиальных лимфоцитов (МЭЛ)
Повышенная инфильтрация эпителия ворсинок МЭЛ + гиперплазия (удлинение) крипт (отношение высоты ворсинки к глубине крипты менее 2:1)
Частичная атрофия ворсинок + гиперплазия крипт
Субтотальная атрофия ворсинок + гиперплазия крипт
Тотальная атрофия ворсинок + гиперплазия крипт
Marsh III
В последующих (атрофических) стадиях целиакии происходит постепенное укорочение и расширение ворсинок параллельно с углублением крипт (Marsh IIIA) вплоть до полного исчезновения ворсинок (Marsh IIIC). В подобных случаях строение слизистой оболочки тонкой кишки напоминает толстую кишку.
Для данной стадии также характерны изменения поверхностного эпителия, связанные с его повреждением и попыткой регенерации:
— увеличение размеров клеток;
— базофилия цитоплазмы;
— увеличение размеров ядра;
— просветление ядерного хроматина;
— потеря ядрами базальной ориентации (псевдостратификация эпителия);
— размытость и нечеткость щеточной каемки (может вообще исчезнуть).
Европейское общество педиатрической гастроэнтерологии, гепатологии и питания (ESPGHAN) в 1990 г. пересмотрело критерии установления определенного диагноза целиакии.
Критерии диагностики целиакии (ESPGHAN)
1. Анамнез и клинические проявления, соответствующие целиакии.
2. Результаты серологических скрининговых тестов, соответствующие целиакии.
3. Гистологические находки, соответствующие целиакии (атрофия слизистой оболочки).
4. Явный клинический и серологический ответ на аглютеновую диету.
5. Возраст пациента более 2 лет.
6. Исключены другие клинические состояния, которые могут симулировать целиакию.
Провокационный тест с нагрузкой глютеном
Проводится для уточнения наличия целиакии в тех случаях, когда поставленный ранее диагноз целиакии выглядит сомнительным, при этом пациент находится на аглютеновой диете.
Как правило, провокационный тест может потребоваться в следующих ситуациях:
1. Соблюдение аглютеновой диеты было начато эмпирически до проведения морфологического исследования тонкой кишки и (или) получения результатов серологического тестирования на маркеры целиакии.
2. Диагноз был выставлен в детском возрасте на основании морфологических данных без серологического подтверждения (у детей возможны транзиторные энтеропатии, симулирующие целиакию: белок-индуцированные энтеропатии, обусловленные непереносимостью коровьего молока, сои и др., транзиторная глютеновая интолерантность, постэнтеритный синдром).
Серологическое определение маркеров целиакии и морфологическое исследование тонкокишечной слизистой оболочки необходимо выполнить до начала провокационного теста. Далее пациенту требуется употреблять ежедневно как минимум 10 г глютена (например, 4 кусочка хлеба). Повторные серологическое и морфологическое исследования проводятся через 4-6 недель. Выявление характерных для целиакии изменений, рассматривается как подтверждение диагноза.
Лабораторная диагностика
Общий анализ крови:
— признаки железодефицитной микроцитарной анемии;
— признаки анемии, связанной с дефицитом В12 и/или фолиевой кислоты (крайне редко).
Биохимия:
— гипопротеинемия;
— гипокалиемия;
— гипокальциемия;
— гипомагниемия;
— гипоферментемия.
Изменения выявляются в основном у больных с типичной формой целиакии и выраженной мальабсорбцией.
Серологические тесты отличаются высокой чувствительностью и специфичностью. Все диагностические тесты следует проводить на фоне обычного для пациента рациона питания, так как пища должна содержать глютен.
Вследствие низкой чувствительности и специфичности (70-80%) тест с антиглиадиновыми антителами (AGA-IgA, AGA-IgG) в настоящее время проводить не рекомендуется. Тест на антиретикулиновые антитела также не нашел широкого применения.
1. Определяют: IgA t-TG (антитела к тканевой трансглютаминазе) и IgA EMA (эндомизиальные антитела). Чувствительность аnti-tTG-IgA в диагностике целиакии составляет 91-97%, специфичность близка к 100%.
«Золотым стандартом» серологической диагностики целиакии считается тест EMA-IgA. Его специфичность достигает 100% при чувствительности около 90%. Аnti-tTG-IgA определяют методом иммуноферментного анализа (ELISA). Эти тесты могут оставаться положительными в течение длительного времени (до 1 года) независимо от гистологической картины болезни.
2. Серологические тесты при целиакии у детей младше 5 лет менее надежны.
3. При проведении серологической диагностики особого внимания требуют пациенты, страдающие селективным дефицитом IgA. У таких больных могут не определяться маркеры класса IgA даже при наличии целиакии. В подобных случаях рекомендуется проводить тестирование на anti-tTG, EMA или AGA-IgG.
Дифференциальный диагноз
Осложнения
3. Динамическая кишечная непроходимость.
5. Вторичный остеопороз вследствие снижения всасывания витамина D и кальция.
Лечение
После установления диагноза пациенты должны пройти обучение по оценке симптомов болезни и возможных осложнений, составлению адекватной диеты.
Принципы терапии:
— консультация опытного диетолога;
— образование в отношении болезни;
— пожизненное соблюдение аглютеновой диеты;
— диагностика и лечение нутриционного дефицита;
— долгосрочное наблюдение различными специалистами.
Стойкое нарушение серологических тестов может свидетельствовать об отсутствии приверженности к аглютеновой диете или о непреднамеренном употреблении глютена с пищей.
Пожизненная аглютеновая диета: исключение пшеницы, ржи и ячменя, которые содержат пептиды глютена. Даже небольшие количества глютена нежелательны, т.к. даже употребление глютена в количестве 0,1-2 г/сут. приводит к прогрессированию заболевания.
Прием в пищу овса (который, вероятно, безопасен для большинства пациентов с целиакией) должен быть также ограничен в связи с его возможным загрязнением глютеном во время приготовления пищи.
Строгое определение аглютеновой диеты остается спорным из-за отсутствия точного метода определения глютена в пищевых продуктах и отсутствия научных данных о том, какие их составляющие содержат безопасные количества глютена.
Разрешаются продукты животного происхождения, а также кукурузная, рисовая и соевая мука, овощи, фрукты, ягоды. Иногда необходимо исключить прием лактозы (возможно развитие вторичной лактазной недостаточности).
Медикаментозная терапия
Коррекция витаминной, минеральной недостаточности, остеопороза, включая дефицит железа, кальция, фосфора, фолата, витамина В12 и жирорастворимых витаминов.
При тяжелом течении показаны следующие препараты: кальция глюконат 5-10 г/сут., эргокальциферол 0,01-1 мг/сут. (до 2,5 мг/сут. при выраженной мальабсорбции), железа сульфат 300 мг/сут., фолиевая кислота 5-10 мг/сут., поливитаминные препараты.
Инфузионная терапия: белковые препараты, жировые эмульсии, раствор глюкозы, коррекция водно-электролитного баланса и кислотно-основного равновесия.
Что такое целиакия (непереносимость глютена)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Троицкой И. Н., эндокринолога со стажем в 7 лет.
Определение болезни. Причины заболевания
Основной причиной возникновения целиакии является глютен — белковый компонент злаковых культур: пшеницы, ржи, ячменя. Он, как клейковина, связывает между собой белки этих злаковых культур.
Непереносимость глютена развивается только у людей с генетической поломкой в иммунной системе. В таких случаях продукты с этим компонентом воспринимаются организмом как аллерген, «чужеродный» агент. Он приводит к активации иммунного ответа, который способствует повреждению ворсинок кишечника. Это приводит к уменьшению всасывания питательных веществ, из-за чего у человека с глютеновой непереносимостью не только снижается вес, но и появляется множество других заболеваний, маскирующих основную проблему.
В каких изделиях может содержаться глютен :
Учитывая его широкое применение в качестве «загустителя», глютен также содержат:
Так как глютен входит во множество продуктов, он неизбежно попадает в организм во время еды. От какого именно количества разовьётся целиакия у предрасположенных людей, пока не установлено — каждый случай индивидуален. То, насколько серьёзными будут проявления заболевания, зависит в первую очередь от активности аутоиммунного процесса.
Симптомы целиакии
Иногда все эти симптомы вновь возникают после перенесённых инфекций: кишечного гриппа (ротавирусной инфекции) или респираторных заболеваний. Любая инфекция активирует иммунную систему для борьбы с вирусами и микробами. При целиакии эта иммунная реакция будет неправильной: она будет направлена не только на уничтожение вирусов, но и на поражение слизистой оболочки тонкого кишечника.
Дети постарше жалуются на боли в животе, которые имеют непостоянный, но локализованный характер — они возникают в околопупочной области. У подростков и взрослых пациентов преобладают внекишечные проявления. Клиническая картина целиакии становится стёртой, что значительно усложняет постановку правильного диагноза. Поэтому пациент может годами наблюдаться по поводу других заболеваний, которые на самом деле являются следствием глютеновой непереносимости [1] :
В целом существует несколько специфических симптомов, по которым педиатр может заподозрить наличие непереносимости глютена:
Патогенез целиакии
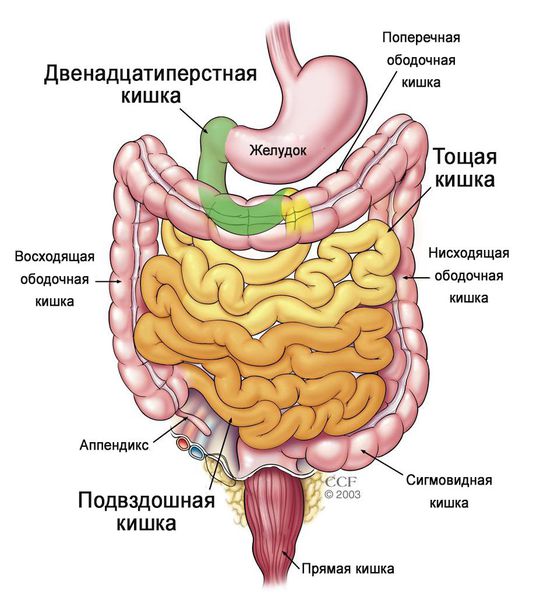
Патогенез заболевания связан с механизмом поражения тонкого кишечника — самого длинного отдела пищеварительного тракта, который включает в себя три отдела: двенадцатиперстную, тощую и подвздошную кишку.
Основной функцией тонкого кишечника является всасывание питательных веществ. Этот процесс в первую очередь происходит на уровне слизистой оболочки. Она состоит из множества складок, которые увеличивают всасываемую поверхность кишечника.
В результате токсического воздействия нарушается структура слизистой оболочки тонкого кишечника, площадь всасываемой поверхности уменьшается. Таким образом, поражается основное место всасывания полезных веществ, из-за чего снижается количество питательных веществ, попадающих в организм. Это в свою очередь нарушает обменные процессы, приводя к дефициту макро- и микронутриентов (биологически значимых элементов), которое сопровождается снижением веса, диареей, рвотой, появлением болей в животе.
Классификация и стадии развития целиакии
В соответствии с клинической картиной и преобладанием в ней кишечных симптомов, типичных для глютеновой непереносимости, выделяют две основные формы заболевания:
Так же, как у любой болезни, у целиакии выделяют периоды заболевания в зависимости от активности процесса:
Осложнения целиакии
Осложнения целиакии чаще всего развиваются у взрослых с атипичной формой целиакии через много лет после начала заболевания. К ним относятся:
Так как генетическая поломка в организме часто поражает не один ген, а сразу несколько, целиакия может сочетаться с другими аутоиммунными и генетическими заболеваниями. К таким патологиям относятся:
Диагностика целиакии
Диагностика проводится при подозрении на целиакию и ассоциированные с ней заболевания, например задержку физического развития, сахарный диабет 1-го типа и др. Очень важно сдавать анализы перед началом безглютеновой диеты, т. е. на фоне обычного питания, при котором появились симптомы. При соблюдении диеты снижается количество специфических антител, что может привести к ложноотрицательным результатам. Это затруднит постановку правильного диагноза.
Также существует анализ на специфические антитела, которые формируются иммунитетом при глютеновой непереносимости:
Лечение целиакии
Так как причина данного заболевания — это глютеносодержащие продукты, нужно не просто ограничить их потребление, а полностью исключить. Заболевание нельзя устранить окончательно, можно только поддерживать организм, поэтому диету необходимо соблюдать постоянно.
Покупая продукты в магазине, пациент с целиакией может ориентироваться на специальный логотип перечёркнутого колоса, размещённый на упаковке товара. Он является зарегистрированной товарной маркой Ассоциации европейских обществ целиакии AOECS. Его могут получить только проверенные продукты, безопасные для людей с глютеновой непереносимостью.
Также на упаковках продуктов можно встретить надпись «без глютена» или похожий по смыслу символ. Иногда они используются как рекламный ход и не гарантируют отсутствие аллергена. В товарах с такой маркировкой может присутствовать «скрытый глютен». С огласно своей рецептуре, его могут содержать следующие продукты:
Прогноз. Профилактика
Расшифровка целиакии
Уважаемые читатели, в рубрике «Практикум» мы продолжаем обсуждение одного из наиболее важных направлений — диетотерапии — как основного метода лечения пациентов. В этом номере предлагаем вашему вниманию серию статей, посвященных нюансам клиники и диагностике наименее изученного аутоиммунного заболевания — целиакии, а также особенностям назначения диетотерапии больным целиакией.
В силу особенностей течения рассматриваемого заболевания диагностика его затруднена. Именно поэтому врачу-диетологу, консультирующему пациента, прежде чем назначить диетотерапию, важно понимать природу возникновения целиакии, особенности клинической картины заболевания и остальные не менее важные нюансы, о которых пойдет речь в этой статье.
Определение
Дефицит ферментов, расщепляющих белки растительного происхождения, ведет к непереносимости белков риса, пшеницы и других злаков и развитию заболевания — целиакии (coeliakia; от греч. koilikos — кишечный, страдающий расстройством кишечника). Это необычное заболевание имеет несколько синонимов: глютеновая болезнь, глютеновая энтеропатия, нетропическая спру, болезнь Ги-Гертера-Гейбнера, англ.: — coeliac disease.
Авторы книги «Секреты питания» (Москва, 2009 г.) Чарльз В. Ван Вэй III, Кэрол Айэротон-Джонс дают следующее определение рассматриваемому заболеванию:
«Целиакия, называемая также „нетропическое спру“ или „глютенчувствительная энтеропатия“, — это болезнь детского возраста, вызываемая реакцией на глютен. Более точно, реакция возникает на глиадин-спирторастворимый компонент глютена. Симптомы появляются с детства и включают диарею, рвоту и острый синдром мальабсорбции. Лечение почти полностью нутриционное и сводится к назначению диеты, свободной от глютена и глиадина».
Немного из истории
По данным ряда исследований, первые упоминания о целиакии как заболевании найдены в работах древнегреческих врачей Аретея из Каппадокии и Целия Аврелиана. Они описали хроническую диарею со стеатореей и назвали болезнь “Morbus coeliacus”.
Первое официальное описание клинической картины целиакии датировано 1888 г. Врач Лондонского Бартоломеевского госпиталя S. J. Gee описал наиболее типичные симптомы целиакии: хроническую диарею, истощение, отставание в физическом развитии и анемию. Первая догадка о связи развития целиакии с непереносимостью белка злаковых глютена и развития диареи принадлежит голландскому педиатру W. Dicke. И только более чем через 50 лет G. Vclver и J. French, воспользовавшись предположением W. Dicke о возможной связи целиакии с употреблением в пищу хлеба, исключили из пищевого рациона детей хлебные злаки и убедились в терапевтическом эффекте такой диеты (Парфенов А. И., 2007).
Выдержки из научных теорий
Ключевым моментом в формировании клинической картины целиакии является воздействие глютена на слизистую оболочку тонкой кишки, развитие заболевания реализуется по одному из трех механизмов:
Нормальная слизистая оболочка не может быть повреждена при контакте с глиадиновой фракцией глютена (клейковиной) белка, содержащейся в злаках (пшенице, ржи, ячмене, овсе), так как содержит пристеночные ферменты, расщепляющие его на нетоксические фракции: глутаминилпролил и глицилпролиндипептидазу, гаммааглютаминилтранспептидазу, пирролидонилпептидазу. У больных целиакией эти ферментативные реакции не происходят до конца из-за наличия дефектов разного уровня. Происходит реализация токсического воздействия глиадина и продуктов частичного гидролиза на поверхностный эпителий слизистой оболочки тонкого кишечника.
Рядом научных исследований доказано, что у большинства больных целиакией обнаруживаются антитела (IgA) к глиадину в слизистой тонкого кишечника. Титр антител к глиадину начинает снижаться при проведении безглютеновой диеты. В то же время при морфологических исследованиях установлено значительное увеличение плазмоцитарной инфильтрации подслизистого слоя и содержания плазматических клеток, содержащих IgA, M, G и большое количество межэпителиальных лимфоцитов. В плазме крови, кишечном содержимом, кале обнаруживаются антиретикулярные антитела. Наличие наследственной предрасположенности у 80–90 % пациентов (HLA-B8 и HLA-DR3) определяет формирование по меньшей мере двух генетических дефектов. Генетически кодируемые белки ответственны за запуск продукции антител.
При отсутствии ферментов глютен не расщепляется, что приводит к повреждению энтероцитов за счет непосредственного воздействия глютена и за счет антигенной стимуляции слизистой продуктами его неполного расщепления. Этот механизм запуска патологического процесса на слизистой тонкого кишечника ведет к значительному слущиванию эпителия и гибели энтероцитов на фоне повышенной пролиферации эпителиального покрова крипт, не происходит полная компенсация клеток покровного эпителия, в результате чего снижается высота ворсинок, формируется картина вначале порциальной, субтотальной и далее тотальной атрофии ворсинок.
Важно, что в процессе атрофии ворсинок эпителий, выстилающий ворсинки, уплощается, количество бокаловидных энтероцитов резко уменьшается. Ускоренное новообразование клеток приводит к тому, что на поверхности ворсинок оказываются незрелые энтероциты, в которых содержится меньше ферментов, чем в высокодиффенцированном эпителии. Недостаточность протеолитических ферментов в эпителии тонкой кишки больных целиакией доказана гистохимическими и биохимическими методами. Таким образом, в результате повреждения энтероцитов ворсинок глютеном происходит повышенное отторжение клеток в просвет кишки и реактивное по принципу отрицательной обратной связи ускорение регенерации. Это приводит к тому, что на поверхности ворсинок оказываются незрелые энтероциты, неспособные выполнять свои специфические функции.
В результате развивается классическая клиническая картина синдрома мальабсорбции.
Шифр по МКБ-10:
XI. Болезни органов пищеварения.
K90–К93. Другие болезни органов пищеварения.
К90. Нарушения всасывания в кишечнике.
K90.0. Целиакия. Глютенчувствительная энтеропатия. Идиопатическая стеаторея. Нетропическая спру.
Синдром мальабсорбции
Синдром мальабсорбции характеризуется нарушением или неадекватным всасыванием питательных веществ в пищеварительном тракте и включает в себя ряд взаимосвязанных симптомов: диарею, потерю массы тела, белковую недостаточность и признаки гиповитаминоза. Степень проявления и выраженность перечисленных выше симптомов зависит от степени дефицита питания, вовлеченности органов и систем в патологический процесс и нарушения обменных процессов. В связи с этим синдром мальабсорбции может клинически проявляться различной клиникой: от легких проявлений дисфункции желудочно-кишечного тракта с минимальными проявлениями гиповитаминоза до тяжелых расстройств всасывания и метаболических нарушений с потерей массы тела.
Диарея при мальабсорбции может развиваться по двум направлениям: осмотическому и секреторному.
Процесс развития диареи при мальабсорбции профессор Джозеф М. Хендерсон в своем труде «Патофизиология органов пищеварения» (2012 г.) описывает следующим образом:
«Диарея при мальабсорбции развивается преимущественно по принципу осмотического механизма, однако при некоторых общих заболеваниях тонкой кишки может присоединяться и секреторный компонент.
Осмотическая диарея является характерным признаком нарушения всасывания углеводов, так как наличие в просвете кишечника непереваренных и невсосавшихся углеводов за счет их осмотической активности способствует выходу в просвет кишки воды. Более того, когда углеводы попадают в толстую кишку, они метаболизируются бактериями до жирных кислот с короткой цепью, повышающих осмоляльность содержимого толстой кишки, что также сопровождается выходом воды в просвет кишечника. Жирные кислоты с короткой цепью абсорбируются колоноцитами, и это несколько снижает осмоляльность в просвете кишки. Однако, если поступление углеводов в толстую кишку превышает способность микроорганизмов их метаболизировать, углеводы остаются в просвете кишки как осмотически активные вещества. Нарушение всасывания углеводов часто сочетается с метеоризмом из-за ферментативного расщепления углеводов микроорганизмами».
При осмотической диарее повреждается функционально активная поверхность апикальных ворсинок тонкой кишки, что приводит к уменьшению абсорбционной поверхности слизистой оболочки и дисахаридаз, Nа+, К+, АТФ-азы, глюкозостимулированного транспорта. Сохранение в просвете кишечника осмотически активных дисахаридаз приводит к задержке жидкости в просвете тонкой кишки и нарушению реабсорбции воды и солей.
В своей книге «Патофизиология органов пищеварения» (2012 г.) Джозеф М. Хендерсон рассказывает о заболеваниях, способствующих развитию диареи с секреторным компонентом:
«Заболевания, при которых поражается слизистая оболочка тонкой кишки, также вызывают диарею с секреторным компонентом. Например, при повреждении кончиков ворсинок оставшиеся интактными крипты компенсаторно гиперплазируются. Недифференцированные клетки крипт не имеют необходимых дисахаридаз и пептидаз или натрийсвязанных транспортеров, служащих для абсорбции ряда веществ. Клетки также теряют Na+-, H+-антипорт и Сl-, НСО3-антипорт на апикальных участках мембран энтероцитов. Однако эти клетки остаются способными секретировать хлор, благодаря наличию Na+-, K+-ATФ- азы и Na+-, K+-, Cl-котранспортера. Общим результатом является нарушение абсорбции натрия и воды и усиленная секреция осмотически активных хлоридов, приводящая к секреторной диарее».
Схема 1. Симптомокомплекс синдрома мальабсорбции
Распространенность заболевания
Оцененная по клиническим данным, распространенность целиакии составляет 1 на 1000– 10 000 человек (Mylotte М. et al, 1973; Van Stikum J. et al, 1982; Logan R. F. A. et al, 1986). Исследования с использованием серологических и гистологических методов определили распространенность целиакии в отдельных странах значительно выше, а именно 1 на 100–200 человек (Maeki М. et al, 2003; Shahbazkhani В. et al, 2003; Tomassini A. et al, 2004; Tatar G. et al, 2004; Ertekin V. et al, 2005).
Источник: «Скрининг населения Центрального региона России на антитела класса IgA к тканевой трансглутаминазе и применение данного метода обследования для диагностики целиакии у детей», Стройкова М. В., кандидатская диссертация, Москва, 2007 г.
Снижение массы тела
Один из ключевых симптомов развития и прогрессирования синдрома мальабсорбции — снижение массы тела. Основной причиной снижения массы тела является уменьшение поступления в организм основных пищевых компонентов. Главную роль в этом играет белок. Так как при недостаточном поступлении белка организм начинает использовать резервный белок и белок скелетной мускулатуры, внутренних органов.
Профессор Джозеф М. Хендерсон в своей книге «Патофизиология органов пищеварения» (2012 г.) объясняет причины снижения массы тела:
«Причины снижения массы тела при мальабсорбции различны. Характерные для мальабсорбции длительные заболевания слизистой оболочки кишечника вызывают анорексию и, как следствие, общее истощение. При нарушении всасывания питательных веществ в желудочно-кишечном тракте органы начинают использовать запасы жиров и белков организма, что приводит к уменьшению массы тела. Поступление питательных веществ из-за мальабсорбции не соответствует потере запасов, возникает отрицательный баланс между поступлением и потреблением калорий. Несмотря на компенсаторную гиперфагию, у больных наблюдается потеря массы тела».
Белковая недостаточность
Другой основной симптом при развитии синдрома мальабсорбции — белковая недостаточность. Естественный барьер слизистой оболочки кишечника нарушается, что приводит к свободному выходу белков из интерстициального пространства через энтероцит в просвет кишечника. Характерно, что синтез альбуминов в печени не успевает восстановить потери альбуминов плазмы крови. Параллельно в связи с развитием повреждения эпителия слизистой оболочки нарушаются пристеночные процессы пищеварения, гидролиз и всасывание аминокислот, приостанавливается процесс синтеза альбуминов. Проявлением снижения синтеза белков, альбуминов является развитие гипопротеинемии с клиническими проявлениями отека и асцита. В связи с нарушениями структуры слизистой оболочки формируется обструкция лимфатических сосудов, что усиливает потерю белков и лимфы через кишечник за счет повышения гидростатического давления и увеличения интерстициального пространства.
Гиповитаминозы
Развитие гиповитаминозов как проявление нарушения всасывания жирорастворимых витаминов A, D, Е и К происходит по таким же механизмам, как и всасывание жиров пищи. Нарушение образования мицелл, отсутствие щелочной среды в просвете кишечника, нарушение метаболизма в энтероцитах и лимфооттока приводит к нарушению всасывания (Джозеф М. Хендерсон, 2012 г.). Поражение слизистой оболочки тонкого кишечника приводит к нарушению всасывания витаминов.
О механизме нарушения всасывания фолатов (солей фолиевой кислоты) подробно рассказывает Джозеф М. Хендерсон в монографии «Патофизиология органов пищеварения» (2012 г.):
«Нарушение всасывания фолатов встречается при заболеваниях тощей кишки, так как в ней на апикальной мембране энтероцитов имеется фермент конъюгаза. Потеря неповрежденных энтероцитов исключает нормальный метаболизм фолатов и образование 5-метилтетрагидрофолиевой кислоты (многие препараты, такие как метотрексат, способны нарушить образование тетрагидрофолиевой кислоты). Это приводит к нарушению всасывания фолатов.
Для всасывания витамина В12 необходимо наличие внутреннего фактора и интактного состояния слизистой оболочки подвздошной кишки. Нарушения образования соединения ВФ–В12 в двенадцатиперстной кишке (панкреатическая недостаточность, низкий рН в просвете кишки, снижение уровня ВФ) или связывания ВФ–B12 в подвздошной кишке (резекция или воспаление) приводят к нарушению всасывания витамина B12.
Железо абсорбируется в виде геминового или негеминового железа. Нарушение перевода железа из трехвалентного в двухвалентное, вызванное снижением кислотности желудочного сока или развитием дуоденита, а также быстрым сбросом химуса, может приводить к нарушению всасывания. Поскольку геминовое железо всасывается лучше негеминового, его прием препятствует развитию железодефицита в этих случаях».
На уровне генетики
В настоящее время проведена более углубленная расшифровка заболевания целиакии, знание которой очень важно при сборе анамнеза у пациента при проведении дифференциального диагноза неспецифических энтеритов и целиакии.
Об одном из подходов изучения генетических факторов риска при целиакии рассказывает Е. В. Лошкова в своем научном труде — автореферате кандидатской диссертации «Генетические и иммунологические механизмы формирования клинических проявлений целиакии у детей и подростков и их значение в реабилитации» (2009 г.):
«Несмотря на то что заболевание впервые было описано в 1888 г. (Gee S. J.), на сегодняшний день отношение диагностированных к недиагностированным случаям целиакии в Европе находится на уровне от 1:5 до 1:13 (Bai J. et al., 2005). Клиническая картина заболевания настолько полиморфна, что лишь 20–30 % пациентов имеют классические симптомы болезни, в то время как почти 70–80 % случаев целиакии остаются не диагностированными (Hill I. et. al., 2006). Одним из подходов изучения генетических факторов риска при мультифакториальных заболеваниях, к которым относится и целиакия, является концепция молекулярной генетики о пяти ассоциациях полиморфных генетических маркеров с предрасположенностью или устойчивостью к развитию патологии (Sollid L. M. et. al., 2007). Эти специфичные для конкретной патологии маркеры могут быть выявлены задолго до ее клинической манифестации, что позволит определить группы риска, организовать их мониторинг, а в случае необходимости назначить превентивную терапию (Sturges R. P. et al., 2001; Srinivasan U. et al., 2008). Особый интерес представляет изучение генов-кандидатов, если продукт их экспрессии (фермент, гормон, рецептор) прямо или косвенно участвует в развитии патологического процесса (Kim C. Y. et. al., 2004)».
В чем особенность с позиции медицинской генетики формирования целиакии более чем у 95 % больных? Присутствие генов (одного из двух типов HLA-DQ), вызывающих повышение риска возникновения целиакии, приводит к тому, что рецепторы этих генов образуют с пептидами глиадина более сильную связь, чем другие антиген-представляющие рецепторы (antigen-presenting receptor). Именно эти формы рецептора активируют Т-лимфоциты и, соответственно, весь каскад реакций аутоиммунного процесса.
Хотите больше новой информации по вопросам диетологии?
Оформите подписку на информационно-практический журнал «Практическая диетология»!
Особенности этиологии и патогенеза развития целиакии
Целиакия, являясь хроническим генетически детерминированным заболеванием, характеризуется стойкой непереносимостью глютена (злакового белка) с развитием гиперрегенераторной атрофии слизистой оболочки тонкой кишки и связанного с ней синдрома мальабсорбции. Основную роль в запуске всех патологических реакций при развитии клинической картины целиакии отводится началу приема в составе пищевого рациона белков растительного происхождения.
Группа белков-проламинов, входящих в ряд пищевых продуктов, таких как пшеница (глиадин), ячмень (гордеин), рожь (секалин), кукуруза (зейн), овес (минимальное количество авенина), отвечает за развитие иммунных реакций при целиакии. Главной особенностью этих белков является высокая устойчивость к протеазам и пептидазам кишечника. Таким образом, при попадании в кишечник данные виды белков не могут подвергаться естественному гидролизу и участвовать в пристеночном пищеварении в качестве субстрата для всасывания. В то же время при стимулировании α-глиадином клеток мембран энтероцитов кишечника развивается нарушение плотных контактов клеток, мембраны которых объединены вместе для формирования практически непроникающего для жидкости барьера, что позволяет пептидам, содержащим от трех аминокислот и более, попадать в организм человека.
Развитие иммунопатологической реакции вызывает аутоиммунный воспалительный процесс, вызванный Т-клетками, приводит к нарушению структуры и функций слизистой оболочки тонкой кишки и к развитию лимфоидной инфильтрации подслизистого слоя, атрофии слизистой, нарушению всасывания и снижению способности организма усваивать питательные вещества, минералы и жирорастворимые витамины А, D, E и K. Как правило, развивается вторичный синдром лактазной недостаточности.
Риск формирования целиакии
В большинстве случаев у больных целиакией определяются антитела к тканевой трансглутаминазе. Тканевая трансглутаминаза меняет пептиды клейковины на форму, которая вызывает более эффективную иммунную реакцию. В результате данных реакций образуется устойчивый ковалентно связанный комплекс глиадина и трансглутаминазы. Эти комплексы вызывают первичный иммунный ответ, в результате которого образуются аутоантитела против трансглутаминазы.
Результаты биопсии слизистой оболочки тонкого кишечника у пациентов, у которых подозревали целиакию, показывают, что наличие аутоантител свидетельствует о высоком риске формирования целиакии. Глиадин может быть ответственным за первичные проявления целиакии, тогда как наличие антител к трансглутаминазе является критерием появления вторичных эффектов, таких как аллергические реакции и вторичные аутоиммунные заболевания.
Также установлено, что у большинства больных целиакией антитела к трансглутаминазе могут распознавать ротавирусный белок VP7. Эти антитела стимулируют пролиферацию моноцитов, именно поэтому ротавирусная инфекция может объяснить первоначальную причину процесса пролиферации иммунных клеток. Доказано, что на начальном этапе ротавирусное повреждение кишечника приводит к атрофии ворсинок и может провоцировать активацию кросреакции организма, при которой производятся анти-VP7.
Источник: www.vse-pro-geny.ru
Морфологическая картина целиакии
Характерной особенностью развития морфологических изменений слизистой оболочки при целиакии является сочетание процессов атрофии ворсинчатого эпителия и воспалительного процесса в подслизистом слое. Атрофия слизистой оболочки носит при целиакии гиперрегенераторный характер и проявляется, наряду с укорочением и утолщением ворсинок, удлинением и гиперплазией крипт.
Воспалительная инфильтрация слизистой оболочки характеризуется инфильтрацией поверхностного эпителия лимфоцитами и лимфо-плазмоцитарной инфильтрацией собственной пластинки слизистой оболочки. Одним из важных признаков воспаления при целиакии является повышение содержания межэпителиальных лимфоцитов в ворсинках и интраэпителиальный лимфоцитоз. Среди клеток, инфильтрирующих как собственную пластинку слизистой оболочки, так и эпителий, в достаточно большом количестве встречаются нейтрофилы.
Схема 2. Морфогенез целиакии
Клиническая картина
Для клинической симптоматики, развивающейся при целиакии, характерны симптомокомплексы заболевания тонкого кишечника, характеризующиеся поражением слизистой оболочки. Поражение слизистой оболочки вызывается непосредственно глютеном, растительным белком, содержащимся в злаковых и бобовых.
Проявление заболевания характерно в раннем детском возрасте при добавлении в пищевой рацион каш. Развитие заболевания возможно и в более старшем возрасте.
О наиболее значимых факторах проявления целиакии у детей рассказывает М. О. Ревнова в докторской диссертации «Целиакия у детей: клинические проявления, диагностика, эффективность безглютеновой диеты» (2005 г.):
«Манифестация симптомов целиакии произошла у 29,3 % обследованных детей в возрасте до 1 года жизни; у 33,3 % — в возрасте от 1 до 2 лет; обращает на себя внимание, что у 21,8 % детей заболевание развилось в возрасте 9 лет и старше.
Наиболее значимым фактором, содействующим развитию целиакии, следует признать раннее введение глютенсодержащих продуктов (манифестация целиакии произошла у 29,3 % обследованных в возрасте до 1 года). Острая кишечная инфекция, верифицированная посевами, перенесенная в возрасте до года (9,7 % пациентов), может явиться провоцирующим фактором манифестации целиакии и, возможно, влияет на развитие тяжелой формы заболевания.
Тяжесть течения целиакии проявляется частотой стула в сутки, количеством стула, наличием вздутия живота, рвотой, болью в костях, морфометрическим показателем соотношения «длина ворсинки – глубина крипты» в биоптате слизистой оболочки 12-перстной кишки».
Степень выраженности клинической симптоматики зависит от степени распространения процесса в слизистой оболочке тонкого кишечника и степени нарушения всасывания пищевых нутриентов.
Развивающиеся вслед за активацией иммунно-патологических реакций патофизиологические нарушения являются следствием нарушения всасывания основных питательных веществ. Эти нарушения влекут за собой развитие прогрессирующей недостаточности питания, замедление роста, нарушение функционирования и проходимости кишечника и, как следствие, нарушение процессов пищеварения. Характерны увеличение объема испражнений, значительное их разжижение, анемия, гиповитаминоз, гипопротеинемия, остеопороз. При формировании полной атрофии слизистой оболочки тонкого кишечника, атрофии ворсинок значительно нарушается абсорбция белков, жиров, углеводов, витаминов, микро- и макроэлементов.
До настоящего времени целиакия остается наименее изученным аутоиммунным заболеванием, основным проявлением которого является нарушение всасывания — синдром мальабсорбции. Данные вызывают развитие нарушений всех видов обмена, в свою очередь, формируется клинический полиморфизм, затрудняя диагностику заболевания. Как правило, у больных достаточно быстро развивается белково-энергетическая недостаточность (Ревнова М. О., 2004; Бельмер С. В. и соавт., 2004; Maiuru L. et al., 2005; Hoffenberg E. J. et al., 2007).
Гистологическая классификация целиакии
Патологические изменения, характерные для целиакии тонкой кишки, классифицируются согласно классификации, предложенной М. Маршал в 1992 г.
В зависимости от наличия и сочетания признаков гистологическая картина целиакии классифицируется в соответствии с модифицированной системой Marsh, представленной в таблице.
| Стадия | Гистологические изменения |
| Marsh I | Повышенная инфильтрация эпителия ворсинок МЭЛ |
| Marsh II | Повышенная инфильтрация эпителия ворсинок МЭЛ + гиперплазия (удлинение) крипт (отношение высоты ворсинки к глубине крипты менее 2:1) |
| Marsh IIIA | Частичная атрофия ворсинок + гиперплазия крипт |
| Marsh IIIB | Субтотальная атрофия ворсинок + гиперплазия крипт |
| Marsh IIIC | Тотальная атрофия ворсинок + гиперплазия крипт |
Marsh I. Инфильтрация эпителия ворсинок лимфоцитами — самое раннее гистологическое проявление глютеновой энтеропатии. Инфильтрация эпителия лимфоцитами сохраняется на всех стадиях целиакии, однако на поздних (атрофических) стадиях (Marsh IIIB–C) оценить содержание МЭЛ в эпителии бывает достаточно сложно из-за выраженной регенераторно-дистрофической псевдостратификации эпителия.
Marsh II. Первое проявление гиперрегенераторной атрофии слизистой оболочки тонкой кишки — удлинение крипт (гиперпластическая стадия целиакии). На данной стадии отношение длины ворсинки к глубине крипты уменьшается до 1:1. Параллельно с удлинением крипт происходит некоторое расширение ворсинок. Инфильтрация эпителия лимфоцитами сохраняется. Оценка отношения длины ворсинки к глубине крипты должна производиться только в правильно ориентированном препарате.
Marsh III. В последующих (атрофических) стадиях целиакии происходит постепенное укорочение и расширение ворсинок параллельно с углублением крипт (Marsh IIIA) вплоть до полного исчезновения ворсинок (Marsh IIIC). В таких случаях строение слизистой оболочки тонкой кишки напоминает толстую кишку. Для этой стадии также характерны изменения поверхностного эпителия, связанные с его повреждением и попыткой регенерации: увеличение размеров клеток, базофилия цитоплазмы, увеличение размеров ядра, просветление ядерного хроматина, потеря ядрами базальной ориентации (псевдостратификация эпителия), размытость и нечеткость щеточной каемки (может вообще исчезнуть).
Источник: «Клинико-морфологическая диагностика целиакии», Горгун Ю. В., Портянко А. С., журнал «Медицинские новости», № 10, 2007.
Нарушение белкового обмена
При развитии целиакии у больных формируется белково-энергетическая недостаточность, клинические проявления которой являются основой клинической картины формирующихся осложнений и причиной хронизации патологического процесса. Большую роль играет при этом формирование дефицита белка. Основой своевременной коррекции белково-энергетической недостаточности является только обеспечение белкового рациона пищевыми продуктами с высокой биологической ценностью, не содержащими белки группы проламинов.
Схема 3. Патогенез формирования клинической картины целиакии
Особая роль белка
В составе пищевого рациона в течение суток поступают белки различного происхождения — животного и растительного. Именно это и является причиной полиэтиологичности нарушений белкового обмена. В зависимости от развивающихся дефектов формируются ограничения поступления экзогенных белков при полном или частичном голодании, при низкой биологической ценности пищевых белков, дефиците незаменимых аминокислот (валина, изолейцина, лейцина, лизина, метионина, тиронина, триптофана, фенилаланина, гистидина, аргинина), нарушении всасывания. Следствием указанных нарушений часто является вторичная (или эндогенная) белковая недостаточность с характерным отрицательным азотистым балансом.
При длительной белковой недостаточности резко нарушается биосинтез белков в различных органах, что ведет к патологическим изменениям всех видов обмена веществ. Особенно тяжело проявляется белковая недостаточность в детском возрасте. Белковая недостаточность может развиться и при достаточном поступлении белков с пищей, но при нарушении всасывания белка в тонком кишечнике. При целиакии недостаточное всасывание белка обусловлено нарушением как расщепления, так и всасывания. Дефицит ферментов, расщепляющих белки растительного происхождения, ведет к непереносимости белков риса, пшеницы и других злаков и развитии целиакии. Причинами нарушения всасывания аминокислот являются повреждения стенки тонкого кишечника (отек слизистой оболочки, воспаление), что обусловливает нарушение (дисбаланс) соотношения аминокислот в крови и нарушение синтеза белка в целом, поскольку незаменимые аминокислоты должны поступать в организм в определенных количествах и соотношениях. Недостаточное переваривание белка в верхних отделах желудочно-кишечного тракта сопровождается увеличением перехода продуктов его неполного расщепления в толстый кишечник и усилением процесса бактериального расщепления аминокислот. Это вызывает увеличение образования ядовитых ароматических соединений (индола, скатола, фенола, крезола) и развитие общей интоксикации организма этими продуктами гниения.
В книге «Основы патохимии» (Санкт Петербург, 2001 г.) авторы А. Ш. Зайчик, Л. П. Чурилов описывают механизм патологических процессов:
«Имеются данные о наличии у пациентов изначальной недостаточности конечных ферментов переваривания пептидов из состава глиадина (Л. Н. Валенкевич, 1984 г.). Не разрушаясь до конца, эти пептиды захватываются антигенпредставляющими элементами и презентуются лимфоцитами, что ведет к сенсибилизации слизистой оболочки. Надо учесть лектиноподобные потенции злаковых белков как поликлональных иммунностимуляторов, которые, подобно фитогемагглютининам, могут стимулировать сразу многие клоны лимфоидных клеток».
Наиболее важными для хронизации патологических процессов и развития осложнений являются изменения в биосинтезе белков органов и крови, приводящие к сдвигу соотношений отдельных фракций белков в сыворотке крови. Развитие при целиакии гипопротеинемии сопровождается, как правило, серьезными сдвигами в гомеостазе организма (нарушением онкотического давления, водного обмена). Значительное уменьшение синтеза белков, особенно альбуминов и гамма-глобулинов, ведет к резкому снижению сопротивляемости организма к инфекциям, снижению иммунологической устойчивости.
Схема 4. Патогенез формирования белково-энергетической недостаточности при целиакии
Диагностика недостаточности питания
Степень недостаточности питания при целиакии необходимо оценивать по показателям массы тела, выраженным в стандартных отклонениях от средней величины для эталонной популяции. Отсутствие прибавки массы тела у детей или свидетельство снижения массы тела у детей или взрослых при наличии одного или более предыдущих измерений массы тела является индикатором недостаточности питания.
Если масса тела индивида ниже среднего показателя для эталонной популяции, то тяжелую недостаточность питания с высокой степенью вероятности можно предположить тогда, когда наблюдаемое значение на 3 или более стандартных отклонений ниже среднего значения для эталонной группы.
Недостаточность питания средней степени, если наблюдаемая величина на 2 или более, но менее чем на 3 стандартных отклонений ниже средней величины, и легкая степень недостаточности питания, если наблюдаемый показатель массы тела на 1 или более, но менее чем на 2 стандартных отклонения ниже среднего значения для эталонной группы.
Схема 5. Типичная картина целиакии
Клиническая картина целиакии
Для типичной картины целиакии характерно развитие синдрома мальабсорбции (нарушение всасывания), включающего хроническую диарею, полифекалию, метеоризм, прогрессирующее снижение массы тела, гипопротеинемию, признаки дефицита витаминов и микроэлементов.
Первые симптомы заболевания могут появиться в раннем детском возрасте, чаще к концу первого года жизни и на 2–3-м году. Это напрямую связано с появлением в пищевом рационе ребенка продуктов, содержащих глютен. Клиническая картина заболевания также может проявиться несколько позже, через несколько месяцев после включения в состав пищи хлеба, каш, содержащих глютен. Первым клиническим симптомом заболевания является диарея, которая не купируется обычными методами лечения: антибактериальной терапией, эубиотиками, пробиотиками. Частота жидкого стула может быть от 1 раза в день до 4–6. Стул достаточно обильный, кашицеобразной формы, сероватого цвета, с жирным блеском, неприятным запахом с переходом на водянистый стул. В период обострения появляется рвота, интоксикация, обезвоживание. Наблюдается усиленная потеря с каловыми массами и рвотным содержимым калия, магния и кальция, развивается гипопротеинемия и гипогликемия.
В межприступный период поносы могут чередоваться с запорами.
При типичном течении заболевания имеет место прогрессирующая гипотрофия, со снижением мышечной массы тела и развитием дистрофических изменений внутренних органов, увеличивается живот. В отдельных случаях внешний вид больного напоминает пациента с врожденной миопатией, выделяется большой и отвисший живот, при пальпации отмечается урчание, пальпируются вздутые петли тонкого и толстого кишечника. Данный вид больного связан с нарушением перистальтики кишечника, скоплением в петлях кишки жидкого содержимого (псевдоасцит). Характерно нарушение аппетита вплоть до полной анорексии. Изменяется поведение больного, пациенты становятся раздражительными, капризными, замкнутыми. При длительном протекании болезни у детей прогрессирует клиническая картина рахита, возможно изменение пальцев, по типу «барабанных палочек».
Л. С. Орешко, автор докторской диссертации «Целиакия взрослых: особенности патогенеза, клинических проявлений, диагностики, лечения и профилактики осложнений» (Санкт-Петербург, 2009 г.), определяет варианты клинического течения заболевания:
«Выделяется четыре варианта клинического течения заболевания: преобладание диареи, преобладание запоров, преобладание внекишечных проявлений и бессимптомное течение. Клиническая гетерогенность заболевания характеризуется развитием у больных гастроэнтерологической патологии: хронического гастродуоденита (у 97,9 %), дискинезии желчевыводящих путей (у 69,7 %), эрозивного бульбита (у 34,0 %)».
В детском возрасте без проведения лечения заболевание быстро прогрессирует, характерна выраженная гипотрофия, анемия, клинические проявления гиповитаминозов: хейлит, глоссит, ангулярный стоматит, кератомаляция, кожные петехии. Со стороны желудочно- кишечного тракта быстро формируется хронический гастрит, дисбактериоз. Развитие белково-энергетической недостаточности, как правило, сопровождается выраженной гипопротеинемией и безбелковыми отеками. Симптомы рахита сопровождаются развитием спазмофилии и остеопороза, могут быстро формироваться переломы. Характерно отставание в массе тела и росте, часто присоединяется инфекция, характерно развитие осложнения целиакии в виде формирования мегаколона, кишечной непроходимости, инвагинации.
Классы МКБ-10. Недостаточность питания (E40–E46)
E40. Квашиоркор.
Тяжелое нарушение питания, сопровождаемое алиментарными отеками и нарушениями пигментации кожи и волос. Исключен: маразматический квашиоркор (E42).
E41. Алиментарный маразм.
Тяжелое нарушение питания, сопровождающееся маразмом. Исключен: маразматический квашиоркор (E42).
E42. Маразматический квашиоркор.
Тяжелая белково-энергетическая недостаточность (как в Е43): промежуточная форма с симптомами квашиоркора и маразма.
E43. Тяжелая белково-энергетическая недостаточность неуточненная.
Тяжелая потеря массы тела у детей или взрослых или отсутствие прибавки массы тела у ребенка, которые приводят к тому, что выявляемая масса тела оказывается как минимум на 3 стандартных отклонения ниже среднего показателя для эталонной группы (или подобное снижение массы тела, отраженное другими статистическими методами). Если в распоряжении имеются данные лишь однократного измерения массы тела, то о тяжелом истощении с большой степенью вероятности можно говорить, когда выявленная масса тела на 3 или более стандартных отклонений ниже среднего показателя для эталонной группы населения. Голодный отек.
E44. Белково-энергетическая недостаточность умеренной и слабой степени.
E45. Задержка развития, обусловленная белково-энергетической недостаточностью.
Алиментарная: низкорослость (карликовость), задержка роста, задержка физического развития вследствие недостаточности питания.
E46. Белково-энергетическая недостаточность неуточненная.
Недостаточность питания БДУ. Белково-энергетический дисбаланс БДУ.
Течение целиакии может быть атипичным. Кишечная симптоматика либо не выражена, либо отсутствует. Ведущими в клинической картине становятся внекишечные проявления, которые могут характеризоваться совершенно различными по патогенезу симптомами. На первый план может выступать постоянная усталость, слабость, быстрая утомляемость или задержка полового созревания, бесплодие и т. д. Данные симптомы не связаны между собой, но основным диагностическим критерием является отсутствие причин развития данных симптомокомплексов.
Несмотря на то что все представленные в схеме 6 симптомокомплексы не являются специфичными для целиакии, ни в отдельности, ни в сочетании они не являются диагностическими критериями заболевания. При наличии гематологических, неврологических, метаболических, гинекологических, гастроинтестинальных, психиатрических, дерматологических проявлений необходимо провести дифференциальный диагноз с целиакией, в случае, если отсутствуют другие патологические состояния, объясняющие имеющуюся симптоматику.
В настоящее время также определены группы риска, в которые входят лица, имеющие более высокую, чем в общей популяции, вероятность развития целиакии, группы риска, указанные в рекомендациях Всемирной гастроэнтерологической организации (OMGE).
Пациентам, имеющим клинические симптомы, позволяющие подозревать целиакию, а также лицам из групп риска показано проведение сероиммунологического тестирования на маркеры целиакии.
М. О. Ревнова в своей докторской диссертации обращает внимание на особенности формирования диагноза:
«В связи со сложностью установления диагноза целиакии необходима этапность в формировании диагноза с использованием клинико-лабораторного этапа, биохимического (определения АГА IgA, IgG, tTG), инструментального (биопсии слизистой оболочки 12-перстной кишки и морфометрии биоптата) и дополнительного (определения генетической предрасположенности по данным HLA DQ2, DQ8) и глютеновой провокации.
Клинико-лабораторный этап диагностики малосимптомных форм заболевания предполагает наличие трех основных симптомов и двух основных и двух и более дополнительных, помогая заподозрить целиакию. В случае манифестных форм заболевания требуется сумма диагностических коэффициентов 30 и более, что указывает на вероятность целиакии и предполагает обращение ко II, III и IV этапу алгоритма обследования.
Определенной группе детей требуется проведение провокации глютеном. С целью ужесточения показаний к проведению провокации мы выработали правила нагрузочных проб глютеном, что, по нашему мнению, снизит необоснованность данного мероприятия у больных целиакией и вред, им наносимый.
Группа риска, подлежащая обследованию для исключения целиакии, включает в себя детей с сочетанной патологией ЖКТ, костной, нервной систем, проявлениями белково-витаминно-минеральной недостаточности».
Таблица 1. Группы риска по целиакии в соответствии с рекомендациями OMGE
| Группа риска | Частота развития целиакии, % |
| Родственники первой и второй степени родства | 5–15 |
| Синдром Дауна | 12 |
| Аутоиммунные болезни щитовидной железы | 5 |
| Сахарный диабет 1-го типа | 5–6 |
| Лимфоцитарный колит | 15–27 |
| Синдром хронической усталости Хронический активный гепатит Синдром раздраженной кишки | 2 |
Источник: www.omge.org
Схема 6. Клинические атипичные проявления целиакии
Диагностика целиакии
В ряде случаев клинические проявления целиакии могут быть неспецифичными и для того, чтобы заподозрить целиакию, необходимо провести ряд исследований. Одним из классических признаков целиакии является реакция организма на исключение из диеты глютена или, наоборот, на его введение в рацион. Подтверждение этой реакции является ключевым моментом установления определенного диагноза глютеновой энтеропатии. В 1970 г. Европейское общество детской гастроэнтерологии, гепатологии и питания (ESPGHAN) разработало рекомендации по трехэтапной диагностике целиакии, которые использовались как у детей, так и у взрослых.
На первом этапе при наличии характерных для целиакии гастроинтестинальных проявлений (диареи, вздутия живота, низкого веса) и патологических результатов неспецифических скрининговых тестов (например, D-ксилозного теста, определения мальабсорбции жира) необходимо проведение биопсии слизистой оболочки тонкой кишки и при выявлении атрофии ворсинок назначение аглютеновой диеты.
На втором этапе через 12 месяцев соблюдения аглютеновой диеты необходимо провести повторную биопсию, и в случае нормализации гистологической картины, а также исчезновения клинических проявлений и отклонений скрининговых тестов пациента проводится перевод на глютенсодержащий рацион.
Третий этап заключается в оценке реакции на введение глютена через 3 месяца — возобновление клинической симптоматики, патологические результаты скрининговых тестов и явления атрофии свидетельствуют в пользу целиакии. При наличии всех трех составляющих устанавливается определенный диагноз целиакии.
Схема 7. Критерии установления диагноза целиакии
Подтверждение диагноза
Провокационный тест может потребоваться в тех случаях, если соблюдение аглютеновой диеты было начато эмпирически до проведения морфологического исследования тонкой кишки и/или получения результатов серологического тестирования на маркеры целиакии либо если диагноз был выставлен в детском возрасте на основании морфологических данных без серологического подтверждения (у детей возможны транзиторные энтеропатии, симулирующие целиакию: белок-индуцированные энтеропатии, обусловленные непереносимостью коровьего молока, сои и др., транзиторная глютеновая интолерантность, постэнтеритный синдром). До начала провокационного теста необходимо выполнить серологическое определение маркеров целиакии и морфологическое исследование тонкокишечной слизистой оболочки. Затем пациента просят употреблять ежедневно как минимум 10 г глютена, что соответствует четырем кусочкам хлеба. Через 4–6 недель повторяют серологическое и морфологическое исследования. Появление изменений, характерных для целиакии, рассматривают как подтверждение диагноза.
Источник: Guidelines for the management of patients with celiac disease // British Society of Gastroenterology [Electronic resource], 2002.
Золотой стандарт диагностики
После внедрения в клиническую практику сероиммунологических скрининговых тестов, имеющих высокую чувствительность и специфичность, в большинстве случаев отпала необходимость в повторном изучении ответа слизистой оболочки на введение (исключение) глютена.
В настоящее время золотым стандартом диагностики целиакии OMGE называет выявление характерных гистологических изменений в сочетании с положительными результатами сероиммунологических тестов (аnti-tTG-IgA или EMA-IgA). ESPGHAN в 1990 г. пересмотрело критерии установления диагноза целиакии.
При типичных для целиакии серологических и гистологических данных, при наличии явного клинического ответа на аглютеновую диету от проведения повторной биопсии можно воздержаться. В то же время Британское гастроэнтерологическое общество рекомендует выполнение повторного гистологического исследования спустя 4–6 месяцев от начала соблюдения аглютеновой диеты, обосновывая данный диагностический тест как тест, абсолютно подтверждающий диагноз целиакии. При нетипичном течении целиакии или малосимптомном, а также при серонегативных формах течения заболевания в динамике необходимо проводить гистологическое исследование. В этих случаях нельзя точно оценить клинический ответ.
Таблица 2. Клинические формы целиакии
Особенности при подтверждении диагноза
В случае если результаты гистологического исследования биоптата слизистой оболочки тонкого кишечника сомнительны, результаты серологических тестов отрицательны, необходимо проведение типирования на наличие гаплотипов HLA-DQ2 и HLA-DQ8 главного комплекса гистосовместимости. Экспрессия этих молекул является обязательным условием для развития целиакии. Отсутствие данных диагностических критериев полностью исключает диагноз целиакии.
Для дифференциальной диагностики целиакии и неспецифических поражений тонкого кишечника используют провокационный тест с нагрузкой глютеном.
В зависимости от сочетания клинических, сероиммунологических и гистологических характеристик выделяют несколько основных клинических форм заболевания: явную (классическую, типичную), атипичную, стертую (асимптоматическую, скрытую), латентную (потенциальную) и рефрактерную (Fasano A., Catassi C. // Gastroenterology, 2001).
Ю. В. Горгун, А. С. Портянко обращают внимание в своей статье «Клинико-морфологическая диагностика целиакии» (журнал «Медицинские новости», № 10, 2007) на профессионализм врача, занимающегося ведением больных с целиакией:
«Таким образом, диагноз целиакии основан на результатах специальных методов исследования (дистальной дуоденальной биопсии, сероиммунологических тестов), проведение которых требует от врача знания различных вариантов клинической презентации, а также заболеваний и состояний, ассоциированных с высоким риском развития целиакии. Эффективное выявление лиц, страдающих целиакией, реально лишь при условии высокой настороженности как врачей-клиницистов, так и врачей-эндоскопистов в отношении возможного наличия данного заболевания».
Для диагностики целиакии важно определить план обследования, включающий следующие этапы: I — клинико-лабораторный, II — биохимический, III — инструментальный, IV — дополнительный (определение генетических маркеров HLA II класса или провокационную пробу с глютеном). Провокация глютеном должна проводиться только по строгим показаниям, особенно в детском возрасте.
Единственным методом этиотропной терапии целиакии остается строгая безглютеновая диета, соблюдать которую пациент должен на протяжении всей своей жизни.
// ПД
Хотите больше новой информации по вопросам диетологии?
Оформите подписку на информационно-практический журнал «Практическая диетология»!