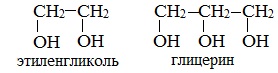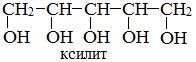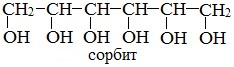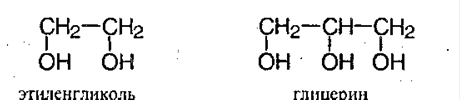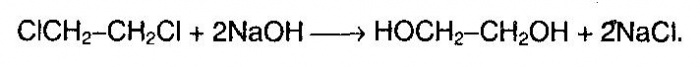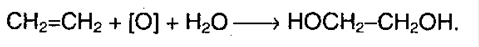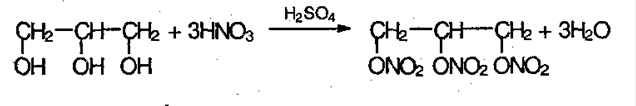Что такое многоатомный спирт
Что такое многоатомный спирт
Многоатомные спирты (полиспирты, полиолы) – органические соединения, в молекулах которых содержится несколько гидроксильных групп (-ОН), соединённых с углеводородным радикалом.
Многоатомные спирты — соединения, у которых две или несколько гидроксильных групп расположены у соседних атомов углерода.
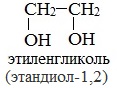
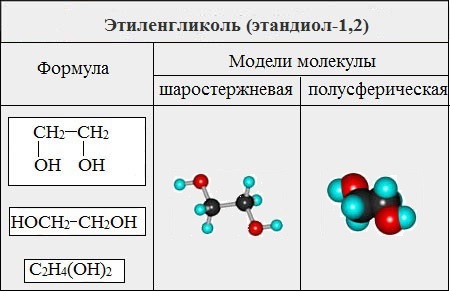
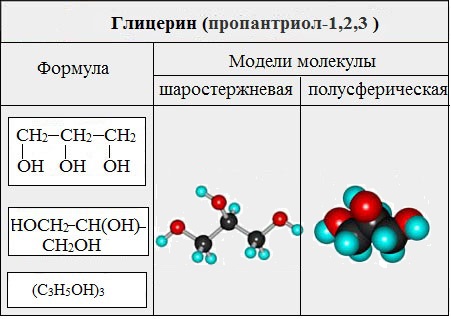
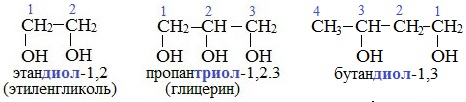
Важнейшими представителями многоатомных спиртов являются двухатомный спирт этандиол-1,2 (этиленгликоль), и трехатомный спирт пропантриол-1,2,3 (глицерин):
или шестиатомный спирт гексанол (сорбит):
I. Гликоли (диолы)
Название гликоли получили вследствие сладкого вкуса многих представителей ряда (греч. «гликос» — сладкий).
II. Глицерины (триолы)
Номенклатура
Физические свойства
Поэтому этиленгликоль широко используется в системах охлаждения двигателей в качестве антифриза (от анг. to freeze — «замерзать») – вещества с низкой температурой замерзания, заменяющего воду в радиаторах автомобильных и авиационных моторов в зимнее время. Антифризы также замедляют ее испарение летом.
Этиленгликоль используется также для производства синтетического волокна полиэфирного волокна – лавсана.
Этиленгликоль очень токсичен! Это сильный яд! Этиленгликоль вызывает длительное угрожающее жизни угнетение центральной нервной системы и поражение почек. Продуктами его превращения в организме являются щавелевая кислота и другие не менее ядовитые соединения. Он имеет спиртовой запах, в связи, с чем может быть принят за этиловый спирт и стать причиной тяжелых отравлений.
Видеоопыт «Изучение физических свойств глицерина»
Глицерин – бесцветная, вязкая, сиропообразная жидкость, сладкая на вкус. Не ядовит. Глицерин не имеет запаха, его tпл = 18 0 С, tкип = 290 0 С. Глицерин гигроскопичен, хорошо смешивается с водой и этанолом. На этом свойстве основано применение глицерина в косметической промышленности, где глицерин используется для увлажнения кожи.
Абсолютно чистый безводный глицерин затвердевает при +18 0 С, но получить его в твердом виде чрезвычайно сложно.
Глицерин широко распространен в живой природе. Он играет важную роль в процессах обмена в организмах животных, входит в состав большинства липидов – жиров и других веществ, содержащихся в животных и растительных тканях и выполняющих в живых организмах важнейшие функции. Благодаря этим свойствам глицерин является важным компонентов многих пищевых продуктов, кремов, косметических средств.
Этиленгликоль и глицерин, благодаря наличию гидроксильных групп, могут образовывать водородные связи с молекулами воды, этим объясняется их не ограниченная растворимость в воде.
Многоатомные спирты.
Важнейшими представителями многоатомных спиртов являются этиленгликоль и глицерин:
Они представляют собой вязкие жидкости, сладкие на вкус, хорошо растворимы в воде и плохо растворимы в органических растворителях.
Получение многоатомных спиртов.
1. Гидролиз алкилгалогенидов (одноатомных спиртов):
2. Этиленгликоль образуется при окислении этилена водным раствором KMnO4:
Химические свойства многоатомных спиртов.
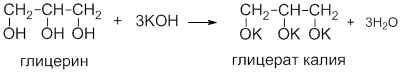
Для двухатомных спиртов характерны основные реакции одноатомных спиртов. Взаимное влияние гидроксильных групп проявляются в том, что многоатомные спирты являются более сильными кислотами. Соли двухатомных спиртов называются гликолятами, трехатомных – глицератами.
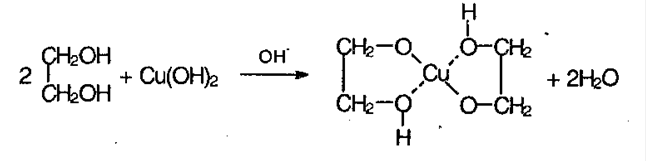
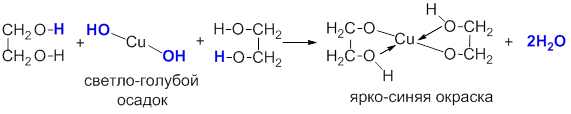
Качественная реакция на спирты – ярко-синее окрашивание при действии свежеосажденного гидроксида меди (II). Цвет возникает от возникновения комплекса меди:
Для многоатомных спиртов характерно образование тринитрата глицерина, известного как нитроглицерин:
Применение многоатомных спиртов.
Этиленгликоль нашел широкое применение в косметике, фармацевтике, производстве взрывчатых веществ, пищевой промышленности.
Динамит – взрывчатое вещество, в основе которого лежит тринитроглицерин.
Спирты
Классификация спиртов
Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода), вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).
Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д.
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.
Получение спиртов
Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола.
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.
Химические свойства спиртов
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.
Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
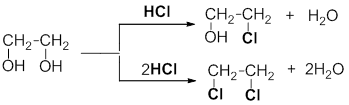
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
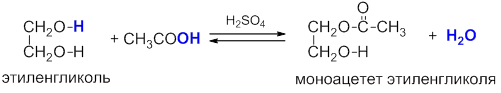
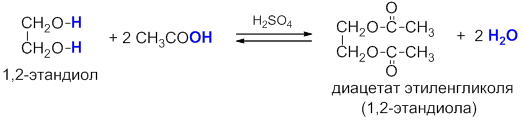
В результате реакций спиртов с кислотами образуются различные эфиры.
Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет.
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Что такое многоатомный спирт
Химия
3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола
Химические свойства многоатомных спиртов
Многоатомными спиртами называют производные углеводородов, в молекулах которых содержатся две или более гидроксильные группы, связанные с разными атомами углерода.
Многоатомные спирты по химическим свойствам сходны с одноатомными спиртами. Они вступают в реакции с металлами, галогеноводородами, карбоновыми кислотами. В реакцию может вступать одна или несколько гидроксильных групп.
Многоатомные спирты, благодаря взаимному влиянию гидроксильных групп проявляют более сильные кислотные свойства. В отличие от одноатомных спиртов они реагируют со щелочами, образуя соли:
Многоатомные спирты, в которых гидроксильные группы расположены у соседних атомов углерода, способны образовывать комплексные соединения со свежеосаждённым гидроксидом меди (II), что служит качественной реакцией для их обнаружения.
Многоатомные спирты, как и одноатомные, могут образовывать сложные эфиры с органическими и неорганическими кислотами. В реакции может участвовать как одна, так и несколько гидроксильных групп:
В 1846 году итальянский химик Асканьо Собреро нагрел глицерин со смесью азотной и серной кислот. Полученный продукт, а это был тринитрат глицерина, взорвался.
Нитроглицерин начали применять как взрывчатое вещество в различных целях. Но работа с ним и при получении на заводах и при применении была опасна. Он взрывался от сотрясения при транспортировке и от ударов. Альфред Нобель – знаменитый шведский изобретатель предложил пропитывать тринитроглицерином кизельгур (рыхлая осадочная горная порода, инфузорная земля). Полученный продукт назвали динамитом. Динамит безопасен при хранении и перевозке.
Многоатомные спирты

Всего получено оценок: 472.
Всего получено оценок: 472.
Представители
В таблице описаны наиболее известные представители полиолов.
Вид спирта
Название
Формула
Физические свойства
Прозрачная маслянистая сильно токсичная жидкость без запаха, со сладким привкусом
Вязкая прозрачная жидкость. Смешивается с водой в любых пропорциях. Имеет сладкий вкус
Кристаллический белый порошок со сладким вкусом. Растворяется в воде и органических растворителях
Кристаллическое бесцветное вещество сладкое на вкус. Хорошо растворяется в воде, спиртах, органических кислотах
Сладкое кристаллическое вещество, хорошо растворимое в воде, но плохо растворимое в этаноле
Некоторые кристаллические многоатомные спирты, например, ксилит, сорбит, используют в качестве сахарозаменителя и пищевой добавки.
Получение
Полиолы получают лабораторным и промышленным путём:
Свойства
Химические свойства многоатомных спиртов обусловлены нахождением в молекуле нескольких гидроксильных групп. Их близкое положение способствует более лёгким разрывам водородных связей, чем у одноатомных спиртов. Многоатомные спирты проявляют кислотные и основные свойства.
Основные химические свойства описаны в таблице.
Реакция
Описание
Уравнение
Со щелочными металлами
Реагируют с органическими и минеральными кислотами с образованием жиров – сложных эфиров
При взаимодействии с гидроксидом меди (II) в щелочной среде образуется тёмно-синий раствор
Соли двухатомных спиртов называются гликолятами, трёхатомных – глицератами.