Что такое модифицированный ген
Как устроены ГМО и почему мы их так боимся
Что такое ГМО?
ГМО — генетически модифицированные организмы — это организмы, в ДНК которых были целенаправленно внесены изменения при помощи методов генной инженерии. То есть им были переданы отдельные гены от другого организма, не обязательно родственного. Обычно таким способом улучшают свойства растений и микроорганизмов, реже — животных или придают им совершенно новые характеристики.
Почему вокруг ГМО так много заблуждений?
По данным ВЦИОМ, больше 80% россиян настроены против ГМО. Подобные опросы проводились также в США, Франции и Германии. В этих странах около 90% населения также негативно относятся к искусственной модификации генома. Один из главных аргументов противников ГМО — какое-либо вмешательство в ДНК противоестественно. А значит, употребление в пищу ГМО-растений и продуктов может вызвать у человека опасные мутации и, как следствие, болезни.
При этом, согласно исследованию британских ученых, ярые противники ГМО гораздо хуже, чем их оппоненты, разбираются в базовых биологических понятиях, не говоря о генетике. По этой причине большинство респондентов неверно представляют себе, что вообще такое вмешательство в геном. На самом деле наука занимается этим достаточно давно. Еще в XVI веке первые агрономы-испытатели, не зная законов генетики, создавали растения-гибриды, отбирая для посева те сорта, которые были устойчивы к вредителям и приносили больше урожая. Это называется селекцией. С развитием науки были изобретены более совершенные методы — в частности, генная инженерия. Она позволила ученым в три раза ускорить процесс выведения новых сортов, или новых полезных свойств растений. Впрочем, даже используя такие современные и точные методы генетики, как, например, CRISPR/Cas9, невозможно создать такой генно-модифицированный продукт, который через кишечник человека смог бы встроиться в его ДНК. Более того, механизма, который позволил бы осуществить перенос генов таким образом, попросту не существует.
Ситуацию усугубляют и псевдонаучные публикации, которые содержат некорректные данные о ГМО, или же неверно их трактуют. Например, в феврале 2019-го в журнале Food and Chemical Toxicology вышел обзор о том, как генно-модифицированные продукты усваиваются человеческим организмом. В кратком содержании авторы пишут: «Убедительные свидетельства показывают наличие ДНК из еды (также генно-модифицированной еды) в крови и тканях человека и животных».
Однако если вчитаться в текст обзора, становится понятно, что на самом деле исследователи не нашли никаких тревожных признаков: в крови испытуемых не было повышенной концентрации трансгенной ДНК.
Наконец, мифы о ГМО успешно распространяются и на государственном уровне. К примеру, авторы сайта Центра гигиены и эпидемиологии при Роспотребнадзоре пишут об опасности ГМ-продуктов, ничем не подкрепляя эти заявления.
Одно из очевидных объяснений подобных предрассудков — банальная научная безграмотность противников ГМО или работа с некорректными источниками информации.
Правда ли, что ГМО — это вредно?
Существует множество исследований, которые доказывают, что ГМ-продукты безопасны. Например, доклад Национальных академий наук, техники и медицины США от 2016 года свидетельствует, что такие продукты не только не вредны, но даже полезны для человека. Авторы изучили более 900 научных работ, опросили 80 экспертов из различных областей, еще 26 привлекли к рецензированию доклада. В основном все проанализированные исследования касались двух типов ГМ-растений: устойчивых к насекомым и к химическим удобрениям. Данные за последние 20 лет показали, что эти сельхозкультуры никак не повлияли на людей и животных, которые ими питались.
Прежде, чем вывести ГМ-продукт на рынок, ученые проводят многолетние испытания. Они наблюдают, как ведут себя трансгены и продукты генной экспрессии, не вызывают ли они аллергии или отравления. Международное законодательство требует, чтобы каждый такой товар проходил жесткую проверку на безопасность для людей, животных и окружающей среды. Кроме того, в ЕС такие продукты отслеживают еще и годы спустя, чтобы выявить возможные отложенные риски.
Пока существует только два вероятных риска, связанных с применением ГМО, о которых, в частности, говорит ВОЗ:
Как ГМО двигает науку и медицину
Сегодня ГМО используют в двух главных сферах: сельское хозяйство и медицина.
Практически все продукты растительного происхождения на нашем столе — с измененными генами. Благодаря этому они дают больше урожая, приспосабливаются к суровому климату и недостаткам почвы, противостоят вредителям. Но главное — они становятся лучше на вкус, содержат больше полезных веществ и приобретают новые ценные свойства. Например, золотой рис — генетически модифицированный сорт риса с повышенным содержанием витамина А. Существует также особый сорт моркови, который содержит вакцину от туберкулеза.
Какое будущее у ГМО?
Несмотря на все сложности с разработкой и проверкой на безопасность, ученые уверены: в будущем человечеству не обойтись без трансгенных растений и продуктов. Мы сможем предотвращать голод или массовый неурожай, а также минимизировать вред для экологии: ГМО-растения можно реже поливать и возделывать беспахотным способом. Это позволит не только экономить воду, но и уменьшать парниковый эффект за счет снижения теплового излучения пашни. Кроме того меньшее количество сельхозтехники на полях поможет контролировать выбросы углекислого газа в атмосферу.
Вот несколько примеров того, на что способна генная инженерия:
Что такое генная инженерия и зачем вмешиваться в природу организмов
Содержание:
Генная инженерия — это современное направление биотехнологии, объединяющее знания, приемы и методики из целого блока смежных наук — генетики, биологии, химии, вирусологии и так далее — чтобы получить новые наследственные свойства организмов.
Перестройка генотипов происходит путем внесения изменений в ДНК (макромолекулу, обеспечивающую хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов) и РНК (одну из трех основных макромолекул, содержащихся в клетках всех живых организмов).
Если внести в растение, микроорганизм, организм животного или даже человека новые гены, можно наделить его новой желательной характеристикой, которой до этого он никогда не обладал. С этой целью сегодня генная инженерия используется во многих сферах. Например, на ее основе сформировалась отдельная отрасль фармацевтической промышленности, представляющая собой одну из современных ветвей биотехнологии.
История развития
Истоки
Основы классической генетики были заложены в середине XIX века благодаря экспериментам чешского-австрийского биолога Грегора Менделя. Открытые им на примере растений принципы передачи наследственных признаков от родительских организмов к их потомкам в 1865 году, к сожалению, не получили должного внимания у современников, и только в 1900 году Хуго де Фриз и другие европейские ученые независимо друг от друга «переоткрыли» законы наследственности.
Параллельно с этим шел процесс формирования знаний о ДНК. Так, в 1869 году швейцарский биолог Фридрих Мишер открыл факт существования макромолекулы, а в 1910 году американский биолог Томас Хант Морган обнаружил на основе характера наследования мутаций у дрозофил, что гены расположены линейно на хромосомах и образуют группы сцепления. В 1953 году было сделано важнейшее открытие — американец Джон Уотсон и британец Фрэнсис Крик установили молекулярную структуру ДНК.
На подъеме
К концу 1960-х годов генетика активно развивалась, а ее важными объектами стали вирусы и плазмиды. Были разработаны методы выделения высокоочищенных препаратов неповрежденных молекул ДНК, плазмид и вирусов, а в 1970-х годах был открыт ряд ферментов, катализирующих реакции превращения ДНК.
Генная инженерия как отдельное направление исследовательской работы зародилась в США в 1972 году, когда в Стэнфордском университете ученые Пол Берг, Стэнли Норман Коэн, Герберт Бойер и их научная группа внедрили новый ген в бактерию кишечной палочки (E. coli), то есть создали первую рекомбинантную ДНК.
Техника ПЦР была впервые разработана в 1980-х годах американским биохимиком Кэри Маллисом. Будущий лауреат Нобелевской премии по химии (1993 года), обнаружил в специфический фермент — ДНК-полимеразу, который участвует в репликации ДНК. Этот фермент буквально считывает отрезки цепи нуклеотидов молекулы и использует их в качестве шаблона для последующего копирования генетической информации.
Новая эра
В 1996 году методом пересадки ядра соматической клетки в цитоплазму яйцеклетки на свет появилось первое клонированное млекопитающее — овца Долли. Это событие стало революционным в истории развития генной инженерии, потому что впервые стало возможным серьезно говорить о создании клонов и выращивании живых организмов на основе молекул.
Технологии генной инженерии
Генная инженерия за короткий срок оказала огромное влияние на развитие различных молекулярно-генетических методов и позволила существенно продвинуться на пути познания генетического аппарата.
Так, появилась технология CRISPR — инструмент редактирования генома. В 2014 году MIT Technology Review назвал его «самым большим биотехнологическим открытием века». Он основан на защитной системе бактерий, которые производят специальные ферменты, позволяющие им защищаться от вирусов.
«Каждый раз, когда бактерия убивает вирус, она разрезает остатки его генома, будь то ДНК или РНК, и сохраняет их внутри последовательности CRISPR, как в архив. Как только вирус атакует снова, бактерия использует информацию из «архива» и быстро производит защитные белки Cas9, в которых заключены фрагменты генома вируса. Если вдруг эти фрагменты совпадают с генетическим материалом нынешнего атакующего вируса, Cas9 как ножницами разрезает захватчика, и бактерия снова в безопасности», — поясняет Алевтина Федина, медицинский директор Checkme.
Уникальное открытие состоялось в 2011 году, когда биологи Дженнифер Дудна и Эммануэль Шарпантье обнаружили, что белок Cas9 можно обмануть. Если дать ему искусственную РНК, синтезированную в лаборатории, то он, найдя в «архиве» соответствие, нападет на нее. Таким образом, с помощью этого белка можно резать геном в нужном месте — и не просто резать, а еще и заменять другими генами.
Теоретически, технология CRISPR может позволить редактировать любую генетическую мутацию и излечивать заболевание, которое она вызывает. Но практические разработки CRISPR в качестве терапии еще только в начальной стадии, и многое еще непонятно.
Есть и другие методы генной инженерии, например, ZFN и TALEN.
Где и как применяется генная инженерия
Медицина
Уже сейчас активно применяется инсулин человека (хумулин), полученный посредством рекомбинантных ДНК. Клонированные гены человеческого инсулина были введены в бактериальную клетку, где начался синтез гормона, который природные микробные штаммы никогда не синтезировали. С 1982 года компании США, Японии, Великобритании и других стран производят генно-инженерный инсулин.
Кроме того, несколько сотен новых диагностических препаратов уже введены в медицинскую практику. Среди лекарств, находящихся в стадии клинического изучения, препараты, потенциально лечащие артрозы, сердечно-сосудистые заболевания, онкологию и СПИД. Среди нескольких сотен генно-инженерных компаний 60% заняты именно разработкой и производством лекарственных и диагностических средств.
«В медицине среди достижений генной инженерии сегодня можно выделить терапию рака, а также другие фармакологические новинки — исследования стволовых клеток, новые антибиотики, прицельно бьющие по бактериям, лечение сахарного диабета. Правда, пока все это на стадии исследований, но результаты многообещающие», — говорит Алевтина Федина.
Сельское хозяйство
В сельском хозяйстве одна из важнейших задач генной инженерии — получение растений и животных, устойчивых к вирусам. В настоящее время уже есть виды, способные противостоять воздействию более десятка различных вирусных инфекций.
Еще одна задача связана с защитой растений от насекомых-вредителей. Путем генетической модификации растений можно уменьшить интенсивность обработки полей пестицидами. Например, трансгенные растения картофеля и томатов стали устойчивы к колорадскому жуку, растения хлопчатника — к разным насекомым, в том числе и к хлопковой совке.
Использование генной инженерии позволило сократить применение инсектицидов (препаратов для уничтожения насекомых) на 40–60%.
Благодаря генной инженерии зерновые культуры стали более устойчивы к климатическим условиям, кроме того появилась возможность увеличить количество витаминов и полезных веществ в продукте. Например, можно обогатить рис витамином «А» и выращивать его в тех регионах, где люди имеют массовую нехватку этого элемента.
С помощью генной инженерии пытаются решить и экологические проблемы. Так, уже созданы особые сорта растений с функцией очистки почвы. Они поглощают цинк, никель, кобальт и иные опасные вещества из загрязненных промышленными отходами почв.
Скотоводство
В Кемеровской области работа генетиков позволила получить устойчивое к вирусу лейкоза племенное поголовье высокопродуктивных животных. Для проведения эксперимента кузбасские ученые отобрали здоровых коров черно-пестрой породы массой до 500 кг. Животным трансплантировали модифицированные эмбрионы, устойчивые к вирусу лейкоза. В середине сентября 2020 года родилось 19 телят с измененными генами.
«В месячном возрасте была проведена оценка, которая показала, что телята отличаются от своих сверстников только устойчивостью к вирусу. Пять особей отобрали для дальнейшей селекционной работы. Это позволит закрепить наследственные признаки устойчивости к вирусу лейкоза у последующих поколений», — пояснила руководитель проекта, доктор биологических наук, профессор кафедры зоотехнии Кузбасской ГСХА Татьяна Зубова.
По словам Зубовой, лейкоз крупного рогатого скота — вирусная хронически неизлечимая болезнь, при которой возникают поражение кроветворной системы и новообразования. Данное заболевание наносит значительный ущерб генофонду пород и мясной промышленности в целом, потому что мясо зараженных животных запрещено употреблять в пищу. Единственным доступным методом борьбы с лейкозом ранее было только уничтожение зараженного скота.
Этот успех позволяет говорить о том, что в дальнейшем будет возможно редактировать гены крупного рогатого скота и от других болезней.
С прицелом на человека
В 2009 году группа ученых под руководством молодого исследователя Джея Нейтца из Вашингтонского университета сумели с помощью генной терапии вернуть обезьянам способность различать оттенки зеленого и красного, которой они были лишены от рождения.
В область сетчатки глаза двух подопытных обезьян был введен безвредный вирус, несущий недостающий ген фоточувствительного рецептора. Вскоре после процедуры обе обезьяны начали различать оттенки красного и зеленого на сером фоне. Два года наблюдения не выявили у них каких-либо нарушений, поэтому ученые не исключают, что данную методику уже вскоре можно будет применять у людей, страдающих дальтонизмом.
Ученые шагнули еще дальше и уже пробуют выращивать в теле животных органы для трансплантации людям. Для минимизации риска отторжения тканей животным вводят специальные гены. Этими опытами занимается научная лаборатория Рослинского института в Великобритании, которая представила миру овцу Долли.
В 2019 году британские ученые вывели кур, яйца которых содержат два вида человеческих белков, способных противодействовать артриту и некоторым видам онкологических заболеваний. В яйцах содержится человеческий белок под названием IFNalpha2a, обладающий мощными противовирусными и противораковыми свойствами, а также человеческий и свиной вариант белка под названием макрофаг-CSF, который планируют использовать для создания препарата, стимулирующего самостоятельное заживление поврежденных тканей.
Изменение ДНК человека
Первые клинические испытания методов генной терапии были предприняты 22 мая 1989 года с целью генетического маркирования опухоль-инфильтрующих лимфоцитов в случае прогрессирующей меланомы.
14 сентября 1990 года в Бетесде (США) четырехлетней девочке, страдающей наследственным иммунодефицитом, обусловленным мутацией в гене аденозиндезаминазы (АDA), были пересажены ее собственные лимфоциты.
Работающая копия гена ADA была введена в клетки крови с помощью модифицированного вируса, в результате чего клетки получили возможность самостоятельно производить необходимый белок. Через шесть месяцев количество белых клеток в организме девочки поднялось до нормального уровня.
После этого область генной терапии получила толчок к дальнейшему развитию. С 1990-х годов сотни лабораторий ведут исследования по использованию генной терапии для лечения различных заболеваний. Уже сегодня с помощью генной терапии можно лечить диабет, анемию и некоторые виды онкологии.
Генная терапия
Генная терапия — введение, удаление или изменение генетического материала, в частности ДНК или РНК, в клетке пациента для лечения определенного заболевания.
Существует три основных стратегии использования генной терапии:
Наиболее часто применяемый метод включает вставку «терапевтического» гена для замены «ненормального» или «вызывающего болезнь».
В 2015 году впервые была проведена процедура изменения ДНК человека с целью продления молодости клеток, когда американке Элизабет Пэрриш 44 лет ввели в организм препарат, влияющий на ДНК, а в 2018 году китайский ученый Хэ Цзянькуй заявил, что с его помощью у двух детей-близнецов якобы изменены гены для выработки у них иммунитета к вирусу ВИЧ, носителем которого являлся их отец.
Все это, с одной стороны, выглядит грандиозно и обнадеживает, но с другой, — вызывает опасения, ведь генетические манипуляции, теоретически, возможно использовать не только в благих и мирных целях.
После эксперимента с ДНК близнецов в Китае, ЮНЕСКО выступила с инициативой о запрете изменения генов у новорожденных до того момента, пока достоверно не будет доказана безопасность таких манипуляций.
Этическая сторона вопроса
В 1997 году ЮНЕСКО выпустила Всеобщую декларацию о геноме человека и его правах, рекомендовав мораторий на генетическое вмешательство в зародышевую линию человека, а в декабре 2015 года на международном саммите по геномному редактированию человека изменение гаметоцитов и эмбрионов для генерации наследственных изменений у людей было объявлено безответственным.
Российское сообщество генетиков в большинстве своем считает, что такие эксперименты на данный момент преждевременны и требуют более глубокого исследования и обсуждений.
«Вопрос клонирования уже давно стоит на горизонте. Этично ли выращивать клонов, чтобы потом забирать их органы для трансплантации человеку… Большой вопрос. Само собой, это абсолютно нормально, что нет единой точки зрения, ведь смысл подобных дискуссий как раз в том, чтобы найти правильные формулировки и отрегулировать потенциально спасительное, но при этом очень опасное знание», — говорит Алевтина Федина.
Страх неизвестности
Вариантов развития событий в области генной инженерии существует множество, и далеко не все они изучены и, в принципе, известны. Поэтому они должны быть последовательно зафиксированы и регламентированы.
Естественно, больше всего опасений вызывают плохие сценарии развития событий. Как правило, все начинается с помощи людям и изобретения новых лекарств. Но потом человек может прийти к желанию сделать своего ребенка светловолосым и зеленоглазым или создать армию универсальных солдат, не боящихся боли и не ведающих страха.
Олег Долгицкий, социальный философ, отмечает, что современное общество настолько неоднородно в культурном и экономическом плане, что любые методы, способные существенно изменить геном, могут создать условия не только для классового, но и видового расслоения, где представители «первого мира» смогут существенно продлевать свою жизнь и не бояться никаких болезней, в отличие от менее богатых людей. Это является серьезнейшей почвой для конфликтов и столкновений.
Эксперты убеждены, что генная инженерия — это будущее медицины. Возможность избавить младенца от пожизненного гнета заболевания, излечить людей от рака, найти лекарство против ВИЧ — за всем этим будет стоять генная инженерия. При этом желание человека изменить, например, цвет глаз или предотвратить наследственное заболевание, несмотря на все риски, будет только расти. И похоже, что остановить этот процесс уже не представляется возможным.
Человек генно-модифицированный / Homo genere mutatio
Человек генно-модифицированный / Homo genere mutatio
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Когда Олдос Хаксли писал «Дивный новый мир», думал ли он, что на самом деле может наступить эра детей, созданных по заказу? «Дети здесь не рождаются. Их выращивают в специальных инкубаторах и делят на альфы, беты, гаммы, дельты и эпсилоны в зависимости от умственных способностей». На сегодняшний день вряд ли найдется более рьяно обсуждаемая в СМИ тема биомедицины, чем CRISPR/Cas. СМИ готовят общество к появлению в будущем фабрик по производству детей на заказ, ученые — к возможности создания генетической панацеи. Исследования на человеческих эмбрионах с применением генетических модификаций лишь подливают масла в огонь. Общественность строит догадки, какие перспективы дает этот инструмент генного редактирования в руках ученых. Ждет ли мир появление «отредактированных» людей? Станет ли Homo genere mutatio в эволюционный ряд после Homo sapiens sapiens? К чему бы ни привела технология CRISPR/Cas, несомненно, что это шаг в бездну новых возможностей.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Что такое CRISPR/Cas9 и с чем его едят
Хотя система CRISPR известна с 1980-х, активно о ней заговорили лишь несколько лет назад [1]. Повышенное внимание к технологии генной модификации связано с перспективами, которые она открывает. В частности, лечение генетических заболеваний. Это может изменить медицину. Освоение CRISPR/Cas9 в рамках человеческого тела подобно первым шагам в космосе.
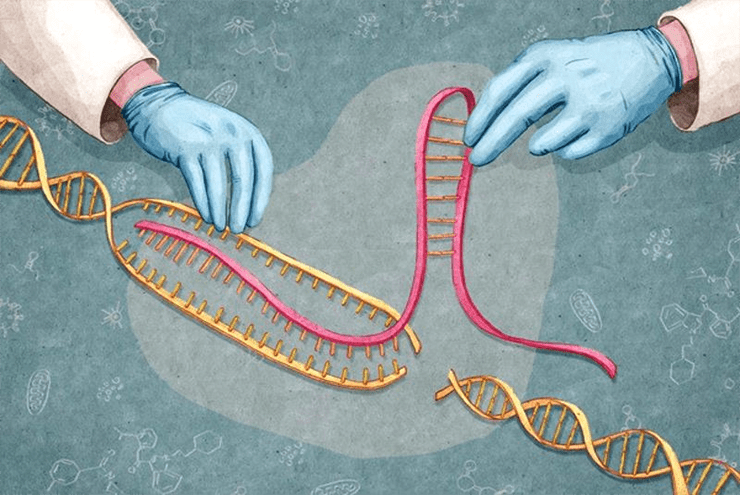
Технология CRISPR (от англ. Clustered Regularly Interspaced Short Palindromic Repeats — короткие палиндромные повторы, регулярно расположенные группами) основана на направленном редактировании генома с помощью эндонуклеазы Cas9. Словно умные ножницы, фермент Cas9 совершает двунитевые разрезы в нужных участках гена, удаляя дефекты генетической информации (рис. 1). После того как разрыв внесен, включаются системы восстановления ДНК, и нужная неповрежденная последовательность встает на место удаленной дефектной [2].
Рисунок 1. Схема работы CRISPR/Cas9.
Это уже не совсем так. В начале ноября 2017 года появилось сообщение о том, что мальчику, больному буллезным эпидермолизом, заменили 80% площади кожи на трансплантаты из его собственных клеток, в которых дефектный ген, вызывающий болезнь, заменили нормальным. — Ред.
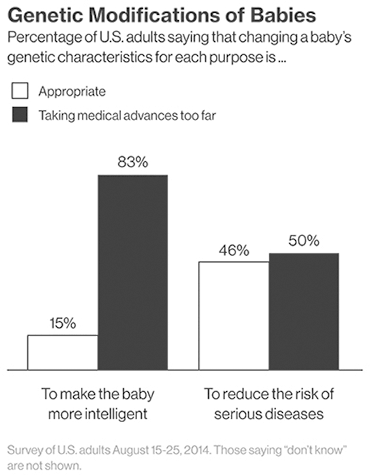
Рисунок 2. Общественное мнение относительно технологии CRISPR/Cas9.
Другой стороной медали может стать использование технологии не по задуманному назначению. Общество страшится появления «дизайнерских» детей, сделанных на заказ родителями. Проведенный опрос среди американцев говорит о том, что люди еще не готовы принять возможности генной терапии. Так, 83% респондентов не хотят использовать технологию для совершенствования детей (рис 2).
Еще один шаг к совершенству
Однако технология генного «ремонтирования» не без изъянов. Она не доведена до совершенства. CRISPR/Cas9 — это не волшебная палочка, призванная исправлять любой генетический дефект. Генетический скальпель не отличается высоким уровнем точности. Эндонуклеаза может совершить разрезы и в нецелевых участках. При этом система CRISPR/Cas9 может не исправлять мутации, как задумывалось, а создавать новые.
Отсутствие стопроцентной точности в работе эндонуклеазы Cas9 делает технологию небезопасной и ненадежной. Пока система не станет более точной, она не получит широкое распространение в практической медицине. Однако маленькие шаги в сторону реальности метода совершаются. Работа ученых из Массачусетского технологического института выводит технологию CRISPR на новый уровень посредством создания улучшенной версии фермента — eSpCas9.
eSpCas9 имеет повышенную специфичность, что снижает вероятность побочных эффектов при редактировании генома. Разрезы этого фермента более точные. Это позволило снизить риск вероятных ошибок примерно в 10 раз. Несомненно, такое открытие — настоящий прорыв для генного редактирования. Оно стало более специфичным и точным, а значит, стало ближе к практической медицине, чем когда-либо [3].
Первый блин комом
В апреле 2015 года мир должен был ахнуть от удивления: впервые ученым удалось не просто прочитать, а еще и отредактировать геном человека (рис. 3). Удивительно, но это событие не привлекло к себе много внимания. Такие авторитетные издания, как Nature и Science, не пожелали публиковать данные об исследовании ввиду его неэтичности. Связано это с тем, что впервые методику генного редактирования CRISPR/Cas9 проверили на человеческих эмбрионах [4].
Рисунок 3. Человеческие эмбрионы с отредактированным геномом.
Китайские ученые из университета Гуанчжоу использовали нежизнеспособные эмбрионы. Их получили посредством ЭКО. На этапе их образования произошел сбой, который привел к формированию трипронуклеарных эмбрионов, которые содержат не два пронуклеуса — материнский и отцовский, — а три. Такие зародыши обычно погибают еще до имплантации и нежизнеспособны: они содержат аномальный тройной набор хромосом (69 шт.), тогда как в норме кариотип составляют 46 [5]. Лишние 23 хромосомы не дают плоду развиваться нормально, что приводит к его гибели [6].
Перед учеными не стояла задача продлить время жизни трипронуклеарных эмбрионов. Их целью было осуществить генный нокаут бета-талассемии, которой страдали эмбрионы. Задумку не вполне удалось реализовать. Из 86-и лишь полсотни эмбрионов удалось протестировать. Генная модификация произошла в 28 зародышах, но почти во всех случаях — не такая, как надо, или в неправильном месте. Дефектный ген бета-талассемии был успешно удален из клеток лишь четырех эмбрионов.
Эксперимент не только не принес ожидаемого эффекта, но и создал новые непредвиденные мутации в геноме множества клеток. По словам лидера научной группы, использованная технология пока слишком «сырая». Она не может быть использована на нормальных эмбрионах. Чтобы приступить к ее клиническому использованию, процент успеха должен приближаться к 100.
Модификация людей одобрена законом
Официальное разрешение от вневедомственного органа Министерства здравоохранения Соединенного Королевства — HFEA (Human fertilisation and embryology authority) — на редактирование человеческих эмбрионов с помощью технологии CRISPR/Cas9 в 2016 году получила исследовательская группа из Института Фрэнсиса Крика в Великобритании под руководством биолога Кэти Ниакан. В качестве объекта исследования будут использоваться лишние эмбрионы, которые получают при ЭКО, — те, что оказались не нужны семьям ввиду свершившегося успешного подсаживания других зародышей. Раньше такой материал просто утилизировали за ненадобностью.
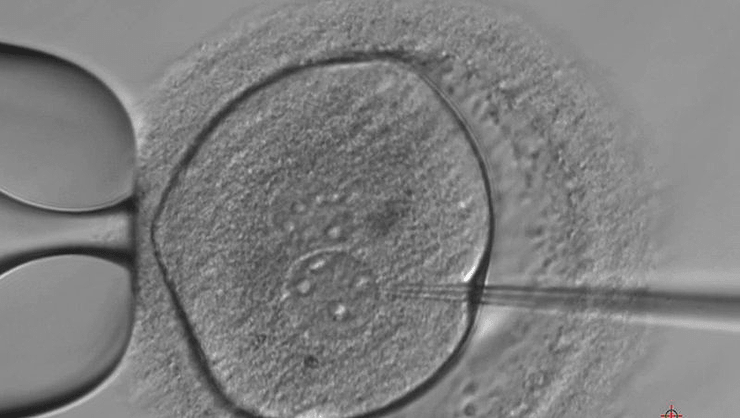
Это первое разрешение на подобную деятельность в Великобритании, и ученых не ждет полная свобода действий. Эмбрионы могут быть использованы лишь для определенных целей, которые будут оценены экспертной комиссией (рис. 4). Применять можно семидневные эмбрионы. Срок жизни объектов исследования после начала эксперимента — 14 дней. После этого они должны быть утилизированы. Подсаживание их к суррогатной матери исключено. Пролонгировать беременность генномодифицированными эмбрионами запрещено [7].
Рисунок 4. Человеческому эмбриону вводят отредактированную ДНК в лондонской лаборатории Института Фрэнсиса Крика.
Успех CRISPR/Cas9
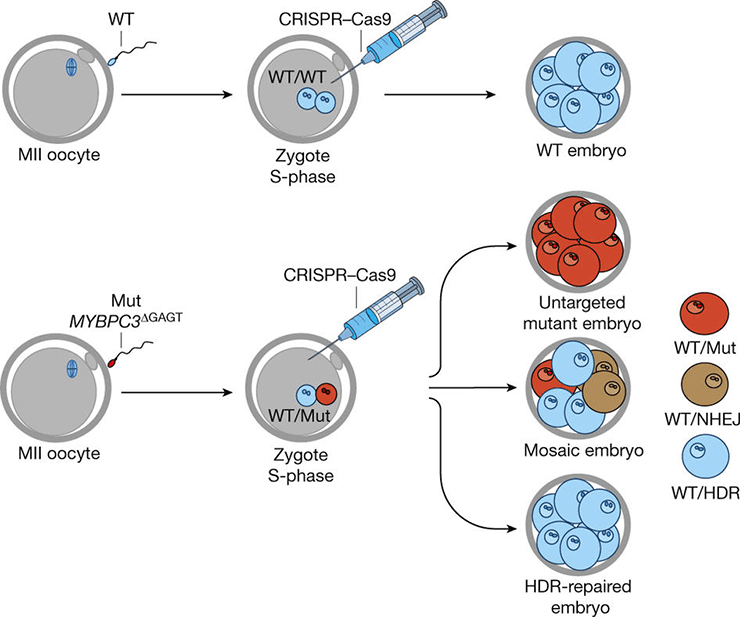
Первые полосы научных журналов в августе 2017 года вновь украшала аббревиатура CRISPR/Cas9. На этот раз новостями об успешном эксперименте спешили поделиться ученые из Орегонского университета здоровья и науки (OHSU). Группа ученых во главе с уроженцем Казахстана Шухратом Миталиповым применили технологии редактирования генов CRISPR/Cas9, чтобы изменить ДНК больных человеческих эмбрионов [8].
Среди безумного моря наследственных патологий выбор объекта исследования пал на гипертрофическую кардиомиопатию. Это серьезное генетическое заболевание сердца с аутосомно-доминантным типом наследования. Это значит, что патология проявится при наличии хотя бы одной дефектной копии гена. При этом данный ген не сцеплен с половой хромосомой, поэтому встречается как у мужчин, так и у женщин.
Особенно часто заболевание поражает молодых спортсменов [9]. Технология CRISPR/Cas9 позволила группе ученых отредактировать дефектный ген. В исследовании использовали 12 здоровых яйцеклеток и сперму, несущую мутантный ген MYBPC3. С помощью CRISPR/Cas9 из ДНК сперматозоидов удалось вырезать дефект, словно ножницами (рис. 5) [10].
Рисунок 5. Схема воздействия CRISPR/Cas9 на ген MYBPC3.
В результате получили 42 здоровых эмбриона из 58-и. Это составило 72,4% потомства без патологии. Такие результаты оказались довольно успешными по сравнению с полученными ранее при других исследованиях с CRISPR/Cas9 на эмбрионах с генетическими заболеваниями. Улучшение показателей, их приближение к ста процентам, дает надежду на лечение наследственных болезней в ближайшем будущем.
«Мы продемонстрировали возможность исправлять мутации в человеческом эмбрионе безопасным способом и с заметной степенью эффективности», — говорит один из руководителей проекта, Хуан Карлос Бельмонте.
Что может предложить миру CRISPR/Cas9
Каждое крупное открытие в истории человечества встречало сопротивление. С этим столкнулись и Галилео Галилей, и Джордано Бруно, и Парацельс, и Игнац Земмельвейс, осмеянный за свое предложение мыть врачам руки перед осмотром больных. Мир с трудом принимает новые открытия. Сотни известных имен стали признанными лишь после смерти и были гонимы за свои убеждения при жизни.
Инквизиция и научное невежество остались далеко позади. Сегодня медицина развивается очень быстро — в сравнении с минувшими столетиями она движется семимильными шагами. Несомненно, CRISPR/Cas9 станет одним из важнейших биотехнологических открытий XXI века. Что же может предложить миру эта технология?
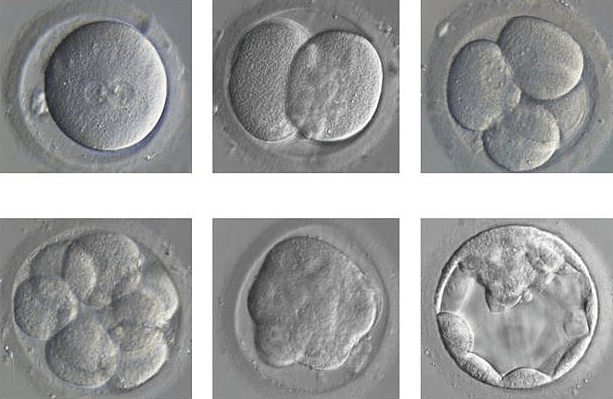
Рисунок 6. Руками врача буквально лечится геном.
Рисунок 7. Развитие эмбриона из одного оплодотворенного яйца до бластоцисты.
Рисунок 8. Схема возможного использования органов свиней.
Рисунок 9. ГМ-пища.
Рисунок 10. Схематичное изображение «дизайнерского» ребенка.
Тем не менее случайные мутации, которые ненароком могут появиться при редактировании генома, потенциально могут быть еще опаснее, чем имеющиеся (рис. 11).
Рисунок 11. Схематичное изображение гена с опасной мутацией.
Этично ли редактировать людей?
CRISPR/Cas9 предстоит преодолеть не только технические трудности, которые требуют приближенного к ста процентам результата для внедрения в практическую медицину, но и этические (рис. 12). Насколько нравственно редактировать геном человека, данный ему при рождении? Можем ли мы вмешиваться в работу природы и модифицировать ее по своему усмотрению?
Рисунок 12. Обложка книги профессора Калифорнийского университета Пола Кнопфлера — GMO sapiens.
Международный мораторий на опыты над людьми говорит сам за себя. А проведенные на данный момент исследования имели четкие рамки, закрепленные законодательно. Вынашивание и рождение «редактированного ребенка» в таких условиях невозможно.
По мнению биоэтика из Университета Висконсина в Мэдисоне Альты Чаро, «дизайнерские дети» — сомнительная перспектива для CRISPR/Cas9. Исследовав положение дел с технологией генной модификации, она сделала заявление: «Озабоченность по поводу проведенных экспериментов раздута. Это увлекательный, важный и достаточно внушительный шаг к изучению правильного редактирования эмбрионов. Независимо от беспокойных предположений, это не начало эпохи „дизайнерских детей“. Наследование таких признаков, как интеллект или атлетизм, определено множеством генов. Разгадать каждый из них и спроектировать ребенка не представляется возможным» [19].
Что же принесет миру технология генного редактирования CRISPR/Cas9 — пользу или вред? Однозначного ответа на этот вопрос не даст никто. Хотя практической пользы от технологии пока получено не было, то будущее, которое рисует CRISPR/Cas9 в рамках биомедицины, рано или поздно наступит. И нам откроется возможность узреть и понять этот новый и смелый отредактированный мир (рис. 13).
Рисунок 13. Безграничные возможности CRISPR/Cas9.