Что такое молекулярная орбиталь
Теория молекулярных орбиталей
Связывание атомов в молекулах определяется тем, как перекрываются их волновые функции.
Атомы объединяются в молекулы благодаря химическим связям. Причем участвуют в образовании этих связей электроны, находящиеся во внешнем слое этих атомов. Существует несколько теорий, описывающих процесс связывания. Одна из них — теория валентных связей, в соответствии с которой связи между атомами образуются, когда атомы обмениваются электронными парами из перекрывающихся орбиталей. Другая — теория молекулярных орбиталей.
Такого рода приблизительные теории полезны, поскольку мы получаем простой, интуитивно понятный способ представления физических процессов. С другой стороны, современные компьютеры дают нам возможность с высокой точностью вычислить энергии связи, однако такие вычисления ничуть не приближают нас к пониманию того, что же происходит, когда атомы соединяются. Роль теорий как раз в том и состоит, чтобы дать нам это понимание.
В основе теории молекулярных орбиталей лежит представление о том, что электронная орбиталь в атоме описывается волновой функцией (см. Уравнение Шрёдингера). Теория объясняет, как при протекании химической реакции атомные орбитали преобразуются в молекулярные. Подобно большинству известных нам типов волн, волновые функции электронов в орбиталях претерпевают интерференцию. Оказывается, орбитали в молекулах можно, с хорошим приближением, представить как результат интерференции волновых функций атомов.
Например, рассмотрим, что происходит при взаимодействии двух атомных орбиталей соседних атомов. Если в области перекрывания орбиталей волновые функции претерпевают конструктивную интерференцию, электроны большую часть времени проводят между ядрами, притягивая атомы друг к другу. С другой стороны, если интерференция в области перекрывания деструктивная, электронная плотность между ядрами равна нулю, и между атомами возникает результирующая сила отталкивания. Таким образом, две атомные орбитали объединяются с образованием двух молекулярных орбиталей: одна стремится связать атомы (связывающая молекулярная орбиталь), а другая — оттолкнуть их (разрыхляющая молекулярная орбиталь). И их взаимодействие определяет, будет ли образована стабильная молекула.
Чтобы понять, как работает эта модель, попробуем разобраться, почему водород образует молекулу из двух атомов, а гелий — из одного. В образовании связи между двумя атомами водорода участвуют по одному электрону от каждого атома, а на низшей (связывающей) молекулярной орбитали как раз есть место для двух электронов. Электроны основное время находятся между ядрами, значит атомы притягиваются и молекула водорода может образоваться. У гелия же в образовании связи между двумя атомами участвуют четыре электрона, поэтому заняты как связывающая, так и разрыхляющая атомные орбитали. Численные вычисления показывают, что в этом случае будет преобладать эффект отталкивания, и, даже если молекулы гелия образуются, они будут крайне нестабильны. Поэтому молекула газа гелия состоит из одного атома.
Метод молекулярных орбиталей. Основные положения метода
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Метод молекулярных орбиталей (ММО, МО).
Хронологически метод молекулярных орбиталей появился позже метода валентных связей, поскольку оставались в теории ковалентной связи вопросы, которые не могли получить объяснение методом ВС. Укажем некоторые из них.
Как известно, основное положение метода ВС состоит в том, что связь между атомами осуществляется за счет электронных пар (связующих двухэлектронных облаков). Но это не всегда так. В ряде случаев в образовании химической связи участвуют отдельные электроны. Так, в молекулярном ионе Н2 + одноэлектронная связь. Метод ВС образование одноэлектронной связи объяснить не может, она противоречит его основному положению.
Метод ВС не объясняет также роли неспаренных электронов в молекуле. Молекулы, имеющие неспаренные электроны, парамагнитны, т. е. втягиваются в магнитное поле, так как неспаренный электрон создает постоянный магнитный момент. Если в молекулах нет неспаренных электронов, то они диамагнитны – выталкиваются из магнитного поля. Молекула кислорода парамагнитна, в ней имеется два электрона с параллельной ориентацией спинов, что противоречит методу ВС. Необходимо также отметить, что метод ВС не смог объяснить ряд свойств комплексных соединений – их цветность и др.
Чтобы объяснить эти факты, был предложен метод молекулярных орбиталей (ММО).
4.5.1. Основные положения ММО, МО.
1. В молекуле все электроны являются общими. Сама молекула — это единое целое, совокупность ядер и электронов.
2. В молекуле каждому электрону соответствует молекулярная орбиталь, подобно тому как каждому электрону в атоме соответствует атомная орбиталь. И обозначения орбиталей аналогичны:
3. В первом приближении молекулярная орбиталь представляет собой линейную комбинацию (сложение и вычитание) атомных орбиталей. Поэтому говорят о методе молекулярных орбиталей ЛКАО (молекулярная орбиталь есть линейная комбинация атомных орбиталей), при которой из N АО образуется N МО (это основное положение метода).
Рис. 12. Энергетическая схема образования молекулы водорода Н2
Рассмотрение химических связей в методе молекулярных орбиталей заключается в распределении электронов в молекуле по ее орбиталям. Последние заполняются в порядке возрастания энергии и с учетом принципа Паули. В этом методе предполагается увеличение электронной плотности между ядрами при образовании ковалентной связи.
Пользуясь положениями 1—3, объясним образование молекулы H2 с точки зрения метода молекулярных орбиталей. При достаточном сближении атомов водорода происходит перекрывание их электронных орбиталей. Согласно п. 3 из двух одинаковых ls-орбиталей образуются две молекулярные орбитали: одна из них от сложения атомных орбиталей, другая от их вычитания (рис.12). Энергия первой E1 св ), а находящиеся на ней электроны—связывающими электронами.
Молекулярная орбиталь, энергия которой больше энергии атомной орбитали, называется антисвязывающей или разрыхляющей (обозначается символом разр ), а находящиеся на ней электроны — разрыхляющими электронами.
Если у соединяющихся атомов водорода спины электронов антипараллельны, то они займут связывающую молекулярную орбиталь, возникает химическая связь (рис. 12), сопровождающаяся выделением энергии E1 (435 кДж/моль). Если же спины электронов атомов водорода параллельны, то они в соответствии с принципом Паули не могут разместиться на одной молекулярной орбитали: один из них разместится на связывающей, а другой на разрыхляющей орбитали, значит химическая связь образоваться не может.
Согласно методу молекулярных орбиталей образование молекул возможно, если число электронов на связывающих орбиталях больше числа электронов на разрыхляющих орбиталях. Если же число электронов на связывающих и разрыхляющих орбиталях одинаково, то такие молекулы образоваться не могут. Так, теория не допускает существования молекулы Нe2, так как в ней два электрона находились бы на связывающей орбитали и два — на разрыхляющей. Всегда разрыхляющий электрон сводит на нет действие связывающего электрона.
В системе обозначений метода молекулярных орбиталей реакцию образования молекулы водорода из атомов записывают так:
2H[1s 1 ] = H2[(σ CB 1s) 2 ],
т. е. используются символы, выражающие размещение электронов на атомных и молекулярных орбиталях. При этом символ каждой молекулярной орбитали заключается в круглые скобки и над скобками справа проставляется число электронов на этой орбитали.
Число валентных связей определяется по формуле:
В молекуле водорода В = (2—0) : 2=1, водород одновалентен. Молекула Н2 диамагнитна (электроны спарены).
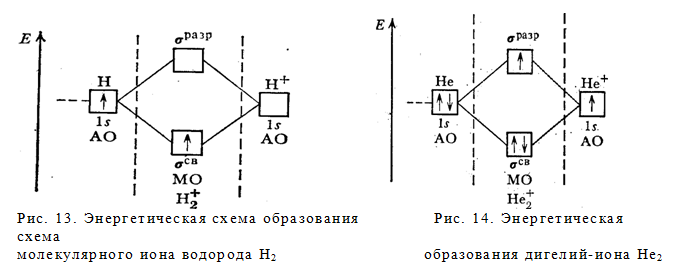
Теперь легко объясняется одноэлектронная связь в молекулярном ионе Н2 + (рис.13). Единственный электрон этого иона занимает энергетически наиболее выгодную орбиталь св 1s. Уравнение процесса:
H[1s 1 ] + H + = H2 + [(σ св 1s) 1 ], ∆H = – 259,4 кДж
Число связей в ионе H2 + равно ½ (связь одним электроном). Ион H2 + — парамагнитен (имеет один неспаренный электрон).
Возможно существование молекулярного дигелий иона Не2 + (рис.14). Уравнение его образования
He[1s 2 ] + He + [1s 1 ] = He2 + [(σ CB 1s) 2 (σ разр 1s) 1 ], ∆H = – 292,8 кДж
Этот ион экспериментально обнаружен. Число связей в нем (2—1) : 2 = 1 /2. Ион— парамагнитен (имеет неспаренный электрон).
4.5.2. Основные двухатомные гомонуклеарные молекулы элементов 2-го периода. Рассмотренный принцип построения молекулярных орбиталей из двух одинаковых АО сохраняется при построении гомонуклеарных молекул элементов 2-го периода системы Д.И. Менделеева. Они образуются в результате взаимодействия 2s- и 2рx-, 2рy– и 2рz-орбиталей.
Рис. 16. Энергетическая схема образования молекулы Li2
Пример 1. Молекула лития Li2. Схема ее образования представлена на рис.16. В ней два связывающих электрона, молекула диамагнитна (электроны спарены). Написание уравнения и формулы можно упростить, обозначив внутренний уровень через K:
2Li[K2s] = Li2[KK(σ CB 2s) 2 ]
Число связей равно 1.
Пример 2. Молекула бериллия Be2. Восемь электронов молекулы размещены на МО следующим образом:
Ве2[KK(σ CB 2s) 2 (σ разр 2s) 2 ]
Как видно, число связей в молекуле равно нулю: два разрыхляющих электрона уничтожают действие двух связывающих. Такая молекула не может существовать, и она до сих пор не обнаружена. Необходимо отметить, что невозможны двухатомные молекулы у всех элементов IIА-группы, палладия и инертных элементов, так как их атомы имеют замкнутую электронную структуру.
Пример 3. Молекула азота N2 (рис. 17). Распределение 14 электронов по МО записывается так:
Рис. 17. Энергетическая схема образования молекулы N2
Под формулой указано число связей в молекуле, исходя из расчета, что два электрона, расположенные на одной МО, образуют валентную связь; знак плюс обозначает связующие орбитали, знак минус – разрыхляющие. Число связей в молекуле 3. нет неспаренных электронов – молекула диамагнитна.
Пример 4. Молекула O2 (рис. 18). Электроны размещаются по молекулярным орбиталям в последовательности:
В молекуле две валентные связи. Последние два электрона разместились на различных π-разрыхляющих орбиталях в соответствии с правилом Гунда. Два неспаренных электрона обусловливают парамагнетизм молекулы кислорода.
Рис. 18. Энергетическая схема образования молекулы O2
4.5.3. Двухатомные гетеронуклеарные молекулы элементов 2-го периода. Энергетическая схема образования МО гетеронуклеарных двухатомных молекул, состоящих из атомов элементов 2-го периода, представлена на рис. 19. Она сходна со схемой образования молекулярных орбиталей гомонуклеарных молекул.
Основное различие сводится к тому, что значения энергии одноименных орбиталей атомов разных элементов не равны между собой, поскольку различны заряды ядер атомов. В качестве примера рассмотрим электронную валентную конфигурацию молекул СО и NO.
Как и предусматривалось теорией ВС, в молекуле СО три валентные связи (сравните с N2). Молекула диамагнитна – все электроны спарены.
Значит, молекула NO имеет две с половиной валентные связи, энергия связи большая —677,8кДж/моль. Она парамагнитна, так как содержит один неспаренный электрон.
Приведенные примеры служат иллюстрацией возможностей метода МО в объяснении строения и свойств молекул.
Пример 7. Какую валентность, обусловленную неспаренными электронами (спинвалентность), может проявлять фосфор в нормальном и возбужденном состояниях?
Решение. Распределение электронов внешнего энергетического уровня фосфора 3s 2 3р 3 (учитывая правило Хунда, ) по квантовым ячейкам имеет вид:
Атомы фосфора имеют свободные d-орбитали, поэтому возможен переход одного 3s-электрона в 3d-состояние:
Отсюда валентность (спинвалентность) фосфора в нормальном состоянии равна трем, а в возбужденном — пяти.
Решение. Теория валентных связей (ВС) предполагает участие в образовании ковалентных связей не только чистых АО, но и смешанных, так называемых гибридных, АО. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и с одинаковой энергией. Число гибридных орбиталей (q) равно числу исходных. Ответ см. в табл. 13.
Гибридизация орбиталей и пространственная конфигурация молекул
Пример 9. Как метод молекулярных орбиталей (МО) описывает строение двухатомных гомоядерных молекул элементов второго периода?
σ CB 1s разр 1s CB 2s разр 2s CB 2px CB 2py =
На рис. 20 изображена энергетическая схема образования молекулярных орбиталей из атомных для двухатомных гомоядерных (одного и того же элемента) молекул элементов второго периода. Число связывающих и разрыхляющих электронов зависит от их числа в атомах исходных элементов.
Следует отметить, что при образовании молекул N2 энергия связывающей 2рx-орбитали больше энергии связывающих 2ру– и 2рz-орбиталей, тогда как в молекулах О2 и F2, наоборот, энергия связывающих 2ру– и 2рz-орбиталей больше энергии связывающей 2рx-орбитали. Это нужно учитывать при изображении энергетических схем (см. рис. соответствующих молекул).
Рис.20. Энергетическая схема образования молекулярных орбиталей из атомных для гомоядерных молекул второго периода
Порядок связи в молекуле определяется разностью между числом связывающих и разрыхляющих электронов, деленной на два. Порядок связи может быть равен нулю (молекула не существует), целому или дробному положительному числу.
Буквами КК показано, что четыре 1s-электрона (два связывающих и два разрыхляющих) практически не оказывают влияния на химическую связь.
Молекулярные орбитали
Теория молекулярных орбиталей (МО) дает представление о распределении электронной плотности и объясняет свойства молекул. В этой теории квантово-механические зависимости для атома распространены на более сложную систему — молекулу. Молекула рассматривается как целое, а не как совокупность сохранивших индивидуальность атомов. В молекуле (как и в атоме) имеются дискретные энергетические состояния отдельных электронов (молекулярные орбитали) с их самосогласованным движением в поле друг друга и всех ядер молекулы.
Предполагается, что все электроны — данной молекулы (как и в атоме) распределяются по соответствующим орбиталям. Состояние электрона в атоме описывается одноэлектронной волновой функцией ψ, являющейся решением уравнения Шрёдингера. Волновая функция ψ, зависящая от четырёх квантовых чисел, имеющая конкретный математический вид и удовлетворяющая условию нормировки и однозначности называется молекулярной орбиталью (МО) (по аналогии с атомной). Каждая орбиталь характеризуется своим набором квантовых чисел, отражающих свойства электронов в данном энергетическом состоянии. В отличие от одноцентровых орбиталей атомов, орбитали молекул многоцентровые, то есть молекулы имеют общие орбитали для двух или более атомных ядер. Каждая молекулярная орбиталь обладает определённой энергией, приближённо характеризующейся соответствующим потенциалом ионизации.
По аналогии с атомными s-, p-, d-, f- орбиталями молекулярные орбитали обозначают греческими буквами σ-, π-, δ-, γ-. МО образуются при комбинировании атомных орбиталей при достаточном сближении. Совокупность МО молекулы с указанием её типа и количеством электронов на ней даёт электронную конфигурацию молекулы. Существуют 3 типа молекулярных орбиталей: связывающие, разрыхляющие и несвязывающие. Электроны на связывающих молекулярных орбиталях упрочняют связь, на разрыхляющих как бы дестабилизируют (расшатывают). Молекула является устойчивой лишь в том случае, если число электронов на связывающих орбиталях превышает число электронов на разрыхляющих. Электроны, находящиеся на несвязывающих молекулярных орбиталях, участие в образовании химической связи не принимают. Из исходных атомных орбиталей возникает nМО. Так, при образовании двухатомной молекулы H2 из атомов Н из s-орбиталей двух атомов Н возникают две двухцентровые МО — одна энергетически более выгодная (связывающая σs св ), другая менее выгодная (разрыхляющая σs разр ), чем исходные атомные орбитали. На связывающей МО электрон большую часть времени пребывает между ядрами (повышается электронная плотность), способствуя их химическому связыванию. Нa разрыхляющей же МО электрон большую часть времени находится за ядрами, вызывая отталкивание ядер друг от друга.
Характер распределения электронов по МО определяет порядок (кратность) связи, ее энергию, межъядерные расстояния (длина связи), магнитные свойства молекул и др. Заполнение молекулярных орбиталей подчиняется тем же правилам, что и заполнение атомных: принципу энергетической выгодности, принципу Паули, правилу Хунда, принципу заполнения электронных структур Aufbau. В общепринятом приближении молекулярная орбиталь рассматривается как линейная комбинация атомных орбиталей (приближение МО ЛКАО).
Кратность связи в теории молекулярных орбиталей определяется выражением
где 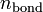
Содержание
Пример
Еще один пример
Хорошим примером работы метода молекулярных орбиталей может явится рассмотрение молекулы кислорода 
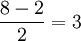
Преимущества
По сравнению с методом валентных схем имеет следующие преимущества:
1. Позволяет описывать химическую связь в электронодефицитных молекулах (диборан), молекулах радикалах (монооксид азота), молекулярных ионах (нитрозил, нитроил, гидразоний, оксигенил), гипервалентных соединениях (соединения благородных газов)
2. Обьясняет образование молекул с многоцентровыми орбиталями. Например, в азотной кислоте азот имеет формально валентность 5, хотя не может образовывать 5 связей. Этот парадокс обьясняется наличием трёхцентровой двухэлектронной связи.
Когда обнаружилась способность благородных газов образовывать соединения, некоторые учёные были склонны считать что электроны распариваются на следующий энергетический уровень и образуются нормальные двухцентровые двухэлектронные связи. Однако энергия на распаривание слишком велика, и она не покрылась бы энергией, выделившейся в результате образования химических связей. Оказывется, образуются трёхцентровые четырёхэлектронные связи. Модель МО ЛКАО позволяет объяснить образование химической связи в такого рода соединениях.
Энергию МО в молекуле либо определяют экспериментально (спектроскопически и др.) либо рассчитывают методами квантовой механики и квантовой химии (чисто теоретическими и полуэмпирическими).
См. также
Посмотрите ссылки
Метод молекулярных орбиталей в качественном изложении, с диаграммами:[1]
Что такое молекулярная орбиталь
Согласно такому описанию, молекула О2 не содержит неспаренных электронов. Однако магнитные свойства кислорода указывают на то, что в молекуле О2 имеются два неспаренных электрона.
Приведенные здесь и многие другие факты получают более удовлетворительное объяснение на основе метода молекулярных орбиталей (метод МО).
Метод МО исходит из предположения, что состояние электронов в молекуле также может быть описано как совокупность молекулярных электронных орбиталей (молекулярных электронных облаков), причем каждой молекулярной орбитали (МО) соответствует определенный набор молекулярных квантовых чисел. Как и в любой другой многоэлектронной системе, в молекуле сохраняет свою справедливость принцип Паули, так что на каждой МО может находиться не более двух электронов, которые должны обладать противоположно направленными спинами.
Молекулярное электронное облако может быть сосредоточено вблизи одного из атомных ядер, входящих в состав молекулы: такой электрон практически принадлежит одному атому и не принимает участия в образовании химических связей. В других случаях преобладающая часть электронного облака расположена в области пространства, близкой к двум атомным ядрам, это соответствует образованию двухцентровой химической связи. Однако в наиболее общем случае электронное облако принадлежит нескольким атомным ядрам и участвует в образовании многоцентровой химической связи. Таким образом, с точки зрения метода МО двухцентровая связь представляет собой лишь частный случай многоцентровой химической связи.
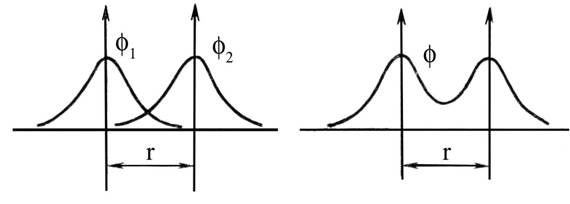
Выясним, какой вид будет иметь молекулярная волновая функция φ, образованная в результате взаимодействия волновых функций (φ1 и φ2) ls-орбиталей двух одинаковых атомов. Для этого найдем сумму С1φ1 + С2φ2. В данном случае оба рассматриваемых атома одинаковы, так что коэффициенты С1 и C 2 равны по величине (С1=С2=С) и задача сводится к определению суммы C (φ1 + φ2). Поскольку постоянный коэффициент С не влияет на вид искомой молекулярной волновой функции, а только изменяет ее абсолютные значения, мы ограничимся нахождением суммы (φ1 + φ2).
Для этого расположим ядра взаимодействующих атомов на том расстоянии друг от друга ( r ), на котором они находятся в молекуле, и изобразим волновые функции 1s-орбиталей этих атомов (рис. 5.1, а). Чтобы найти молекулярную волновую функцию φ, сложим величины φ1 и φ2, в результате получится кривая, изображенная на рис. 5.1, б. Как видно, в пространстве между ядрами значения молекулярной волновой функции φ больше, чем значения исходных атомных волновых функций. Но квадрат волновой функции характеризует вероятность нахождения электрона в соответствующей области пространства, т. е. плотность электронного облака. Значит, возрастание φ в сравнении с φ1 и φ2 означает, что при образовании МО плотность электронного облака в межъядерном пространстве увеличивается. В результате возникают силы притяжения положительно заряженных атомных ядер к этой области, образуется химическая связь. Поэтому МО рассматриваемого типа называется связывающей.
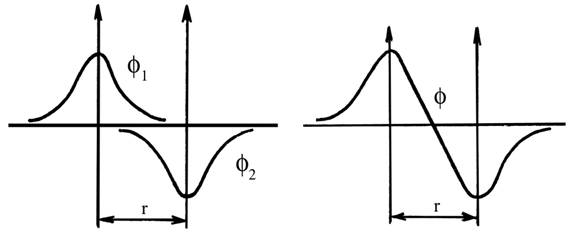
Схемы, иллюстрирующие образование простых двухцентровых МО из атомных орбиталей, представлены на рис. 5.3