Что такое мса в медицине
Что такое мса в медицине
2. Спорадическая оливопонтоцеребеллярная атрофия (ОПЦА). При ОПЦА преобладает мозжечковая симптоматика (особенно атаксия и дизартрия), хотя редко бывает изолированной. Другими сопутствующими проявлениями могут быть паралич взора, гиперрефлексия, патологические стопные знаки и, что особенно важно, признаки паркинсонизма.
3. Синдром Шая-Дрейджера (Shy-Drager). При синдроме Шая-Дрейджера наблюдается дисфункция вегетативной нервной системы, что проявляется ортостатической гипотензией, нарушением функций тазовых органов, импотенцией.
Неясен вопрос о том, являются ли эти нарушения различными по сущности или только клиническими вариантами одного патологического состояния. Однако они обычно наблюдаются одновременно и имеют схожую патологическую картину. С диагностической точки зрения синдром МСА должен быть заподозрен у пациентов с гипокинезией, недостаточным эффектом леводопы при наличии значительных вегетативных или мозжечковых отклонений.
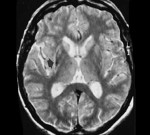
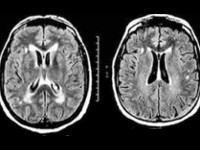
Методы нейровизуализации. МРТ головного мозга выявляет гипоинтенсивность в области скорлупы при СНД, вероятно, вследствие избыточного накопления железа в этой структуре. При ОПЦА можно наблюдать атрофию мозжечка.
Патоморфология. Общим признаком всех синдромов МСА является наличие характерных глиальных цитоплазматических включений. В дополнение к этому при синдроме Шая-Дрейджера обнаруживаются утрата нейронов и глиоз в двигательных ядрах блуждающего нерва и структурах спинного мозга, ответственных за вегетативную регуляцию.
4. Синдромы деменции. Болезнь Альцгеймера, болезнь Пика и болезнь с диффузными тельцами Леви —¦ это дегенеративные поражения ЦНС с преобладанием в клинической картине признаков деменции. Хотя дегенеративный процесс при этих заболеваниях затрагивает преимущественно некоторые области коры, могут быть вовлечены и подкорковые структуры, что приводит к развитию экстрапирамидных нарушений, включая паркинсонизм. Ключ к идентификации первичных дементных нарушений как причины паркинсонизма — это раннее появление признаков деменции, предшествующее развитию гипокинезии или ригидности.
Нейродегенеративные заболевания
Болезнь Вильсона — это аутосомно-рецессивное состояние, которое связано с нарушением экскреции меди, что приводит к накоплению ее в различных органах и системах, включая ЦНС, печень (цирроз), роговицу (кольца Кайзера-Флейшера), сердце и почки.
Болезнь Вильсона может начинаться в широком возрастном диапазоне — от 5 до 50 лет, но чаще всего в возрасте 8—16 лет. Неврологические расстройства присутствуют в начале заболевания примерно у 40 % больных. Такие экстрапирамидные симптомы, как дистония, ригидность и брадикинезия наиболее часто встречаются у детей, в то время как у взрослых более вероятно появление тремора и дизартрии. При болезни Вильсона могут наблюдаться разнообразные психические расстройства. Чрезвычайно важным для установления правильного диагноза является наличие печеночных расстройств (цирроз или хронический активный гепатит), особенно у молодых пациентов. Комбинация брадикинезии и тремора у этих больных позволяет предполагать болезнь Паркинсона. Однако слишком молодой возраст пациентов при появлении первых признаков заболевания, наличие психических расстройств, нарушений функций печени или дистонии являются основанием для поиска лабораторного подтверждения болезни Вильсона. Поскольку последствия этого заболевания предотвратимы при условии раннего назначения специфического лечения, возможность его наличия должна всегда учитываться при дифференциальном диагнозе вариантов атипичного паркинсонизма, особенно у людей моложе 50 лет.
Методы нейровизуализации. МРТ головного мозга выявляет расширение желудочков, а также атрофию в области коры и стволовых отделов. Базальные ганглии, особенно скорлупа, могут иметь гипо- или гиперинтенсивный характер в Т2-режиме исследования и гиподенсивный при КТ.
Иногда эти изменения в срезах среднего мозга при МРТ выглядят как «лицо гигантской панды».
Патоморфология. Наблюдается генерализованная атрофия мозгового вещества. Скорлупа, бледный шар и хвостатое ядро содержат кавитации и коричневый пигмент, что отражает накопление меди. d. Другие тесты. Наиболее информативный лабораторный тест —определение церулоплазмина плазмы, который обычно ниже 20 мг/дЛ (норма — 25—45 мг/дЛ). Уровень меди й плазме снижается, а выведение меди с мочой увеличивается. Исследование роговицы в свете щелевой лампы позволяет обнаружить кольца Кайзера-Флейшера почти у всех пациентов с неврологическими расстройствами, что является высокоспецифической, но не патогномоничной находкой. Если один или более из данных тестов в норме и диагноз вызывает сомнения, его следует подтвердить с помощью биопсии печени, которая позволяет констатировать увеличение содержания меди.
— Вернуться в оглавление раздела «Неврология.»
Что такое мультисистемная атрофия?
Мультисистемная атрофия (МСА) — это редкое нейродегенеративное заболевание, которое влияет на вегетативные функции организма: кровоснабжение, дыхание, пищеварение, эндокринную систему и функцию мочевого пузыря.
Симптомы, как правило, появляются в возрасте 50 лет и быстро прогрессируют. Вскоре человек теряет двигательную функцию и оказывается прикован к постели.
У пациентов с мультисистемной атрофией часто развивается пневмония на поздней стадии заболевания. Они могут внезапно умереть от сердечно-сосудистых и респираторных проблем.
Хотя некоторые симптомы можно облегчить лекарствами, в настоящее время невозможно замедлить или предотвратить развитие болезни.
Первые симптомы схожи с теми, которые наблюдаются при болезни Паркинсона:
Другие симптомы включают:
Причина возникновения заболевания неизвестна.
Текущие наблюдения за пациентами и исследования ДНК не подтвердили семейной истории МСА, поэтому она вряд ли передаётся по наследству.
Особенностью заболевания является накопление белка альфа-синуклеина в глиальных клетках головного мозга. Таким образом, возможный фактор риска — мутации в гене, который обеспечивает производство альфа-синуклеина в организме.
Некоторые исследователи полагают, что МСА могут вызвать плохая экология и токсины.
В зависимости от того, какие симптомы проявлены больше всего, врачи выделяют два вида МСА:
В настоящее время нет способов предотвратить прогрессирование заболевания, но лекарства помогают облегчить симптомы.
С некоторыми нарушениями можно справиться и другими методами:
• Обмороки и головокружение лечат с помощью компрессионных чулок и добавления больше соли в рацион.
• Проблемы с мышцами контролируют с помощью инъекций ботулотоксина.
• Пациентам, которые испытывают трудности с глотанием, могут использовать питательные трубки и обратиться к логопеду.
• Физиотерапия помогает сохранить подвижность мышц, уменьшить контрактуры и спазмы, исправить осанку.
• Трудотерапия помогает адаптироваться к новым условиям жизни и самостоятельно решать повседневные задачи, такие как одевание и питание.
Мультисистемная атрофия
Мультисистемная атрофия — прогрессирующая дегенеративная патология головного мозга с преимущественным поражением глиальных клеток базальных ганглиев, мозжечка, вегетативных центров. Клинически проявляется сочетанием паркинсонизма с мозжечковой, вегетативной и пирамидной недостаточностью. Диагностируется преимущественно по клиническим данным, дополнительно проводится церебральная МРТ, ортостатическая проба, ЭМГ сфинктеров. Терапия мультисистемной атрофии симптоматическая (сосудистая, нейрометаболическая), большинство случаев резистентны к лечению препаратами леводопы.
Общие сведения
Термин «мультисистемная атрофия» (множественная системная атрофия, МСА) был введён в 1969 году. В 1989 году были обнаружены патогномоничные для МСА цитоплазматические включения в олигодендроглиоцитах. Понятие мультисистемная атрофия объединяет три патоморфологически сходные нозологии, клинически представляющие собой сочетание паркинсонического синдрома, вегетативной дисфункции, мозжечковой атаксии и пирамидной недостаточности. Ранее специалисты в области неврологии относили указанные заболевания в группу «паркинсонизм-плюс». На МСА приходится 10-12% случаев паркинсонизма. Встречаемость патологии в 20 раз меньше чем болезни Паркинсона. Заболеваемость составляет 3 случая на 100 тыс. населения. Дебют клинических проявлений приходится на возраст 50-60 лет. Характерно быстрое прогрессирование симптоматики.
Причины мультисистемной атрофии
Наследственный характер МСА не прослеживается, текущие наблюдения не обнаруживают семейных случаев заболевания. Однако многие исследователи предполагают генетическую детерминированность патологии как предрасположенность к развитию МСА при воздействии неблагоприятных факторов. Отдельные учёные связывают повышенный риск возникновения МСА с полиморфизмом в гене альфа-синуклеина. Этиофакторы, провоцирующие заболевание, точно не определены. Одно из проведённых исследований выявило указания на контакт с токсическими веществами (пестицидами, органическими растворителями) в анамнезе 11% пациентов с МСА.
Патогенез
Механизм развития неизвестен. Особенностью дегенеративных изменений является преимущественное поражение глиальных клеток с накоплением альфа-синуклеина, тау-протеина и ряда других нейронных белков. Патологические включения обнаруживаются в олигодендроглиоцитах надсегментарных двигательных структур (пирамидная, экстрапирамидная система, моторная область коры, мозжечок) и вегетативных центров ЦНС. Наряду с поражением чёрной субстанции происходит дегенерация дофаминовых рецепторов скорлупы, обуславливающее развитие устойчивого к дофаминергической терапии «постсинаптического» паркинсонизма. Морфологическая картина характеризуется асимметричными атрофическими изменениями белого вещества, преобладанием поражения олигодендроглиоцитов, менее выраженным повреждением нейронов. Мультисистемная дегенерация затрагивает строго определённые структуры головного мозга. Каждая клиническая форма имеет свою типичную локализацию дегенеративного процесса.
Классификация
В соответствии с современными взглядами на проблематику мультисистемная атрофия включает три нозологические формы. В основу систематизации положены клинические особенности заболевания. В зависимости от превалирующего синдрома выделяют следующие варианты:
Симптомы мультисистемной атрофии
Манифестация приходится на возрастной период 45-60 лет. У 60% пациентов МСА стартует нарушениями двигательной сферы, у 40% вегетативной симптоматикой. В начальном периоде в 60% случаев наблюдаются симптомы паркинсонизма: брадикинезия, замедленность движений, шаркающая походка, гипомимия, монотонность голоса. Их отличительной особенностью является изначальная симметричность проявлений. У 30% больных отмечаются мозжечковые расстройства: постуральные нарушения, дисметрия, адиадохокинез, интенционный тремор. В 10% случаев мозжечковая атаксия сочетается с паркинсонизмом.
Развёрнутая мультисистемная атрофия протекает с паркинсоническим синдромом у 90% больных. Мозжечковые нарушения слабо проявлены из-за выраженной ригидности. Об их наличии свидетельствует широкая постановка стоп при ходьбе, скандированный тип речи, усиление тремора в руке при приближении к цели (например, при попытке взять чашку). Смешанное мозжечково-паркинсоническое нарушение речи при МСА, получившее название дизартрофония, представляет собой мозжечковую дизартрию, сочетающуюся с монотонностью и приглушенностью речи. Пирамидная симптоматика характеризуется повышением сухожильных рефлексов и появлением стопных знаков, классические спастические парезы отсутствуют.
Тремор носит постурально-кинетический характер, возникает в результате сочетания дрожательного гиперкинеза и небольших миоклонических подёргиваний. Возможны дистонические проявления (спастическая кривошея, лицевой гемиспазм, фокальные дистонии конечностей), в отдельных случаях наблюдающиеся уже в дебюте заболевания. Вегетативная недостаточность проявляется ангидрозом, расстройством тазовых функций, ортостатическим коллапсом с обмороками, иногда — триадой Горнера, синдромом Рейно. Выраженные нарушения когнитивной сферы нехарактерны.
Осложнения
Тазовые нарушения осложняются присоединением вторичной инфекции с возникновением восходящего воспаления органов мочевыводящей системы: уретрита, цистита, пиелонефрита. При отсутствии своевременного лечения возможно проникновение инфекционных агентов в кровь с развитием сепсиса. Вовлечение в патологический процесс черепно-мозговых нервов приводит к прогрессирующему бульбарному параличу с характерной для него дисфагией. Последняя может осложниться попаданием пищи в дыхательные пути с последующей аспирационной пневмонией. Бульбарный паралич голосовых связок опасен появлением асфиксии, которая может стать причиной внезапной смерти.
Диагностика
Мультисистемная атрофия диагностируется на основании клинических данных, сбор которых зачастую требует наблюдения пациента в динамике. Диагноз вероятной МСА устанавливается при сочетании вегетативной недостаточности с хотя бы одним из следующих синдромов: резистентный к препаратам леводопы паркинсонизм, мозжечковая дисфункция. Против диагноза МСА выступает дебют заболевания до 30-летнего возраста, семейный анамнез, расстройство когнитивной сферы (деменция), наличие другого заболевания, являющегося причиной аналогичной симптоматики. Достоверная диагностика возможна только в результате патоморфологической экспертизы. С целью подтверждения диагноза необходимо проведение следующих исследований:
Дифференцируется мультисистемная атрофия с болезнью Паркинсона, сосудистым паркинсонизмом, спиноцеребеллярными атаксиями. Главным отличием МСА от классической болезни Паркинсона является наличие дополнительных симптомов, выходящих за рамки расстройств экстрапирамидной системы, слабая эффективность дофаминергической терапии. Сосудистый паркинсонизм отличается сопутствующими когнитивными нарушениями. Спиноцеребеллярные атаксии имеют наследственный характер, в сложных диагностических случаях исключаются при помощи ДНК-диагностики.
Лечение мультисистемной атрофии
Поскольку этиопатогенез остаётся неясным, лечение осуществляется в рамках симптоматической терапии. На начальной стадии заболевания у трети пациентов эффективны фармпрепараты леводопы, однако они усугубляют дистоническую симптоматику и течение ортостатической гипотонии. При отсутствии терапевтического эффекта, выраженных побочных явлениях леводопу отменяют. Применяют средства, улучшающие метаболизм церебральных тканей: вазоактивные, нейрометаболические препараты. Лечение ортостатической дисфункции осуществляется путём наложения компрессионных бинтов на нижние конечности, повышения содержания соли в рационе, приподнимания головного конца кровати.
Прогноз и профилактика
На сегодняшний день мультифокальная атрофия относится к неизлечимым заболеваниям. Симптоматическая терапия позволяет несколько облегчить состояние больного, но не может остановить прогрессирование дегенеративных процессов. Длительность жизни пациентов не превышает 7 лет. Летальный исход обусловлен осложнениями бульбарного синдрома, интеркуррентными инфекциями, сердечно-сосудистой недостаточностью. Профилактические мероприятия не разработаны, поскольку отсутствуют точные данные об этиологии поражения.
PsyAndNeuro.ru
Методы диагностики МСА на ранних стадиях
Мультисистемная атрофия (МСА) – это спорадическое фатальное нейродегенеративное заболевание с началом во взрослом возрасте, характеризующееся прогрессирующей вегетативной недостаточностью, паркинсонизмом, мозжечковым и пирамидным синдромами в различных комбинациях. МСА считается редким заболеванием (см. www.orpha.net ) : оно встречается в 3,4 – 4,9 случаях на 100 000 населения, но для группы старше 40 лет – 7,8.
Аутопсическим индикатором становится большое скопление α-синуклеина в олигодендроцитах вкупе со стриатонигральной дегенерацией или оливопонтоцеребеллярной атаксией.
МСА выделилась в отдельную нозологическую форму в 1969 г., обобщив три ранее отдельных диагноза. До начала XX века заболевание существовало под разными названиями: стриатонигральная дегенерация (СНД), оливомостомозжечковая атрофия (ОПЦА) и синдром Шая-Дрейджера (по имени исследователей Джорджа Милтона Шая и Глена Алберта Дрейджера).Термин МСА служит отныне отдельной клинико-патоморфической единицей для разнообразных сочетаний симптомов МСА. Термин «синдром Шая-Дрейджера» более не используется.
На данный момент заболевание имеет два подкласса: МСА-п (паркинсонического типа, или стратонигральная дегенерация, MSA-p – англ.) и МСА-ц (оливопонтоцеребеллярная атрофия, MSA-c – англ.). Различие двух типов становится ярче по мере прогрессирования заболевания.
Диагностика МСА очень затруднительна. Как правило, начало болезни приходится на шестой десяток жизни пациента. Продолжительность жизни варьируется от 6 до 15 лет после постановки диагноза.
Симптоматика носит смешанный характер: помимо паркинсонизма, мозжечковой атаксии, двигательной атаксии, ортостатического коллапса , выявляются проблемы вегетативной системы (см. Табл. 1, и рис.1). Преобладание паркинсонизма или же мозжечковой атаксии предопределяет возможность (possible) или вероятность заболевания (probable, definite) и выбор подтипа.
Рис. 1 Мультидисциплинарное проявление МСА. Перевод на русский язык. Источник: Fanciulli, Alessandra, and Gregor K. Wenning. “Multiple-system atrophy.” New England Journal of Medicine 372.3 (2015): 249-263
В ходе лечения на первых порах можно отметить реакцию на леводопосодержащие медикаменты, но со временем их эффективность снижается. Для обоих типов МСА характерно драматически быстрое развитие болезни. Потеря автономности пациента сопровождается трудностями пищеварения, дыхания (стридор может вести к необходимости трахеостомии). По статистике, приведённой A. Фанчулли и Г. Веннингом, во время сна у 40% пациентов замечено ночное апноэ. На поздних стадиях заболевания следует избегать условий для развития пневмонии. Кроме того, МСА сопутствует гипертензия в позе лёжа. Во время сна у пациентов отмечается нарушение движений глазных яблок во время быстрого сна [5]. Также замечено уменьшение потоотделения, недержание (в т.ч. ночной полиурией), у мужчин – эректильная дисфункция. При этом следует учитывать, что последние два из перечисленных симптомов могут быть не связаны с МСА. Но в любом случае требуется превентивное и постоянное лечение инфекций мочевыводящих путей.
На более развитых стадиях болезни у 50% пациентов по статистике Фанчулли и Веннинга испытывают парализующую боль. Характерным условием для развития этого симптома была дистония. Симптом чаще наблюдается у женщин.
В обыденной жизни пациенты сталкиваются не только с ограничениями медицинского характера, но и с каждодневными трудностями, которые накладывает болезнь. Внешние проявления болезни выражаются в необычной походке, положении головы. Из-за спазмов на лице больных МСА иногда появляется “сардоническая улыбка”. При МСА-п непроизвольно происходит сильный наклон или вытягивание головы вперёд. Скованность и замедленность движений затрудняют выполнение рутинных задач.
Редкое заболевание известно далеко не всем, и порой вызывает непонимание окружающих. Поэтому в публичных местах из-за физических ограничений пациенты испытывают стресс, ограничивают себя в социализации, избегают людных мест, что создаёт дополнительные факторы для усугубления сопутствующей депрессии и психологического дискомфорта (см. «нейропсихологические проявления», Табл. 1).
Урология
2. Увеличенный объём остаточной мочи, недержание
Жалобы на хронический запор
Преобладает при МСА-п
4. Тремор покоя или движения
Преобладает при МСА-ц
Заметна скованность движений
2. Гиперрефлексия
5. Дневная сонливость (17%)
6. Неприятные ощущения в нижних конечностях (синдром беспокойных ног)
*Клинические проявления МСА среди 437 пациентов, EMSA-registry.
Карло Колозимо предлагает синтетическую таблицу основных и дополнительных критериев диагностики МСА (Таблица 3.5, глава “Multiple system atrophy”, Carlo Colosimo, David E. Riley, Gregor K. Wenning, Handbook of Atypical Parkinsonism, Cambridge University Press, 2011, P. 36.)
Основные критерии:
Дополнительные симптомы
Диагностика заболевания, как уже было сказано, затруднена. Нет единого критерия или сочетания симптомов, которые могли бы однозначно указать на МСА с самого начала болезни. Выход на финальный диагноз проводится методом исключения по мере её развития. При всех общих неизвестных, первостепенным аргументом для подтверждения МСА остаётся снимок МРТ (как минимум 1,5 тесла). Но анализ МРТ на начальных стадиях не даёт точной уверенности, поэтому как правило первоначальным диагнозом становится болезнь Паркинсона (БП). Более достоверное выявление потери нейронов возможно на снимках ПЭТ (PET, позитронно-эмиссионная томография) или ОЭМТ (SPECT,однофотонная эмиссионная компьютерная томография).
Подтипы МСА изображены на фиг. 1 и 2. [1]
Фиг. 1 А : двусторонняя атрофия в области скорлупы, гиперинтенсивность края (отмечено стрелочками). В-С : гиперинтенсивность двустороннего кортикопинального тракта в кортикальной и подкорковой предцентральной извилине и за пределом тракта (С).
Фиг. 2 A : “крест” в области варолиевого моста (“hot cross bun” (англ.) – по внешней схожести с пасхальным хлебом “мазанецем”, “крестовой булочкой”), B-C : гиперинтенсивность в области двустороннего кортикопинального тракта в подкорковой предцентральной извилине и за пределом тракта (С).
При МСА-п (паркинсонического типа, MSA-p)(характерный снимок-см. Фиг. 1) заметны проявления брадикинезии и ригидности; гипокинетической дизартрии; постуральная неустойчивость; часто – тремор покоя.
На 2003 г. случаи паркинсонического подтипа встречались вдвое-вчетверо раз чаще, чем МСА-ц в западном полушарии. Однако МСА-ц чаще встречается в Японии. По собранной на данный момент статистике МСА-п начинает уступать по частоте МСА-ц.
МСА-ц (оливоцеребеллярная атрофия, MSA-c)(характерный снимок – см. Фиг. 2) характеризуется прежде всего мозжечковой атаксией; постепенным, но неуклонным затруднением движения, речи и походки, а также движения глазных яблок и работы верхних век. У пациентов с МСА-ц чаще наблюдается тремор действия, например, при доставании предметов. Мышечная слабость при МСА-ц может привести к невнятной речи и попёрхиванию при глотании. Яркие проявления обнаруживаются среди ортостатических расстройств кровообращения: у пациента могут быть обмороки, слабость с головокружнием, тошнота, дрожь, боль области шеи и плеч. Мозжечковая дисфункция проявляется на более ранних стадиях и сочетается более заметным затруднением дыхания во время сна.
В статье французской исследовательской группы из Тулузы MRI Supervised and Unsupervised Classification of Parkinson’s Disease and Multiple System Atrophy приводится предварительный вывод многостороннего анализа снимков МРТ пациентов обоих подтипов МСА. На развитой стадии МСА (начало болезни наблюдаемых варьировалось между 5 и 7 годами) с высокой степенью вероятности можно отличить МСА от БП, опираясь только на МРТ-данные. Изменения отображаются на снимках в области:
1) лучистого венца верхнего отдела пирамидного пути (обе стороны),
2) верхней извилины лобной доли.
Для МСА-п характерны сокращение фракционной анизотропии в скорлупе, дополнительной моторной области и лучистом венце верхнего отдела пирамидного пути. Исходя из снимков МРТ, труднее отличить от бП МСА церебеллярного типа [7].
С помощью фтордеоксиглюкозы на снимках ПЭТ видны гипометаболизм в стриатуме, в основном в путамене, также стволе головного мозга и мозжечке при МСА-п. При МСА-ц – в основном в путамене, а также может быть заметна потеря допаминергических нейронов нигростриарного пути.
| Тест | Типичный результат |
| Кардиоваскулярные тесты | Ортостатическая гипотензия Низкий коэфициент при пробе Вальсавы Слабое выделение норадреналина в лимфе, слабое сосудосужение |
| Определение уровня глюкозы | Слабый релизинг гормона роста (спорный результат) |
| Тест терморегуляции и количественный тест вызванного судомоторного аксон-рефлекса | Судомоторная дисфункция, проявляющаяся гипо- ангидрозом |
| Электрофизиологические исследования (sympathetic skin response) | Кожный симпатический потенциал либо отсутвует, либо аномальный |
| Тест цереброспинальной жидкости | Повышенный уровень нейрофиламентов |
| Электромиография наружного сфинктера заднего прохода | Либо денервация, либо раздражение (нерелевантные результаты) |
| Транскраниальная сонография | Гиперэхогенность чечевицеобразного ядра и нормальная эхогенность чёрной субстанции |
| Компьютерная томография | Не дала результатов |
| МРТ на 1,5 тесла | Аномалии в базальных ганглиях, «крест» в области варолиевого моста, атрофия мозжечка или ствола мозга |
| ДВИ (диффузно-взвешенное изображение) | Диффузность в области путамена, варолиева моста и средней ножки мозжечка |
| Волюметрия | Потеря объёма в путамене при МСА-п, потеря объёма в стволе и мозжечке при МСА-ц |
| Cканирование с радиоактивным изотопом-метайодобензилгуанидином MIBG | В норме |
| Сканирование переносчиков Иофлупаном I123 (123I-FP-CIT SPECT imaging) | Недостаток транспортёров дофамина в полосатом теле |
| Сканирование переносчиков йодобензамидом I123 123I-IBZM-SPECT | Недостаток транспортёров дофаминового рецептора D2 в полосатом теле |
| ПЭТ с флуородопой | Недостаток захвата флуорисцентной леводопы |
| ПЭТ с раклопридом | Недостаток транспортёров дофаминового рецептора D2 в полосатом теле |
| ПЭТ с изохинолиновым карбоксамидом PK-11195 | Микроглиальная активация в области базальных ганглий и ствола мозга |
| ПЭТ с использованием радиофармпрепарата фтордеоксиглюкозы | Замедленный метаболизм |
Благодаря дополнительным тестам на данный момент выявлены несколько направлений, в которых будет развиваться диагностика. Они базируются не только на исключении других болезней или изучении снимков ПЭТ (см. Табл. 3, Типичные результаты дополнительных тестов.), но и на анализе офтальмологических особенностей МСА, терморегуляции, дисфункции вегетативной системы. Остановимся на результатах некоторых из них.
Офтальмологические особенности МСА
Целевое ретроспективное наблюдение больных МСА в клинике Мэйо (Рочестер, Миннесота, США) позволило выявить основные аномалии зрения, сопутствующие заболеванию. Из 285 рассмотренных случаев были отобраны 39 пациентов с подтверждённым диагнозом. Среди пациентов с МСА-п 14 человек жаловались преимущественно на синдром сухого глаза, у 13-ти были выявлены асинхронность глазных движений. У 7-х было отмечено смещение или ограничение движения глазного яблока, у одного пациента наблюдалась монокулярная диплопия (двоение изображения для одного глаза) из-за аномального роста ресниц. Единичными случаями стали двусторонняя атрофия зрительного нерва и синдром Холмса – Эйди (парасимпатическая денервация зрачка, проявляющаяся мидриазом со снижением, а иногда и полным исчезновением способности зрачка сужаться, реагируя на свет ).
Следует различать аномалии, которые по независимым причинам сопровождают МСА, и те, которые проистекают из заболевания. К последним относятся, по предположению учёных, атрофия глазного нерва и рубцевание конъюнктивы (рубцовый пемфогоид).
Среди наблюдаемых с МСА-ц офтальмологические особенности чаще всего проявляются в асинхронности движения и смещении глазного яблока. Особо выделена корреляция длительности жизни пациентов после установления диагноза и зрительными аномалиями, за исключением синдрома “сухого глаза”. В связи с этими наблюдениям медики призывают пациентов с МСА регулярно проходить офтальмологическое обследование с целью раннего выявления аномалий и предупреждения несчастных случаев по причине плохого зрения [2].
Особенности ортостатического давления и пульса при МСА
Среди критериев, указывающих на вероятное развитие болезни, отмечено падение ортостатического давления. Ортостатическая проба заключается в замере давления стоя. За три минуты в стоячем положении систолическое давление падает как минимум на 20-30 мм.рт.ст., а диастолическое – на 10-15 мм.рт.ст. при заниженном сердцебиении. Поэтому пациентам с МСА желательно носить абдоминальный бандаж, компрессионное бельё, увеличить частоту потребления воды и соли, а также медикаментов для повышения артериального давления.
Признаки тахикардии с гипотонией являются характерной особенностью пациентов с вегетативными нарушениями. Но диапазон нарушений пока ещё не изучен. В статье Orthostatic Heart Rate Changes in Patients with Autonomic Failure caused by Neurodegenerative Synucleinopathies сообщается о диапазоне ортостатических изменений сердечного ритма у пациентов с вегетативной недостаточностью, в том числе и при МСА.
При МСА речь идёт о вегетативной нервной системе. Ортостатическая гипотензия вызвана нарушением активации симпатических вазоконстрикторных нейронов. Сердечный пульс значительно выше у пациентов с МСА в отличие от других пациентов с заболеваниями, связанными с образованием телец Леви, и в частности БП. Заметное повышение сердечного ритма при МСА объясняется тем, что постганглионарные волокна и их аксоны остаются почти незатронутыми, однако при этом констатируется потеря вегетативных нейронов головного и спинного мозга [3]. Это, например, проявляется в том, что у пациентов с МСА очень низкая температура конечностей: холодные ладони и ступни [4].
Потоотделение при МСА
У пациентов с МСА, по сравнению с БП, значительно ниже показатели потоотделения ладоней и особенно ступней. Гипогидроз (пониженная потливость) или вовсе отсутствие потоотделения при МСА считается связанными с дегенерацией центральных предганлиев [6].
Изучение МСА затруднено редкостью заболевания, затруднённой диагностикой на начальной стадии и тем, что до сих пор не найдены способы эффективного торможения болезни. Интерес к разносторонним проявлениям болезни может в будущем привести к раннему выявлению заболевания, улучшенному лечению и повышению качества жизни пациентов.
Термины:
Проба Вальсальвы (напряжение по Вальсальве) — это форсированное выдыхание при закрытом носе и рте.
Гипокинетическая дизартрия — вид экстрапирамидной дизартрии, возникающий при поражении подкорковых узлов и их нервных связей.
Стриатонигральная дегенерация — спорадическое прогрессирующее нейродегенеративное расстройство, которое представляет собой одно из проявлений МСА. Проявляется, как правило, в снижении численности нейронов и глиозом в скорлупе, черной субстанции, стволе и мозжечке, а также в дегенерации клеток боковых рогов спинного мозга.
Оливопонтоцеребеллярные дегенерации — наследственные дегенеративные заболевания ЦНС, объединенные сходной локализацией патологического процесса в мозжечке, нижних оливах и мосте головного мозга.
Глазной рубцовый пемфигоид — заболевание, при котором происходит рубцевание конъюнктивы у пациентов пожилого возраста.
Монокулярная диплопия — ви́дение одним глазом двух или более изображений предмета.
Подготовила: Мартемьянова Е.О.
Помощь в редакции: Оськин С.
Carlo Colosimo, David E. Riley, Gregor K. WenningHandbook of Atypical Parkinsonism, Cambridge University Press (2011).
Fanciulli, Alessandra, and Gregor K. Wenning. “Multiple-system atrophy.” New England Journal of Medicine 372.3 (2015): 249-263.