Что такое наночастицы в медицине
Наномедицина будущего: трансдермальная доставка с использованием наночастиц
Применение нанотехнологий в медицине в ближайшем будущем обеспечит возможность доставки практически любого потенциально активного соединения точно по адресу
Автор
Редакторы
Стоит сразу оговорить, что в данной статье речь пойдет не о каких-то чудодейственных средствах, которые активно предлагаются с прилавков магазинов или на различных сомнительных веб-сайтах (часто слово «нано» и «стволовые клетки» употребляют в таком случае в одном контексте — видимо, чтоб уж наверняка). Здесь мы кратко обсудим существующие и наиболее перспективные варианты молекулярных конструкций (или далее — наночастиц), которые уже используются или будут активно применяться в будущем для прямой доставки биологически активных молекул через кожу.
Введение
Для того чтобы преодолеть роговой слой кожи (лат. — stratum corneum), являющийся основой барьерной функции покровов тела, на практике используются методы физического и химического воздействия. В тоже время наука не стоит на месте, и в лабораториях по всему миру ученые активно разрабатывают новые и высокоэффективные подходы в трансдермальной доставке, которые настолько обнадеживают, что складывается впечатление, будто в ближайшем будущем практически любое потенциально активное соединение — гидрофильное или гидрофобное, низкомолекулярное или полимерное (в том числе, белки и молекулы нуклеиновых кислот), — не составит труда доставить точно по адресу. Именно эти достижения и хотелось бы вынести из лабораторных кулуаров на всеобщее обозрение. И так, речь пойдет о нанотехнологиях и их применении в медицине (наномедицине). В России это слово, в свете последних государственных инициатив, наверняка знакомо даже школьнику, и практически стало именем нарицательным. Поэтому читателям, как мне кажется, будет небезынтересно познакомиться поближе с этой областью в уже упомянутом контексте.
Барьерные свойства рогового слоя
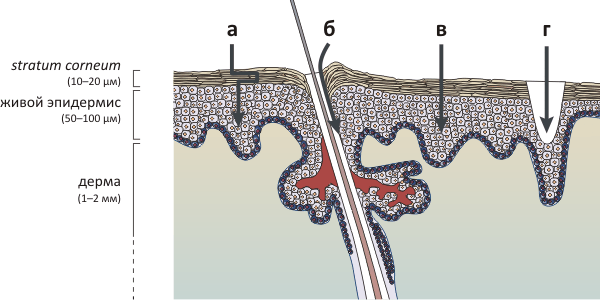
Кожа является естественным барьером на пути инородных молекул и частиц, стремящихся попасть в организм. Само ее строение таково, что препятствует проникновению крупных гидрофильных молекул, а также воды — что предотвращает обезвоживание организма, позволяя, тем не менее, коже «дышать». Основной «линией обороны» является самый верхний и тонкий слой кожи — роговой слой (stratum corneum).
Роговой слой состоит из корнеоцитов — мертвых клеток, заполненных фибриллярным белком кератином и образующих роговые «чешуйки» толщиной 0,2–0,4 μм и ≈40 μм в диаметре. Корнеоциты соединены между собой корнеодесмосомами, связывающими клетки в прочную сеть. Непроницаемым роговой слой делает липидный матрикс, в который «погружены» корнеоциты; он состоит в основном из церамидов, холестерина и жирных кислот, образующих систему мультиламеллярных бислоев. Ниже находится слой живых эпидермальных клеток и слой дермы, пронизанной капиллярами, способными «разнести» проникшее через барьер вещество по всему организму.
Стрелками на рисунке показаны возможные пути проникновения веществ через кожу — как с помощью пассивного переноса, так и под действием физических и химических факторов. а — «Извилистый» путь трансдермальной диффузии может быть облегчен с помощью химических энхансеров — веществ, сравнительно легко преодолевающих липидный барьер и «увлекающих» за собой молекулы доставляемого лекарства. б — Низковольтный ионофорез облегчает проникновение веществ трансфолликулярным путем — через волосяные фолликулы и протоки потовых желез. в — Высоковольтная электропорация временно дестабилизирует липидные бислои, «приоткрывая» дверь доставляемому веществу. Сонофорез (ультразвук) дополнительно может увеличить эффективность путей переноса а и в. г — Микроиглы и термопорация создают в коже отверстия микронного размера, через которые может осуществляться транспорт. Из-за малости отверстий, эти процедуры безболезненны, а сами отверстия очень быстро затягиваются.
Наночастицы как они есть
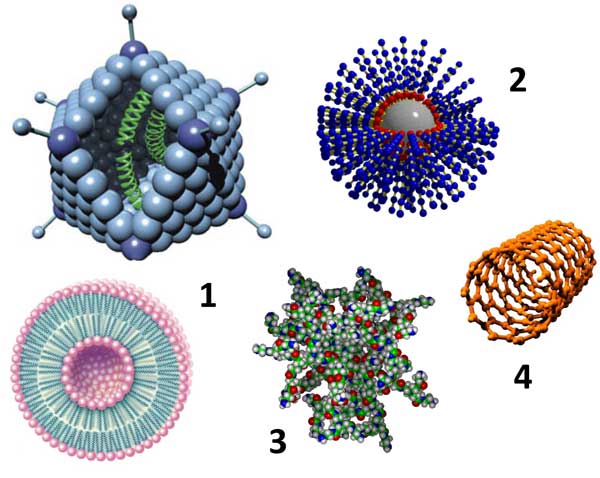
«Нано» (греч. — миллиардная доля) в применении к описываемым объектам подразумевает, что их размеры находятся в пределах 1–1000 нм (10 −9 м), что соответствует уровням биологической организации от атомарного до субклеточного. Таким образом, под определение «наночастицы», вообще-то, попадают практически любые супрамолекулярные комплексы. Однако, по уже сложившейся традиции в биологической и медицинской литературе, под наночастицами обычно подразумевают вполне конкретные (и, прежде всего, искусственно созданные) молекулярные конструкции. Их можно условно разделить на несколько классов (рис. 1).
Рисунок 1. Наночастицы, используемые в доставке терапевтических молекул. 1 — липосома и аденовирус; 2 — полимерная наноструктура; 3 — дендример; 4 — углеродная нанотрубка.
Биологические и биогенные наночастицы. Биологический мир буквально наполнен наночастицами — это ферменты (белки с каталитической активностью), молекулы ДНК и РНК, рибосомы, клеточные везикулы, вирусы и пр. Отличительной особенностью таких объектов является их способность к агрегации и самоорганизации. Это свойство активно используется при создании искусственных конструкций, имитирующих реальные биологические структуры. Яркий пример представляют собой различные однокомпонентные и мультикомпонентные липосомы, которые способны при определенных условиях формироваться из раствора смеси липидов. Часто на практике используют и уже существующие в природе биологические наночастицы. Например, различные вирусы активно применяют для генной модификации (трансфекции) клеток. Показано, что аденовирусы с подавленной системой репликации могут быть эффективно использованы и для местной неинвазивной вакцинации через кожу (доставке антигенов к клеткам Лангерганса, присутствующим в коже) [1]. К искусственным биогенным наночастицам, предназначенным для направленной доставки, помимо липосом обычно также относят липидные нанотрубки [2], липидные наночастицы и наноэмульсии, циклические пептиды [3], хитозаны, наночастицы на основе нуклеиновых кислот [4].
Полимерные наночастицы. Полимерные материалы обладают рядом преимуществ, определяющих эффективность их применения в технологиях доставки, — биосовместимость, способность к биодеградации, функциональная совместимость. Типичными соединениями, которые представляют основу для создания полимерных наночастиц, являются полимолочная и полигликолевая кислоты, полиэтиленгликоль (ПЭГ), поликапралактон и др., а также их различные сополимеры. ПЭГ часто используют для повышения стабильности различных молекулярных переносчиков. Например, липосомы, покрытые ПЭГ («стелс-липосомы»), по сравнению с обычными, менее подвержены биодеградации, в результате чего обладают заметным пролонгированным действием [5].
Дендримеры. Дендримеры являются уникальным классом полимеров с сильно разветвлённой структурой. При этом их размер и форма могут быть очень точно заданы при химическом синтезе [6]. Дендримеры получают из мономеров, проводя последовательные конвергентную и дивергентную полимеризации (в том числе используя методы пептидного синтеза). Типичными «мономерами», используемыми в синтезе дендримеров, являются полиамидоамин (ПАМАМ) и аминокислота лизин. «Целевые» молекулы связываются с дендримерами либо путём образования комплексов с их поверхностью, либо встраиваясь глубоко между их отдельными цепями. Контролируемые размеры и свойства поверхности, а также стабильность дендримеров делают их весьма перспективными для использования в качестве переносчиков. На животных моделях показана эффективность их применения для трансдермальной доставки ряда препаратов [7].
Углеродные наночастицы. Нанотрубки и фуллерены являются одними из самых «узнаваемых» наноструктур — практически ни один популярный текст про нанотехнологии не обходится без их изображений. За открытие этой новой формы существования углерода Р. Керл, Р. Смолли и Г. Крото в 1996 г. были удостоены Нобелевской премии по химии. Эти структуры, образованные только атомами углерода, могут быть получены при помощи вольтовой дуги, лазерной абляцией (выжиганием), химическим осаждением из газовой фазы, а также в процессе горения. Сегодня в промышленных масштабах фуллерены получают термическим распылением углеродсодержащей сажи в атмосфере инертного газа при пониженном давлении в присутствии катализатора. Нанотрубки обладают повышенным сродством к липидным структурам; при этом они способны образовывать стабильные комплексы с пептидами и ДНК-олигонуклеотидами [8, 9], и даже инкапсулировать эти молекулы [10, 11]. Это определяет их применение в области создания эффективных систем доставки вакцин и генетического материала [12].
Неорганические наночастицы. К этому классу обычно относят наноструктуры, полученные на основании оксида кремния, а также различных металлов (золото, серебро, платина). При этом часто такая наночастица имеет кремниевое ядро и внешнюю оболочку, сформированную атомами металла. Использование металлов позволяет создавать переносчики, обладающие рядом уникальных свойств. Так, их активность (и в частности, высвобождение терапевтического агента) может быть модулирована термическим воздействием (инфракрасное излучение), а также изменением магнитного поля [12]. При этом показано, что металлические наночастицы могут эффективно проникать вглубь эпидермиса [13].
Не только доставка
Использование описанных выше наночастиц в медицине позволит не только эффективно доставлять биологически активные молекулы сквозь различные барьеры организма, которые они не способны преодолевать самостоятельно (кожный, гематоэнцефалический), но и существенно изменять характер действия препарата. Например, трансдермальная доставка, по сравнению с доставкой через кровяное русло, позволяет избежать нежелательных побочных эффектов, снизить эффективную дозу препарата за счет существенного повышения его локальной концентрации. Кроме того, было показано, что у терапевтических молекул, доставляемых в организм с помощью наночастиц, меняется фармакокинетика. Если для препаратов, попадающих в организм перорально или в результате инъекции, увеличение концентрации во времени описывается характерной кинетической кривой первого порядка (концентрация экспоненциально увеличивается во времени), то в случае использования наночастиц наблюдается идеальная временная зависимость нулевого порядка (равномерное увеличение концентрации препарата во времени) [12]. Это позволяет более точно планировать дозировки препарата и пролонгировать его действие.
Наномедицина или нанокосметика?
Упомянутые методики доставки на основе наночастиц, а также общий уровень развития современной молекулярной биологии, биотехнологии и фармакологии, существенно модифицируют представления о возможностях кожной терапии. С одной стороны, это обеспечивает заметный прогресс в области медицины (в частности, дерматологии), с другой — позволяет косметическим препаратам выйти на качественно новый уровень. Действительно, от нанокосметики будущего стоит ожидать, что в основе её действия будет лежать не маскировка нежелательных эффектов, как зачастую это происходит на сегодняшний момент, а устранение их биологической причины. Но как же в таком случае разграничить сферы косметики и медицины? Возможно, что такие границы и вовсе исчезнут в будущем, пока же отметим возможные точки их соприкосновения.
Обойдемся без шприцов
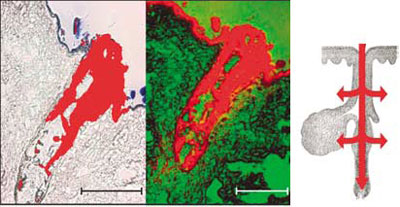
Рисунок 2. Проникновение наночастиц (40 нм) внутрь волосяного фолликула. На рисунке представлены изображения, полученные с помощью флуоресцентной (чёрно-белое) и лазерной сканирующей (черно-зеленое) микроскопии, а также схематически показан волосяной фолликул. Красный цвет соответствует флуоресцентному сигналу, регистрируемому от наночастиц. В работе использованы препараты человеческой кожи, полученные от пациентов из отделения пластической хирургии.
Многочисленные прививки от всевозможных заболеваний стали привычными для современного человека. Однако сама методика практически не изменилась за последнее столетие. Впрочем, скоро пациентам можно будет по праву цитировать известный стишок С. В. Михалкова: «Я прививки не боюсь». На смену шприцам с раствором антигенов в ближайшем будущем придут нанопереносчики (размеры до 500 нм), способные доставлять антигены через stratum corneum к клеткам Лангерганса. Эффективность таких конструкций показана в лабораторных исследованиях, однако детальные механизмы до сих пор остаются неизвестными. Тем не менее, экспериментально установленные ограничения в размерах эффективных переносчиков позволяют предположить, что проникновение во внутренние слои кожи осуществляется через липидные каналы между корнеоцитами [15]. Также было показано, что использование малых наночастиц (всего 40 нм) позволяет доставлять антигены непосредственно через волосяные фолликулы [16] (рис. 2). Использование такого пути доставки является крайне перспективным, поскольку в области фолликулов находится не только скопление дендритных клеток, но также обнаружены и стволовые клетки. Это обеспечивает возможность не только кожной иммунизации, но также и направленной дерматотерапии, включающей стимуляцию клеточной пролиферации [17].
«ДНК-косметика» — это реально?
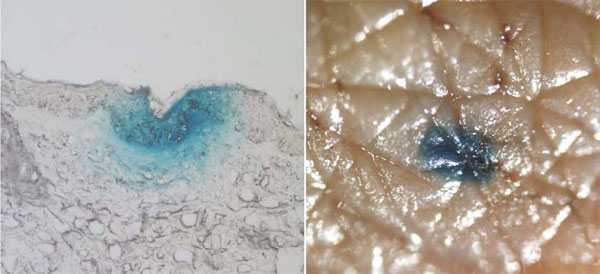
Способность влиять на генную экспрессию клеток кожи, а также доставлять разные «полезные» гены — весьма заманчивая идея, причем настолько, что современные косметические производители нередко занимаются ее воплощением. правда, пока только на словах. Тем не менее, существуют и реальные подвижки в этой области. Хотя вопрос «что доставлять» остается открытым, и потребуется еще немалое время для его решения, вопрос «как доставлять» уже имеет конкретные ответы. Например, сочетание подходов физического (радиочастотного) воздействия и использования наночастиц позволяет проводить эффективную эпидермальную доставку ДНК-плазмид (кольцевых молекул ДНК, способных вызывать экспрессию, находящихся в них генов в клетках-мишенях) [18]. При этом исследователям удалось не только доставить молекулы ДНК, но и наблюдать их экспрессию в клетках кожи (рис. 3).
Рисунок 3. Доставка генетического материала (ДНК-плазмид) в клетки кожи. ДНК-плазмиды содержат ген β-галактозидазы (фермента-репортера, экспрессию которого можно выявить с помощью специфического окрашивания по субстрату). Синий цвет соответствует области, в которой наблюдается экспрессия целевой плазмиды. Показаны микроскопические изображения среза (слева) и поверхности кожи (справа). В работе использованы препараты человеческой кожи, культивируемой ex vivo. В качестве системы доставки использованы частицы 100 нм, содержащие ДНК-плазмиды. Их проникновение в кожу потенциировано радиочастотным воздействием с помощью прибора ViaDerm™.
Заключение
Несмотря на многообещающие результаты исследований, упомянутых в этом кратком обзоре, необходимо отметить, что большинство из них посвящено лишь экспериментам на лабораторных животных или даже модельных системах. Тем не менее, учитывая повышенный интерес к описанным технологиям со стороны фармацевтики и косметологии, достаточно скоро станет вполне возможно говорить о нанокосметике и кожной наномедицине не в отдалённой перспективе, а всерьез.
Первоначально статья опубликована в журнале «Косметика и Медицина» № 2 за 2008 г. [19].
Наночастицы — инструмент адресной доставки лекарств
Опухоль в момент атаки наночастицами
Автор
Редакторы
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Биофармацевтика» конкурса «био/мол/текст»-2018.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Антибиотики при инфекции и раке
Противоопухолевые антибиотики отличаются от антибиотиков, применяющихся для лечения бактериальных инфекций. Данные вещества взаимодействуют с ДНК в организме человека и останавливают процесс деления клеток. Сегодня для лечения опухолей широко используют антибиотики антрациклинового ряда, например, дауномицин, доксорубицин и эпирубицин. В этой статье словом «антибиотики» будут обозначаться именно такие вещества.
Зачем нужна адресная доставка лекарств?
Взаимодействие биологических и наноразмерных систем подробно рассмотрено в статье «Невидимая граница: где сталкиваются “нано” и “био”» [2]. — Ред.
На «Биомолекуле» уже была серия материалов, посвященная вопросам адресной доставки и применению нанотехнологий в медицине [4–11]. — Ред.
Липосомы: все дело в волшебных пузырьках
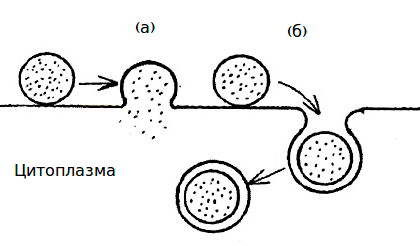
Рисунок 1. Типы взаимодействия липосом с клеточной мембраной: слияние (а) и эндоцитоз (б)
Липосомы — это сферические пузырьки из двойного слоя липидов размером 25–100 нм, заполненные жидкостью. Липосомы эффективны, потому что состоят из нативных липидов и обладают высоким сродством к клеточным мембранам. После контакта с плазматической мембраной, содержимое липосом проникает в клетку при слиянии мембран, или по пути эндоцитоза (рис. 1).
Противоопухолевый антибиотик доксорубицин был открыт в 1960-х годах и широко применяется в химиотерапии метастазирующих опухолей и рака молочный железы [12], [13]. Однако применение доксорубицина было ограничено из-за его побочного действия на сердце. Адресная доставка этого вещества к опухоли может решить эту проблему, снизив системную токсичность и эффекты на сердце. Первый внедренный в терапию препарат доксорубицина на основе липосом — «Миоцет» — представляет собой соль доксорубицина (10–15 тыс. молекул), заключенную в бислойный липидный пузырек. Бислой сформирован фосфатидилхолином и холестерином, которые содержатся в клеточных мембранах. Преимущества «Миоцета» перед свободным доксорубицином — более медленное выведение из организма и иное распределение препарата в организме. При этом значительно снижается опасное накопление антибиотика в сердечной мышце [14].
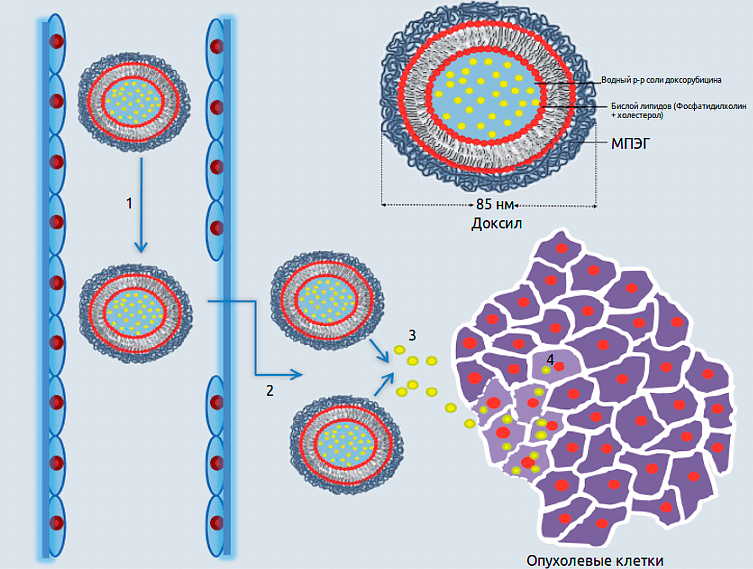
Липосомы другого препарата доксорубицина — «Доксила» — содержат положительно заряженный липид дистеароилфосфатидилэтаноламин, ковалентно сшитый с полимером метоксиполиэтиленгликолем (МПЭГ) (рис. 2). Дополнительный слой оболочки из производного полиэтиленгликоля позволяет «обмануть» иммунные клетки (фагоциты), препятствуя поглощению липосом и увеличивая время циркуляции таких «стелс-липосом» в организме. «Доксил» был одобрен FDA для лечения рака молочной железы и яичников в 1995 году [14].
Рисунок 2. Строение липосом «Доксила» и путь транспорта липосом в опухоль. Дополнительная оболочка из МПЭГ позволяет «обмануть» фагоциты иммунной системы.
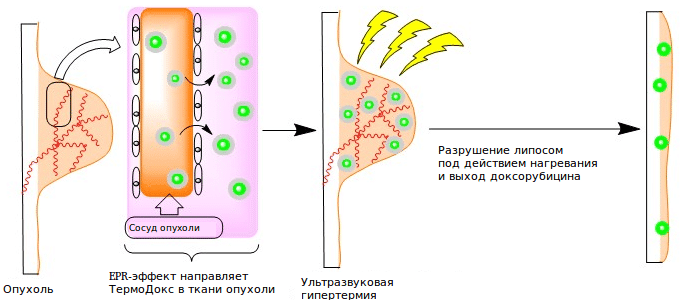
В препарате нового поколения — «Термодоксе» — селективность действия дополнительно увеличена за счет инновационного подхода «контролируемого высвобождения». Липосомы «Термодокса» термочувствительны: они разрушаются и высвобождают доксорубицин при нагревании опухоли до 43 °С. «Термодокс» применяют для лечения твердых опухолей. Прием лекарства проводят в сочетании с прогреванием опухоли ультразвуком (рис. 3).
Рисунок 3. Доксорубицин высвобождается из липосом «Термодокса» под действием ультразвуковой гипертермии
На примере доксорубицина и ряда других антибиотиков с опасными побочными эффектами была доказана эффективность и безопасность липосомальной доставки. EPR-эффект — основная движущая сила, направляющая наночастицы в опухоль. Однако чрезмерная плотность слоев раковых клеток препятствует доставке препарата вглубь опухоли. Также не все опухоли демонстрируют EPR-эффект: например, поры отсутствуют в сосудах опухолей головного мозга. Поэтому для повышения эффективности доставки могут использоваться некоторые клеточные механизмы транспорта. В настоящее время исследуют наночастицы, проникающие в опухоль за счет взаимодействия рецепторов на мембранах раковых клеток с лигандами на поверхности наночастиц [6].
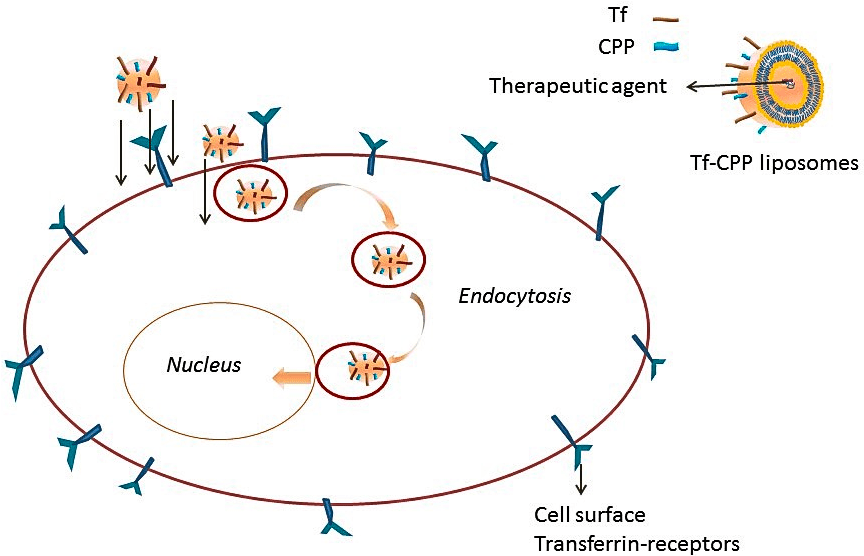
Одним из них является рецептор трансферрина — TfR, — необходимый для импорта железа в клетку. Трансферрин — это белок, образующий комплексы с ионами железа [15]. Свободное железо токсично для организма, поэтому в организме оно связано в комплекс с трансферрином. В свою очередь, комплекс взаимодействует с рецептором TfR на поверхности клеток и проникает внутрь по механизму эндоцитоза (рис. 4). Такие липосомы активно захватываются из сосудов опухоли мозга клетками эндотелия.
Рисунок 4. Трансферриновые липосомы активно проникают в клетку за счет взаимодействия с рецептором TfR. Молекулы трансферрина пришиваются к липосоме за свободные концы ПЭГ.
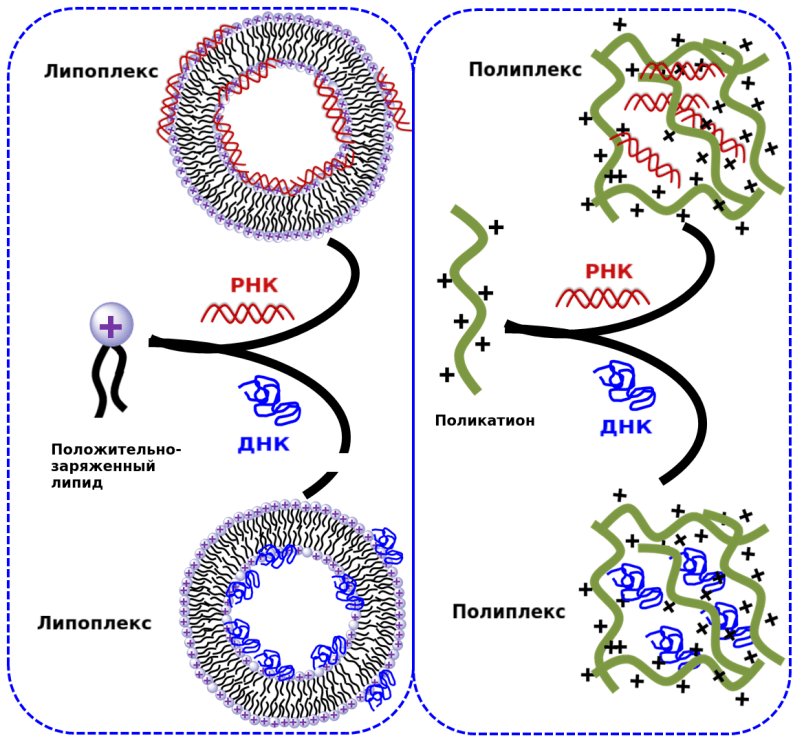
Липоплексы: способ доставки нуклеиновых кислот
Одна из разновидностей липосом — липоплекс — применяется для доставки в раковые клетки коротких интерферерующих РНК (киРНК) (рис. 5). Открытие РНК-интерференции [16] и ее внедрение в терапию опухолей потребовало разработки новых носителей и модификации уже существующих — из-за наличия отрицательного заряда у молекул РНК. В основе РНК-интерференции лежит взаимодействие киРНК длиной 20–25 нуклеотидов и комплементарной ей мРНК-мишени, приводящее к разрушению последней. С помощью нее можно подавить аномально высокую транскрипцию или транскрипцию гена с мутацией, характерную для раковых клеток [16]. Такие «целебные» киРНК часто называют антисенсами [17].
Рисунок 5. Схема строения липоплекса и полиплекса
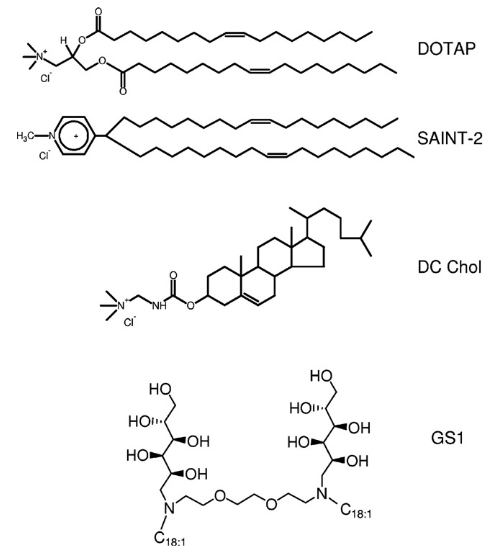
Данный вид терапии невозможен без адресной доставки, поскольку время жизни свободной РНК в крови исчисляется минутами, а распознавание свободной нуклеиновой кислоты иммунной системой дает аллергические реакции. Для доставки РНК могут использоваться липоплексы. Липоплекс — это липосома, содержащая липиды с положительно заряженными аминогруппами: с ними и взаимодействуют фосфатные группы РНК (рис. 6) [18].
Рисунок 6. Структурные формулы некоторых положительно заряженных липидов
В отличие от незаряженных липосом, липоплексы проникают в клетку по механизму эндоцитоза. При этом вокруг липоплекса формируется эндосома. Аминогруппы липоплекса нарушают кислотно-щелочной баланс (рН) внутри эндосомы, что приводит к ее разрушению и выходу РНК в цитоплазму. Разработан ряд липосомных препаратов киРНК, некоторые из которых проходят клинические испытания (табл. 1) [19], [20].
| Препарат | Гены-мишени | Функция генов | Заболевания |
|---|---|---|---|
| ALN-VSP02 | KSP и VEGF | Моторный тубулин-зависимый белок, осуществляющий расхождение хромосом при митозе. Сигнальный белок для стимуляции роста сосудов | Рак печени |
| Atu027 | PKN3 | Регуляторный белок, сверхэкспрессирующийся в опухолевых клетках | Рак легких |
| TK080301 | PLK1 | Нейроэндокринные опухоли, адренокортикальный рак | |
| DCR MYC | MYC | Твердые опухоли, меланолма, лимфома |
Полиплексы: плюс на минус дает плюс?
Полиэлектролиты
Другие носители киРНК — поликатионы — высокомолекулярные соединения из положительно заряженных органических мономеров. В растворе они самопроизвольно образуют комплексы-наночастицы с отрицательно заряженными нуклеиновыми кислотами — полиплексы. Наиболее часто используемые поликатионы — полиэтиленимин, поли-L-лизин, полиамидоамин и хитозан (рис. 5) [21]. Полиплекс также проникает в клетку по пути эндоцитоза, где разрушает мембрану лизосом за счет сдвига pH внутри органоида [21], [22].
Эффективность поликатионов зависит от их молекулярной массы. Полиэтиленимин (ПЭИ) и полиамидоамин с высокой молекулярной массой отлично проникают в клетку, однако сами полимеры способны повреждать плазматическую мембрану, вызывая гибель клеток. Полимеры малой длины обладают минимальной токсичностью, но их эффективность невелика. Сополимеризация с гидрофобными молекулами, такими как ПЭГ, улучшает свойства носителя. Препарат ICS-283 компании Intradigm представляет собой сополимер ПЭИ, ПЭГ и пептида Арг—Гли—Асп, несущий киРНК к фактору ангиогенеза VEGF. В доклинических испытаниях показана высокая эффективность препарата [21].
Один из первых «натуральных» поликатионов — пептид поли-L-лизин — малоэффективен в немодифицированном виде, поскольку расщепляется лизосомальными протеазами, не разрушая оболочку эндосомы.
Другой широко используемый поликатион — хитозан (производное натурального полимера хитина) — слишком сильно взаимодействует с РНК и плохо диссоциирует внутри клеток. Модификация полимера по гидроксильной группе (С-3) и аминогруппе (С-2) гидрофобными молекулами жирных или жёлчных кислот повышает сродство полимера к клеточной мембране и одновременно ослабляет взаимодействие с киРНК [22].
Наномицеллы: совместить несовместимое
Подробнее о таких явлениях, как гидрофобность и амфифильнось, читайте в статье «Физическая водобоязнь» [23].
В водном растворе они самоорганизуются в наномицеллы, состоящие из гидрофобного «ядра» и заряженной «оболочки» из свободных хвостов полиэлектролита. Помимо преимущества наномицелл по основным характеристикам, они обладают и качественно новым свойством носителей. В оболочке могут располагаться молекулы РНК, а в гидрофобном ядре — нерастворимые соединения, например, некоторые антибиотики. РНК-интерференция рассматривается как вспомогательный элемент терапии рака, в дополнение к уже имеющимся методам. В частности, она способна подавить механизмы резистентности опухоли, повысив эффективность химиотерапии [22].
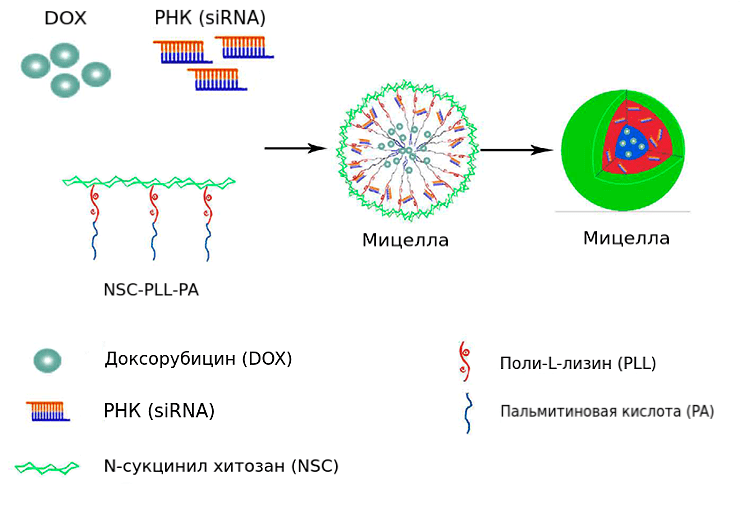
Активность транспортеров из группы белков множественной лекарственной устойчивости (multi-drug resistance, MDR) является одним из главных механизмов резистентности. Сверхэкспрессия гена белка P-gp (MDR1) из данного семейства колеблется от 30% до 70% в разных типах опухолей. Снижение экспрессии MDR1 возвращает чувствительность клеток к антибиотику. Однако для достижения кооперативного действия важно одновременное попадание обеих молекул в опухолевую клетку. При введении киРНК и антибиотика «по отдельности» вероятность того, что обе молекулы синхронно проникнут в одну и ту же клетку, слишком низка. Для проверки данной концепции были созданы трехслойные наночастицы.
В водном растворе полимер N-сукцинилхитозан–поли-L-лизин–пальмитат (NSC-PLL-PA) образует наномицеллы. Они доставляют в клетки доксорубицин и киРНК MDR1 одновременно (рис. 7) [24].
Рисунок 7. Строение амфифильной мицеллы для совместного транспорта киРНК и доксорубицина. В ядре находится пальмитат, в промежуточном слое — поли-L-лизин, а оболочка образована N-сукцинилхитозаном. При смешивании полимера с гидрохлоридом доксорубицина и киРНК MDR1 они распределяются в ядре и промежуточном слое соответственно.
Противоопухолевая активность комбинированного препарата в два раза выше, чем у мицелл с доксорубицином. Количество всевозможных комбинаций полимеров практически не ограничено и открывает широкий простор для исследователей.
Циклодекстриновые наночастицы: «бублик» для доставки лекарств
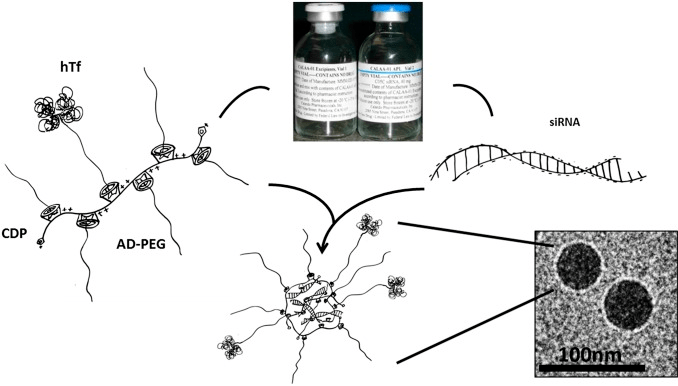
Очень высоким потенциалом для адресной доставки обладает сополимер поликатиона и циклодекстрина. Циклодекстрины — кольцевые олигомеры глюкозы с гидрофобной полостью [25]. В природе циклодекстрины встречаются как продукты неполного ферментативного гидролиза крахмала. Шестичленный α-циклодекстрин и семичленный β-циклодекстрин одобрены FDA для медицинского применения. Сополимеры циклодекстрина и поликатионов могут «сворачиваться» с образованием наночастиц в присутствии отрицательно заряженных молекул РНК. Находящиеся на поверхности циклодекстрины представляют собой ячейки, в которые могут помещаться гидрофобные молекулы. Ранее было обнаружено, что гидрофобная полость β-циклодекстрина вмещает в себя трициклический углеводород адамантан, образуя стабильный комплекс. К молекуле адамантана могут «довешиваться» те или иные молекулы, при этом он выступает в роли адаптера. В качестве производных адамантана могут использоваться адамантан-ПЭГ или адамантантрансферрин.
Первый препарат киРНК на основе циклодекстриновых наночастиц — CALAA-01 с киРНК к гену RRM2 (рис. 8) — проходит клинические испытания.
Рисунок 8. Структура препарата CALAA-01 на основе циклодекстриновых наночастиц. CALAA-01 состоит из четырех компонентов, входящих в состав двух растворов. В первом растворе содержится сополимер поликатиона и β-циклодекстрина (CDP), ячейки которого служат матрицей для адамантан-ПЭГ (AD-PEG) и адамантантрансферрина (hTf). Второй раствор содержит сайленсинг киРНК к гену рибонуклеотидредуктазы RRM2. При смешивании растворов происходит конденсация поликатиона и нуклеиновой кислоты с образованием 75-нанометровых наночастиц.
В ходе испытаний была показана высокая безопасность и эффективность доставки киРНК, а также снижение экспрессии RRM2 на 50% [26].
Белковые наночастицы
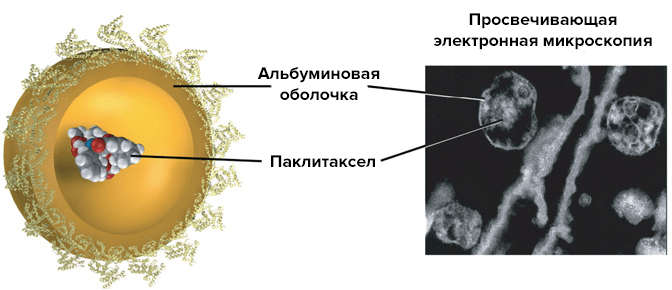
Некоторые белки (например, альбумин) способны образовывать наночастицы. Препарат на основе альбуминовых наночастиц называется «Абраксан» и содержит действующее вещество — паклитаксел. Это алкалоид с противоопухолевым эффектом, открытый примерно в то же время, что и доксорубицин. Однако он имеет серьезный недостаток, ограничивающий его применение. Молекулы паклитаксела гидрофобны, и чистый антибиотик нерастворим в воде. Ранее для введения использовался раствор препарата в кремофоре (производном касторового масла). Инъекции кремофора сами по себе вызывают тяжелые аллергические реакции, поэтому требовался прием пациентом иммуносупрессоров. В «Абраксане» паклитаксел помещен внутрь 130-нанометровой наночастицы альбумина (рис. 9). Использование «Абраксана» позволяет отказаться от применения кремофора. Также он обладает более высокой биодоступностью и активно проникает в клетку, в отличие от свободного паклитаксела. Транспорт «Абраксана» через мембрану происходит за счет взаимодействия альбумина с рецептором альбондином (gp60).
Рисунок 9. Строение наночастиц «Абраксана»
Наночастицы золота
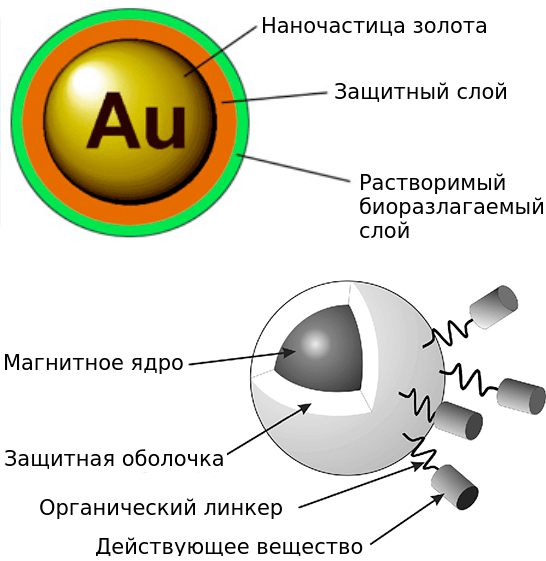
Помимо органических наночастиц, для адресной доставки активно применяют наночастицы металлов и оксидов — наночастицы золота и магнитные наночастицы (рис. 10). Металлы и их оксиды токсичны для организма, поэтому применяемые в медицине наночастицы несут защитную оболочку из полимера. Транспортируемые молекулы содержатся либо в составе оболочки, либо закреплены на поверхности через молекулу-линкер. Подробно ознакомиться с применением наночастиц золота можно в статье «Мал золотник, да дорог, или об использовании золотых наночастиц в бионанотехнологиях» [27].
Рисунок 10. Строение наночастиц золота, применяемых в медицине
В инновационном препарате «Ауримун» (Aurimune) 27-нанометровые наночастицы золота использованы в качестве носителя для белка фактора некроза опухоли (tumour necrosis factor, TNF). Препарат существенно расширяет возможности TNF в лечении рака. Свободный TNF был получен еще в 1980-х годах и продемонстрировал высокую противоопухолевую активность: считается, что он разрушает сосуды опухоли. Это нарушает питание раковых клеток и увеличивает проницаемость опухоли для антибиотиков. Однако избыточный TNF вызывает ряд побочных эффектов, таких как гипотония, гепатотоксичность и физическое недомогание. Доставка с помощью наночастиц снимает эти эффекты. Фармакологи сравнивают Aurimune с троянским конем, который преодолевает границы крепости опухоли и «тащит» за собой химиотерапевтические препараты. Развивая данный подход, разработчики добавили на поверхность «Ауримуна» упомянутый ранее паклитаксел. Полученный препарат второго поколения проходит доклинические испытания.
В отличие от органических наночастиц, наночастицы металлов и их соединений могут преобразовывать оптическое излучение в тепло за счет эффекта поверхностного плазмонного резонанса. На основании этого разработали две терапии — фототермическую и фотодинамическую. Первая основана на нагревании клеток, «поглотивших» наночастицу под действием БИК-излучения (БИК — ближняя инфракрасная область). Вторая терапия заключается во введении молекул-фотосенсибилизаторов, химически связанных с наночастицей. При активации светом, они реагируют с кислородом внутри клетки с образованием активных форм кислорода, которые запускают апоптоз (программируемую клеточную смерть). Обе активности наночастиц стимулируются электромагнитным излучением, поэтому перспективным подходом является комбинация указанных методов в единую терапию [27].
Препарат «Ауролаз» (Aurolase) — это комбинированные наночастицы из кремния и золота раковинообразной формы, обернутые в оболочку из ПЭГ. Препарат прошел клинические испытания для фототермической терапии опухолей легких, головы и шеи. В настоящее время препарат проходит испытания для терапии рака простаты. Поскольку «голые» частицы не несут действующего вещества, «Ауролаз» не обладает токсичностью, а направленное воздействие исключает повреждение здоровых тканей.
Магнитные наночастицы
Идея использовать магнитные наночастицы для доставки биоактивных молекул была предложена в 1970-х годах. С помощью магнитного поля частицы собираются в нужной точке в организме. Для этого разработали модифицированные аппараты МРТ. В качестве магнитного материала могут использоваться магнетит (Fe3O4), маггемит (Fe2O3), смешанные оксиды железа и других переходных металлов [28].
Магнитные наночастицы применяли в клинике много лет в основном как контрастирующие агенты для магнитно-резонансной томографии. Чтобы использовать их в качестве носителя для нуклеиновых кислот и лекарств, требуется создание подходящей защитной оболочки.
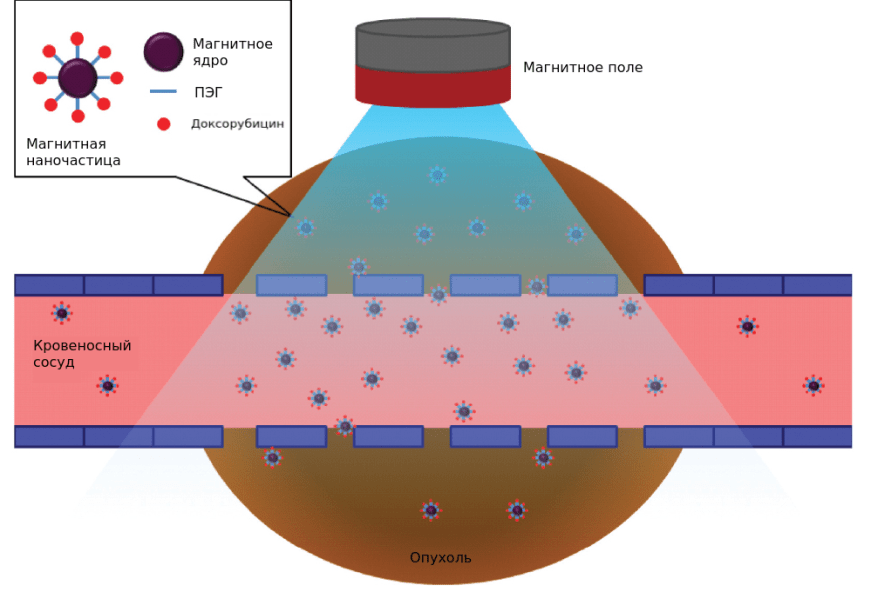
В настоящее время проведено всего несколько клинических испытаний с применением магнитных наночастиц. В 1996 году они были использованы для транспорта эпирубицина. Наночастицы были стабилизированы оболочкой из полимера глюкозы, на который сорбировался эпирубицин. Коллоидный раствор наночастиц представлял собой ферромагнитную жидкость, которая вводилась мышам в виде инъекций и направлялась в опухоль под действием магнитного поля (рис. 11) [29]. Магнитные наночастицы способны генерировать тепло в изменяющемся магнитным поле или БИК (так же, как и наночастицы золота). Терапия Nano-Cancer заключается во введении в опухоль 12-нанометровых наночастиц Fe3O4 с защитной оболочкой из полимера аминосилана. Установлено, что комбинированное воздействие магнитного поля и БИК создает исключительно высокое нагревание и эффективно подавляет рост опухоли [30].
Рисунок 11. Магнитное поле направляет магнитные наночастицы в опухоль
Наночастицы на основе графена
Графен — одномерный «лист» из атомов углерода. Начиная с 2008 года, производные графена — оксид графена (GO) и восстановленный оксид графена (RGO) — тестируются в качестве носителей для доставки лекарств. Они обладают исключительными физико-химическими свойствами: высокой площадью поверхности и делокализованными «ароматическими» электронами. Связывание препарата с носителем может осуществляться ковалентно через линкеры и/или через π-π стэкинг. Стэкинг позволяет взаимодействовать с гидрофобными молекулами, такими как доксорубицин, а также нуклеиновыми кислотами [31].
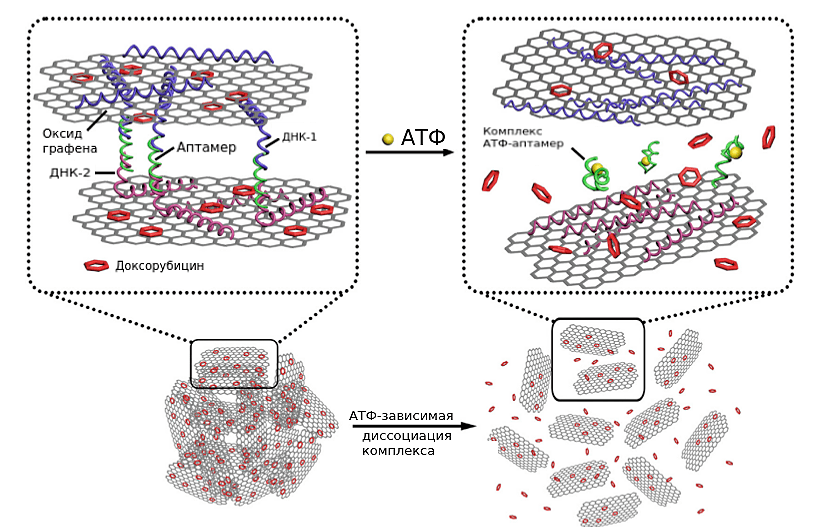
Наличие в составе полимеров большого количество ОН- и эпокси-групп открывает широкие возможности для модификации полимера. На основе оксида графена был описан примечательный препарат с контролируемым высвобождением доксорубицина (рис. 12). Его структура напоминает сэндвич из двух слоев оксида графена. Между слоями располагаются молекулы доксорубицина. К поверхностям «сэндвича» присоединены одноцепочечные молекулы ДНК, свободные концы которых сцеплены через АТФ-аптамер, играющий роль «застежки». В присутствии АТФ он меняет свою конформацию, и «застежка» расцепляется, выпуская доксорубицин [32].
Рисунок 12. Наночастицы оксида графена с АТФ-зависимым высвобождением доксорубицина. Свободные концы ДНК-1 и ДНК-2 комплементарно взаимодействуют с АТФ-аптамером. Таким образом образуется двухслойная структура из оксида графена. На слои оксида графена адсорбированы молекулы доксорубицина.
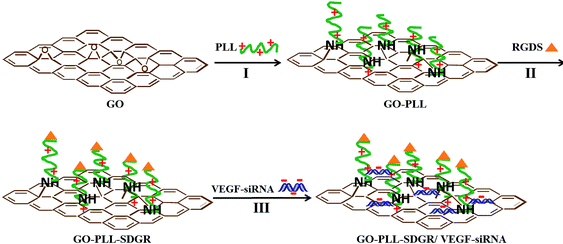
Для транспорта киРНК могут использоваться комбинированные полимеры оксида графена и полиэлектролитов. На поверхность оксида графена нанесли цепочки полилизина, на свободном конце которых был транспортный пептид RGDS, стимулирующий активный транспорт внутрь клеток за счет взаимодействия с рецептором. Комбинация электростатических и стэкинг-взаимодействий с нуклеиновыми кислотами создало высокую «емкость» этих наночастиц для киРНК. С помощью такой трехслойной структуры в опухоль была доставлена киРНК к гену ангиогенеза VEGF (рис. 13) [33].
Рисунок 13. Комбинированные наночастицы оксида графена и поли-L-лизина для транспорта сайленсинг РНК
Способность связываться как с нуклеиновыми кислотами, так и с антибиотиками делает графеновые материалы перспективными для комбинированной терапии по аналогии с наномицеллами.
Рынок адресной доставки
Не обойдем вниманием и экономический аспект внедрения наночастиц в терапию рака. Число публикаций по теме targeted drug delivery постоянно растет. В 2017 году вышло более двух тысяч таких публикаций, и было проведено 17 клинических испытаний. На сегодняшний день в авангарде разработки нанолекарств остаются небольшие стартапы, в то время как крупные фармацевтические компании обходят данную тематику. Причина —высокая стоимость производства препаратов. Однако более аккуратный расчет стоимости лечения, включающий госпитализацию и уход за больным в процессе химиотерапии, показал, что использование препаратов на основе наночастиц приводит к значительной экономии. Видимо, число таких исследований пока что недостаточно велико, чтобы побудить фармацевтических гигантов к выходу на этот рынок. Однако ситуация меняется уже сейчас, и к 2021 году ожидается рост рынка технологий лекарственной доставки на 24% по сравнению с состоянием на 2018 год [34–36].
Заключение
Сегодня мы регулярно слышим о новых возможностях, которые нам открывают нанотехнологии. Но как полноценно применить полученный опыт в лечении раковых заболеваний? Улучшить терапию можно путем совершенствования «системы наведения» и механизмов ликвидации раковой клетки.
Полагаю, что наночастицы будут иметь в составе несколько модулей и станут полноценными нанороботами [37]. Можно представить, как модули «системы наведения» такого наноробота будут ингибировать модуль ликвидации и диссоциировать от него по мере получения тревожного сигнала от клетки. Им может быть концентрация какого-нибудь внутриклеточного вещества-маркера опухолевых клеток. Для этих целей пригодятся антитела или аптамеры [38], [39]. Несколько «узнающих» модулей совместно контролируют модуль ликвидации по принципу логических операторов «И»/«ИЛИ» [40].
Управлять уничтожением клетки можно, либо используя описанное контролируемое высвобождение антибиотика, либо какой-нибудь ингибируемый фермент, производящий, к примеру, свободные радикалы [32], [41].
Таким образом, наноробот, попав внутрь клетки, сможет самостоятельно принимать решение о ее дальнейшей судьбе.