Что такое неметаллы определение
Неметаллы
Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее:
| Группа | III | IV | V | VI | VII | VIII |
| 2-й период | B | C | N | O | F | Ne |
| 3-й период | Si | P | S | Cl | Ar | |
| 4-й период | As | Se | Br | Kr | ||
| 5-й период | Te | I | Xe | |||
| 6-й период | At | Rn |
Кроме того, к неметаллам относят также водород [источник?] и гелий.
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов, их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
У некоторых неметаллов наблюдается проявление аллотропии. Так, для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода множество форм — алмаз, астралены, графен, графан, графит, карбин, лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры (нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты, а ещё возможны и другие модификации, например, чаоит и металлический углерод.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод.
См. также
Полезное
Смотреть что такое «Неметаллы» в других словарях:
НЕМЕТАЛЛЫ — НЕМЕТАЛЛЫ, химические элементы, которые не обладают свойствами, характерными для металлов. Неметаллы как правило плохие проводники тепла и электричества (они обычно являются изоляторами тепла и электричества). К неметаллам относятся углерод,… … Научно-технический энциклопедический словарь
НЕМЕТАЛЛЫ — химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов. К неметаллам обычно относят 22 элемента: газы водород, азот, кислород, фтор, хлор и благородные газы; жидкость бром; твердые тела бор,… … Большой Энциклопедический словарь
НЕМЕТАЛЛЫ — хим. элементы, которые образуют в свободном состоянии простые вещества, не обладающие физ. и хим. свойствами (см.); устаревшее название металлоиды. К Н. принято относить 22 элемента Периодической системы элементов Д. И. Менделеева (см.): водород … Большая политехническая энциклопедия
неметаллы — химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов. К неметаллам обычно относят 22 элемента: газы водород, азот, кислород, фтор, хлор и благородные газы; жидкость бром; твёрдые тела бор,… … Энциклопедический словарь
Неметаллы — [nonmetals, metalloids] химические элементы, которые образуют простые тела, не обладающие характерными для металлов свойствами. К неметаллам относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии Н, N, О, F, Cl … Энциклопедический словарь по металлургии
Неметаллы — химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов (См. Металлы). Название Металлоиды, которое иногда применяют для Н., выходит из употребления. К Н. относятся 22 элемента. Из них при… … Большая советская энциклопедия
НЕМЕТАЛЛЫ — простые в ва, не обладающие св вами металлов. Хотя резкой границы между металлами и Н. провести нельзя, к Н. принято относить благородные газы, водород, галогены, кислород, халькогены, азот, фосфор, мышьяк, углерод, кремний и бор … Большой энциклопедический политехнический словарь
НЕМЕТАЛЛЫ — хим. элементы, к рые образуют простые тела, не обладающие свойствами, характерными для металлов. К Н. обычно относят 22 элемента: газы водород, азот, кислород, фтор, хлор и благородные газы; жидкость бром; тв. тела бор, углерод, кремний, фосфор,… … Естествознание. Энциклопедический словарь
НЕМЕТАЛЛЫ — простые вещества, не обладающие свойствами металлов: они не имеют металлического блеска, нековки, плохо проводят теплоту и электричество. Резкой границы между неметаллами и металлами нет. К неметаллам относятся 22 элемента. Из них при нормальной… … Металлургический словарь
Неорганическая химия — Неорганическая химия раздел химии, связанный с изучением строения, реакционной способности и свойств всех химических элементов и их неорганических соединений. Это область охватывает все химические соединения, за исключением органических… … Википедия
Характеристики и физические свойства
Хотя химических элементов-неметаллов всего 16, они являются настоящими кирпичиками жизни, из них состоят все органические соединения. Ученые выяснили, что земная кора на 76% состоит из кремния и кислорода, а водород является самым распространенным веществом во Вселенной, из него состоят все объекты космоса, а также наше светило.
В растительном и животном мирах неметаллы составляют больше 96% от общей массы и 96,7% от массы человека. Это органогенные элементы, формирующие молекулы белков, жиров, углеводов и нуклеиновых кислот. Безусловно, без этих простых веществ привычное существование было бы невозможным.
Основная масса металлов, кроме золота и меди, не обладает цветом, только металлическим блеском. Неметаллы ярко и разнообразно окрашены:
Значительное влияние на физические свойства неметаллов оказывают их молекулярное строение и вид кристаллической решетки. Кремний, как и алмаз с атомным кристаллическим строением решетки, обладает большой прочностью и высокой температурой плавления и кипения. Соединения с молекулярной решеткой (йод, сера и фосфор) начинают плавиться и кипеть при довольно низких температурах.
Простые вещества-неметаллы можно разделить на три вида агрегатных состояний: газы, жидкости и твердые вещества. Однако эта классификация будет верной только при стандартных параметрах окружающей среды, при крайне низких или высоких температурах состояние веществ может меняться.
Самую большую группу составляют газообразные неметаллы: кислород, азот, водород, белый фосфор, озон. Они обладают высокой сжимаемостью и расширяемостью, легко смешиваются между собой и заполняют весь объем сосуда. Кислород является сильным окислителем, необходимым для развития жизни на планете, а легко воспламеняющийся белый фосфор быстро образует активные токсичные соединения, поэтому смертельно опасен.
К жидким неметаллам можно отнести только бром — тяжелую темно-бурую вязкую жидкость, обладающую резким и неприятным запахом. Несмотря на то что в природе бром является смертельным ядом, даже его пары вызывают сильное раздражение слизистой и кожных покровов, он присутствует в организме человека, предохраняя от гормональных сбоев.
К твердым веществам относят бор, красный и черный фосфор, мышьяк, кремний, серу, йод и все стабильные аллотропные модификации углерода. В обычном состоянии они являются веществами с прочной атомной кристаллической решеткой, обладают высокой твердостью, но при этом хрупкие, легко слоятся и ломаются.
Интересным примером разных свойств одного и того же неметалла станет сравнение двух разновидностей углерода — алмаза и графита. Утверждение о твердости алмаза имеет научное обоснование — расположение атомов в кристаллической решетке этих веществ настолько различно, что алмаз разрушить практически невозможно, а графит легко ломается и крошится.
Место в периодической системе
Элементы, расположенные возле воображаемой диагонали, обладают двойственным характером и считаются полуметаллами (металлоидами). Список неметаллов в таблице Менделеева зависит от их положения в системе и количества электронов на внешнем слое:
Отдельно находятся водород и гелий, расположенные в левом и правом верхнем углу таблицы. Это объясняется уникальностью атома водорода, имеющего всего 1 электрон на внешнем слое. Причем водород может одинаково хорошо проявлять свойства как восстановителя, отдавая его, так и окислителя, принимая дополнительный электрон.
Химические особенности
Для большинства элементов этой группы характерна способность вступать в быстрые окислительно-восстановительные реакции, это обеспечивают особенности строения атомов неметаллов. Их атомы содержат большое количество электронов (4−8) на внешнем электронном уровне и способны принимать дополнительные для его устойчивой конфигурации. Благодаря этому образуются отрицательно заряженные ионы, увеличивающие заряд ядра, атом сжимается, а его радиус уменьшается.
Эти процессы ослабляют восстановительные свойства неметаллов, а окислительная способность и электроотрицательность увеличиваются. Некоторые, например, бром, являются окислителем для большинства металлов, но при этом выступают восстановителем для более сильных неметаллов.
Проявляемые химические свойства неметаллов, их активность, возможные степени окисления и характер получаемых соединений могут варьироваться в зависимости от их места в периодической системе и текущего агрегатного состояния.
Взаимодействие с другими веществами
Каждый неметалл обладает специфическими свойствами, характерными только для него, которые подробно рассматриваются при изучении неорганической химии. Общими свойствами является способность реагировать с металлами, водородом и кислородом.
При взаимодействии с металлами большинство неметаллов выступают окислителями и в образующихся бинарных соединениях проявляют отрицательную степень окисления:
Неметаллы могут вступать в реакции между собой, при этом более электроотрицательный элемент будет играть роль окислителя, а менее отрицательный станет восстановителем.
Получение и применение
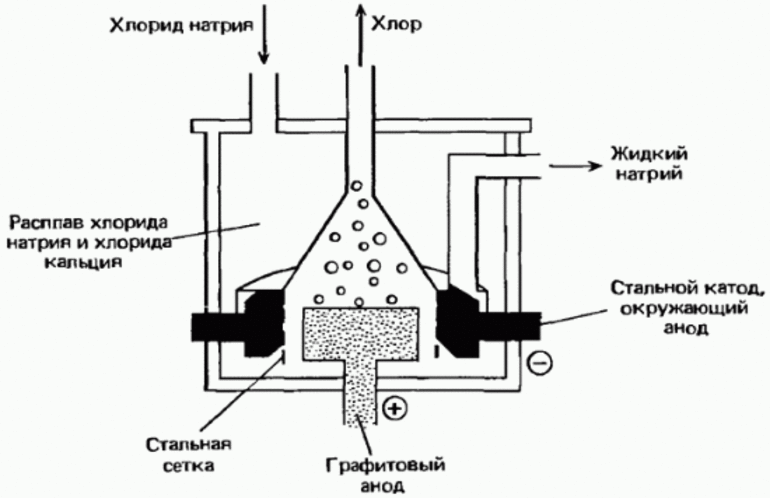
Некоторые элементы встречаются в природе в свободном виде, поэтому их можно выделить из смесей или очистить физическим методом. Фтор, хлор, бром и йод встречаются только в виде соединений, поэтому нужные вещества получают методом химических реакций:
В земных условиях водород встречается только в связанном состоянии в виде водородных соединений, поэтому для его выделения используют различные химические методы, в основном паровую конверсию метана или природного газа.
Учитывая разнообразные свойства неметаллов, они находят применение в большинстве отраслей нашей жизни: медицине, пиротехнике, сельском хозяйстве, пищевой промышленности и для подготовки высоких температур. Для дезинфекции воды используют хлор и озон, медицина невозможна без йода и активированного угля (углерод), жидкий азот применяют в косметологии, а сера помогает бороться с болезнями растений.
Неметаллы
Из Википедии — свободной энциклопедии
Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Курсивом выделены металлоиды, чьи свойства близки к металлам.
| Группа | I | III | IV | V | VI | VII | VIII |
|---|---|---|---|---|---|---|---|
| 1-й период | H | He | |||||
| 2-й период | B | C | N | O | F | Ne | |
| 3-й период | Si | P | S | Cl | Ar | ||
| 4-й период | As | Se | Br | Kr | |||
| 5-й период | Te | I | Xe | ||||
| 6-й период | At | Rn |
В отличие от металлов, неметаллов гораздо меньше, всего их насчитывается 22 элемента.
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов, их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
У некоторых неметаллов наблюдается проявление аллотропии. Так, для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода множество форм — алмаз, астралены, графен, графит, карбин, лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры (нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты, а ещё возможны и другие модификации, например, чаоит и металлический углерод.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод, теллур.
Что такое неметаллы
Азот, водород, кислород, сера, углерод и фтор являются органогенными элементами, являясь составными частями молекул белков, жиров, углеводов и нуклеиновых кислот.
В довершении «важности» неметаллов скажем, что воздух, которым мы дышим, состоит из простых и сложных веществ, образованных неметаллами.
Познакомимся поближе с этими «чудо»-элементами, играющую такую важную роль в жизни на Земле.
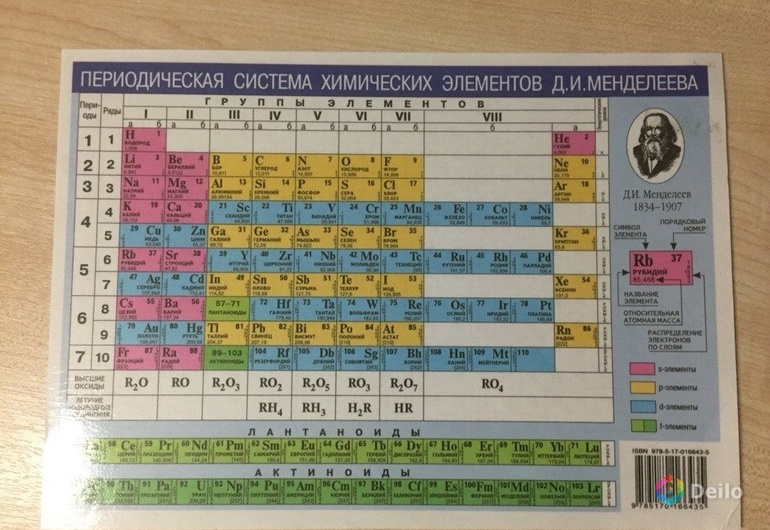
Неметаллы в Периодической таблице Д.И.Менделеева находятся в правом верхнем углу, отграничиваясь диагональю «бор-астат» + водород и гелий,которые расположены в левом верхнем и правом верхнем углу таблицы.
Рис. Расположение неметаллов в Периодической таблице (выделены желтым цветом)
Перечислим все неметаллы в порядке увеличения их атомных масс: водород, гелий, бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, мышьяк, селен, бром, криптон, теллур, йод, ксенон, астат, радон.
Характерной особенностью многих неметаллов является наличие на внешнем электронном слое большого кол-ва электронов (от 4 до 8), при этом радиус атомов неметаллов мал по сравнению с атомами металлов.
Особняком стоят инертные (благородные) газы, имеющие завершенный внешний энергетический уровень, и по этой причине они фактически не относятся ни к металлам, ни к неметаллам, занимая, таким образом, некое пограничное положение «на нашим, ни вашим».
К неметаллам инертные газы можно отнести лишь по их физическим признакам. Подробнее об инертных газах см. Атомы элементов 18(0) группы.
Положение неметаллов в Периодической системе и электронные конфигурации внешнего электронного слоя их атомов представлены на таблице внизу.
| 1 период | 1s 1 | 1s 2 | ||||
|---|---|---|---|---|---|---|
| H | He | |||||
| Группы | III | IV | V | VI | VII | VIII |
| Общее кол-во электронов на внешнем электронном слое | 3 | 4 | 5 | 6 | 7 | 8 |
| Электронная конфигурация внешнего слоя | ns 2 np 1 | ns 2 np 2 | ns 2 np 3 | ns 2 np 4 | ns 2 np 5 | ns 2 np 6 |
| 2 период | B | C | N | O | F | Ne |
| 3 период | Si | P | S | Cl | Ar | |
| 4 период | As | Se | Br | Kr | ||
| 5 период | Te | I | Xe | |||
| 6 период | At | Rn | ||||
Из таблицы хорошо видно, что:
В горизонтальном направлении (в периодах) радиусы атомов неметаллов уменьшаются слева направо, например, радиус атома бора равен 0,091 нм, а у фтора = 0,064 нм. В то же время, в этом же направлении возрастает заряд ядра атома. Говоря другими словами, в направлении слева направо в периодах возрастает электроотрицательность элементов и сродство к электрону. То же самое происходит и в вертикальном направлении снизу вверх. Таким образом, фтор, находящийся в правом верхнем углу, имеет самый большой заряд ядра при самом маленьком радиусе атома, что позволяет ему очень легко присоединять недостающий единственный электрон. Поэтому, фтор характеризуется наибольшей электроотрицательностью и является самым сильным окислителем.
| B(5)-0,091 нм 2s 2 2p 1 2,0 | C(6)-0,077 нм 2s 2 2p 2 2,5 | N(7)-0,071 нм 2s 2 2p 3 3,0 | O(8)-0,066 нм 2s 2 2p 4 3,5 | F(9)-0,064 нм 2s 2 2p 5 4,0 |
| Cl(17)-0,099 нм 3s 2 3p 5 3,0 | ||||
| Br(35)-0,114 нм 4s 2 3p 5 2,8 | ||||
| I(53)-0,133 нм 5s 2 3p 5 2,2 | ||||
| At(85) 6s 2 3p 5 1,9 |
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Неметаллы. Физические и химические свойства
Положение неметаллов в периодической системе
Как же определить, относится вещество к металлам или к неметаллам?
Если внимательно посмотреть на Периодическую систему Д.И. Менделеева (подробно с классификацией элементов знакомимся в параграфе 42 учебника по химии для 8 класса под редакцией Еремина В.В.) и провести условную диагональ от водорода через бор до астата и неоткрытого пока элемента № 118, таблица неметаллов займет правый верхний угол.
Каждый горизонтальный период таблицы заканчивается элементом с завершенным внешним энергетическим уровнем. Эта группа элементов носит название благородные газы и имеет особые свойства, с которыми можно познакомиться в параграфе 18 учебника «Химия» для 8 класса под редакцией Еремина В.В.
При рассмотрении электронного строения неметаллов можно заметить, что энергетические уровни атома заполнены электронами больше чем на 50% (исключение – бор), и у элементов, расположенных в таблице справа налево количество электронов на внешнем уровне увеличивается. Поэтому в химических реакциях эта группа веществ может быть как акцептором электронов с окислительными свойствами, так и донором электронов с восстановительными свойствами.
Вещества, образующие диагональ бор-кремний-германий-мышьяк-теллур, являются уникальными, и в зависимости от реакции и реагента могут проявлять как металлические, так и неметаллические свойства. Их называют металлоиды. В химических реакциях они проявляют преимущественно восстановительные свойства.
Физические свойства неметаллов. Аллотропия
Если смотреть на металлы, то невооруженным глазом можно заметить общие свойства — металлический блеск, твердое агрегатное состояние (исключение — жидкая ртуть), тепло- и электропроводность.
С неметаллами все намного сложнее. Они могут иметь молекулярное и немолекулярное строение. Благодаря различиям в строении, простые вещества неметаллы существуют в трех агрегатных состояниях:
Большинство из неметаллических веществ плохо проводят электричество и тепло.
Исключением является графит — разновидность углерода.
Аллотропия — уникальная способность неметаллического элемента образовывать несколько простых веществ. В естественной среде существуют аллотропные модификации элементов, которые отличаются физическими и химическими свойствами. К ним относятся озон и кислород, графит и алмаз. Подробнее о физических свойствах неметаллов вы можете узнать в учебнике «Химия. 9 класс».
Химические свойства неметаллов
Как мы разобрали выше, группа неметаллов довольно полиморфна и в зависимости от типа реакций, в которых они участвуют, могут проявлять и окислительные, и восстановительные свойства. Фтор — исключение в этом ряду. Он всегда окислитель.
В ряду F,O,N,CL,Br,I,S,C,Se,P,As,Si,H окислительные свойства уменьшаются. Восстановительные свойства кислород может проявлять только в отношении фтора.
В этом типе реакций проявляются окислительные свойства и неметаллы принимают электроны с образованием отрицательно заряженных частиц.
Практически все неметаллы реагируют с водородом. Лишь благородные газы составляют исключение для реакций данного типа. Продуктом реакции являются летучие водородные соединения:
P + 5O2 = 2P2O5
4. Взаимодействие с водой и кислотами для неметаллов не характерно.
История открытия неметаллов
Медная посуда, железные орудия труда, золотые украшения — издавна человек замечал, что у всех этих веществ есть определенные общие свойства:
В противовес металлам были и другие вещества, не обладающие металлическими свойствами, и названные соответственно неметаллами. Практически до конца XVII века ученым-алхимикам было известно всего лишь два вещества-неметалла — углерод и сера.
В 1669 году Бранд в поисках «философского камня» открыл белый фосфор. И за короткий период с 1748 по 1798 годы было открыто около 15 новых металлов и 5 неметаллов.
В настоящее время открыто 22 неметаллических элемента.