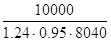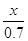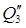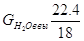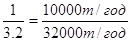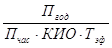Что такое нитрозный газ
Нитрозные газы
а) в колонне 1/2 количества (1,5%) HNO3 разлагается до NO2 по реакции (3)
При этом образуются газообразные вещества:
NO2=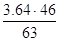
H2O =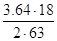
O2 = 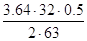
б) по реакции (4) разлагается ½ количества (1,5%) HNO3 до N2:
N2=
H2O = 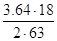
O2 = 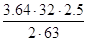
в) при разложении N2O3 по реакции (5):
NO2=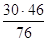
NO = 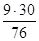
г) при разложении HNSO5 по реакции (2):
NO2=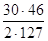
NO = 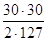
Выделившаяся в процессе реакции серная кислота вновь войдет в состав отработанной кислотной смеси и доля ее в последней составит 450кг.
д) с нитрозными газами уносится 1% HNO3:
В результате гидролиза получается следующее количество сухих нитрозных газов (без учета подсоса воздуха):
Подсос воздуха uпод через неплотности соединений царг колонны принимаем равным 100% объема сухих газов
N2=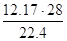
O2=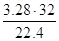
Принимаем, что подсасываемый воздух поступает при t=20 О С, относительная влажность 80%
d0 = 14.61 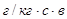
Всего воздуха: 19,89+0,23=20,12 кг.
Количество и состав сухих газов, выходящих из колонны с учетом подсоса воздуха:
Количество паров воды, уходящих из колонны (за конденсатом) с нитрозными газами при t=35 О С
H2O = 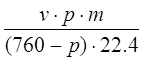
p=1,8 мм. Рт. Ст – парциальное давление воды над 98% HNO3 при t=35 О С
H2O = 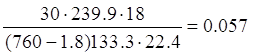
в объеме v= 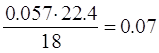
Общий состав газов, поступающих на поглощение:
| Приход: | |
| 1. Отработанная кислота | 1000 кг. |
| 2. Купоросное масло | х кг. |
| 3. Перегретый пар | у кг. |
| 4. Воздух через неплотности | 19,89 кг. |
| Итого: | 1019,89+х+у |
| Расход: | |
| 242,3 кг. | |
| 3. Нитрозные газы | 46,54 кг. |
| Итого: | (931,70+х)/0,7 |
Приравнивая приход к расходу, получаем уравнение материального баланса
1019,89+х+у=931,7+
2.7. Расчет теплового баланса [1]
Так как в уравнении материального баланса входит распад пара (у), то будем определять его с помощью уравнения теплового расчета.
4. Температура выходящих из колонны HNO3 и нитрозных газов – 85 О С
Температура крепкой HNO3 98%, выходящей из колонны в холодильник 85 О С
6. Температура подсасываемого воздуха 20 О С
1) С отработанной кислотой
c1=2,22 
2) С перегретым паром, теплосодержание которого при t=220 О С равно 700.8 кДж; Q2=700,8*у
3) Теплота от H2SO4 состоит из физической теплоты 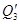
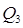
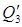
Физическая теплота определяется по формуле
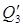
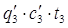
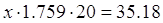
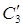
Теплота разбавления H2SO4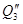
Удельная теплота разбавления g=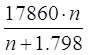
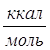
В H2SO4 с массовой долей 91%, моль:
H2O = х 0,09/18 = 0,005 х
n = 0,005 х/0,0094 х =0,53
H2O = z 0.3/18 = 0,016 z
n = 0,016 z/0.007 z = 2.38
Удельная теплота разбавления 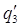
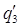
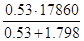
Уд теплота разбавления 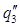
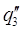
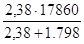
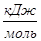
Удельная теплота разбавления с 91% до 70%:
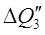
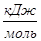
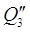
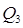
4) С HNO3 98%, поступающей из конденсатора в колонну с t=40 О С
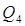
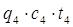
5) С воздухом, подсасываемым из помещения с t=20 О С
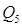
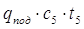
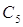
Всего в колонну приход тепла, кДж

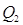
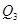
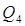
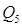
1) С парами HNO3 98%, выходящих из колонны:
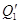
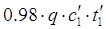
2) На испарение HNO3:
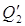
где i=483кДж/кг – теплота испарения 1 кг кислоты.
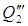
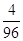
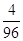
i=2259 кДж/кг – теплота парообразования воды
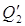
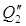
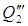
3) Теплота, уносимая с 70% H2SO4 при t=150 О С
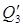

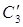
4) С HNO3 98%, уносимой из колонны с t=85 О С в холодильник:
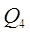
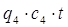
5) На нагрев подсасываемого воздуха из помещения в среднем до t=90 О С
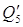
6) На закрепление содержащихся в отработанной кислоте слабой HNO3 при ее массовой доле в смеси:

Удельная теплота для HNO3:
В кислоте с массовой долей 49%, моль:
Удельная теплота разбавления для HNO3 98%:
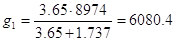
В кислоте с массовой долей HNO3 98%, моль:
Удельная теплота разбавления для HNO3 98%
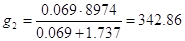
Теплота закрепления HNO3, находящейся в отработанной кислоте с 49% до 98%: 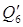
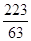
7) Теплота, уносимая с нитрозными газами:
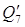

c- удельные теплоемкости газов с t=85 О С
H2O 0,07*1,373*85 = 8,17 кДж
HNO3 2,42*1,8*85 = 370,26 кДж
8) В окружающую среду колонна ГБХ в течение 1 часа теряет порядка 800 ккал (33520 кДж). При условии подачи в колонну 92 кг/мин тройной смеси и выработки колонны 60 тиг в сутки.
Потери тепла в окружающую среду:
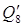

Всего расход тепла, кДж:
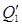
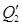
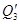
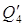
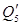
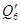

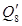
Приход приравним к расходу:
Решаем совместно уравнение материального и теплового балансов:
Расчет составлен на 1 тонну отработанной кислоты
| Приход | Расход | ||||
| статьи прихода | кг | % | статьи расхода | кг | % |
| 1. Отработанная кислота | 900 | 42 | 1852,86 | 86,5 | |
| 3. Купоросное масло | 847 | 39,52 | 3. Нитрозные газы | 46,54 | 2,2 |
| 4. Перегретый пар | 276,11 | 12,88 | |||
| 5. Воздух через неплотности | 19,89 | 0,93 | |||
| Всего: | 2143 | 100 | Всего: | 2143 | 100 |
| Приход | Расход | ||
| статьи прихода | КДж | статьи расхода | кДж |
| 1. С отработанной кислотой | 199800 | 39075,43 | |
| 2. С перегретым паром | 193497,89 | 2. На испарении HNO3 | 137040,64 |
| 3. Теплота от H2SO4 91% | 485336,86 | 89017,7 | |
| 7. С нитрозными газами | 3843,73 | ||
| 8. В окружающую среду | 6072,46 | ||
| Всего: | 897738,11 | Всего: | 897738,11 |
На 1 тонну отработанной кислоты приходится в 4.127 раза больше крепкой 98% HNO3. Пересчитаем на 1 тонну готового продукта 98% HNO3
| Приход | Расход | ||||
| статьи прихода | кг | % | статьи расхода | кг | % |
| 1. Отработанная кислота | 3714,3 | 41,97 | 1000 | 11,3 | |
| 2. 50% HNO3 | 412,7 | 4,73 | 2. Слабая HNO3 70% | 7654,87 | 86,5 |
| 3. Купоросное масло | 3492,48 | 39,52 | 3. Нитрозные газы | 194,69 | 2,2 |
| 4. Перегретый пар | 1138,24 | 12,88 | |||
| 5. Воздух через неплотности | 79,54 | 0,9 | |||
| Всего: | 8849,6 | 100 | Всего: | 8849,6 | 100 |
2.8 Расчет материального баланса концентрирования H2SO4
1. Температура кислоты на входе 150 О С
2. Температура кислоты на выходе 250 О С
3. Температура дымовых газов на входе 900 О С
4. Температура дымовых газов на выходе 130 О С
В вихревую колонну поступает разбавленная серная кислота (с учетом потерь):
Gразб = G(1-0,0006) = 7654,87*0,9994 = 7650,28 кг.
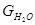
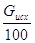
В колонну подается кислота ( в пересчете на моногидрат):
Gпр = G(1-0.0006) 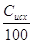
2. При концентрировании серная кислота разлагается по формуле:
Qразл = 228900 кДж/кмоль – теплота разложения H2SO4. Потери от разложения составляют 50% общих потерь или 0,03%:
Gпот = Gт*0,03/100 = 7650,28*0,0003 = 2,3 кг.
3. Потери вследствие уноса серной кислоты с дымовыми газами составляют также 50% общих потерь (0,03%)
Gун = 0,0003*7650,28 = 2,3 кг.
4. Общие потери составляют:
5. При разложении серной кислоты образуется:

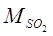
SO2 = 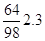
O2 = 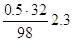
H2O = 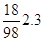
6. В колонне выпариваются воды:
7. Выход 91% продукционной H2SO4:
8. Приход кислоты по моногидрату:
Gпр = Gисх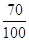
2.9. Расчет теплового баланса вихревой колонны [4]
1. с разбавленной серной кислотой 70% при t = 150 О С
Q1 = QпрHпр = 7654.87*342 = 2617934.76 кДж = 624805,43 ккал.
Hпр = 342 кДж/кг – энтальпия исходной кислоты
2. С дымовыми газами, поступившими из топки:
Q2 = 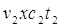
V2 = 31,37 м 3 – объем газов
С2 = 1,450 кДж/м 3 град
Общий приход тепла: Qобщ = Q1+ Q2 = 2617934,76+40937,85х кДж
1. С продукционной кислотой при 250 О С:
Q1 = Ck*Hk = 5355.2*458 = 2452681.6 кДж = 585365,54 ккал
Hк = 458 кДж/кг – энтальпия серной кислоты 91%
2. С водяным паром выделяется при выпаривании и разложении:
Q2 = Cвп*Hвп = 1606.98*2737.7 = 4399429.15 кДж = 1049983.09 ккал
Gвп = Gуп + Gразл = 1606,56 + 0,42 = 1606,98 кг.
Hвп = 2737,7 кДж/кг – энтальпия водяного пара
Gуп и Gразл – из материального баланса.
3. С дымовыми газами, уходящими с t = 30 О С:
Q3 = 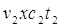
V2 – объем дымовых газов на м 3 сжигаемого газа
С2 = удельная теплоемкость дымовых газов при t=130 О С
С2 = 1,336 кДж/м 3 град
4. На испарение серной кислоты:
5. С парами серной кислоты:
Q5 = Gисп+ H = 2,3*201,4=463,22 кДж=110,55 ккал
Н – энтальпия 100% серной кислоты при температуре отходящих газов 130 О С.
6. На разложение серной кислоты:
Q6 = 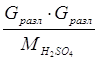
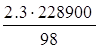
7. С продуктами разложения серной кислоты в результате разложения серной кислоты при температуре отходящих газов 130 О С образуются:
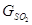
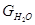
Q7 = (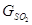
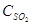

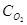
8. При концентрировании серной кислоты (дегидратации) от 70% до 91% расходуется тепла:
Q70% = 427,4 кДж/кг – теплота разбавления до 70%
Q91% = 157,3 кДж/кг – теплота разбавления до 91%
Q8 = 5355,2(427,4-157,3)=1446439,52 кДж = 345212,3 ккал
9. Потери тепла в окружающую среду примем 1% от общего количества расхода тепла на концентрировании серной кислоты:
Q= 2452681,6 + 4399429,15 + 5448,34х + 463,22 + 1175,76 + 5372,14 + 171,08 + 1446439,52 = 5853050,87 + 5448,34 х кДж
Qд = 58530,51 + 54,48 х к`Дж
Qрасх = 5911581,38 + 5502,82 х кДж
10. Для определения расхода топлива ^приравниваеме приход тепла к расходу:
11. Определяем часовое количество и состав газов, поступающих на установку из топки.
12. Определяем часовое количество газов, уходящих с установки:
CO2: 
N2: 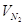
O2: 
SO2: 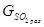
H2O: 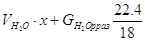
H2SO4: 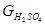
| Приход | Расход | ||||
| статьи прихода | кг | % | статьи расхода | кг | % |
| 1. Газы из топки | 3805,63 | 33,2 | 1. Газы в аотмосферу | 5417,22 | 46,26 |
| 2. Серная кислота 70% | 7654,87 | 66,8 | 2. серная кислота 91% | 6043,72 | 52,72 |
| 3. Пары серной кислоты | 2,3 | 0,02 | |||
| Всего: | 11460,5 | 100 | Всего: | 11460,5 | 100 |
| Приход | Расход | ||
| статьи прихода | КДж | Статьи расхода | кДж |
| 1. С серной кислотой 70% | 2617934,76 | 1. С серной кислотой 91% | 2452681,6 |
| 2. С дымовыми газами | 6423107,92 | 2. С водяным паром | 4399429,15 |
| 3. С дымовыми газами | 672179,0 | ||
| 4. На испарение серной кислоты | 1175,76 | ||
| 5. Теплота разложения | 5372,14 | ||
| 6. С продуктами разложения | 171,08 | ||
| 7. Теплота дегидратации | 1446439,52 | ||
| 8. Потери в окружающую среду | 63594,43 | ||
| Всего: | 9041042,68 | Всего: | 9041042,68 |
3. Технико-технологическая часть 3.1. Выбор и расчет производительности основного и вспомогательного оборудования технологической схемы
Исходя из заданной производительности проектируемого производства по готовой продукции (98% HNO3) определяем суточную и часовую производительность основного аппарата цеха-колонны ГБХ.
Псут=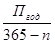
n – время на ремонт и простои оборудования
Псут=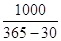
Пчас=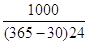
При отгонке концентрированной HNO3 определенного состава расход безводной H2SO4 зависит от массовой доли H2SO4 в разбавленной HNO3, при этом расход H2SO4 будет тем больше, чем сильнее разбавлена HNO3. Для одной и той же исходной разбавленнной HNO3 удельный расход H2SO4 обратно пропорционален ее степени концентрации. В соответствии с расчетом по треугольным диаграммам (услович – Температура кипения смеси на палках) при массовой доле HNO3 48-50% и технической H2SO4 91-92% соотношение HNO3:H2SO4 составляет 1:32 при исходной HNO3 50% и H2SO4 92%. Исходя из сказанного выше, годовая производительность по H2SO4 будет равна 32000 т/год.
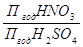
Рассчитаем суточную и часовую производительность вихревой колонны:
Псут=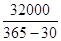
Пчас=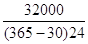
3.2 Расчет количества аппаратов
n=
Пгод – годовая производительность
Пчас – часовая производительность
КИО – коэффициент использования оборудования
Тэф – эффективный фонд времени работы аппарата, ч
Денитрационная колонна ГБХ
n=