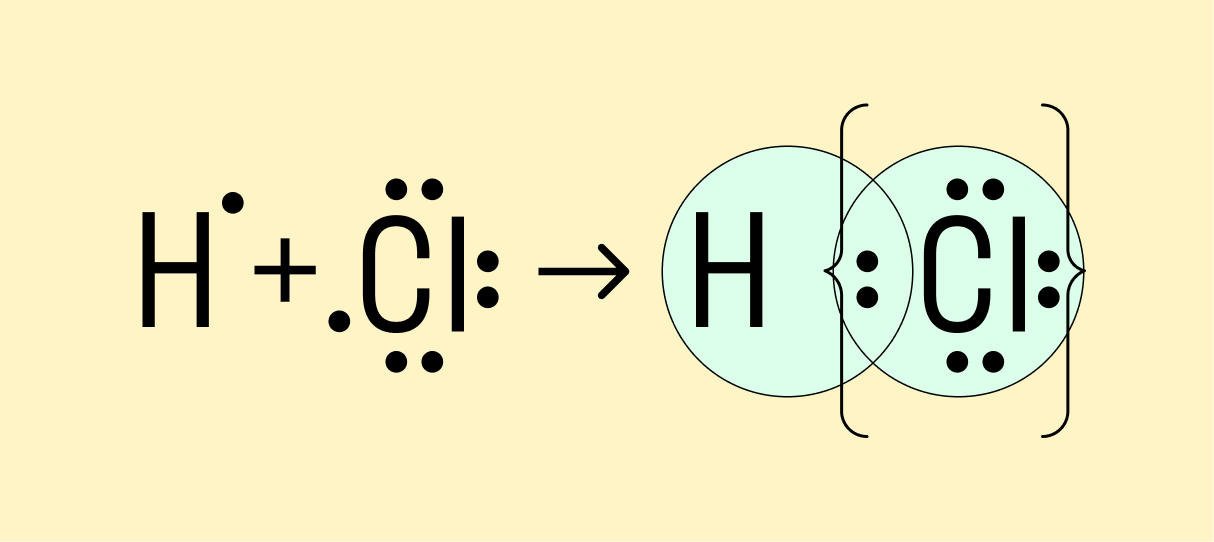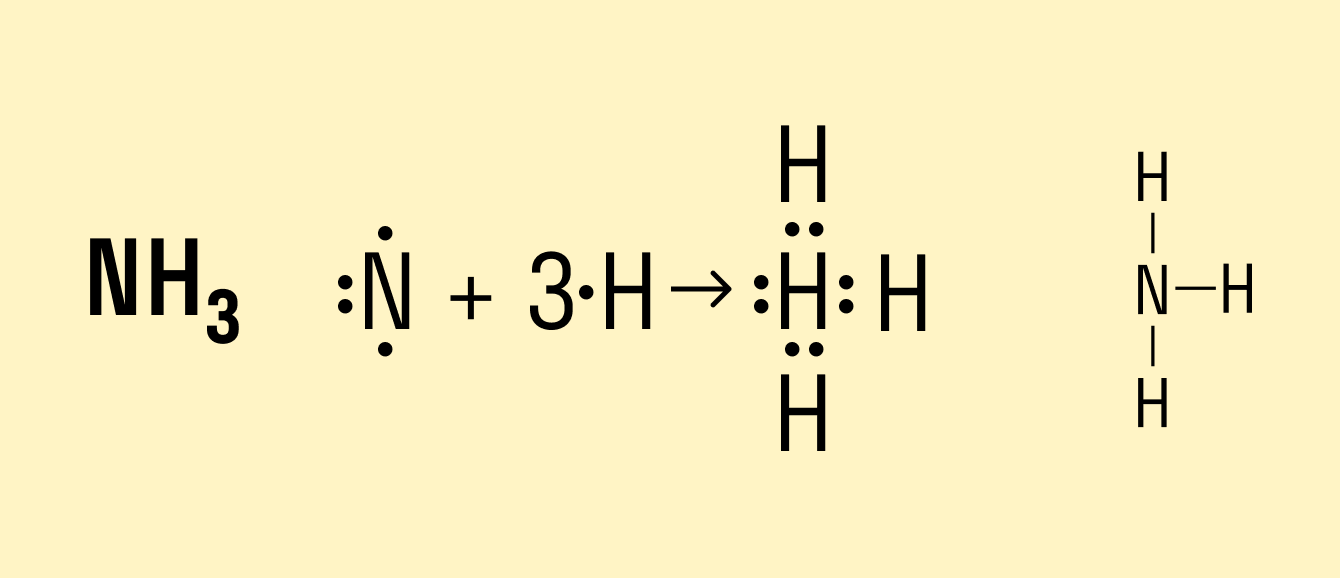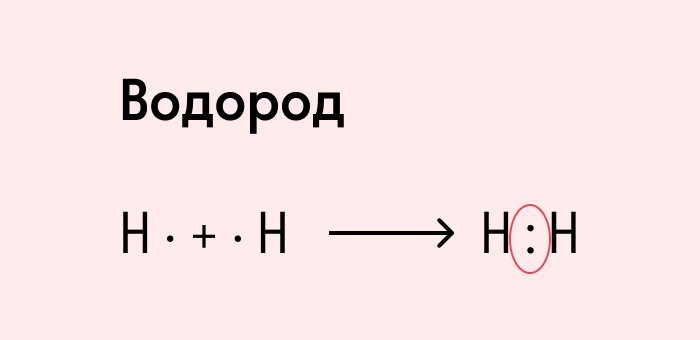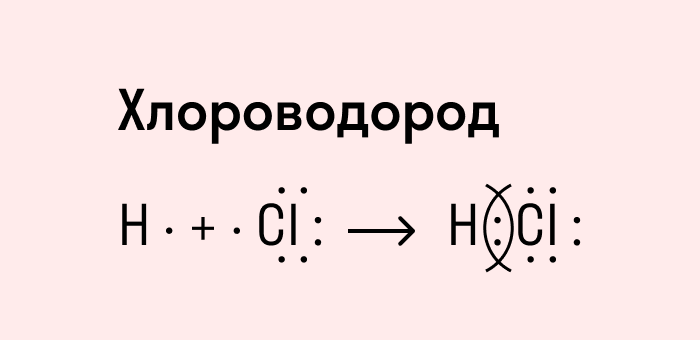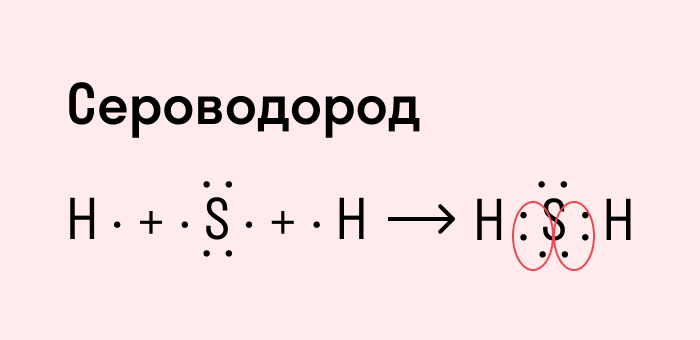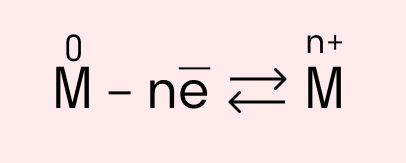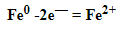Что такое общая электронная пара
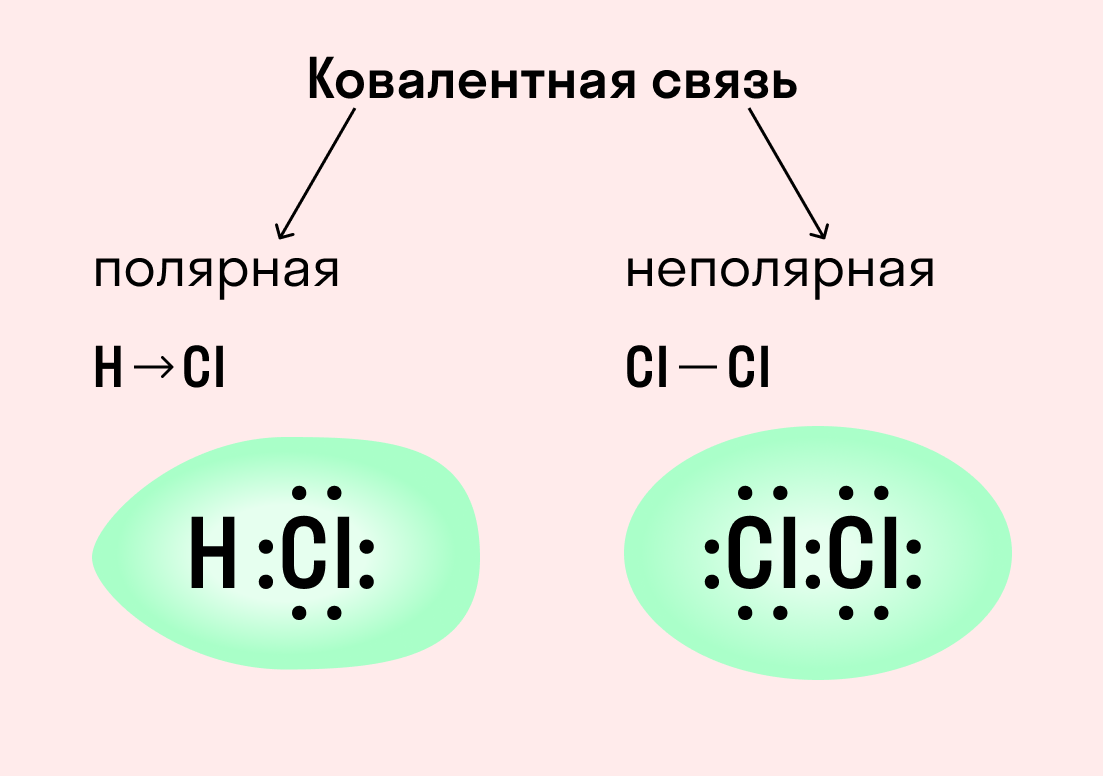
Ковалентные неполярные и полярные связи
Что такое ковалентная связь
На примере ковалентных связей удобно описывать механизм химической связи в целом. Впервые это сделал американский ученый Гилберт Льюис, анализируя взаимодействие между частицами в молекулах водорода, азота, кислорода и других простых неметаллов.
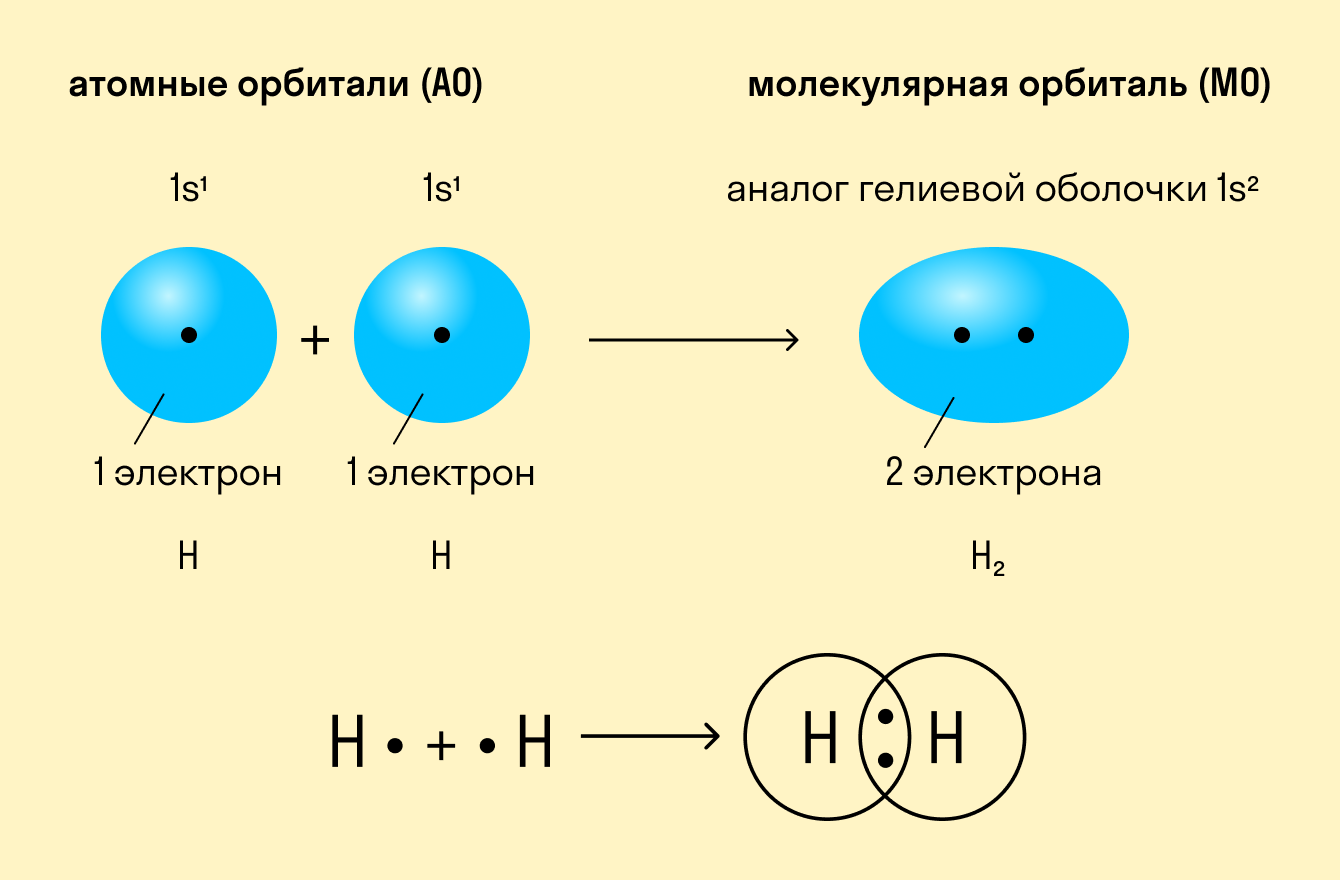
Как происходит такое взаимодействие? Атом водорода отличается очень простым строением — его электронное облако или орбиталь содержит лишь один свободный (валентный) электрон. При сближении двух атомов водорода их орбитали пересекаются и начинают частично перекрывать друг друга.
Свободные электроны на этих орбиталях объединяются в пару, которая принадлежит обоим участникам взаимодействия. Это и есть процесс образования ковалентной связи. По ее итогам каждый атом имеет уже два электрона и приобретает устойчивую внешнюю оболочку.
Ковалентная связь — это образование общей электронной пары у двух атомов вещества при сближении ядер этих атомов.
В зависимости от того, будет ли пара принадлежать обоим атомам в равной мере или сместится к одному из них, ковалентная связь бывает полярной или неполярной.
Ковалентная неполярная связь
Приведенный выше пример с атомами водорода иллюстрирует ковалентную неполярную связь. Образованная пара электронов находится на общей молекулярной орбитали и принадлежит обоим атомам. Это происходит потому, что в простых веществах взаимодействуют атомы с одинаковой электроотрицательностью (ЭО), т. е. они имеют равную способность притягивать электроны.
Ковалентная неполярная связь — это такое взаимодействие двух атомов, при котором их общая пара электронов равноудалена от атомных ядер и одинаково принадлежит обоим атомам. Другими словами, электронная плотность (область, в которой наиболее вероятно нахождение электронов) распределена равномерно.
Ковалентная неполярная связь образуется между атомами элементарных веществ с одинаковой ЭО.
Интересный пример ковалентной связи этого типа — молекула ромбической серы S8. У атома серы есть 2 свободных электрона, поэтому он может образовать 2 связи. Это простое вещество, а значит, все атомы будут притягивать электроны с одинаковой силой.
Формула данного вещества с ковалентной неполярной связью:
Ковалентная полярная связь
Мы рассмотрели, как проходит ковалентная химическая связь в молекулах, где все частицы одинаковы. Но если сблизить два атома с разной ЭО — например, водорода и хлора, получится другая картина. Поскольку у хлора ЭО выше и он притягивает электроны немного сильнее, чем водород, общая пара смещается в его сторону. Другими словами, у такой химической связи есть полярность.
Атом, принимающий электроны (в данном случае хлор), приобретает условно отрицательный заряд. Второй же атом, отдающий валентные электроны, заряжается положительно.
Ковалентная полярная связь — это электронный обмен между двумя атомами в молекуле вещества, при котором общая пара электронов смещается к одному атому (более электроотрицательному). Электронная плотность распределена неравномерно.
Ковалентная полярная связь образуется между атомами неметаллов с разной ЭО в составе сложных веществ.
Проиллюстрируем все, о чем сказано в определении ковалентной полярной связи, на примерах.
В молекуле аммиака NH3 атом азота имеет 3 свободных электрона, т. е. может образовать 3 химические связи. Поскольку это сложное вещество, состоящее из атомов неметаллов, можно говорить о полярности. Атом азота имеет общие электронные пары с тремя атомами водорода. При этом азот обладает более высокой ЭО, чем водород, поэтому электронная плотность смещена в его сторону.
Формула данного вещества с ковалентной полярной связью:
Механизмы образования ковалентной связи
Не всегда взаимодействие атомов происходит так, как в молекуле водорода. Иногда один атом отдает оба электрона, а второй забирает их на свою свободную орбиталь. В зависимости от этого выделяют два механизма ковалентной связи:
Обменный механизм — объединение в пару свободных электронов от взаимодействующих атомов (по одному электрону от каждого).
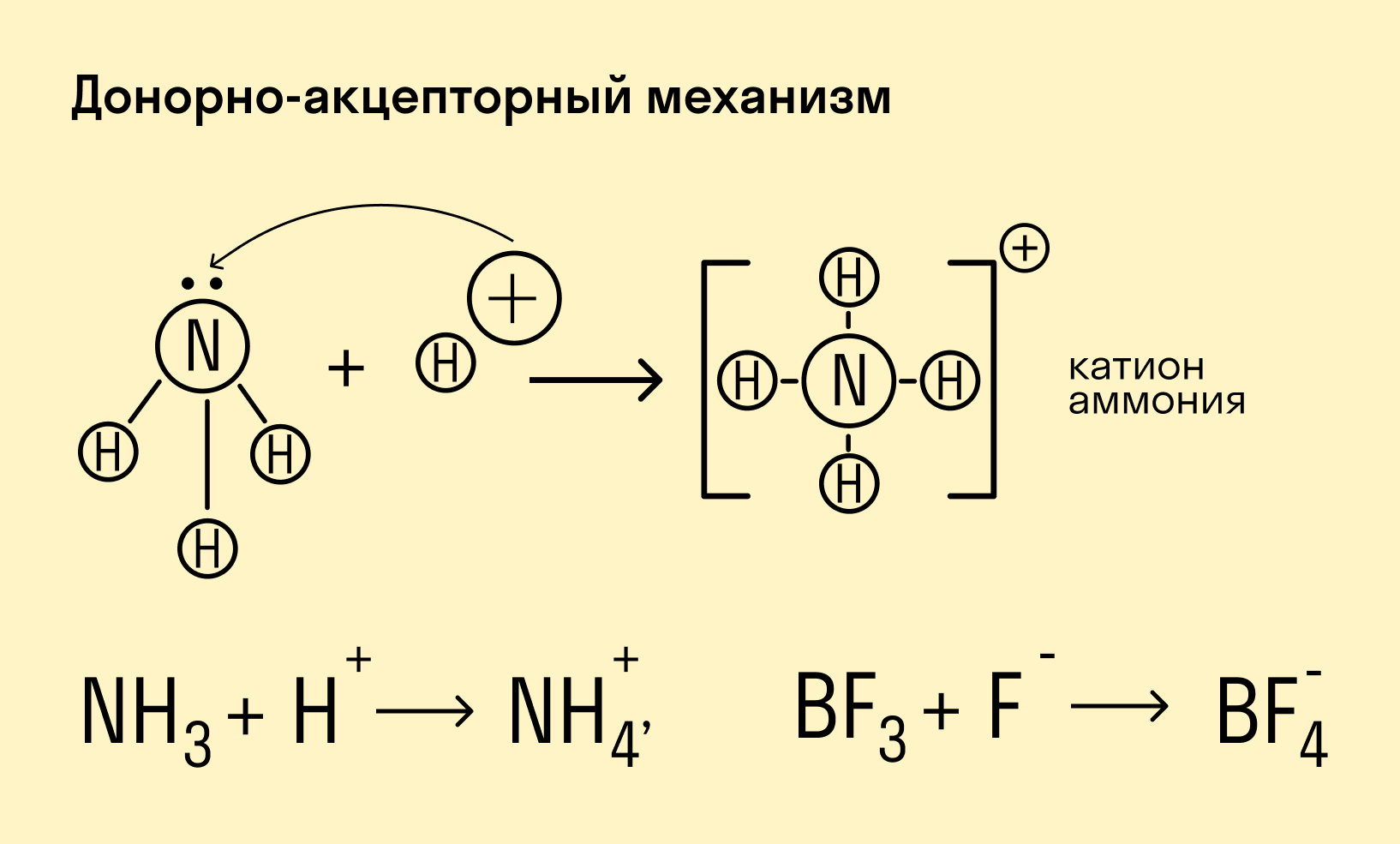
Донорно-акцепторный механизм — процесс, при котором атом-донор отдает два электрона, а атом-акцептор предоставляет для них орбиталь.
Химическую связь, образованную по донорно-акцепторному принципу, можно рассмотреть на примере молекулы катиона аммония. В данном случае атом азота, который содержится в аммиаке NH3, имеет неподеленную пару электронов и является донором. Он передает эти электроны на орбиталь атома водорода — акцептора. В результате такой связи образуется молекула NH4 + в форме тетраэдра, где углы представлены четырьмя атомами водорода.
Вещества, в молекулах которых есть хотя бы одна ковалентная химическая связь, осуществляемая по донорно-акцепторному принципу:
Химическая связь
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Химическая связь и строение вещества
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Механизм образования химической связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
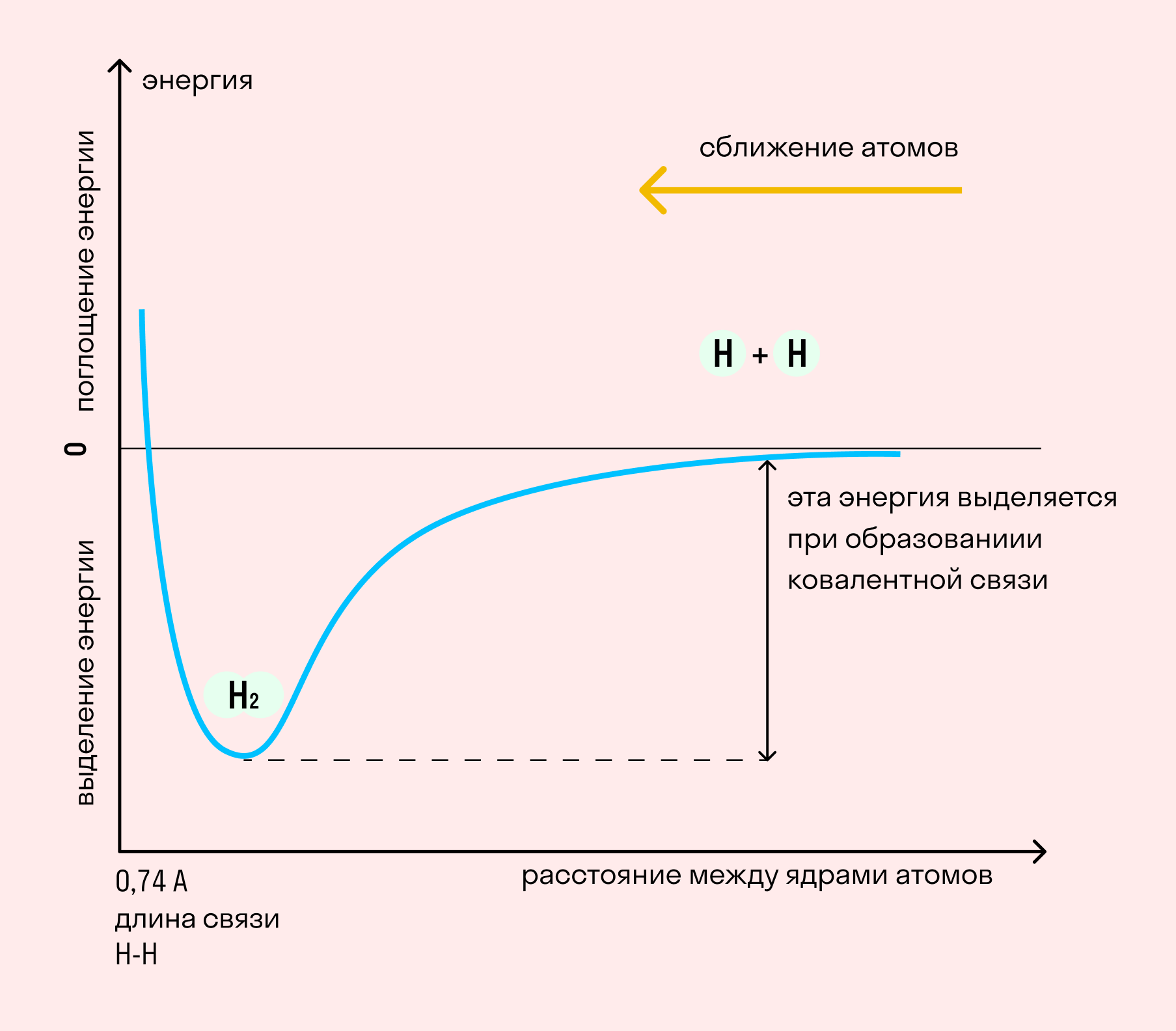
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
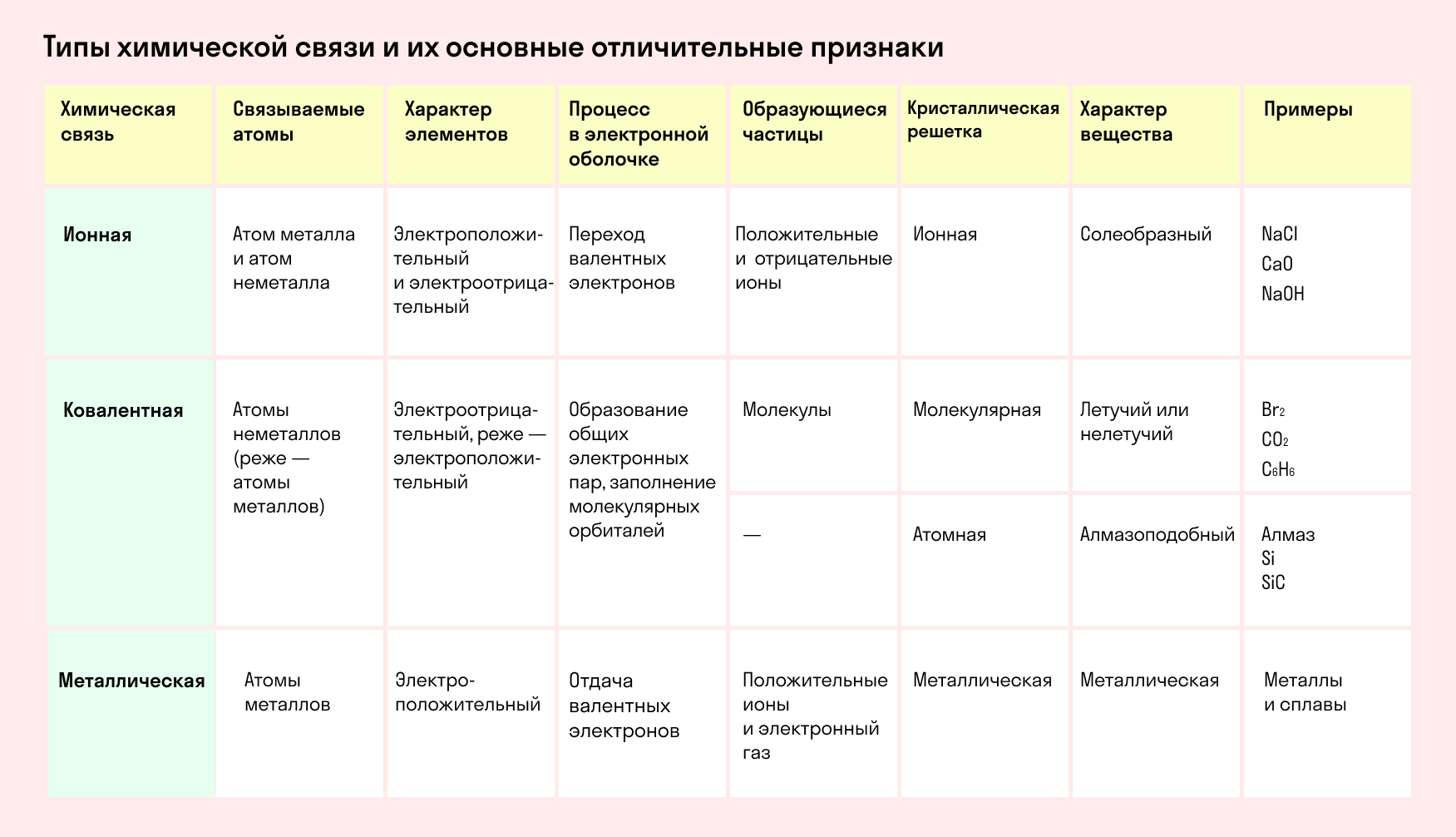
Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Если это ковалентная связь — образуется атомная решетка, если водородная — молекулярная решетка, а если ионная или металлическая — соответственно, будет ионная или металлическая решетка. Таком образом, влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью.
Характеристики ковалентной связи:
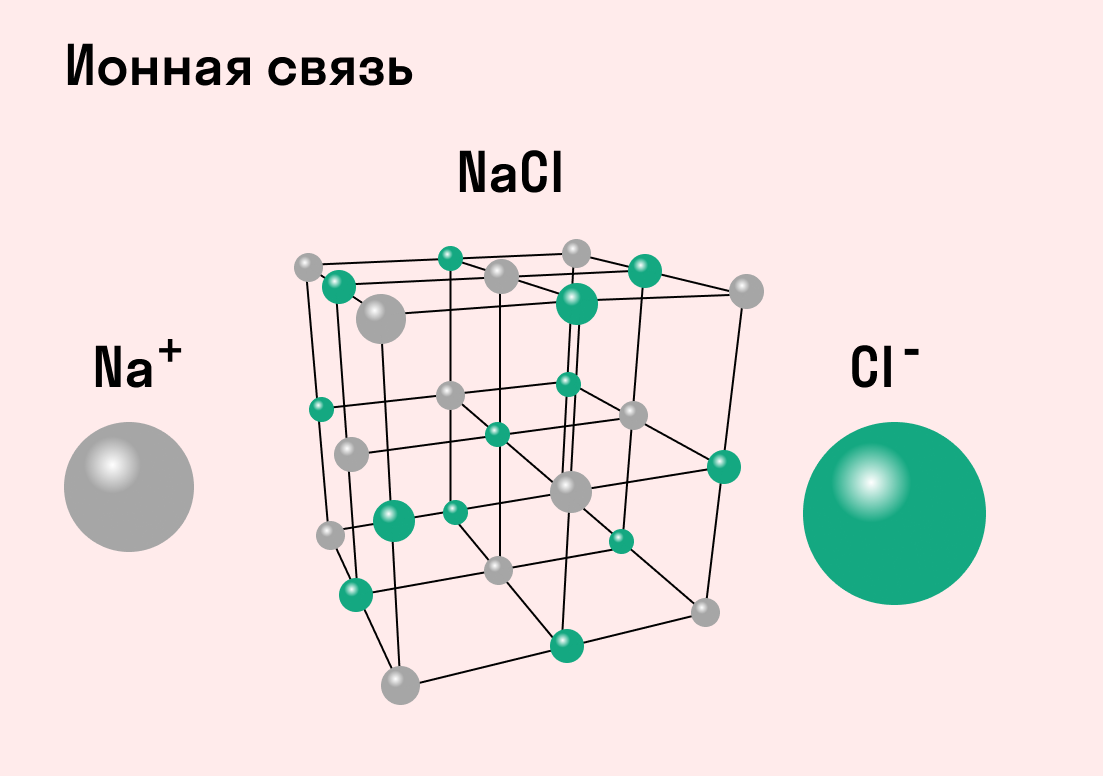
Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд. В результате этого процесса образуются ионы.
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.
Характеристики ионной связи:
не имеет направленности.
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Характеризуется появлением электронных пар, принадлежащих обоим атомам.
Характеризуется появлением и взаимным притяжением ионов.
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов.
Ионы с противоположными зарядами подвержены кулоновскому притяжению.
Имеет направленность и насыщенность.
Ненасыщенна и не имеет направленности.
Количество связей, образуемых атомом, называется валентностью.
Количество ближайших соседей атома называется координационным числом.
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО.
Образуется между металлами и неметаллами — веществами со значимо разной ЭО.
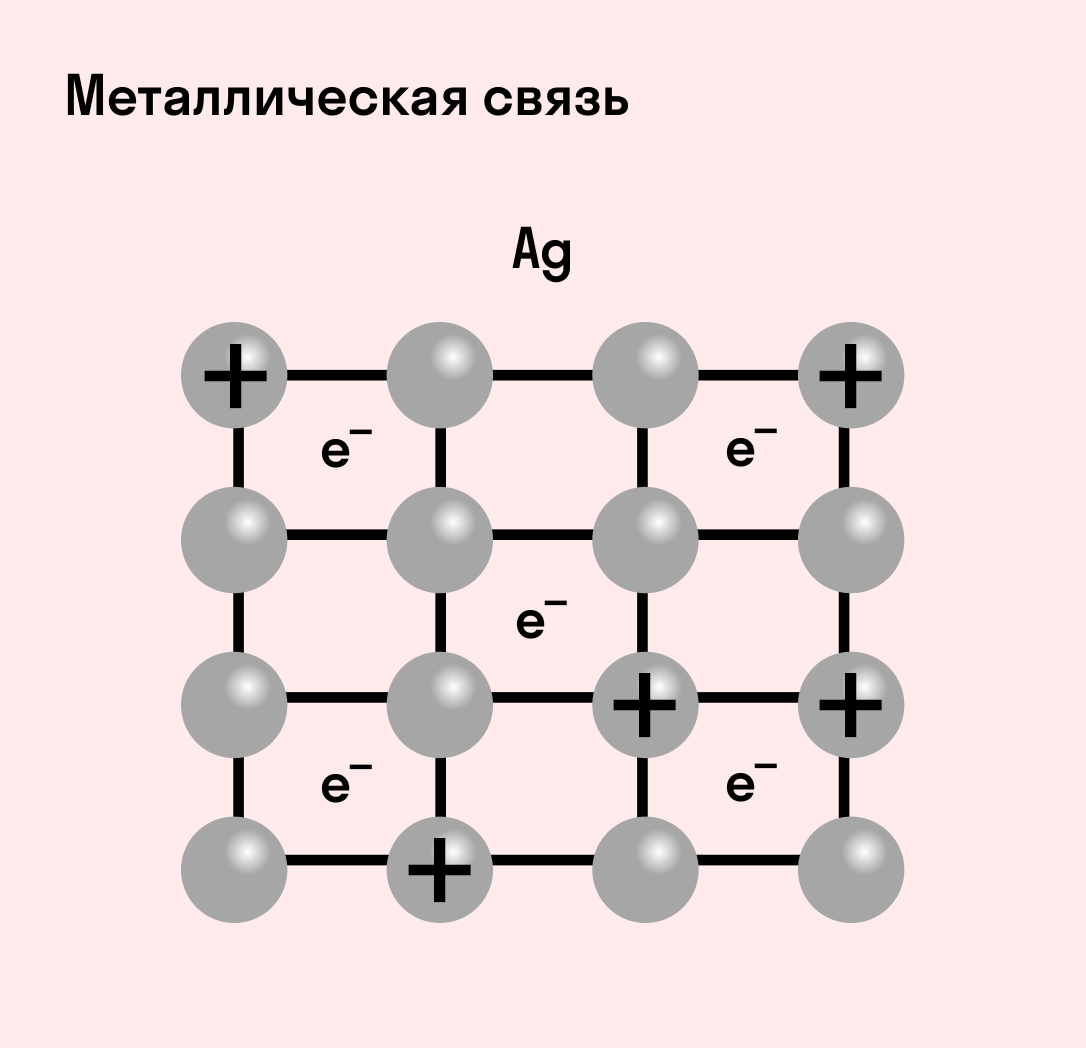
Металлическая связь
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
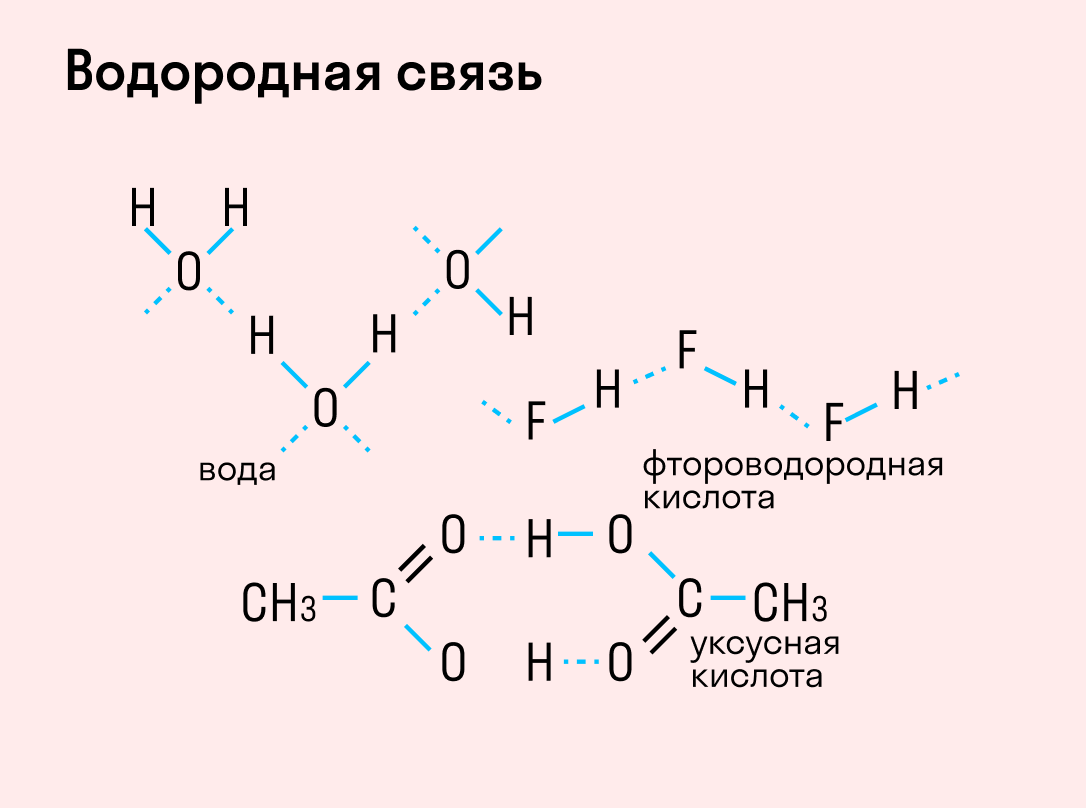
Водородная связь
Данный тип связи в химии стоит отдельно, поскольку он может быть как внутри молекулы, так и между молекулами. Как правило, у неорганических веществ эта связь происходит между молекулами.
| Водородная связь образуется между молекулами, содержащими водород. Точнее, между атомами водорода в этих молекулах и атомами с большей ЭО в других молекулах вещества. |
Объясним подробнее механизм этого вида химической связи. Есть молекулы А и В, содержащие водород. При этом в молекуле А есть электроотрицательные атомы, а в молекуле В водород имеет ковалентную полярную связь с другими электроотрицательными атомами. В этом случае между атомом водорода в молекуле В и электроотрицательным атомом в молекуле А образуется водородная связь.
Такое взаимодействие носит донорно-акцепторный характер. Донором электронов в данном случае выступают электроотрицательные элементы, а акцептором — водород.
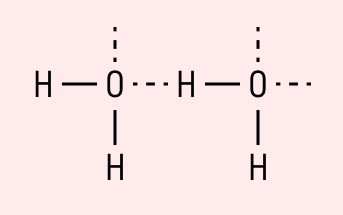
Графически водородная связь обозначается тремя точками. Ниже приведена схема такого взаимодействия на примере молекул воды.
Характеристики водородной связи:
Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
Ковалентная неполярная связь имеет место между атомами с разной ЭО.
Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
Металлическая связь бывает только между атомами металлов. Это взаимодействие положительных ионов в кристаллической решетке и свободных отрицательных электронов. Масса рассеянных по всему объему свободных электронов представляет собой «электронное облако».
Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.
Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
Определить тип химической связи в 8 классе поможет таблица.
Электронная пара
Различают поделённые (связывающие) электронные пары, принимающие участие в образовании химической связи за счёт взаимодействия неспаренных электронов, и неподелённые электронные пары (внешние электронные пары), не принимающие участия в образовании химической связи. Различают также свободные (подвижные) электронные пары (куперовские пары), обладающие большой свободой движения в кристаллической решётке, образуемой положительными ионами металла.
Считается, что термин «электронная пара» ввёл американский физикохимик Льюис в процессе разработки электронной теории химической связи.
Льюис подчеркнул важность явлений спаривания как общих, так и неподелённых электронов и стабильность группы из восьми электронов (октетная теория): «химической связью всегда и во всех молекулах является только пара электронов, соединяющих два атома». Позднее Л. Полинг и П. Полинг уточнили это понятие: «Атомы в большинстве молекул прочно удерживаются вместе благодаря действию так называемых ковалентных связей, имеющих очень важное значение; для этого типа связи характерно то, что пара электронов, осуществляющая связь, одновременно принадлежит обоим связываемым атомам».
Связанные понятия
Упоминания в литературе
Связанные понятия (продолжение)
В химии валентными электронами называют электроны, находящиеся на внешней (валентной) оболочке атома. Валентные электроны определяют поведение химического элемента в химических реакциях. Чем меньше валентных электронов имеет элемент, тем легче он отдаёт эти электроны (проявляет свойства восстановителя) в реакциях с другими элементами. И наоборот, чем больше валентных электронов содержится в атоме химического элемента, тем легче он приобретает электроны (проявляет свойства окислителя) в химических.
Урок 14 Бесплатно Химическая связь
Химическая связь атомов в молекулах простых веществ
После подробного изучения строения атома и состояния электронных оболочек можно приступать к вопросу о том, каким же образом происходит соединение атомов в молекулы.
В образовании химической связи участвуют электроны внешнего электронного слоя.
На одной орбитали могут находиться не более двух электронов, причем их спины (четвертое квантовое число) должны быть противоположны. Более того, состояние атома, в котором на орбитали имеется один неспаренный электрон, является нестабильным: атом стремится к объединению с другим атомом (или с несколькими) с той целью, чтобы электроны на всех орбиталях были спаренными.
Получив недостающий электрон, атом переходит в стабильное состояние.
Экспериментально доказано, что почти все вещества, находясь в газообразном состоянии, объединяются в двухатомные молекулы.
Это касается не только привычных нам газов: водорода, кислорода, азота, хлора, но и веществ, которые при нормальном состоянии представляют собой жидкости (бром) или твердые вещества (йод).
В двухатомные молекулы объединяются даже пар ы металлов (литий, натрий).
Рассмотрим процесс образования молекул водорода.
При взаимодействии атомов водорода, электроны которых имеют антипараллельные спины, они взаимно притягиваются, их электронные облака перекрываются.
В месте взаимного перекрывания плотность двухэлектронного облака увеличивается, расстояние между ядрами атомов уменьшается.
При этом электроны образуют в пространстве уже не два электронных облака, а одно.
Атомы перешли в более стабильное состояние, при котором электроны спарены.
Внутренняя энергия системы, состоящей из двух атомов водорода, также уменьшается (избыток энергии выделяется в виде теплоты).
Область повышенной двухэлектронной плотности связывает два атома водорода в молекулу Н2. Между атомами образовалась химическая связь.
Итак, химическая связь между атомами водорода осуществляется обобществленной парой электронов.
Каждый из атомов отдает на образование связи по одному электрону.
Подобным образом осуществляется связь между атомами любого элемента.
В молекулах водорода атомы связаны одной общей электронной парой.
Такую связь называют одинарной. Но химическая связь между атомами в молекулах может быть образована с помощью большего числа электронных пар.
Это зависит от строения взаимодействующих атомов.
Например, у атома азота на внешнем электронном слое 5 электронов: 2 спаренных на s-орбитали и 3 неспаренных на трёх p-орбиталях.
Атом стремится к такому состоянию, чтобы все электроны были спарены, поэтому при объединении двух атомов азота образуется три общие пары электронов – такую связь называют тройной.
Увеличение числа электронных пар, связывающих атомы в молекулу, увеличивает прочность молекул.
Именно поэтому азот не так активно вступает в химические реакции, как, например, кислород или водород.
Конечно, на реакционную способность простого вещества влияет не только кратность связи в молекуле, но и другие факторы.
Поскольку атомы при объединении в молекулы проявляют валентность (т.е. способность объединяться с другими атомами) и связь образуется с образованием общих электронных пар, такую связь называют ковалентной.
Приставка «ко-» как риз и обозначает совместное участие.
С помощью ковалентной связи между атомами неметаллов образуются молекулы простых веществ, а также и многих сложных веществ.
Американский физикохимик Джилберт Льюис предложил электронные формулы веществ, отражающие природу ковалентной связи, которые затем назвали формулами Льюиса.
В этих формулах валентные электроны внешнего слоя условно изображены точкой. В них ковалентные связи обозначены общей электронной парой.
Общие электронные пары, осуществляющие химическую связь, для удобства также обозначают черточками:
Пройти тест и получить оценку можно после входа или регистрации
Виды и свойства ковалентной связи
Ковалентная связь устанавливается между атомами не только одного элемента, но и разных.
Рассмотрим установление химической связи между атомами разных элементов-неметаллов на примере образования фторида водорода.
Запишем схему электронных структур атомов водорода и фтора.
У каждого из атомов имеется по одному неспаренному электрону.
При взаимодействии этих электронов может образоваться общая электронная пара, связывающая атомы разных элементов:
В данном случае перекрываются сферическая s- орбиталь атома водорода и гантелеобразная p-орбиталь атома фтора.
Эта химическая связь также ковалентная.
Она осуществляется общей электронной парой, для образования которой каждый из этих атомов поставляет по одному электрону.
Связывающая их электронная пара принадлежит обоим атомам, однако уже не в равной степени.
Это связано с тем, что атомы разных элементов имеют разную электроотрицательность.
Общая электронная пара в молекуле сложного вещества смещена к одному из атомов, что образует вокруг этого атома избыток отрицательного заряда, а у другого – избыток положительного заряда.
Такая молекула имеет как бы два полюса: положительный и отрицательный.
Поэтому такую связь называют ковалентной полярной.
Молекулы хлороводорода, воды, аммиака являются полярными.
Их еще называют диполями (имеющими два полюса).
В противоположность этому, связь между одинаковыми атомами, где электронная пара принадлежит обоим атомам в равной степени, называют ковалентной неполярной.
Важнейшим свойством ковалентной связи является ее прочность.
Она определяется энергией связи. Вы уже знаете, что при образовании химической связи выделяется энергия – это экзотермический процесс.
При образовании H2выделяется 431 кДж/моль, при образовании HF– 565 кДж/моль (количество энергии, выделяющееся при образовании 1 моль вещества).
Чем выше степень перекрывания электронных облаков связывающихся атомов, тем больше энергия их связи и тем прочнее образованная молекула.
Длина связи зависит от радиуса взаимодействующих атомов, от кратности связи между ними.
Чем меньше длина связи, тем она прочнее.
Направленностьковалентной связи определяется взаимным расположением электронных облаков, участвующих в образовании химической связи.
Рассмотрим направленность ковалентных связей в молекуле воды.
У атома кислорода два неспаренных р-электрона.
Их р-электронные облака расположены в пространстве взаимно перпендикулярно по отношению друг к другу.
При взаимодействии с атомами водорода образуются две химические связи.
В молекуле воды они также образуют угол.
Экспериментально установлено, что угол связи Н–О–Н в молекуле воды равен не 90°, а 104,45° вследствие их взаимного отталкивания: у молекулы воды угловая форма.
Здесь настало время рассказать про ещё один вид связи.
Эту связь нельзя назвать полностью химической, а скорее электрохимической.
Кислород имеет очень большую электроотрицательность по отношению к водороду, вследствие чего в молекуле воды он очень сильно смещает на себя электронные пары, поэтому образующиеся вокруг атомов заряды ощутимы до такой степени, что между соседними молекулами воды образуются силы притяжения.
Поскольку такой вид связи образуется преимущественно с участием атомов водорода, её называют водородной.
Прочность такой связи примерно в 10 раз меньше прочности ковалентной, однако она значительно влияет на свойства веществ: повышает температуру плавления и кипения, вязкость, теплопроводность, теплоёмкость веществ.
Для примера рассмотрим температуры кипения и плавления водородных соединений элементов VI группы периодической системы (кислород, сера, селен, теллур) и рассмотрим их в виде таблицы и графика.
Вещество
Температура кипения
Температура плавления
Если бы между молекулами воды не существовало водородных связей, температура кипения воды была бы около минус 80 °С, а температура плавления около минус 90°С.
Водородная связь играет большую роль не только в том, что вода при нормальных условиях представляет собой жидкость.
Она также участвует в стабилизации очень многих органических молекул в живых организмах, таких как белки или нуклеиновые кислоты.
Молекулы разных веществ могут иметь линейное, угловое, пирамидальное и другое строение, плоскостную и неплоскостную формы.
Двухатомные молекулы, естественно, линейной формы.
Трехатомные молекулы могут иметь линейную или угловую форму. Четырехатомная молекула аммиака имеет форму пирамиды.
Пройти тест и получить оценку можно после входа или регистрации
Ионная связь и ее свойства
В том случае, когда электроотрицательности элементов в составе молекулы отличаются друг от друга весьма значительно, электрон в такой же степени сдвигается в сторону одного из атомов, становится почти полностью принадлежащим этому атому.
Примером такой связи можно назвать связь атомов в хлориде натрия (поваренная соль).
Положительно заряженные ионы называют катионами, а отрицательно заряженные ионы – анионами.
Между ними возникают силы электростатического притяжения.
За счет этих сил разноименно заряженные ионы связываются между собой, образуя соединение NaCl(поваренная соль).
Связь атомных частиц в ионном соединении объясняется не повышенной плотностью двухэлектронного облака (общей электронной пары), а силами электростатического притяжения ионов.
Химическая связь между ионами, осуществляемая силами их электростатического притяжения, называется ионной связью, а соединения, которые образовались вследствие притяжения ионов, называются ионными.
Ионных соединений сравнительно немного. Их образуют типичные металлы и неметаллы, резко отличающиеся по своей электроотрицательности. Примерами таких соединений являются соединения металлов первой или второй групп периодической системы с неметаллами седьмой группы.
При обычных условиях большинство ионных соединений находится в твердом состоянии.
При определенных условиях ионные соединения распадаются на ионы.
Обычно ионные соединения легко отличить по двум признакам: высокая температура плавления и хорошая растворимость в воде.
Почему ионные соединения хорошо растворимы в воде?
Вспомните, как говорили алхимики: подобное растворяется в подобном.
Молекула воды сильно полярна, и поэтому ионы в составе ионного соединения ассоциируются с молекулами воды, при этом молекулы воды как бы «облепляют» ионы растворённого вещества, образуются водородные связи.
Понятно, что данная схема отображает состояние ионов в растворе приблизительно, чтобы вы поняли суть процесса растворения вещества с ионной связью.
При диссоциации ионной связи энергия поглощается, а при образовании водородных связей – выделяется. Однако поскольку водородная связь намного слабее ковалентной и тем более слабее ионной, выделяется энергии гораздо меньше, чем поглощается.
Диссоциация – разделение в пространстве положительных и отрицательных ионов без разрыва химической связи (т.е. с сохранением общей электронной пары, которая становится принадлежащей одному атому).
Поэтому при растворении абсолютного большинства ионных соединений в воде поглощается энергия, проще говоря, раствор охлаждается.
У меня есть дополнительная информация к этой части урока!
Часто проводят такой опыт: стакан, стоящий на тарелке с небольшим количеством холодной (почти ледяной) воды, наливают ту же воду и насыпают смесь хлорида калия и хлорида натрия.
Смесь этих солей при растворении в воде поглощает больше теплоты, чем такое же количество каждой соли по отдельности. Из доступных в быту веществ также можно взять аммиачную селитру.
После растворения солей температура раствора понижается настолько, что чистая вода, на которой стоит стакан, замерзает.
Ионы в природе существуют вокруг нас.
Много разнообразных ионов в морской воде, прибрежный воздух также ионизирован и поэтому весьма полезен для здоровья.
Однако ионы химически активны, и результатом их взаимодействия часто бывают негативные явления, например, кислотные дожди.
Также ионы играют большую роль в процессах обмена веществ в живых организмах, при этом отклонение концентрации ионов в тканях в обе стороны губительно сказывается на этих процессах.
Ионную связь можно рассматривать как предельный случай полярности ковалентной связи.
Однако чисто ионной связи практически не существует.
Отсюда деление химической связи на типы (ковалентная и ионная) также условно.
Пройти тест и получить оценку можно после входа или регистрации