какие факторы влияют на транспорт слизи в дыхательных путях
Какие факторы влияют на транспорт слизи в дыхательных путях
Сотрудники «Российского национального исследовательского медицинского университета им. Н.И. Пирогова» в своей статье рассмотрели вопросы защитных механизмов слизистых оболочек верхних дыхательных путей: мукоцилиарный клиренс, продукция защитных белков и система мукозального иммунитета. Привели данные о значении и взаимосвязи лимфоидных структур, связанных со слизистыми оболочками различной анатомической локализации. Рассмотрели механизмы воздействия топических бактериальных лизатов, описаны их эффективность в лечении и профилактике респираторных заболеваний и их осложнений.
Цель данной статьи обратить внимание врачей, особенно первичного звена, не на системные, а на топические препараты, воздействующие на слизистые оболочки верхних дыхательных путей и назначаемые как с лечебной, так и с профилактической целью.
Топические лекарственные средства исторически широко применяются в отечественной медицине, яркий пример – ушные капли и сосудосуживающие средства. Назальный (интраназальный) путь введения препаратов используют при необходимости воздействия непосредственно в локусе воспаления (с этим связана и быстрота появления эффекта от их применения) и при назначении средств, которые при пероральном введении подвержены предсистемной элиминации. При рассасывании лекарственных форм абсорбция из полости рта через слизистую оболочку щек или из подъязычной области (сублингвально) дает возможность лекарству поступать непосредственно в кровь, минуя воздействия в желудочно-кишечном тракте и печени, связанные с переходом в систему v. portae. Важно помнить, что топические формы выпуска лекарственных средств могут оказывать системный эффект, хотя независимо от локуса применения взаимодействуют с «барьерными» структурами: кожей, конъюнктивой или слизистыми оболочками.
Слизистая оболочка верхних дыхательных путей представляет собой обширную площадь «контакта» организма человека с окружающей средой, своего рода «платформу» для взаимодействия инфекционных и неинфекционных агентов (в том числе ксенобиотиков) с макроорганизмом. C вдыхаемым воздухом (его ежедневный объем составляет около 7 м3) на слизистую оболочку верхних дыхательных путей попадает 7·10 4 –10 7 только бактериальных клеток. Кроме того, на нее воздействуют физические и химические факторы (влажность воздуха, его газовый состав, примеси (выхлопные газы, продукты утилизации отходов, выбросы промышленных производств) и т.д. Поэтому в процессе эволюции сформировался особый комплекс иммунобиологических механизмов защиты от различных патогенов, распознавания непатогенных частиц и толерантности к собственной симбиотической/индигенной микрофлоре.
Обсуждая вопрос о собственных защитных силах организма, можно вспомнить все механизмы врожденного и приобретенного иммунитета, но мы остановимся на защитных способностях именно слизистых оболочек верхних дыхательных путей: мукоцилиарном клиренсе, продукции защитных белков и системе мукозального иммунитета. Особый интерес в последние годы уделяется роли лимфоидной ткани, ассоциированной со слизистыми оболочками – MALT (от англ. Mucosa associated lymphoid tissue; система мукозального иммунитета, иммунитет барьерных тканей). Она подразделяется на несколько уровней в зависимости от анатомического расположения лимфоидной ткани. В верхних дыхательных путях находятся такие уровни MALT, как TALT (носоглотка, евстахиева труба, среднее ухо), NALT (носовая полость, рот и ротоглотка), LALT (лимфоидная ткань, ассоциированная с гортанью), BALT (трахея, бронхи, легкие), но есть и другие не менее важные: GALT (желудочно-кишечный и урогенитальный тракты), SALT (кожа, или дерма), CALT (лимфоидная ткань, ассоциированная с коньюнктивой), LDALT (лимфоидная ткань, ассоциированная со слезными протоками), DALT (лимфоидная ткань, ассоциированная со слюнной железой и ее протоками), VALT
(лимфоидная ткань, ассоциированная с сосудами). Хотя в слизистых оболочках человека сосредоточено более 80% всех плазматических клеток организма, некоторые ее уровни (GALT, BALT) хорошо изучены, о других до сих пор мало что известно (CALT, LDALT, DALT, LALT).
Предполагается, что лимфоидная ткань, связанная с конъюнктивой (CALT), и слезная лимфоидная ткань, ассоциированная с дренажной системой (LDALT), формируют единое функциональное подразделение («дренажная система глаза» – содержит все компоненты, присущие MALT), части которого соединены между собой благодаря течению слезной жидкости, рециркуляции лимфоцитов и, по-видимому, нервным рефлексам. Лимфоидная ткань, связанная с протоками слюнных желез (DALT), в неизмененных слюнных железах человека развита слабо, но возможно ее поражение при аутоиммунных заболеваниях (синдром Шегрена); постоянная антигенная стимуляция также может приводить к развитию MALT-лимфом B-клеточной лимфоидной ткани.
Выявление элементов LALT наиболее часто описывают на гортанной поверхности надгортанника и в желудочках гортани, а в области голосовой щели и в подскладковом отделе гортани они обнаруживаются очень редко. У лиц в возрасте от 2 до 20 лет LALT присутствовала в гортани в 84% случаев и в 56% случаев – в возрастной группе старше 20 лет.
Одной из важных составляющих MALT считается NALT, хотя молекулярные механизмы, а также ее роль в захвате антигена в носовой полости в значительной степени неизвестны. По данным гистологического исследования тканей и структур полости носа, NALT была выявлена в различных частях слизистой оболочки полости носа с преимущественной локализацией на средней носовой раковине. Анатомическое расположение ТALT, NALT и LALT на перекрестке дыхательного и пищеварительного трактов – идеальная локализация для участника системы мукозального иммунитета, чьи отделы в различных системах организма тесно взаимодействуют между собой, подчиняясь единым регулирующим влияниям.
Общей для всех отделов MALT задачей является продукция иммуноглобулина А (IgA), защитные свойства которого связаны с его способностью предупреждать адгезию и инвазию патогенных бактерий, а также проникать в энтероциты кишечника и воздействовать на репликационный цикл вирусов, находящихся внутри клеток. Важен IgA и для нормального существования кишечных бактерий-комменсалов, которые индуцируют гуморальные адаптивные иммунные ответы. Нарушение данного взаимодействия (например, при изменении состава или полном подавлении нормальной флоры кишечника) приводит к снижению продукции секреторного IgA и размера пейеровых бляшек, в которых располагаются плазматические клетки, его синтезирующие. Кроме того, установлено, что бактерии-комменсалы с иммуномодулирующими свойствами могут способствовать развитию иммунного ответа организма человека против патогенов. В связи с этим напомним, что избыточное/бесконтрольное назначение антимикробных препаратов (в частности антисептиков) в ряде случаев сопровождается уничтожением и нормальной флоры локуса применения.
Секреторные IgA в отличие от остальных иммуноглобулинов выполняют функции специфического иммунологического барьера. Связывая антигены на поверхности эпителия и препятствуя их проникновению внутрь организма, они тем самым уменьшают вероятность развития как воспалительного, так и аллергического процессов. MALT в определенной степени изолирована от других (периферических) вторичных лимфоидных органов в связи с автономностью путей рециркуляции лимфоцитов и может функционировать независимо от системного иммунитета. Наивные T- и B-лимфоциты непрерывно перемещаются из места первичной локализации в конкретном лимфоидном органе или ткани в лимфатическое и кровяное русло и затем возвращаются в ту же ткань (хоминг), благодаря находящимся на поверхности лимфоцитов рецепторам. При этом MALT различных анатомических локализаций функционально связана между собой (общая мукозальная иммунная система), поэтому презентация антигена и активация B-клеток в одной анатомической области может вызвать секрецию вирусспецифичных иммуноглобулинов в слизистых оболочках других локализаций, что следует учитывать при выборе лекарственных средств в пользу топических.
Не стоит забывать про другие защитные механизмы, присущие слизистой оболочке верхних дыхательных путей и относящиеся к системе врожденного иммунитета, в частности особенности строения мерцательного (или респираторного) эпителия. Слизистые железы и бокаловидные клетки слизистой оболочки секретируют слизь, содержащую липиды, гликопротеины и гликоконъюгаты, которая увлажняет поверхность верхних дыхательных путей и является «ловушкой» для патогенов и других микрочастиц. Эта «инфицированная» слизь продвигается к пищеводу при помощи движений реснитчатых клеток мерцательного эпителия в процессе мукоцилиарного клиренса. Данный механизм транспорта секрета нарушается при воспалительном процессе различной этиологии, при котором меняется двигательная активность реснитчатых клеток и реология самого секрета желез слизистой оболочки. Защитными свойствами обладают и продуцируемые слизистыми верхних дыхательных путей активные формы кислорода (оксид азота, перекись водорода) или белки (лакто-феррин, дефензины, лизоцим).
Лизоцим, открытый Александром Флемингом около 100 лет назад, вызывает лизис клетки путем гидролиза клеточной стенки бактерии с выделением различных продуктов распада, в том числе пептидогликана, который узнают рецепторы клеток человека. С течением времени патогенные бактерии выработали ряд механизмов, защищающих их от лизоцима, например изменение структуры пептидогликана, делающее его устойчивым к гидролизу; изменение заряда и структуры клеточной стенки и синтез ингибиторов лизоцима. У здоровых людей содержание лизоцима в сыворотке крови равно приблизительно 10 мкг/л, а в носовой слизи и слюне – 75–80 мкг/л.
Важную роль во врожденном иммунитете играют TOLL-подобные рецепторы (TOLL-like receptors, TLR). У человека выделено 10 различных типов TLR, все они располагаются на поверхности антигенпрезентирующих клеток (дендритные клетки, моноциты и макрофаги), распознают патогенассоциированные молекулярные паттерны (PAMP – Pathogen-associated molecular patterns) и активируют клеточный иммунный ответ. Активация TLR определенного типа косвенным путем активирует синтез интерферонов, которые делятся на 3 типа (I, II и III) и являются цитокинами, способными запускать механизмы противовирусной защиты организма и препятствовать репликации вирусов, за что и получили свое название (interfere – мешать, препятствовать).
Слизистые оболочки носо- и ротоглотки также служат входными воротами респираторных инфекций, поэтому возможность активации их собственных защитных сил – способ не только лечения, но и профилактики инфекций верхних дыхательных путей (ринита, синусита, назофарингита, тонзиллита, фарингита, тонзиллофарингита). Препаратами
выбора в данной ситуации могут быть иммуномодуляторы, к которым относятся топические бактериальные лизаты. Основные компоненты этих препаратов – антигенные и неантигенные структуры лизированных бактерий (липо-полисахариды, протеогликаны и другие структуры бактериальной стенки), которые являются РАМР.
Иммуномодулирующее действие лактобактерий связывают с наличием в их клеточной стенке пептидогликанов и тейхоевых кислот (поликлональных индукторов и иммуномодуляторов). Введение лактобактерий мышам сопровождалось увеличением количества плазматических клеток, усилением синтеза антител к вирусу гриппа и ротавирусу, а также увеличением синтеза IgA и IgM на слизистых оболочках бронхов. К настоящему времени в клинических исследованиях установлено, что виды лактобактерий различаются по степени выраженности оказываемого ими иммуномодулирующего эффекта и в отличие от бифидобактерий обладают большей резистентностью к антибиотикам и могут применяться на фоне антибиотикотерапии.
Механизм действия топических иммуномодуляторов – бактериальных лизатов заключается в следующем. После нанесения препаратов на слизистую оболочку полости носа и носоглотки или ротовой полости и ротоглотки РАМР бактерий, входящих в состав препарата, распознаются TLR нейтрофилов, циркулирующих моноцитов и тканевых макрофагов. Это активирует клетки врожденного иммунитета (нейтрофилы, моноциты, макрофаги), в результате чего повышается их активность, ускоряется созревание дендритных клеток, повышается продукция интерлейкинов (ИЛ-2, ИЛ-10, ИЛ-12) и интерферона-γ (ИФН-γ), происходит активация натуральных киллеров, возрастает экспрессия ко-стимулирующих молекул на мембране дендритных клеток и повышается чувствительность рецепторов к ИЛ-2 на лимфоцитах. Отмеченная выше активация факторов врожденного иммунитета позволяет запустить процессы презентации антигенов и дифференцировку Т- и В-лимфоцитов, благодаря чему инициируются процессы адаптивного иммунитета. Таким образом, бактериальные лизаты при топическом использовании активируют и врожденный, и адаптивный иммунитет, и местные защитные механизмы (в частности, выработку собственных интерферона и лизоцима). На этом аспекте остановимся более подробно, так как препараты, содержащие лизоцим, довольно часто назначаются в педиатрической практике.
Радциг Е.Ю., Радциг А.Н., Варавина М.А.
Российский вестник перинатологии и педиатрии, 2021; 66:(1)
Какие факторы влияют на транспорт слизи в дыхательных путях
6.1. Патогенез обструктивной формы дыхательной недостаточности
1) обтурации (закупорки воздухоносных путей инородными телами, рвотными массами, мокротой, слизью, меконием (у новорожденных); воспалительных изменений слизистой оболочки дыхательных путей, гиперсекреции и диссекреции слизи, задержки в дыхательных путях патологического отделяемого (рис.7,8);
Рис.7. Обструкция дыхательных путей
Рис.8. Обструкция дыхательных путей у курильщика
2) компрессии (сдавления) дыхательных путей опухолью, гипертрофированной щитовидной железой, заглоточным абсцессом;
3) утолщения слизистой оболочки трахеи и бронхов вследствие отека слизистой дыхательных путей и клеточной нифильтрации при воспалении, иммуноаллергическом процессе;
4) стеноза при спазме мышц гортани психогенного (истерия) или рефлекторного характера (раздражение газообразными веществами), при формировании послеожогового рубца, при клапанной обструкции бронхов, характерной для хронической обструктивной эмфиземы легких; в результате утраты легкими эластических свойств и нарушения тонуса бронхиальной мускулатуры может развиться дискинезия (экспираторный стеноз) дыхательных путей.
Патогенетическую основу обструктивного синдрома дыхательных путей составляет повышение сопротивления воздушному потоку. Это приводит к тому, что снижается уровень альвеолярной вентиляции. Повышение сопротивления увеличивает нагрузку на дыхательную мускулатуру, и наблюдается быстрое утомление мышц. У больного развивается стенотическое дыхание (удлинение вдоха, т.е. инспираторная одышка).
Достаточно часто в клинической практике наблюдается хроническая бронхиальная обструкция, которая обозначается термином «хроническая обструктивная болезнь легких» (ХОБЛ). Причинами развития ХОБЛ являются: хронический бронхит (это самая частая причина), бронхиальная астма, эмфизема легких, муковисцидоз, бронхоэктатическая болезнь.
Обструкция конечного отдела дыхательных путей наблюдается при бронхо- и бронхиолоспазмах, спадении мелких бронхов, утративших эластичность, сужении просвета бронхиол вследствие отечно-воспалительных изменений, обтурации бронхиол патологическим содержимым (кровью, экссудатом), компрессии бронхиол в условиях повышенного внутригрудного давления (при кашле). При обструкции нижних дыхательных путей для осуществления полноценного выдоха необходимо участие дыхательных мышц, так как сила эластической тяги легких недостаточна для изгнания воздуха из альвеол. Давление и бронхиальное сопротивление на выдохе более выражены, чем на вдохе, при этом возникает удлинение выдоха по сравнению с вдохом (экспираторная одышка).
6.2. Патогенез рестриктивной формы дыхательной недостаточности
а) внелегочные факторы приводят к ограничению дыхательных движений вследствие сдавления легочной ткани (например, при гемо- и пневмотораксе, образовании плеврального выпота);
б) внутрилегочные факторы вызывают изменение эластичности легочной ткани. Основой рестриктивных нарушений является повреждение белков интерстиция под действием эластазы, коллагеназы и других протеаз. Как известно, основными компонентами интерстиция легких являются коллаген (60-70%), эластин (25-30%). Гликозаминогликаны составляют около 1%, а фибронектин – 0,5%. Фибриллярные белки обеспечивают стабильность каркаса легких, его растяжимость, эластичность, создают оптимальные условия для газообмена. При ряде патологических процессов в легких (воспалительного характера, нарушениях кровотока, при тромбозе, эмболии сосудов, застойных явлениях в легких, эмфиземе, опухолевом и кистозном поражении) возможна активация лизосомальных гидролаз, в частности, эластазы, коллагеназы. Последняя приводит к интенсивному распаду фибриллярных белков, что проявляется снижением эластичности легочной паренхимы и повышением эластического сопротивления легочной ткани вдыхаемому воздуху.
Снижение эластичности легочной ткани и развитие рестриктивной формы дыхательной недостаточности возникают при диффузном межальвеолярном разрастании соединительной ткани в случаях пневмосклероза, пневмофиброза, а также при отеке легких различного генеза.
Рестриктивные изменения легочной ткани обуславливают уменьшение глубины вдоха и вызывают тахипноэ, т.е. развивается «короткое» или поверхностное дыхание.
Достаточно часто в клинической практике наблюдается дыхательная недостаточность смешанного обструктивно-рестриктивного характера, когда сочетаются нарушение проходимости воздухоносных путей и ограничение подвижности легких. Последнее наблюдается при эмфиземе легких, крупозной пневмонии, бронхиальной астме, бронхоэктатической болезни, хронической пневмонии т.д.
Какие факторы влияют на транспорт слизи в дыхательных путях
1.1. Анатомо-физиологические особенности воздухоносных путей
Дыхание – это многокомпонентный процесс жизнеобеспечения всех внутренних органов, включающий внешнее дыхание, транспорт газов кровью, обмен газов между кровью и тканями, а также тканевое дыхание. В свою очередь внешнее дыхание включает газообмен между внешней средой и альвеолярным воздухом, а также альвеолярное дыхание – газообмен между альвеолярным воздухом и притекающей к легким кровью (рис.1).
Внешнее дыхание – процесс, регулируемый центральной и периферической вегетативной и соматической нервной системой, носит произвольный и непроизвольный характер, включает акт активного регулируемого вдоха (активную инспирацию), пассивную постинспирацию (расслабление вдыхательной мускулатуры) и активный регулируемый выдох (экспирацию). Вентиляция альвеол обеспечивается за счет чередования вдоха и выдоха. При вдохе в альвеолы поступает насыщенный кислородом воздух, а при выдохе удаляется из альвеол в окружающую среду воздух, насыщенный CO2 и бедный O2. Передвижение воздуха во время вдоха и выдоха по воздухоносным путям обусловлено попеременным расширением и уменьшением размеров грудной клетки за счет последовательного сокращения и расслабления дыхательных мышц грудной клетки (вдыхательных и выдыхательных), а также диафрагмы. Дыхательные мышцы грудной клетки включают инспираторную и экспираторную мускулатуру.
Диафрагма ограничивает снизу грудную полость, состоит из сухожильного центра и мышечных волокон.
Во время вдоха диафрагма уплощается в результате сокращения мышечных волокон, отходящих от внутренней поверхности грудной клетки, а купол диафрагмы сглаживается, открывается реберно-диафрагмальный синус. Участки легких, расположенные в этих синусах, хорошо вентилируются.
К инспираторным мышцам грудной клетки относятся наружные межреберные и внутренние межхрящевые мышцы. В момент вдоха нижележащее ребро поднимается к вышележащему, а грудная клетка поднимается.
Во время выдоха сокращаются экспираторные мышцы, к которым относятся внутренние межреберные. При их сокращении вышележащее ребро подтягивается к нижележащему, а грудная клетка опускается.
Для усиления дыхания в условиях нормы и патологии используется вспомогательная инспираторная и экспираторная мускулатура. К вспомогательным инспираторным мышцам относятся грудинно-ключично-сосцевидная мышца, а также большие и малые грудные, лестничные, зубчатые мышцы. К важнейшим вспомогательным экспираторным мышцам относятся мышцы живота.
В зависимости от того, связано ли расширение грудной клетки преимущественно с поднятием ребер или уплощением диафрагмы, различают реберный (грудной) и брюшной тип дыхания. Тип дыхания в значительной мере зависит от возраста. С возрастом подвижность грудной клетки уменьшается и начинает преобладать брюшной тип дыхания. Брюшное дыхание затрудняется в последние месяцы беременности. Принято считать, что у женщин преобладает грудной тип дыхания, а у мужчин – брюшной. Брюшное дыхание наиболее эффективно, так как при таком дыхании улучшается вентиляция легких и облегчается венозный возврат от брюшной полости к сердцу.
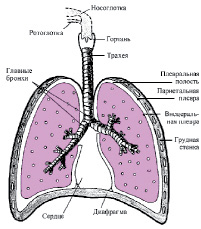
В условиях нормы легкие отделяются от грудной клетки плевральной полостью, находящейся между висцеральным и париетальным листками плевры и заполненной несжимаемой жидкостью (рис.2). Последняя обеспечивает скольжение мешков плевры друг относительно друга. В случаях развития плеврита и скопления жидкости в полости плевры с последующим образованием спаек, вентиляция легких резко затрудняется.
Рис.2. Схема строения органов дыхания
В плевральной полости создается определенной давление, которое на высоте вдоха на 0,6 – 0,8 кПа ниже атмосферного, а в конце выдоха внутриплевральное давление на 0,3-0,5 кПа также ниже атмосферного. Таким образом, в плевральной полости давление постоянно отрицательное, ниже атмосферного. Поступление воздуха, крови или эксудата в плевральную полость называют, соответственно – пневмо-, гемо-, или гидроторакс. При этом поджатые легкие не следуют за сокращением дыхательной мускулатуры, либо их смещение происходит в меньшем объеме. Искусственный односторонний пневмоторакс иногда проводят с диагностической целью, чтобы уменьшить нагрузку на поражённые туберкулезом легкие.
1.2. Роль воздухоносных путей в обеспечении дыхания и недыхательных функций.
Дыхательные пути начинаются с полости носа, включая носоглотку, гортань, трахею, бронхи, бронхиолы и заканчиваются альвеолярными ходами и альвеолами. Внутренняя поверхность дыхательных путей покрыта слизистой оболочкой, которая выстлана мерцательным эпителием, содержит значительное количество желез, выделяющих слизь, а также различные виды рецепторов. Отдельные участки воздухоносных путей отличаются особенностями структуры и функции.
Касаясь роли носового дыхания, необходимо отметить его способность очищать, увлажнять и согревать воздух. При участии реснитчатого эпителия и слизи здесь задерживаются взвешенные в воздухе частицы размером до 4мкм. При носовом дыхании происходит обеззараживание воздуха за счет иммуноглобулинов классов A,G,M, секретируемых или пассивно диффундирующих в слизистую, а также при участии микро- и макрофагов, лизоцима, комплемента, интерферона, содержащихся в слизи.
Слизистая носа и носоглотки содержит значительное количество ирритантных рецепторов, механорецепторов, обонятельных рецепторов, рецепторов болевой чувствительности, являющихся окончаниями обонятельного, тройничного, лицевого, верхнегортанного нервов. С рецепторов слизистой оболочки носа формируются защитные рефлексы в виде чихания и усиленного слизеотделения, а также рефлексы, влияющие на функциональную активность центральной нервной системы, ряда внутренних органов.
С механорецепторов и хеморецепторов слизистой носа и носоглотки возникает афферентная импульсация в ретикулярную формацию ствола мозга, а затем в слюноотделительный, дыхательный, сосудодвигательный центры продолговатого мозга, в гипоталамус. При этом усиливаются неспецифические восходящие активирующие влияния и на кору головного мозга.
Возбуждение рецепторов слизистой носа и носоглотки резко усиливается при развитии воспалительного процесса в верхних дыхательных путях инфекционной или аллергической природы под влиянием медиаторов воспаления и аллергии: гистамина, кининов, лейкотриенов, причем возбуждение ирритантных рецепторов вызывает развитие тахипноэ, спазм дыхательных путей, кашлевой рефлекс, чихание, чувство першения.
Гортань – завершает верхний отдел дыхательных путей и переходит в трахею – начальную часть нижних дыхательных путей. Гортань обеспечивает дыхательную, защитную и речевую функции, в частности регулирует поступление воздуха в нижние дыхательные пути за счет сужения и расширения голосовой щели. Слизистая гортани содержит механорецепторы, ирритантные рецепторы, возбуждение которых при участии верхне- и нижегортанного нервов, языкоглоточного нерва регулирует частоту и глубину дыхательных движений. Кроме дыхательной функции, гортань выполняет защитную, голосовую и речевую функции.
В трахее и бронхах продолжаются процессы усиленного увлажнения, согревания и очищения воздуха. Здесь при участии слизи и мерцательного эпителия задерживаются более мелкие, взвешенные в воздухе частицы размером от 4 мкм до десятых долей мкм, а также происходит инактивация патогенных агентов за счет выделительного фагоцитоза, иммуноглобулинов, лизоцима, лактоферрина, интерферона.
Стенки трахеи и крупных бронхов содержат хрящевые кольца и не спадаются при дыхании, а мышечные волокна, образующие стенку бронха, регулируют просвет бронхов на фоне изменения нервных и гуморальных влияний, а также уровня локально образующихся медиаторов воспаления и аллергии.
Воздухоносные пути (ВП) легких представляют собой ряд дихотомически-делящихся трубок, представленных 23 генерациями В.П.. Первые 16 генераций включают бронхи, бронхиолы и терминальные бронхиолы, выполняющие проводящую функцию для воздуха. Последние 7 генераций состоят из дыхательных бронхов, альвеолярных ходов и альвеолярных мешочков, дающих начало альвеолам. Стенки проводящих воздухоносных бронхов состоят из 3-х основных слоев: внутренней слизистой оболочки, гладкомышечного слоя и внешнего соединительнотканного слоя, содержащего хрящ в больших бронхах. Эпителиальные клетки ВП несут на апикальной поверхности реснички, продвигающие слизь в направлении носоглотки. В свою очередь слизь образуется бокаловидными клетками. Реснитчатый эпителий и бокаловидные клетки формируют мукоцилиарный эскалатор, обеспечивающий очищение ВП (рис.3).
Диаметр просвета воздухоносных путей регулируется при участии холинергических нервных влияний; освобождение ацетилхолина приводит к сокращению гладких мышц воздухоносных путей. В то же время неадренергические, нехолинергические нейроны и нервные волокна за счет высвобождения субстанции Р обеспечивают сокращения гладких мышц воздухоносных путей, а при участии ВИП (вазоактивного интестинального пептида) возникает расслабление гладких мышц воздухоносных путей.
Важная роль в регуляции просвета воздухоносных путей отводится медиаторам воспаления, аллергии: гистамину, гепарину, серотонину, лейкотриенам, факторам активации тромбоцитов, хемотаксиса. В свою очередь эозинофилы в зоне воспаления являются источником таких медиаторов, как главный основной белок, катионный белок, лейкотриены В4,С4 и других, также оказывающих выраженное влияние на просвет воздухоносных путей.
Большинство медиаторов воспаления, вызывающих бронхоспастическое действие, реализуют биологические эффекты при участии специфических рецепторов.
Слизистая трахеи и бронхов является слабой рефлексогенной зоной, несмотря на наличие достаточного количества механо-, хемо- и ирритантных рецепторов. Значительная часть этих рецепторов относится к быстро-адаптирующимся или промежуточным, высокопороговым и, соответственно, низкочувствительным структурам, нефункционирующим в условиях нормы и возбуждающимся лишь при сверхпороговых раздражениях или под влиянием медиаторов воспаления и аллергии, а также при застойных явлениях в малом кругу кровообращения. Импульсация в этих рецепторах распространяется по чувствительным волокнам к центрам n. Vagus, а затем при участии ретикулярной формации ствола мозга к инспираторным и экспираторным бульбарным нейронам, определяя частоту и глубину дыхательных движений, а также развитие кашлевого рефлекса.