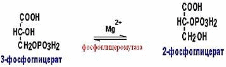какие ферменты обеспечивают гликолиз
БИОХИМИЧЕСКАЯ ХАРАКТЕРИСТИКА ФЕРМЕНТОВ ГЛИКОЛИЗА
Гликогенфосфорилаза (КФ 2.4.1.1.) относится к классу трансфераз. Катализирует расщепление концевой α-1,4-глюкозной связи в полисахаридной цепи глюкана с образованием глюкозо-1-фосфата и укороченного на один глюкозидный остаток полисахарида. В организме животных катализирует расщепление гликогена [2].
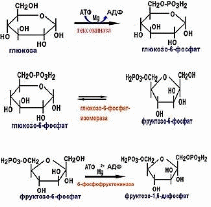
Глюкозофосфатизомераза (КФ 5.3.1.9.) относится к классу трансфераз, катализирует обратимую реакцию изомеризации, в которой глюкозо-6-фосфат (альдоза) превращается во фруктозо-6-фосфат (кетозу).
Фруктозобисфосфатальдолаза (КФ 4.1.2.13.) фермент класса лиаз, катализирующий распад Д-фруктозо-1,6-дифосфата на диоксиацетонфосфат и глицеринальдегид-З-фосфат.
Фосфофруктокиназа (КФ 2.7.1.11.) относится к классу трансфераз, фермент киназа, отвечающий за фосфорилированиефруктозо-6-фосфата в процессе гликолиза [3].
Фосфоглицеромутаза (КФ 2.7.5.3.) относится к классу изомераз. Фермент фосфоглицеромутаза, катализирует изомеризацию 3-фосфо-глицериновой кислоты в процессах спиртового брожения.
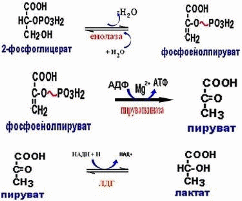
Енолаза (КФ 4.2.1.11.) фермент класса лиаз, катализирующий обратимую реакцию отщепления воды от 2-фосфо-D-глицерата с образованием макроэргических соединений фосфоенолпирувата [5].
Пируваткиназа (КФ 2.7.1.40.) относится к классу оксидоредуктаз. Гликолитический фермент, катализирующий (при наличии ионов магния и калия) предпоследнюю реакцию гликолиза – перенос остатка фосфорной кислоты от фосфоенолпирувата к АДФ с образованием АТФ и пирувата (пировиноградной кислоты).
Лактатдегидрогеназа (КФ 1.1.1.27.) относится к классу оксидоредуктаз. Фермент, принимающий участие в реакциях гликолиза. Лактатдегидрогеназа (ЛДГ) катализирует превращение лактата в пируват, при этом образуется NADH.
Регуляция активности ферментов гликолиза происходит под действием гормонов. Важное значение среди их принадлежит инсулину, глюкагону и адреналину. Причем глюкагон и адреналин являются наиболее значимыми гормональными ингибитором гликолиза. Инсулин стимулирует гликолиз через активацию гексокиназной реакции, стимуляцию фосфофруктокиназы и пируваткиназы.
Также на гликолиз влияют и другие гормоны. Так, соматотропин ингибирует ферменты гликолиза, а тиреоидные гормоны являются стимуляторами [6].
Регуляция гликолиза осуществляется через несколько ключевых этапов. Реакции, катализируемые гексокиназой, фосфофруктокиназой и пируваткиназой, отличаются существенным уменьшением свободной энергии и являются практически необратимыми, что даёт возможность им быть эффективными точками регуляции гликолиза.
В целом регулятором гексокиназы является отношение АТФ к АДФ. При снижении расхода энергии в клетке увеличивается количество молекул АТФ (относительно АДФ), а так же глюкозо-6-фосфата. В следствие этого активность гексокиназы снижается и, следовательно, снижается поступление глюкозы в клетку [7].
Таким образом, гликолиз – это сложный последовательный ферментативный процесс расщепления глюкозы до двух молекул пирувата (аэробный гликолиз) или двух молекул лактата (анаэробный гликолиз). Гликолиз регулируется одиннадцатью ферментами, которые локализованы в цитозоле и образуют мультиферментный комплекс.
Благодаря гормональной регуляции действия ферментов гликолиза обеспечивается последовательность реакций и интенсивность обмена веществ во всем организме.
Список использованных источников
Комов, В.П. Биохимия : учеб. для вузов / В.П. Комов, В. Н. Шведова – Москва : Дрофа, 2008. – 640 с. – ISBN 978-5-358-04872-0.
Щербаков, В.Г. Биохимия : учебник / В.Г. Щербаков, В.Г. Лобанов, Т.Н. Прудникова, А.Д. Минакова – Москва : ГИОРД, 2009. – 472 с. – ISBN 5-98879-008-9.
Ткачук, В.А. Клиническая биохимия : учеб. пособие / В.А. Ткачук – Москва : ГЭОТАР-Медиа, 2008. – 264 с. – ISBN 978-5-9704-0733-2.
33. Гликолиз. Биологическое значение, химизм процесса. Необратимые этапы и ключевые ферменты гликолиза. Биоэнергетика и регуляция этого процесса. Эффект Пастера.
— это анаэробный распад глюкозы до лактата.
С6Н12О6 + 2АДФ +2Фн = 2 лактата + 2АТФ + 2Н20.
-включает 11 реакций и 2 этапа.
Благодаря гликолизу организм осуществляет ряд функций в условиях недостаточности кислорода.
Когда на Земле не было кислорода, то гликолиз был основным источником энергии.
-Ферменты гликолиза локализуются в цитоплазме.
-Наиболее интенсивен гликолиз в: эритроцитах, работающей мышце, эмбриональной ткани, опухоли.
-3 необратимые реакции (киназные).
Первый этап гликолиза
Второй этап гликолиза
В активном центре фермента глицеральдегидфосфатдегидрогеназы содержатся SН-группы цистеина.
На первом этапе происходит отщепление водорода с альдегидной группы субстрата, а второй водород от SН-группы активного центра.
Водород переходит на НАД, в результате получаем НАДН+Н+, образуется фермент-субстратный комплекс, который взаимодействует с фосфорной кислотой.
Свободная энергия, освобождённая при окислении альдегидной группы, сохраняется в высокоэнергетической фосфатной группе.
НАДН+Н+, образующийся при окислении глицеральдегид-3фосфата,вновь окисляется в НАД, восстанавливая при этом ПВК до лактата.
Эта реакция происходит в анаэробных условиях
АТФ образуется за счёт двух реакций субстратного фосфорилирования (ПК, фосфоглицераткиназной).
Из глюкозы образуется 4АТФ.
2АТФ тратится в гликолизе на фосфорилирование (ГК, ФФК реакции).
Фосфоглицераткиназная реакция 2АТФ
Пируваткиназная реакция 2АТФ
—Гексокиназа – аллостерический фермент, ингибируется глюкозо-6-фосфатом. Инсулин стимулирует синтез глюкокиназы, которая не ингибируется глюкозо-6-фосфатом.
-Отрицательный модулятор – АТФ и цитрат.
Когда величина значительна, то происходит угнетение ФФК.
Причина этого: кислород окисляет НАДН+Н и он не восстанавливает ПВК в лактат.
— Пируваткиназа – аллостерический фермент.
Положительный модулятор – АДФ.
Отрицательный модулятор – АТФ, ацетил-КоА, жирные кислоты.
Гликолиз обратим. Биологическое значение обратимости гликолиза:
-освобождение тканей от лактата,
-возможность осуществления глюконеогенеза
34. Аэробный (дихроматический) распад глюкозы. Роль пируватдегидрогеназного комплекса в процессе окислительного декарбоксилирования пирувата. Биоэнергетика аэробного распада глюкозы.
Аэробный распад глюкозы Основной путь катаболизма глюкозы. Дихотомический распад молекулы глюкозы на 2 триозы. Происходит в нервной ткани, почках, печени, сердце. Поставляет энергию в клетку. Требуется кислород.
В процессе аэробного распада глюкозы выделяют три этапа:
Гликолитическая фаза (распад глюкозы до пирувата в цитозоле клеток).
Окислительное декарбоксилирование ПВК (в митохондриях).
Цикл трикарбоновых кислот (в митохондриях).
I этап аэробного распада – гликолиз без последней реакции. Все реакции протекают в цитоплазме.
Две реакции идут с затратой энергии (гексокиназная, фосфофруктокиназная).
Субстратное фосфорилирование обеспечивает на одну молекулу глюкозы 4 молекулы АТФ.
2 НАДН+Н+ (на 1 молекулу глюкозы) образуются в глицеральдегидфосфатдегидрогеназной реакции, проникают в митохондрии, где дают 3*2=6 АТФ.
Большинство реакций обратимы, три реакции необратимые (гексокиназная, фосфофруктокиназная, пируваткиназная).
Баланс: приход 6+4= 10АТФ. расход 2АТФ. 10-2 = 8АТФ.
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Путь гликолиза можно разделить на две фазы:
СОДЕРЖАНИЕ
Обзор
Общая реакция гликолиза:
Использование символов в этом уравнении делает его несбалансированным по отношению к атомам кислорода, атомам водорода и зарядам. Атомный баланс поддерживается двумя фосфатными (P i ) группами:
Клетки, выполняющие аэробное дыхание, синтезируют гораздо больше АТФ, но не в процессе гликолиза. Эти дальнейшие аэробные реакции используют пируват и НАДН + Н + из гликолиза. Эукариотическое аэробное дыхание производит приблизительно 34 дополнительных молекулы АТФ для каждой молекулы глюкозы, однако большинство из них продуцируются по механизму, сильно отличающемуся от фосфорилирования на уровне субстрата при гликолизе.
Более низкое производство энергии на глюкозу при анаэробном дыхании по сравнению с аэробным дыханием приводит к большему потоку через этот путь в условиях гипоксии (с низким содержанием кислорода), если не найдены альтернативные источники анаэробно окисляемых субстратов, таких как жирные кислоты.
История
Путь гликолиза, известный сегодня, занял почти 100 лет, чтобы полностью выяснить. Чтобы понять путь в целом, потребовались объединенные результаты множества небольших экспериментов.
Понимание составляющих этапов гликолиза было обеспечено экспериментами Эдуарда Бюхнера по неклеточной ферментации в 1890-х годах. Бюхнер продемонстрировал, что преобразование глюкозы в этанол возможно с использованием неживого дрожжевого экстракта из-за действия ферментов в экстракте. Этот эксперимент не только произвел революцию в биохимии, но и позволил более поздним ученым проанализировать этот путь в более контролируемых лабораторных условиях. В серии экспериментов (1905-1911) ученые Артур Харден и Уильям Янг открыли еще несколько фрагментов гликолиза. Они обнаружили регулирующие эффекты АТФ на потребление глюкозы во время спиртовой ферментации. Они также пролили свет на роль одного соединения в качестве промежуточного продукта гликолиза: фруктозо-1,6-бисфосфата.
Выяснение содержания фруктозо-1,6-бисфосфата было достигнуто путем измерения уровней CO 2, когда дрожжевой сок инкубировали с глюкозой. Производство CO 2 быстро увеличивалось, а затем замедлялось. Харден и Янг отметили, что этот процесс возобновится, если к смеси будет добавлен неорганический фосфат (Pi). Харден и Янг пришли к выводу, что этот процесс дает органические эфиры фосфата, и дальнейшие эксперименты позволили им извлечь дифосфат фруктозы (F-1,6-DP).
Артур Харден и Уильям Янг вместе с Ником Шеппардом во втором эксперименте определили, что термочувствительная высокомолекулярная субклеточная фракция (ферменты) и термочувствительная низкомолекулярная фракция цитоплазмы (АДФ, АТФ и НАД) + и другие кофакторы ) необходимы вместе для продолжения брожения. Этот эксперимент начался с наблюдения, что диализованный (очищенный) дрожжевой сок не может сбраживать или даже создавать фосфат сахара. Эта смесь была спасена добавлением недиализованного дрожжевого экстракта, который был прокипячен. Кипячение дрожжевого экстракта делает все белки неактивными (поскольку это денатурирует их). Способность вареного экстракта и диализованного сока к завершению ферментации предполагает, что кофакторы были небелковыми по своему характеру.
В 1920-х Отто Мейерхоф смог связать воедино некоторые из множества отдельных фрагментов гликолиза, открытых Бюхнером, Харденом и Янгом. Мейерхоф и его команда смогли извлечь различные гликолитические ферменты из мышечной ткани и объединить их, чтобы искусственно создать путь от гликогена к молочной кислоте.
В одной статье Мейерхоф и ученый Рената Юнович-Кокколати исследовали реакцию, которая расщепляет 1,6-дифосфат фруктозы на два триозофосфата. Предыдущая работа предполагала, что расщепление происходит через 1,3-дифосфоглицеральдегид плюс окисляющий фермент и уютамазу. Мейерхофф и Юнович обнаружили, что на константу равновесия для изомеразной и альдозной реакции не влияют неорганические фосфаты или какие-либо другие ферменты-ферменты или окисляющие ферменты. Далее они удалили дифосфоглицеральдегид как возможное промежуточное соединение при гликолизе.
Имея все эти компоненты, доступные к 1930-м годам, Густав Эмбден предложил подробный, пошаговый план того пути, который мы теперь знаем как гликолиз. Наибольшие трудности в определении сложности пути были связаны с очень коротким временем жизни и низкими стационарными концентрациями промежуточных продуктов быстрых гликолитических реакций. К 1940-м годам Мейерхоф, Эмбден и многие другие биохимики наконец решили загадку гликолиза. Понимание изолированного пути было расширено в последующие десятилетия, чтобы включить дополнительные детали его регуляции и интеграции с другими метаболическими путями.
Последовательность реакций
Резюме реакций
Подготовительный этап
Первые пять этапов гликолиза считаются подготовительной (или инвестиционной) фазой, поскольку они потребляют энергию для преобразования глюкозы в два трехуглеродных сахарных фосфата ( G3P ).
Кроме того, второе событие фосфорилирования необходимо для образования двух заряженных групп (а не только одной) на последующей стадии гликолиза, обеспечивая предотвращение свободной диффузии субстратов из клетки.
Эту же реакцию может катализировать пирофосфат-зависимая фосфофруктокиназа ( PFP или PPi-PFK ), которая содержится в большинстве растений, некоторых бактериях, архее и простейших, но не у животных. Этот фермент использует пирофосфат (PPi) в качестве донора фосфата вместо АТФ. Это обратимая реакция, повышающая гибкость гликолитического метаболизма. Более редкий вариант АДФ-зависимого фермента PFK был идентифицирован у видов архей.
Дестабилизация молекулы в предыдущей реакции позволяет альдолазе расщепить гексозное кольцо на два триозных сахара: дигидроксиацетонфосфат (кетоза) и глицеральдегид-3-фосфат (альдоза). Существует два класса альдолаз: альдолазы класса I, присутствующие у животных и растений, и альдолазы класса II, присутствующие в грибах и бактериях; два класса используют разные механизмы расщепления кетозного кольца.
Электроны, делокализованные при разрыве углерод-углеродной связи, ассоциируются со спиртовой группой. Образующийся карбанион стабилизируется структурой самого карбаниона за счет резонансного распределения заряда и присутствия протетической группы заряженных ионов.
Триозофосфат-изомераза быстро превращает дигидроксиацетонфосфат с глицеральдегид-3-фосфатом ( GADP ), который далее переходит в гликолиз. Это выгодно, поскольку он направляет дигидроксиацетонфосфат по тому же пути, что и глицеральдегид-3-фосфат, упрощая регулирование.
Фаза окупаемости
Вторая половина гликолиза известна как фаза отдачи, характеризующаяся чистым приростом богатых энергией молекул АТФ и НАДН. Поскольку глюкоза приводит к образованию двух триозных сахаров в подготовительной фазе, каждая реакция в фазе отдачи происходит дважды на молекулу глюкозы. Это дает 2 молекулы НАДН и 4 молекулы АТФ, что приводит к чистому приросту 2 молекул НАДН и 2 молекул АТФ от гликолитического пути на глюкозу.
Биохимическая логика
На второй регулируемой стадии (третья стадия гликолиза) фосфофруктокиназа превращает фруктозо-6-фосфат во фруктозо-1,6-бисфосфат, который затем превращается в глицеральдегид-3-фосфат и дигидроксиацетонфосфат. Дигидроксиацетонфосфат можно удалить из гликолиза путем преобразования в глицерин-3-фосфат, который можно использовать для образования триглицеридов. И наоборот, триглицериды можно расщепить на жирные кислоты и глицерин; последний, в свою очередь, может быть преобразован в дигидроксиацетонфосфат, который может вступить в гликолиз после второй контрольной точки.
Изменения свободной энергии
| Сложный | Концентрация / мМ |
|---|---|
| Глюкоза | 5.0 |
| Глюкозо-6-фосфат | 0,083 |
| Фруктозо-6-фосфат | 0,014 |
| Фруктозо-1,6-бисфосфат | 0,031 |
| Дигидроксиацетонфосфат | 0,14 |
| Глицеральдегид-3-фосфат | 0,019 |
| 1,3-бисфосфоглицерат | 0,001 |
| 2,3-бисфосфоглицерат | 4.0 |
| 3-фосфоглицерат | 0,12 |
| 2-фосфоглицерат | 0,03 |
| Фосфоенолпируват | 0,023 |
| Пируват | 0,051 |
| АТФ | 1,85 |
| ADP | 0,14 |
| P i | 1.0 |
Этап 5 на рисунке показан позади других этапов, поскольку этот этап является побочной реакцией, которая может уменьшать или увеличивать концентрацию промежуточного глицеральдегид-3-фосфата. Это соединение превращается в дигидроксиацетонфосфат под действием фермента триозофосфат-изомеразы, который является каталитически совершенным ферментом; ее скорость настолько высока, что можно предположить, что реакция находится в равновесии. Тот факт, что Δ G не равен нулю, указывает на то, что фактические концентрации в эритроците точно не известны.
Регулирование
Ферменты являются основными компонентами, которые управляют метаболическим путем, и, следовательно, изучение регуляторных механизмов этих ферментов даст нам представление о регуляторных процессах, влияющих на гликолиз. Всего существует 9 основных этапов гликолиза, которые управляются 14 различными ферментами. Ферменты могут быть изменены или затронуты с помощью 5 основных регуляторных процессов, включая посттрансляционную модификацию (PTM) и локализацию.
Биологические механизмы, с помощью которых регулируются ферменты
1. Экспрессия гена
2. Аллостерия
3. Взаимодействие белок-белок (PPI)
4. Посттрансляционная модификация (PTM)
5. Локализация
Регулирование инсулином у животных
Регулирование ферментов, ограничивающих скорость
Кроме того, гексокиназа и глюкокиназа действуют независимо от гормональных эффектов в качестве контроля в точках входа глюкозы в клетки различных тканей. Гексокиназа реагирует на уровень глюкозо-6-фосфата (G6P) в клетке или, в случае глюкокиназы, на уровень сахара в крови, обеспечивая внутриклеточный контроль гликолитического пути в различных тканях (см. Ниже ).
Гексокиназа и глюкокиназа
Фосфофруктокиназа
Фосфофруктокиназа является важной контрольной точкой в гликолитическом пути, поскольку она является одной из необратимых стадий и имеет ключевые аллостерические эффекторы, АМФ и 2,6-бисфосфат фруктозы (F2,6BP).
Пируваткиназа
Постгликолизные процессы
Общий процесс гликолиза:
Глюкоза + 2 НАД + + 2 АДФ + 2 P i → 2 пируват + 2 НАДН + 2 H + + 2 АТФ
Аноксическая регенерация НАД +
Пируват + НАД + Н + → лактат + НАД +
Этот процесс происходит в бактериях, участвующих в производстве йогурта (молочная кислота заставляет молоко свертываться). Этот процесс также происходит у животных в гипоксических (или частично анаэробных) условиях, например, в переутомленных мышцах, которым не хватает кислорода. Во многих тканях это крайнее клеточное средство для получения энергии; большая часть тканей животных не может выдерживать анаэробные условия в течение длительного периода времени.
Молочная кислота брожения и этанола брожения может происходить в отсутствие кислорода. Эта анаэробная ферментация позволяет многим одноклеточным организмам использовать гликолиз в качестве единственного источника энергии.
Чувство жжения в мышцах во время тяжелых упражнений можно объяснить высвобождением ионов водорода во время перехода к ферментации глюкозы от окисления глюкозы до углекислого газа и воды, когда аэробный метаболизм больше не может поспевать за энергетическими потребностями мышц. Эти ионы водорода входят в состав молочной кислоты. Организм возвращается к этому менее эффективному, но более быстрому методу производства АТФ в условиях низкого содержания кислорода. Считается, что это было основным средством производства энергии у более ранних организмов до того, как кислород достиг высоких концентраций в атмосфере между 2000 и 2500 миллионами лет назад, и, таким образом, представлял бы более древнюю форму производства энергии, чем аэробное пополнение НАД + в клетки.
Ферментация пирувата в лактат иногда также называется «анаэробным гликолизом», однако гликолиз заканчивается образованием пирувата независимо от наличия или отсутствия кислорода.
В двух приведенных выше примерах ферментации НАДН окисляется путем передачи двух электронов пирувату. Однако анаэробные бактерии используют широкий спектр соединений в качестве концевых акцепторов электронов в клеточном дыхании : азотистые соединения, такие как нитраты и нитриты; соединения серы, такие как сульфаты, сульфиты, диоксид серы и элементарная сера; углекислый газ; соединения железа; соединения марганца; соединения кобальта; и соединения урана.
Аэробная регенерация НАД + и удаление пирувата
В аэробных организмах разработан сложный механизм использования кислорода воздуха в качестве конечного акцептора электронов.
Превращение углеводов в жирные кислоты и холестерин
Превращение пирувата в оксалоацетат для цикла лимонной кислоты
Промежуточные звенья для других путей
В этой статье основное внимание уделяется катаболической роли гликолиза в преобразовании потенциальной химической энергии в полезную химическую энергию во время окисления глюкозы до пирувата. Многие метаболиты гликолитического пути также используются анаболическими путями, и, как следствие, поток через этот путь имеет решающее значение для поддержания запаса углеродных скелетов для биосинтеза.
Все следующие метаболические пути сильно зависят от гликолиза как источника метаболитов: и многое другое.
Хотя глюконеогенез и гликолиз имеют много общих промежуточных звеньев, одно функционально не является ответвлением или притоком другого. В обоих путях есть два регуляторных шага, которые, когда они активны в одном пути, автоматически становятся неактивными в другом. Следовательно, два процесса не могут быть активными одновременно. Действительно, если бы оба набора реакций были высокоактивными одновременно, чистым результатом был бы гидролиз четырех высокоэнергетических фосфатных связей (двух АТФ и двух ГТФ) за цикл реакции.
Гликолиз при болезни
Диабет
Генетические заболевания
Интерактивная карта проезда
Нажмите на гены, белки и метаболиты ниже, чтобы ссылки на соответствующие статьи.