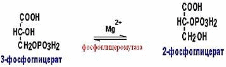какие ферменты в гликолизе являются ключевыми
Гликолиз в мышечных волокнах
Дается определение одного из анаэробных путей ресинтеза АТФ в мышечных волокнах – гликолиза. Описаны количественные критерии гликолиза в мышечных волокнах : максимальная мощность, время развертывания, время работы с максимальной мощностью. Дается характеристика ключевым ферментам гликолиза, протекающего в мышечных волокнах: фосфорилазе и фосфофруктокиназе.
Гликолиз в мышечных волокнах
Определение
Под гликолизом понимается процесс окисления глюкозы, при котором из одной молекулы глюкозы образуются две молекулы пировиноградной кислоты (Н.И.Волков с соавт. 2000).
Гликолиз, протекающий в мышечных волокнах (гликолитический ресинтез АТФ, лактатный ресинтез АТФ) – анаэробный распад гликогена мышц до молочной кислоты (лактата).
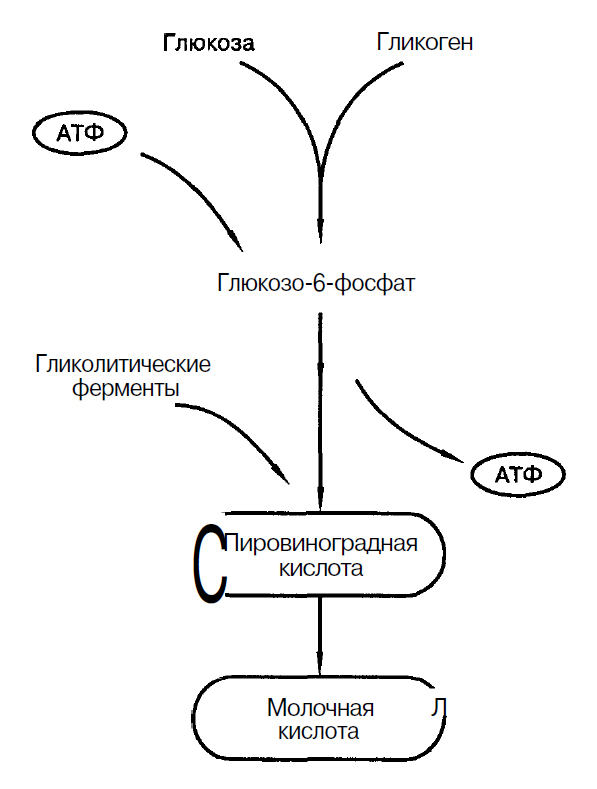
Источником энергии, необходимой для ресинтеза АТФ является мышечный гликоген, который находится в саркоплазме мышечных волокон. Концентрация гликогена в саркоплазме составляет 0,5-2% от массы мышцы (С.С. Михайлов, 2009). Также может быть использована глюкоза, поступающая из крови (Н.И. Волков с соавт., 2000), рис.1.
Рис. 1. Процесс гликолиза (Дж. Уилмор, Д.Л. Костилл, 1997)
Гликолиз – основной механизм энергообеспечения при работе субмаксимальной мощности длительностью 2-3 мин. Поэтому видами спорта, в которых гликолиз является основным механизмом обеспечения являются: бег на 800 – 1500 м; бег на коньках на 1500 м; плавание на 200 м и др.
Ключевыми ферментами гликолиза являются: фосфорилаза и фосфофруктокиназа. Эти ферменты регулируют скорость протекания гликолиза. Фермент фосфорилаза активируется адреналином.
Количественные критерии гликолиза в мышечных волокнах
Максимальная мощность
Максимальная мощность гликолиза составляет 750-850 кал/мин кг. Этот показатель в два раза превышает мощность тканевого дыхания. Высокие значения максимальной мощности объясняются большим количеством гликогена, содержащегося в мышечных волокнах, наличием механизмов активации ключевых ферментов гликолиза, благодаря которым скорость гликолиза возрастает в 2000 раз, отсутствием потребности в кислороде.
Время развертывания гликолиза
Время развертывания гликолиза составляет 20-30 с. Достаточно небольшое время развертывания гликолиза объясняется тем, что все участники этой реакции, а именно гликоген и ключевые ферменты находятся в саркоплазме. Кроме того, ключевой фермент гликолиза – фосфорилаза, активируется стрессовым гормоном адреналином, который выделяется в кровь непосредственно перед началом физической нагрузки. Также фермент фосфорилаза активируется ионами кальция, концентрация которых в саркоплазме повышается более чем в 1000 раз при развитии потенциала действия.
Время работы с максимальной мощностью
В покое до физической нагрузки концентрация лактата в крови составляет 1-2 ммоль/л. После физической нагрузки субмаксимальной мощности концентрация лактата в крови резко возрастает и может достигать 18-20 ммоль/л.
Если физическая активность продолжается более 20 минут, запасы гликогена в мышечных волокнах истощаются. Основным источником АТФ в мышцах становится окисление жирных кислот в митохондриях мышечных волокон. Именно по этой причине считается, что для профилактики борьбы с ожирением нужны длительные циклические нагрузки аэробного характера.
Экономичность гликолиза
Гликолиз характеризуется низкой экономичностью. Распад до молочной кислоты одного остатка глюкозы дает только три молекулы АТФ, в то время как при аэробном окислении гликогена до воды и углекислого газа образуется 39 молекул АТФ в расчете на один остаток глюкозы.
Следует отметить, что гликолиз активно протекает в мышечных волокнах IIА и IIB типа.
БИОХИМИЧЕСКАЯ ХАРАКТЕРИСТИКА ФЕРМЕНТОВ ГЛИКОЛИЗА
Гликогенфосфорилаза (КФ 2.4.1.1.) относится к классу трансфераз. Катализирует расщепление концевой α-1,4-глюкозной связи в полисахаридной цепи глюкана с образованием глюкозо-1-фосфата и укороченного на один глюкозидный остаток полисахарида. В организме животных катализирует расщепление гликогена [2].
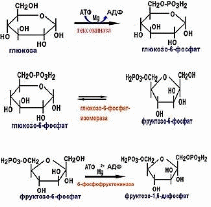
Глюкозофосфатизомераза (КФ 5.3.1.9.) относится к классу трансфераз, катализирует обратимую реакцию изомеризации, в которой глюкозо-6-фосфат (альдоза) превращается во фруктозо-6-фосфат (кетозу).
Фруктозобисфосфатальдолаза (КФ 4.1.2.13.) фермент класса лиаз, катализирующий распад Д-фруктозо-1,6-дифосфата на диоксиацетонфосфат и глицеринальдегид-З-фосфат.
Фосфофруктокиназа (КФ 2.7.1.11.) относится к классу трансфераз, фермент киназа, отвечающий за фосфорилированиефруктозо-6-фосфата в процессе гликолиза [3].
Фосфоглицеромутаза (КФ 2.7.5.3.) относится к классу изомераз. Фермент фосфоглицеромутаза, катализирует изомеризацию 3-фосфо-глицериновой кислоты в процессах спиртового брожения.
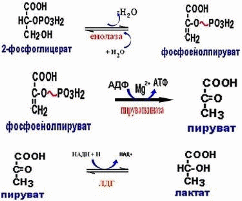
Енолаза (КФ 4.2.1.11.) фермент класса лиаз, катализирующий обратимую реакцию отщепления воды от 2-фосфо-D-глицерата с образованием макроэргических соединений фосфоенолпирувата [5].
Пируваткиназа (КФ 2.7.1.40.) относится к классу оксидоредуктаз. Гликолитический фермент, катализирующий (при наличии ионов магния и калия) предпоследнюю реакцию гликолиза – перенос остатка фосфорной кислоты от фосфоенолпирувата к АДФ с образованием АТФ и пирувата (пировиноградной кислоты).
Лактатдегидрогеназа (КФ 1.1.1.27.) относится к классу оксидоредуктаз. Фермент, принимающий участие в реакциях гликолиза. Лактатдегидрогеназа (ЛДГ) катализирует превращение лактата в пируват, при этом образуется NADH.
Регуляция активности ферментов гликолиза происходит под действием гормонов. Важное значение среди их принадлежит инсулину, глюкагону и адреналину. Причем глюкагон и адреналин являются наиболее значимыми гормональными ингибитором гликолиза. Инсулин стимулирует гликолиз через активацию гексокиназной реакции, стимуляцию фосфофруктокиназы и пируваткиназы.
Также на гликолиз влияют и другие гормоны. Так, соматотропин ингибирует ферменты гликолиза, а тиреоидные гормоны являются стимуляторами [6].
Регуляция гликолиза осуществляется через несколько ключевых этапов. Реакции, катализируемые гексокиназой, фосфофруктокиназой и пируваткиназой, отличаются существенным уменьшением свободной энергии и являются практически необратимыми, что даёт возможность им быть эффективными точками регуляции гликолиза.
В целом регулятором гексокиназы является отношение АТФ к АДФ. При снижении расхода энергии в клетке увеличивается количество молекул АТФ (относительно АДФ), а так же глюкозо-6-фосфата. В следствие этого активность гексокиназы снижается и, следовательно, снижается поступление глюкозы в клетку [7].
Таким образом, гликолиз – это сложный последовательный ферментативный процесс расщепления глюкозы до двух молекул пирувата (аэробный гликолиз) или двух молекул лактата (анаэробный гликолиз). Гликолиз регулируется одиннадцатью ферментами, которые локализованы в цитозоле и образуют мультиферментный комплекс.
Благодаря гормональной регуляции действия ферментов гликолиза обеспечивается последовательность реакций и интенсивность обмена веществ во всем организме.
Список использованных источников
Комов, В.П. Биохимия : учеб. для вузов / В.П. Комов, В. Н. Шведова – Москва : Дрофа, 2008. – 640 с. – ISBN 978-5-358-04872-0.
Щербаков, В.Г. Биохимия : учебник / В.Г. Щербаков, В.Г. Лобанов, Т.Н. Прудникова, А.Д. Минакова – Москва : ГИОРД, 2009. – 472 с. – ISBN 5-98879-008-9.
Ткачук, В.А. Клиническая биохимия : учеб. пособие / В.А. Ткачук – Москва : ГЭОТАР-Медиа, 2008. – 264 с. – ISBN 978-5-9704-0733-2.
33. Гликолиз. Биологическое значение, химизм процесса. Необратимые этапы и ключевые ферменты гликолиза. Биоэнергетика и регуляция этого процесса. Эффект Пастера.
— это анаэробный распад глюкозы до лактата.
С6Н12О6 + 2АДФ +2Фн = 2 лактата + 2АТФ + 2Н20.
-включает 11 реакций и 2 этапа.
Благодаря гликолизу организм осуществляет ряд функций в условиях недостаточности кислорода.
Когда на Земле не было кислорода, то гликолиз был основным источником энергии.
-Ферменты гликолиза локализуются в цитоплазме.
-Наиболее интенсивен гликолиз в: эритроцитах, работающей мышце, эмбриональной ткани, опухоли.
-3 необратимые реакции (киназные).
Первый этап гликолиза
Второй этап гликолиза
В активном центре фермента глицеральдегидфосфатдегидрогеназы содержатся SН-группы цистеина.
На первом этапе происходит отщепление водорода с альдегидной группы субстрата, а второй водород от SН-группы активного центра.
Водород переходит на НАД, в результате получаем НАДН+Н+, образуется фермент-субстратный комплекс, который взаимодействует с фосфорной кислотой.
Свободная энергия, освобождённая при окислении альдегидной группы, сохраняется в высокоэнергетической фосфатной группе.
НАДН+Н+, образующийся при окислении глицеральдегид-3фосфата,вновь окисляется в НАД, восстанавливая при этом ПВК до лактата.
Эта реакция происходит в анаэробных условиях
АТФ образуется за счёт двух реакций субстратного фосфорилирования (ПК, фосфоглицераткиназной).
Из глюкозы образуется 4АТФ.
2АТФ тратится в гликолизе на фосфорилирование (ГК, ФФК реакции).
Фосфоглицераткиназная реакция 2АТФ
Пируваткиназная реакция 2АТФ
—Гексокиназа – аллостерический фермент, ингибируется глюкозо-6-фосфатом. Инсулин стимулирует синтез глюкокиназы, которая не ингибируется глюкозо-6-фосфатом.
-Отрицательный модулятор – АТФ и цитрат.
Когда величина значительна, то происходит угнетение ФФК.
Причина этого: кислород окисляет НАДН+Н и он не восстанавливает ПВК в лактат.
— Пируваткиназа – аллостерический фермент.
Положительный модулятор – АДФ.
Отрицательный модулятор – АТФ, ацетил-КоА, жирные кислоты.
Гликолиз обратим. Биологическое значение обратимости гликолиза:
-освобождение тканей от лактата,
-возможность осуществления глюконеогенеза
34. Аэробный (дихроматический) распад глюкозы. Роль пируватдегидрогеназного комплекса в процессе окислительного декарбоксилирования пирувата. Биоэнергетика аэробного распада глюкозы.
Аэробный распад глюкозы Основной путь катаболизма глюкозы. Дихотомический распад молекулы глюкозы на 2 триозы. Происходит в нервной ткани, почках, печени, сердце. Поставляет энергию в клетку. Требуется кислород.
В процессе аэробного распада глюкозы выделяют три этапа:
Гликолитическая фаза (распад глюкозы до пирувата в цитозоле клеток).
Окислительное декарбоксилирование ПВК (в митохондриях).
Цикл трикарбоновых кислот (в митохондриях).
I этап аэробного распада – гликолиз без последней реакции. Все реакции протекают в цитоплазме.
Две реакции идут с затратой энергии (гексокиназная, фосфофруктокиназная).
Субстратное фосфорилирование обеспечивает на одну молекулу глюкозы 4 молекулы АТФ.
2 НАДН+Н+ (на 1 молекулу глюкозы) образуются в глицеральдегидфосфатдегидрогеназной реакции, проникают в митохондрии, где дают 3*2=6 АТФ.
Большинство реакций обратимы, три реакции необратимые (гексокиназная, фосфофруктокиназная, пируваткиназная).
Баланс: приход 6+4= 10АТФ. расход 2АТФ. 10-2 = 8АТФ.
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Какие ферменты в гликолизе являются ключевыми
13.1. Механизмы энергообеспечения клеток различной морфофункциональной организации в условиях нормы и гипоксических состояний
Гипоксия – типовой патологический процесс, осложняющий течение различных заболеваний.
Как известно, гипоксия определяет тяжесть течения ишемического поражения сердца, головного мозга, формирование полиорганной недостаточности при ДВС – синдроме, шоковых и коллаптоидных состояний, является неизменным спутником заболеваний инфекционной и неинфекционной природы, а также стрессовых ситуаций.
Тяжесть течения многих заболеваний и их исход в конечном итоге определяется особенностями вторичных неспецифических метаболических расстройств, степенью дестабилизации клеточных мембран, а также возможностями реактивации структурных и ферментных белков в условиях гипоксии.
Вышеизложенное указывает на необходимость дальнейшей детализации механизмов развития гипоксии на молекулярно-клеточном, органном, системном уровнях, а также патогенетического обоснования новых принципов медикаментозной коррекции метаболических и функциональных сдвигов при указанном типовом патологическом процессе.
Как указывалось выше, в соответствии с общепринятыми классическими описаниями происхождения и классификации гипоксических состояний различают гипоксии экзогенного и эндогенного происхождния. Последняя включает дыхательную, циркуляторную, гемическую и тканевую гипоксии системного или локального характера.
Общепринятым является представление о том, что в основе развития гипоксий различного генеза лежат нарушения окислительно-восстановительных реакций в связи с дефицитом кислорода. В то же время высказывается точка зрения о возможности развития субстратного типа гипоксии, обусловленной недостаточностью субстратов окисления, например, глюкозы для нервных клеток, жирных кислот для миокарда.
Как известно, динамика формирования структурных и функциональных сдвигов в различных органах и тканях при гипоксии определяются в значительной мере темпами ее развития, локализацией патологии, характером этиологических факторов, инициирующих гипоксию, и особенностями компенсаторно-приспособительных реакций в том или ином органе.
В соответствии с данными литературы устойчивость тканей различных органов и систем к гипоксии широко варьируют. Наиболее чувствительной к гипоксии является нервная система: при полном прекращении кровотока признаки повреждения коры головного мозга обнаруживается через несколько секунд. Снижение потребления кислорода на 20% структурами головного мозга вызывает потерю сознания. Через 5-6 мин аноксии головного мозга возникают глубокие структурные изменения нейронов, а в продолговатом мозге – через 10-15 мин.
В сердечной мышце мелкие очаги некроза появляются через 3-5 мин с момента, развития ишемии, а крупноочаговый инфаркт миокарда формируется уже спустя 20-30 мин.
Недостаток кислорода в тканях приводит, прежде всего, к дефициту макроэргических соединений, образуемых в сопряженных с окислительно-восстановительными процессами реакциях фосфорилирования на внутренней мембране митохондрий.
Основным энергетическим субстратом для нервной системы, а также для клеток других органов и тканей, является глюкоза. Между тем, при нормальной оксигенации миокарда основным источником его энергетического обеспечения являются высшие жирные кислоты. Так, при окислении 1 молекулы пальмитиновой кислоты образуется 130 М АТФ. В условиях ишемии миокарда усиливается конкурентное ингибирование использования жирных кислот лактатом, что приводит к значительному снижению энергообеспечения миокарда. Так, в процессе анаэробных гликолитических реакций энергетический выход на 1 молекулу глюкозы составляет 2 М АТФ.
Вышеизложенное свидетельствует о том, что независимо от характера этиологических факторов и механизмов развития гипоксии, наиболее ранними проявлениями нарушения оксигенации тканей являются сдвиги их энергетического обеспечения и связанные с ними нарушения углеводного, жирового и белкового метаболизма.
Как известно, процессы ресинтеза АТФ а митохондриях тесно связаны не только с окислительно-восстановительными реакциями, но и с реакциями гликолиза, липолиза, протеолиза, являющимися поставщиками Ац-СоА для цикла Кребса. Установлено, что регулирующими ферментами гликолиза являются фосфорилаза, гексокиназа, фосфофруктокиназа, пируваткиназа, поэтому их подавление в условиях гипоксии приводит к уменьшению образования свободной энергии и в ряде случаев носит необратимый характер. В то же время роль главного регуляторного фермента в последовательных реакциях гликолиза играет фосфофруктокиназа, которую ингибируют АТФ и цитрат, а стимулируют АМФ и АДФ.
Таким образом, в условиях гипоксии, в случаях увеличения потенциала фосфорилирования, возникает активация ключевого фермента гликолиза – фосфофруктокиназы (ФФК) и соответственно возрастание пропускной способности реакции анаэробного гликолиза. При этом резко снижается запас гликогена в сердце, мозге, печени, почках, мышцах и других тканях и соответственно накапливаются продукты гликолитических реакций – молочная и пировиноградная кислоты.
Так активация ФФК на начальных этапах ишемического или гипоксического повреждения клеток приводит к усилению мобилизации гликогена, несколько улучшает энергообеспечение тканей. При этом истощаются запасы гликогена, усиливается ацидоз, приводящий на пике своего развития к подавлению ФФК, и соответственно полной блокаде энергообеспечения клетки.
Развитие метаболического ацидоза при гипоксических состояниях усугубляется также недостаточностью реакций окисления жирных кислот, аминокислот, чрезмерным накоплением кислых продуктов метаболизма указанных соединений.
На обеих стадиях окисления жирных кислот атомы водорода или соответствующие им электроны передаются по митохондриальной цепи переноса электронов на кислород. С этим потоком электронов сопряжен процесс окислительного фосфорилирования АДФ до АТФ. Следовательно, в условиях гипоксии различного генеза блокируются процессы окисления жирных кислот в тканях, в избытке накапливаются кислые продукты, формируется метаболический ацидоз, и соответственно развиваются дефицит АТФ, подавление всех энергозависимых реакции.
Касаясь функциональной значимости метаболического ацидоза, закономерно развивающегося при гипоксии различного генеза, следует отметить ряд последующих неспецифических метаболических и функциональных расстройств, представляющих собой динамическую трансформацию реакций адаптации в реакции дезадаптации.
Как известно, типовой реакцией тучных клеток и тромбоцитов на развитие гипоксии и ацидоза является их дегрануляция с избыточным освобождением в окружающую среду высокоактивных соединений – гистамина, серотонина, ФАТ, ФХЭ, ФХН, лейкотриенов, интерлейкинов. В свою очередь, избыточное накопление ионов водорода, биологически активных соединений приводит к резкому увеличению проницаемости биологических мембран за счет структурных переходов в белках и липидах, и активации процессов свободно-радикального окисления.
Таким образом, среди механизмов, приводящих к повреждению биологических мембран при гипоксии различного генеза, необходимо выделить следующие:
1) развитие метаболического ацидоза,
2) выброс вазоактивных соединений тучными клетками,
3) активацию процессов липопероксидации,
4) высвобождение лизосомальных гидролаз при дезорганизации лизосомальных мембран с последующим усугублением метаболических сдвигов.
13.2. Механизмы развития гипоксического некробиоза.
В настоящее время очевидно, что развитие гипоксического некробиоза связано в значительной мере с дезорганизацией цитоплазматических, лизосомальных, митохондриальных, и других биологических внутриклеточных мембран, формирующих отдельные функциональные и структурные компартменты.
Причем наиболее ранние расстройства возникают у градиентсоздающих и сократительных систем клеток.
Важнейшим фактором повреждения клеток при гипоксии являются ионы кальция.
Как известно, внутриклеточная концентрация кальция в состоянии покоя поддерживается в среднем на уровне 10-7М, что в 100.000 раз меньше, чем в межклеточной жидкости. В период возбуждения кальций проникает из внеклеточной среды в клетку через потенциалзависимые кальциевые каналы. При этом возникают активация фосфолипазы С и образование липидных внутриклеточных посредников – диацилглицерина и инозинфосфамина. Цитоплазматический кальций взаимодействует с кальмодулином – внутриклеточным рецептором с последующей активацией кальмодулинзависимых протеинкиназ и включением тех или иных внутриклеточных реакций.
В условиях гипоксии, дефицита энергетического обеспечения клеток возникают недостаточность механизмов инактивации цитоплазматического кальция и удаления его из клеток в связи с подавлением активности АТФ-зависимого Са-насоса, натрий- кальциевого обменного механизма, дестабилизацией митохондриальных мембран и мембран эндоплазматического ретикулума, играющих в условиях нормы важную роль в поддержании баланса внутриклеточного кальция. При избытке внутриклеточного кальция усугубляются процессы набухания митохондрий, усиливаются дефицит АТФ и подавление всех энергозависимых реакций в клетке. Избыток кальция активизирует ядерные эндонуклеазы, фрагментирующие ДНК, индуцирует апоптоз. При высоком уровне внутриклеточного кальция активизируются нейтральные протеазы – кальципаины, разрушающие цитоскелет клетки, в частности, белки фоурин и В-актин, лизирующие рецепторы и протеинкиназу С.
При гипоксическом некробиозе вокруг гибнущих клеток формируется кальцийзависимая активация системы комплемента, активация коагуляционного и тромбоцитарного звеньев гемостаза, а также фибринолиза и калликреин-кининовой системы.
Активация под влиянием кальция мембранных фосфолипаз приводит к дальнейшей дезинтеграции мембран клеток, активации циклооксигеназы и липооксигеназы с последующим образованием простагландинов, лейкотриенов, свободных радикалов с выраженным цитотоксическим действием.
Чрезвычайно важна роль дезинтеграции митохондриальных мембран в механизмах гипоксического некробиоза клеток.
Как известно, в клетках эукариот все специфические дегидрогеназы принимают участие в окислении пирувата и других субстратов, локализованных в митохондриальном матриксе. Во внутренней мембране митохондрий локализуются переносчики электронов, составляющие дыхательную цепь и ферменты, катализирующие синтез АТФ из АДФ и фосфата.
В связи с этим очевидно, что продукты гликолиза, липолиза, протеолиза, вовлекаемые через ацетил-СоА в цикл Кребса, а также АДФ должны пройти через обе мнтохондриальные мембраны, в то время как новообразованные АТФ проникают из внутренней мембраны митохондрий в цитоплазму клетки и далее к местам энергетических трат. Установлено, что наружная мембрана легко проницаема для всех молекул и ионов небольшого размера, в то время как во внутренней мембране имеются специальные ферментативные транспортные системы, обеспечивающие трансмембранный перенос ионов и различных соединений.
Таким образом, при избыточном накоплении ионов кальция в клетке, активации процессов липопероксидации при гипоксии различного генеза резко повышается проницаемость митохондриальных мембран, возникает набухание митохондрий, пространственная дезориентация ферментативных систем транспорта электронов, синтеза АТФ. В результате происходят разобщение окислительного фосфорилирования и дыхания и соответственно подавление всех энергозависимых систем клетки: синтеза белка, трансмембранного переноса ионов, сопряжения процессов возбуждения и сокращения в мышечных структурах и т.д.
В процессе набухания митохондрии энергия потока электронов трансформируется в тепловую энергию.
Наряду с локальными и системными метаболическими сдвигами в тканях, обусловленными гипоксией, ацидозом, активизацией процессов липопероксидации, возникает комплекс метаболических и функциональных сдвигов, обусловленных выбросом гормонов адаптации – катехоламинов, глюкокортикоидов.
Как известно, при чрезмерной активации симпатоадреналовой системы (САС) реакции адаптации довольно быстро трансформируется в дезадаптационные процессы. Во-первых, при активации освобождения норадреналина происходит спазм сосудов переферических органов и тканей и соответственно усугубление циркуляторной гипоксии. На фоне активации САС при участии постсинаптических β-адренорецпторов возможна активация процессов гликолиза, гликогенолиза, липолиза, что, безусловно, усугубляет развитие ацидотических сдвигов, свойственных гипоксии.
Усиление адренергетических влияний закономерно сопровождается активацией процессов липопероксидации, что вносит весомый вклад в механизмы развития гипоксического некробиоза клеток органов и тканей, чувствительных к ишемии.
Синхронно с освобождением катехоламинов в условиях гипоксического стресса выбрасываются глюкокортикоиды, индуцирующие процессы лизиса и апоптоза в лимфоидной ткани, блокирующие процессы пролиферации и репаративной регенерации в ряде внутренних органов.