какие химические реакции можно провести в домашних условиях
Домашние химические опыты для детей
Мой личный опыт преподавания химии показал, что такую науку, как химию, очень тяжело изучать без каких-либо первоначальных сведений и практики. Школьники очень часто запускают этот предмет. Лично наблюдала, как ученик 8 класса при слове «химия» начинал морщиться, словно съел лимон.
Позже выяснилось, что из-за нелюбви и непонимания предмета, школу он прогуливал втайне от родителей. Конечно, школьная программа составлена таким образом, что учитель должен дать на первых уроках химии много теории. Практика как бы отходит на второй план именно в тот момент, когда школьник еще не может самостоятельно осознать, нужен ли это предмет ему в дальнейшем. В первую очередь это связано с лабораторным оснащением школ. В больших городах в настоящее время с реактивами и приборами дело обстоит лучше. Что касается провинции, то, как и 10 лет назад, так и в настоящее время, во многих школах нет возможности проводить лабораторные занятия. А ведь процесс изучения и увлечения химией, также как и другими естественными науками, обычно начинается с опытов. И это неслучайно. Многие знаменитые химики, такие как Ломоносов, Менделеев, Парацельс, Роберт Бойль, Пьер Кюри и Мария Склодовская-Кюри (всех этих исследователей школьники изучают также и на уроках физики) уже с детства начинали экспериментировать. Великие открытия этих великих людей были сделаны именно в домашних химических лабораториях, поскольку занятия химией в институтах было доступно только людям с достатком.
И, конечно, самое главное — это заинтересовать ребенка и донести ему, что химия окружает нас повсюду, поэтому процесс ее изучения может быть очень увлекательным. Здесь на помощь придут домашние химические опыты. Наблюдая такие эксперименты, можно в дальнейшем искать объяснение, почему происходит так, а не иначе. А, когда на школьных уроках юный исследователь столкнется с подобными понятиями, объяснения учителя ему будут более понятны, так как у него уже будет свой собственный опыт проведения домашних химических экспериментов и полученные знания.
Очень важно начинать изучение естественных наук с обычных наблюдений и примеров из жизни, которые, как вы считаете, будут наиболее удачными для вашего ребенка. Вот некоторые из них. Вода-это химическое вещество, состоящее из двух элементов, а также газов растворенных в ней. Человек тоже содержит воду. Известно, что там, где нет воды, нет и жизни. Без пищи человек может прожить около месяца, а без воды — всего лишь несколько суток.
Речной песок – это не что иное, как оксид кремния, а также основное сырье для производства стекла.
Человек сам того не подозревает и осуществляет химические реакции каждую секунду. Воздух, который мы вдыхаем, это смесь газов — химических веществ. В процессе выдыхания выделяется еще одно сложное вещество — диоксид углерода. Можно сказать, что мы сами это химическая лаборатория. Можно объяснить ребенку, что мытье рук мылом это тоже химический процесс воды с мылом.
Ребёнку постарше, который, например, уже начал изучать химию в школе можно объяснить, что в организме человека можно обнаружить практически все элементы периодической системы Д. И. Менделеева. В живом организме не только присутствуют все химические элементы, но каждый из них выполняет какую-то биологическую функцию.
Химия-это и лекарства, без которых в настоящее время многие люди не могут прожить и дня.
Растения тоже содержат химическое вещество хлорофилл, которое придает листочку зеленый цвет.
Приготовление пищи — это сложные химические процессы. Здесь можно привести пример того, как поднимается тесто при добавлении дрожжей.
Один из вариантов, как заинтересовать ребенка химией — это взять отдельного выдающегося исследователя и прочитать историю его жизни или посмотреть обучающий фильм про него (сейчас доступны такие фильмы про Д. И. Менделеева, Парацельса, М.В. Ломоносова, Бутлерова).
Многие полагают, что настоящая химия это вредные вещества, экспериментировать с ними опасно, тем более в домашних условиях. Есть много очень увлекательных опытов, которые вы сможете провести со своим ребёнком, не навредив здоровью. И эти домашние химические опыты будут не менее увлекательные и поучительные, чем те, которые идут с взрывами, едкими запахами и клубами дыма.
Некоторые родители опасаются также проводить дома химические опыты из-за их сложности или отсутствия необходимого оборудования и реактивов. Оказывается, что можно обойтись подручными средствами и теми веществами, которые есть у каждой хозяйки на кухне. Их можно купить в ближайшем бытовом магазине или аптеке. Пробирки для проведения домашних химических опытов можно заменить флакончиками от таблеток. Для хранения реактивов можно пользоваться стеклянными банками, например, от детского питания или майонеза.
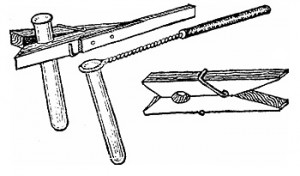
Стоит помнить, что посуда с реактивами должна иметь этикетку с надписью и быть плотно закрыта. Иногда пробирки нужно нагреть. Чтобы не держать ее в руках при нагревании и не обжечься, можно соорудить такое устройство с помощью бельевой прищепки или куска проволоки.
Также необходимо выделить несколько стальных и деревянных ложечек для перемешивания.
Штатив для держания пробирок можно сделать самим, просверлив в бруске сквозные отверстия.
Для фильтрования полученных веществ вам понадобиться бумажный фильтр. Сделать его очень легко согласно приведенной здесь схеме.
Для детишек, которые еще не ходят в школу или обучаются в младших классах, постановка домашних химических опытов с родителями будет своеобразной игрой. Скорее всего, объяснить какие-то отдельные законы и реакции еще не удастся такому юному исследователю. Однако, возможно, именно такой эмпирический способ открытия окружающего мира, природы, человека, растения через опыты заложит фундамент для изучения естественных наук в дальнейшем. Можно даже устраивать своеобразные конкурсы в семье — у кого опыт получится более удачным и затем демонстрировать их на семейных праздниках.
Независимо от возраста ребенка и его способности читать и писать, советую завести лабораторный журнал, в который можно записывать эксперименты или зарисовывать. Настоящий химик обязательно записывает план работы, список реактивов, зарисовывает приборы и описывает ход работы.
Когда вы вместе с ребенком только начнете изучать эту науку о веществах и проводить домашние химические опыты, первое, что нужно помнить это безопасность.
Для этого нужно следовать следующим правилам безопасности:
1. Настоятельно рекомендую, чтобы все домашние химические опыты проводились только под присмотром взрослых.
2. Лучше выделить отдельный стол для проведения химических опытов в домашних условиях. Если у вас дома не найдется отдельного стола, то опыты лучше проводить на стальном или железном подносе или поддоне.
3. Необходимо обзавестись тонкими и толстыми перчатками (их продают в аптеке или в хозяйственно магазине).
4. Для проведения химических экспериментов лучше всего купить лабораторный халат, но также можно вместо халата использовать плотный фартук.
5. Лабораторная посуда не должна в дальнейшем использоваться для еды.
6. В домашних химических опытах не должно быть жестокого отношения с животными и нарушения экологической системы. Кислотные химические отходы нужно нейтрализовать содой, а щелочные — уксусной кислотой.
7. Если хочешь проверить запах газа, жидкости или реактива, никогда не подноси сосуд прямо к лицу, а, удерживая его на некотором расстоянии, направь, помахивая рукой, воздух над сосудом по направлению к себе и одновременно нюхай воздух.
8. Всегда используй в домашних опытах реактивы в небольшом количестве. Избегай оставлять реактивы в посуде без соответствующей надписи (этикетки) на склянке, из которой должно быть ясно, что находится в склянке.
Начинать изучение химии следует с простых химических экспериментов в домашних условиях, позволяющих ребенку освоить основные понятия. Серия опытов 1–3 позволяют ознакомиться с основными агрегатными состояниями веществ и свойствами воды. Для начала ребенку-дошкольнику вы можете показать, как растворяется в воде сахар и соль, сопроводив это объяснением, что вода универсальный растворитель и является жидкостью. Сахар или соль — твердые вещества, растворяющиеся в жидкости.
Опыт № 1 «Потому что — без воды и ни туды и ни сюды»
Вода-это жидкое химическое вещество, состоящее из двух элементов, а также газов, растворенных в ней. Человек тоже содержит воду. Известно, что там, где нет воды, нет и жизни. Без пищи человек может прожить около месяца, а без воды — всего лишь несколько суток.
Реактивы и оборудование: 2 пробирки, сода, лимонная кислота, вода
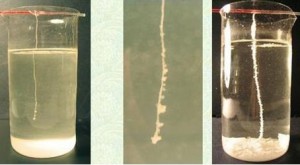
Эксперимент: Взять две пробирки. Насыпать в них в равных количествах соду и лимонную кислоту. Затем в одну из пробирок налить воды, а в другую нет. В пробирке, в которой вода была налита вода стал выделяться углекислый газ. В пробирке без воды — ничего не изменилось
Обсуждение: Данный эксперимент объясняет тот факт, что без воды невозможны многие реакции и процессы в живых организмах, а также вода ускоряет многие химические реакции. Школьникам можно объяснить, что произошла обменная реакция, в результате которой выделился углекислый газ.
Опыт № 2 «Что растворено в водопроводной воде»
Реактивы и оборудование: прозрачный стакан, водопроводная вода
Эксперимент: Налить в прозрачный стакан водопроводную воду и поставить ее в теплое место на час. Через час вы увидите на стенках стакана осевшие пузырьки.
Обсуждение: Пузырьки – это не что иное как газы, растворенные в воде. В холодной воде газы растворяются лучше. Как только вода становится теплой, газы перестают растворяться и оседают на стенки. Подобный домашний химический опыт позволяет также познакомить ребенка с газообразным состояние вещества.
Опыт № 3 «Что растворено в минеральной воде или вода — универсальный растворитель»
Реактивы и оборудование: пробирка, минеральная вода, свеча, лупа
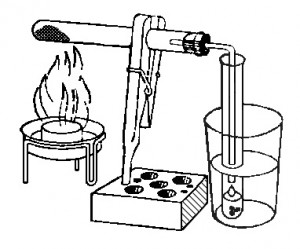
Эксперимент: Налить в пробирку минеральную воду и медленно выпаривать ее над пламенем свечи (опыт можно делать на плите в кастрюле, но кристаллы будут хуже видны). По мере испарения воды на стенках пробирка останутся мелкие кристаллы, все они разной формы.
Обсуждение: Кристаллы – это соли, растворенные в минеральной воде. У них разная форма и размер, так как каждый кристаллик носит свою химическую формулу. С ребенком, который уже начал изучать химию в школе, можно почитать этикетку на минеральной воде, где указан ее состав и написать формулы соединений, содержащихся в минеральной воде.
Опыт № 4 «Фильтрование воды, смешанной с песком»
Реактивы и оборудование: 2 пробирки, воронка, бумажный фильтр, вода, речной песок
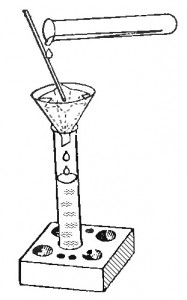
Эксперимент: Налить в пробирку воду и опустить туда немного речного песка, перемешать. Затем по схеме описанной выше сделать фильтр из бумаги. Вставить сухую чистую пробирку в штатив. Медленно выливать смесь песка с водой через воронку с бумажным фильтром. Речной песок останется на фильтре, а в штативной пробирке вы получите чистую воду.
Обсуждение: Химический опыт позволяет показать, что существуют вещества, не растворяющееся в воде, например, речной песок. Также опыт знакомит с одним из метод очистки смесей веществ от примесей. Здесь можно внести понятия чистые вещества и смеси, которые даются в учебнике химия 8 класса. В данном случае смесью является песок с водой, чистым веществом — фильтрат, речной песок – это осадок.
Процесс фильтрования (описывается в 8 классе) применяют здесь для разделения смеси воды с песком. Чтобы разнообразить изучение данного процесса, можно немного углубиться в историю очистки питьевой воды.
Процессы фильтрования применялись еще в 8–7 веках до н.э. в государстве Урарту (ныне это территории Армении) для очистки питьевой воды. Её жители осуществили постройку водопроводной системы с применением фильтров. В качестве фильтров использовали плотную ткань и древесный уголь. Подобные системы из переплетённых водосточных труб, глиняных каналов, снабженные фильтрами были и на территории древнего Нила у древних египтян, греков и римлян. Воду пропускали через такой фильтр нескскали через такой фильтр несколько раз, в конечном итоге доболько раз, в конечном итоге добиваясь наилучшего качества воды.
Одним из самых интересных опытов является выращивание кристаллов. Опыт очень нагляден и дает представление о многих химических и физических понятиях.
Опыт № 5 «Выращиваем кристаллы сахара»
Реактивы и оборудование: два стакана воды; сахар — пять стаканов; деревянные шпажки; тонкая бумага; кастрюля; прозрачные стаканчики; пищевой краситель (пропорции сахара и воды можно уменьшить).
Эксперимент: Опыт следует начинать с приготовления сахарного сиропа. Берем кастрюлю, выливаем в нее 2 стакана воды и 2,5 стакана сахара. Ставим на средний огонь и, помешивая, растворяем весь сахар. В получившийся сироп высыпаем оставшиеся 2,5 стакана сахара и варим до полного растворения.
Теперь приготовим зародыши кристаллов – палочки. Небольшое количество сахара рассыпаем на бумажке, затем обмакнем палочку в получившейся сироп, и обваляем ее в сахаре.
Берем бумажки и протыкаем шпажкой дырочку посередине таким образом, чтобы бумажка плотно прилегала к шпажке.
Затем разливаем горячий сироп по прозрачным стаканам (важно, чтобы стаканы были прозрачными — так процесс созревания кристаллов будет более увлекателен и нагляден). Сироп должен быть горячим, иначе кристаллы не будут расти.
Можно сделать цветные сахарные кристаллы. Для этого в получившейся горячий сироп добавляют немного пищевого красителя и размешивают его.
Кристаллы будут расти по-разному, некоторые быстро, а некоторым может понадобиться больше времени. По окончании опыта получившиеся леденцы ребенок может съесть, если у него нет аллергии на сладкое.
Если у вас нет деревянных шпажек, то опыт можно повести с обычными нитками.
Обсуждение: Кристалл — это твердое состояние вещества. Он имеет определенную форму и определенное количество граней вследствие расположения своих атомов. Кристаллическими считаются вещества, атомы которых расположены регулярно, так что образуют правильную трёхмерную решётку, называемую кристаллической. Кристаллам ряда химических элементов и их соединений присущи замечательные механические, электрические, магнитные и оптические свойства. Например, алмаз – природный кристалл и самый твердый и редкий минерал. Благодаря своей исключительной твердости алмаз играет громадную роль в технике. Алмазными пилами распиливают камни. Существует три способа образования кристаллов: кристаллизация из расплава, из раствора и из газовой фазы. Примером кристаллизации из расплава может служить образование льда из воды (ведь вода – это расплавленный лёд). Пример кристаллизации из раствора в природе – выпадение сотен миллионов тонн соли из морской воды. В данном случае, при выращивании кристаллов в домашних условиях мы имеем дело с наиболее распространённым способам искусственного выращивания — кристаллизация из раствора. Кристаллы сахара растут из насыщенного раствора при медленном испарении растворителя – воды или при медленном понижении температуры.
Следующий опыт позволяет получить в домашних условиях один из самых полезных для человека кристаллических продуктов — кристаллический йод. Перед проведением опыта советую посмотреть вместе с ребенком небольшой фильм «Жизнь замечательных идей. Умный йод». Фильм дает представление о пользе йода и необычной истории его открытия, которая надолго запомниться юному исследователю. А интересна она тем, что первооткрывателем йода была обыкновенная кошка.
Французский ученый Бернар Куртуа в годы наполеоновских войн заметил, что в продуктах, получаемых из золы морских водорослей, которые выбрасывались на берег Франции, находится какое-то вещество, которое разъедает железные и медные сосуды. Но ни сам Куртуа, ни его помощники не знали, как выделить это вещество из золы водорослей. Ускорению открытия помог случай.
На своем небольшом заводе по производству селитры в г. Дижоне Куртуа собирался провести несколько опытов. На столе стояли сосуды, в одном из которых была настойка морских водорослей на спирту, а в другом — смесь серной кислоты с железом. На плечах у ученого сидела его любимая кошка.
В дверь постучали, и напуганная кошка спрыгнула и убежала, хвостом смахнув колбы на столе. Сосуды разбились, содержимое смешалось, и внезапно началась бурная химическая реакция. Когда небольшое облачко из паров и газов осело, удивленный ученый увидел на предметах и обломках какой-то кристаллический налет. Куртуа начал его исследовать. Кристаллы никому до этого неизвестного вещества получили название “йод”.
Так был открыт новый элемент, а домашняя кошка Бернара Куртуа вошла в историю.
Опыт № 6 «Получение кристаллов йода»
Реактивы и оборудование: настойкой аптечного йода, вода, стакан или цилиндр, салфетка.
Эксперимент: Смешиваем воду с настойкой йода в пропорции:10мл йода и 10мл воды. И ставим всё в холодильник на 3 часа. В процессе охлаждения йод выпадет в осадок на дне стакана. Сливаем жидкость, вынимаем осадок йода и кладем на салфетку. Выжимаем салфетками до тех пор, пока йод не станет рассыпаться.
Обсуждение: Данный химический эксперимент называется экстрагированием или извлечением одного компонента из другого. В данном случае вода экстрагирует йод из раствора спиртовки. Таким образом, юный исследователь повторит опыт кота Куртуа без дыма и биения посуды.
О пользе йода для дезинфекции ран ваш ребенок уже узнает из фильма. Таким образом, вы покажите, что между химией и медициной есть неразрывная связь. Однако, оказывается, что йод можно применять в качестве индикатора или анализатора содержания другого полезного вещества – крахмала. Следующий опыт познакомит юного экспериментатора с отдельной очень полезной химией – аналитической.
Опыт № 7 «Йод-индикатор содержания крахмала»
Реактивы и оборудование: свежая картошка, кусочки банана, яблока, хлеба, стакан с разведенным крахмалом, стакан с разведённым йодом, пипетка.
Эксперимент: Разрезаем картофель на две части и капаем на него разведенный йод – картошка синеет. Затем капаем несколько капель йода в стакан с разведенным крахмалом. Жидкость тоже синеет.
Капаем с помощью пипетки растворенный в воде йод на яблоко, банан, хлеб, по очереди.
Яблоко — не посинело вообще. Банан – слегка посинел. Хлеб – посинел очень сильно. Эта часть опыта показывает наличие крахмала в различных продуктах.
Обсуждение: Крахмал, вступая в реакцию с йодом, дает синюю окраску. Это свойство дает нам возможность выявить наличие крахмала в различных продуктах. Таким образом, йод является как бы индикатором или анализатором содержания крахмала.
Как известно, крахмал может преобразовываться в сахар, если взять неспелое яблоко и капнуть йода, то оно посинеет, так как яблоко еще не созрело. Как только яблоко созреет весь содержащийся крахмал перейдет в сахар и яблоко при обработке йодом не синеет вообще.
Следующий опыт будет полезен ребятам, которые уже начали изучение химии в школе. Оно знакомит с такими понятиями, как химическая реакция, реакция соединения и качественная реакция.
Опыт № 8 «Окрашивание пламени или реакция соединения»
Реактивы и оборудование: пинцет, поваренная пищевая соль, спиртовка
Эксперимент: Возьмем пинцетом несколько кристалликов крупной поваренной соли поваренной соли. Подержим их над пламенем горелки. Пламя окрасится в желтый цвет.
Обсуждение: Данный эксперимент позволяет провести химическую реакцию горения, которая является примером реакции соединения. Благодаря наличию натрия в составе поваренной соли, при горении происходит его реакция с кислородом. В результате образуется новое вещество – оксид натрия. Появление желтого пламени свидетельствует о том, что реакция прошла. Подобные реакции является качественными реакциями на соединения, содержащие натрий, то есть по ней можно определить содержится натрий в веществе или нет.
Автор: Плетнева Мария, кандидат химических наук
Химия для смертных или Интересные опыты, которые можно повторить самому
Лично я заинтересовался химией после посмотра фейерверка, и понеслась душа в рай, как говорится.
Возможно этот пост вызовет интерес у кого-нибудь ещё ( по крайней мере я на это надеюсь ))
Я лично облазил всю Лигу химиков, здесь были посты с опытами, но они были одиночные, да и самих этих постов не очень много. Так вот, я решил сделать пост ( или даже серию ) с опытами, которые можно повторить не имея дорогих реактивов, или особых навыков в химии.
И, наконец-то, спустя 7 месяцев долгой подготовки видео и сдачи экзаменов моей лени я готов выложить этот пост. *троекратное ура*
1) Это, наверное, самый известный эффектный химический опыт. Дихроматный вулканчик.
Всё, что надо вам для проведения этого опыта это: негорючая подложка и дихромат аммония, который есть во многих наборах для проведения опытов ( ну или его можно одолжить у учителя химии, он есть в каждой школьной лаборатории )
Порядок проведения опыта:
1) Насыпать горку дихромата аммония на подложку
Над вулканчиком не дышим, если не хотим получить дозу дихромата в лёгкие.
2) Крайне интересный опыт ( честно представить не могу почему о нем почти никто не знает ) Химический хамелеон. Для проведения этого опыта вам понадобятся: марганцовка,сахар и щёлочь ( прекрасно подойдет средство для очистки труб «Крот» ( лучше брать гранулированный ), именно его я использую. Также щёлочь есть в наборах для проведения опытов) обязательно соблюдаем технику безопасности при работе с щёлочью:
2) Если все-таки выпили или накапали в глаза, выполняете первый пункт и бегом к врачу
Для проведения опыта нам понадобятся два раствора:
1) Раствор марганцовки, концентрации приблизительно как на видео ( для этого нужно совсем чуть-чуть маоганцовки )
2) Раствор сахара и щёлочи, я исходил из расчётов: чайная ложка\кубик сахара на 50 мл раствора и около двух третей чайной ложки гранулированной щелочи (ложкой по назначению после этого желательно не пользоваться ) или около 15 мл, если у вас жидкий «Крот»
Растворы слиаются в равных объемах, реакция начнется сразу: сначала раствор потемнеет, потом станет зеленым и потихоньку зелёный перейдёт в жёлтый.
3) Я его назвал «переходы зелёнки», это еще менее известный опыт.
Для его проведения вам понадабятся: зелёнка, серная кислота ( можно купить автомобильный электролит для аккумулятора, я использовал его ) щёлочь и перекись водорода из аптеки.
Здесь мы так же используем два раствора:
1) В 100 мл воды развести пару капель зелёнки.
2) Здесь все немного сложнее, берем около 10 мл перекиси и 50 мл раствора щёлочи ( около чайной ложки гранул). Почему сложнее? Потому что из опыта в опыт может потребоваться разное количество щёлочи, поэтому лучше заготовить дополнительную порцию на всякий случай.
Порядок проведения опыта:
1) В раствор зелёнки добавляем совсем чуть-чуть серной кислоты ( пары мл будет достаточно )
2) Струйкой при перемешивании вливаем второй раствор ( перемешивание для равномерности изменения цвета )
После добавленя серной кислоты раствор зелёнки станет жёлто-оранжевым, при добавлении второго раствора цвет сначала вернется к изначальному, а потом начнётся обесцвечивание, при этом можно будет наблюдать красивый бирюзовый цвет.
Также не забываем про технику безопасности.
Довольно интересный опыт. Чтобы его провести нам понадобятся: фенолфталеин ( его можно взять из набора для опытов, в школьной лаборатории он однозначно есть. Раньше его продавали в аптеках под названием «пурген», сейчас, вроде, перестали ), любая кислота, щёлочь и сода.
Этот опыт требует небольшой подготовки: перед началом показа на дно стаканчика надо налить немного раствора фенолфталеина.
Нам понадобится раствор соды с щёлочью. Почему с щелочью? Потому что если использовать только соду, то 1) цвет «сока» будет не настолькот насыщенный и 2) пена выльется из стакана, как показано на видео. В 50 мл воды растворите половину чайной ложки соды и еще столько же гранул щёлочи.
Порядой проведения опыта:
( опыт проводится в одной ёмкости )
1) Налить немного раствора фенолфталеина на дно стакана
2) Влить раствор соды с щёлочью
3) Прилить приблизительно столько же кислоты
При приливании раствора соды с щёлочью раствор окрасится в малиновый цвет ( как мы все знаем: Фенолфталеиновый *индикатор* в щелочах малиновый :3 )
Довольно простой опыт. Нам понадобятся: жидкое стекло\канцелярский клей и любая кислота.
Порядок проведения опыта:
1) В стакан налить немного жидкого стекла\канцелярского клея
2) Прилить кислоту (примерно столько же сколько и жидкого стекла\концелярского клея ) и немного перемешать
3) Можно вывалить гель из стакана на руку и отжать, чтобы показать, что там образовалось что-то твёрдое ( не забываем после этого помыть руки )
Примечание: у этого опыта есть иная варияция, её проводят в пробирке. После приливания кислоты пробирку переворачивают, но из неё ничего не выливается ( если всё сделано правильно: чем меньше воды, тем лучше )
6) Я назвал этот опыт «переходы меди»
Для проведения опыта понадобятся: медный купорос ( его можно купить в садовом магазине ), щёлочь и аммиак ( он продается в аптеке )
Порядак проведения опыта:
1) Растворить немного медного купороса в 50мл воды ( концентреция не очень важна )
2) Прилить 10 мл раствора щёлочи ( половину чайной ложки гранул на 50 мл будет выше крыши )
3) Прилить немного аммиака и перемешать
При добавлении щёлочи из голубого раствора медного купороса выпадет голубай осодок, после приливания аммиака осодок растворится, а раствор приобретет темно-синюю окраску
Для его проведения нам понадобятся: железный купорос ( его можно купить в садовом магазине ), перекись водорода, щёлочь, кислота и роданид калия ( он не обязателен, но нужен для последней части, он есть в некоторых наборах для проведения опытов, или можно спросить в школьной лаборатории )
Порядок проведения опыта:
( опыт проводится в одной ёмкости )
1) Растворить немного железного купороса в воде ( около половины чайной ложки на 50 мл )
2) Прилить к железному купоросу 10 мл ( половина чайной ложки гранул на 50 мл воды ) раствора щёлочи
3) Прилить около 10 мл ( точность не важна ) перекиси водорода и перемешать
4) Добавить достаточное количество кислоты ( чтобы растворить осадок )
5) Прилить раствор роданида калия ( буквально на кончике ножа на 50 мл )
Для проведения понадобится только раствор трехвалентной соли железа ( можно сделать из железного купороса, добавив немного перекиси с кислотой, или купить хлористое железо на радио рынке ) и роданид калия
Не забудьте после этого помыть руку.
8) Ну и напоследок немного не химический опыт, но от этого не менее завораживающий.
Порядок проведения опыта:
1) Хорошо привязать стальную вату к шнуру ( если она будет привязана не достаточно хорошо, то при вращении она просто разлетится на куски, как показано на видео ) и распушить.
2) Поджечь стальную вату в нескольких местах и начать быстро крутить
Опыт, естественно, лучше проводить в темное время суток.
Сама по себе стальная вата тоже красиво горит.
Вот так выглядит сама вата.
Надеюсь вам понравилось, вы узнали что-то новое.
Не кидайтесь камнями за качество видео, довольно сложно сфокусироваться на прозрачных стаканах на белом фоне.
Если этот пост вызовет большой интерес я постараюсь нашкрести еще опытов на вторую часть и когда-нибудь её выпущу.
Спасибо, что досмотрели пост до конца :3
Только перед публикацией заметил, что чуть не выпустил на свет божий «Химия для смертных или Интересные опяты, которые можно повторить самому» )
Лига Химиков
1.2K постов 10.6K подписчиков
Правила сообщества
Старайтесь выбирать качественный контент и не ставьте теги моё на копипасты
Посты с просьбой решения домашнего задания переносятся в общую ленту
1. Оскорблять пользователей.
2. Постить материал далеко не по теме и непотребный контент (в остальном грамотно используйте теги)
3. Рекламировать сомнительные сайты и услуги коммерческого характера
Спасибо за пост. Но, если честно, освещение ужасное: бесцветные предметы и жидкости не видно вообще.
Результат разложения дихромата аммония приводит к образованию ядовитой окиси хрома. В домашних условиях делать не рекомендую, во избежание проблем.
Нам необходимо выяснить причины создания дубля поста.
1. Укажите версию Пикабу которой Вы пользуетесь: десктопная, мобильная, приложение?
2. Укажите ваше окружение: версия операционной системы, версия браузера, версия приложения (если оно использовалось)
3. Максимально подробно опишите все шаги, которые привели к созданию дубля: какие кнопки нажимали и в каком порядке, какие сообщения всплывали и т.д.
4. Укажите способ подключения к Интернету (3G-модем, xDSL-модем, витая пара и т.д.), качество связи (часто ли случаются сбои, подвисания), скорость Интернета в Мбит/с
5. Если есть возможность, предоставьте нам пожалуйста оригиналы всех фото и видео материалов из поста, например, загрузите их на любое облачное хранилище: Google Drive, Облако Mail.ru и т.д.
Вообще опытов немало провести можно. Учитывая, что просто в обиходе пользуемся порошками и просто уже как должное воспринимаем хим. превращения.
С невидимым письмом есть вариант написать молоком, а для проявления нагреть листок.
Камнями кидаться не стану, но все-таки пожалуюсь: видео использует какой-то неподдерживаемый старыми версиями андроида (6.0.1) кодек (h265 или vp9) и поэтому не воспроизводится. Пикрилейтед. Наблюдал такое иногда на ютубе со свежими видосами, когда ютуб еще не успел перекодировать только что загруженый файл во все возможные форматы и отдает его в оригинале.
Некоторые опыты, да интересные. Главное чтобы школьник придя домой не рассказал матери о опытах и мамаша не начала бомбардировать прокуратуру о том, что у ея личинки могла возникнуть болезнь от опыта. Были знаете прецеденты.
Попробуйте поджечь таблетки кальция (например на положив на сухой спирт). После этого свой вулканчик можете выбросить и забыть.
алибасову этот пост не показывайте
амфетамины химики должны варить😁
Игральные кости с химическими элементами. Видимо, для азартных химиков. )))
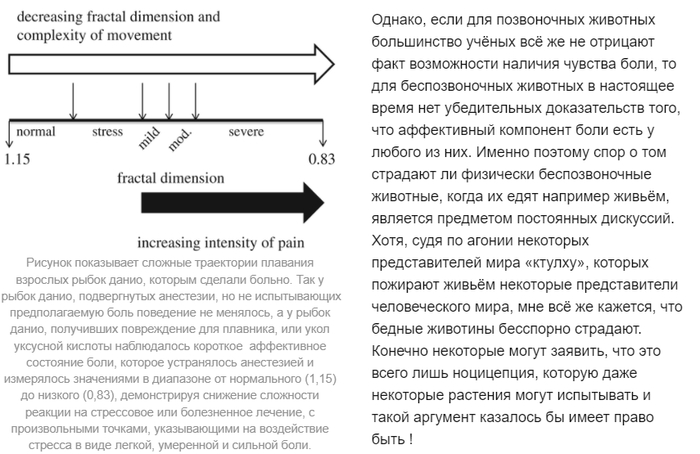
Испытывают ли боль беспозвоночные?
Поскольку боль вызывает сильные неприятные ощущения сравнимые с отвращением, то облегчение от природы её возникновения является полезным для животного. Животные стараются избегать ситуации, в которых они могут испытывать боль, а если они всё-таки её испытали, то они стараются ретироваться в такие места, где смогут получить облегчение от боли
Ни для кого не секрет, что позвоночные практически во всей своей массе могут испытывать боль. Исключениями могут быть всякие там рыбы и примитивные хордовые, но даже и для них существуют доказательства, что всё-таки и они имеют какой-то там слабый аффективный компонент боли [4].
Поэтому если мы хотим найти наличие хотя бы одного состояния боли у беспозвоночных, нам надо найти хотя бы наличие ноцицепоторов, а потом уже думать, что делать. И они таки и обнаруживаются среди многих таксонов беспозвоночных. Ноцицепторы есть у всех головоногих и у некоторых прочих моллюсков, у насекомых, ракообразных и даже нематод. Однако обнаружение этих элементов «программного обеспечения» боли всё ещё недостаточно, чтобы поставить 100% вердикт о существовании физического страдания у беспозвоночных животных. Чтобы это доказать учёные используют общепринятые поведенческие критерии, которые используются для предположения наличия аффективного состояния, выходящего за рамки простого ноцицептивного рефлекса. В качестве основных таких критериев обычно используют:
Т.е. они предоставляли те участки тела к «уничтожению», которые были более защищены от внешнего воздействия, или они покидали то место где их варварски угнетали [1].
Данный аргумент состоит в том, что мозг беспозвоночных недостаточно сложен, чтобы включать в себя цепи, производящие эмоциональную валентность. Однако, что «Илон Маск» сможет сказать на следующее?
Головоногие моллюски, «друзья Лавкрафта» достигшие эпичной крайности в эволюции мозга среди беспозвоночных. Они, в отличие от всех других беспозвоночных, имеют внушительный размер мозга, когнитивные способности и поведенческая гибкость которого, превосходят таковые у некоторых позвоночных с меньшим мозгом, включая земноводных и рептилий. Их нервная система устроена принципиально иначе, чем у позвоночных, с обширным периферическим контролем чувств и движений, который, по-видимому, происходит в значительной степени независимо от центрального мозга.
Их большой мозг и сложное поведение привели к растущему беспокойству об их благополучии, что даже вылилось в ужесточении норм биоэтики по отношению к данным животным. Ужесточились правила по регулированию инвазивных процедур, выполняемых на головоногих моллюсках в исследовательских лабораториях.
А спонсором требуемых доказательств является исследование от 2020 года опубликованное в журнале ISCIENCE, на котором и базируется весь мой текст [3]. Суть данного исследования заключается в том, что к объектам исследования, тобишь осьминогам применялась методика оценки аффективных аспектов боли, применяемая до этого практически только к позвоночным, в частности к млекопитающим.
Тест показал, что время, проведённое в предпочтительной камере, сильно различалось у группы которой вводили уксусную инъекцию, от плацебной группы, указывая на демонстрацию когнитивного и спонтанного поведения, свидетельствующего о переживании аффективной боли. Животные в «уксусе» возвращались в предпочтительную камеру лишь спустя очень большой промежуток времени.
Далее осьминогам в двух группах вводился препарат, который обеспечивает облегчение тонической боли у позвоночных выражающееся в соответствующем поведении. Поэтому, если тонической боли нет, то и соответствующего поведения облегчения от тонической боли быть не должно. Проверка облегчения боли, связанной с анальгетиком, считается убедительным доказательством наличия боли у позвоночных животных. Данный эксперимент показал, что осьминоги с предполагаемой индуцированной тонической болью получившие локализованную инъекцию лидокаина и помещённые в камеры, которые они избегали в первом тесте из-за боли, вновь получили предпочтение находиться именно в этих камерах, т.е. они перестали их избегать.
Более того данные из всех трёх экспериментов над осьминогами абсолютно доказали, что осьминоги испытывают состояние постоянной (тонической) боли, что ранее считалось возможным только у млекопитающих. Поэтому, по-моему, мнению принцип предосторожности с такими животными категорически необходим.
Данное исследование в полном объёме представляет собой первый пример вероятной продолжающейся боли у любого животного, не являющегося млекопитающим, что собственно заставляет с одной стороны задуматься, например, на сколько сильно, страдает живой рак, кипящий в котле, а с другой стороны радоваться, что реинкарнация существует только в буддизме. P.s. А вы варите раков живыми?
Автор: биолог, вдохновитель научного сообщества Фанерозой Ефимов Самир.
Бериллий в гифках
Взаимодействие бериллия с жидким хлором
Бериллий активно реагирует с соляной кислотой
Не так активно бериллий реагирует со щелочью, образуя комплексное соединение тетрагидроксобериллат натрия
Температура плавления бериллия 1287 °C, однако при попытке расплавить небольшой образец газовой горелкой он практически весь переходит в оксид
Плавление бериллия в промышленных условиях
Демонстрация диамагнитных свойств бериллиевой бронзы (сплава бериллия и меди). Также сплавы содержащие бериллий примечательны тем, что не создают искр
В природе бериллий основной компонент минерала берилла, благодаря которому элемент и получил своё название. Наиболее ценной разновидностью берилла является изумруд
Как сделать бесцветный огонь
Химия для смертных V 2.75
1) Растворение пенопласта
Название само за себя говорит. В любую тару, которую не очень жалко, наливаем пару сантиметров ацетона ( покупается в строительном ), отламываем кусок пенопласта, который пролезет в тару. Насаживаем пенопласт на шпажку, так удобнее, и потихоньку погружаем его в ацетон. Пузырясь, наш кусок пенопласта будет сильно уменьшаться в объёме, а мы получим не самую полезную жвачку для рук.
3) Буря в банке
Делаем вот такую длинную ложку из фольги. Если есть алюминиевая столовая ложка, которую не жалко, можно и её погнуть. Берём ненужную трёхлитровую банку с крышкой, наливаем на дно сантиметр аммиака и закрываем настояться ( можно потрясти немного ). В ложку насыпаем дихромата калия и нагреваем его над банкой. Как только он начнет стабильно разлагаться закрепляем ложку на краю банки и прикрываем крышкой. Любуемся красивым моментом.
Этот опыт засел у меня в памяти и сердце, несмотря на то что он у меня не очень то
получается. Это один из моих первых опытов. Есть ещё вариант со всыпанием с ложки раскаленного докрасна оксида хрома, но дома так делать не очень удобно. Крышкой это дело закрывается, чтобы оксид хрома не разлетелся в радиусе 5 километров, как
это обычно получается.
5) Несгораемый платок
Реактивы просты: водка и соль, на том список заканчивается. Если у вас в доме не оказалось водки, но нашёлся технический спирт, разведите его с водой 1 к 1. В наш водный раствор спирта добавьте щепотки три поваренной соли, это сделает огонь более заметным. Теперь, когда наш раствор готов, ищем платок, купюру, которую не жалко, ( для демонстрации 50 рублей у меня не нашлось ) или, как в моем случае, полоску бумаги. Окунаем нашего подопытного в раствор, избавляемся от излишков и поджигаем. Наша жертва немного погорит и сама потухнет. Если не потухнет, значит в растворе слишком много спирта и это дело как минимум обуглится. Если же спирта
слишком мало, то и поджечь ничего не выйдет.
Думаю мне следует напомнить, что огонь всё ещё горячий и им можно обжечься,
поэтому пользуемся щипцами или пинцетом, пальцы нам ещё потом пригодятся, обещаю.
Кстати, насчёт моих «точных» навесок. На самом деле, тут всё довольно просто: в опытах, которые я показываю, основными мерами измерения являются «щепотка», «пара капель», «немного» и «относительно много». В большинстве случаев я не использую растворы полностью, а лишь их часть ( тоже довольно произвольно ). Точные количества тут лишь усложняют подготовку. Это дело практики, понимать сколько этого порошка и того раствора мне понадобится для проведения опыта. Я лишь даю ориентировочные количества, чтобы вы для себя потом могли понять какие количества реактивов и объёмы будет удобно использовать именно вам.
Я нанёс йод на стенки стаканчика и перевернул его ( пары йода тяжёлые и идут сверху вниз ) на салфетку в надежде, что пары йода будут оседать на ней. Не-а, ему, как и он сам, фиолетово, он осядет на поверхности за салфеткой, пусть и испарится с нее через полчаса, всё равно неприятно.
Естественно, у некоторых может возникнуть логичный вопрос: «У меня в наборе для проведении опытов есть соляная кислота, зачем мне беспонтовый уксус?». Ну, во-первых, уксус дома есть у всех и его не жалко. Во-вторых, уксус в получении йодида натрия жизненно необходим для проведения «золотого дождя», так как хлорид и сульфат свинца в воде нерастворимы и запорят нам опыт. Если же вы собираетесь использовать йодид только в «египетской ночи», то кто я такой, чтобы ограничивать вас в выборе кислот?
Ну и по старой, доброй традиции держи котов в конце :3