какие химические свойства характерны для непредельных углеводородов
Какие химические свойства характерны для непредельных углеводородов
г) гидрогалогенирование (гидрохлорирование):
Присоединение молекул галогеноводородов протекает по правилу Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода).
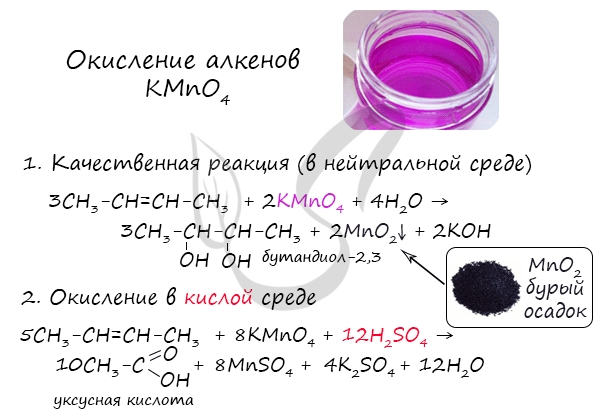
4. Качественные реакции на алкены: обесцвечивание бромной воды (см. уравнение 2 б ) и раствора перманганата калия
Алкины – это непредельные углеводороды, в молекулах которых есть одна тройная связь между атомами углерода
Физические свойства алкинов
Химические свойства алкинов
В этой реакции температура пламени может достигать 3000 o С, поэтому она применяется для сварки металлов.
в) гидрогалогенирование (первая стадия):
CH CH + HCl CH 2 = CHCl
г) гидратация (реакция Кучерова):
ацетальдегид
(уксусный альдегид)
5. Качественные реакции на алкины: обесцвечивание бромной воды (см. реакцию 2 б ) и раствора перманганата калия; образование осадка ацетиленида серебра (см. реакцию 4).
Алкадиены – это непредельные углеводороды, в молекулах которых есть две двойные связи между атомами углерода
Физические свойства алкадиенов
Химические свойства алкадиенов
Такой же состав, как полиизопрен, (C5H8)n – имеет и природный полимер − натуральный каучук.
Алкадиены, как алкены и алкины, обесцвечивают бромную воду (реакция 2 б ) и раствор перманганата калия.
Получение непредельных углеводородов
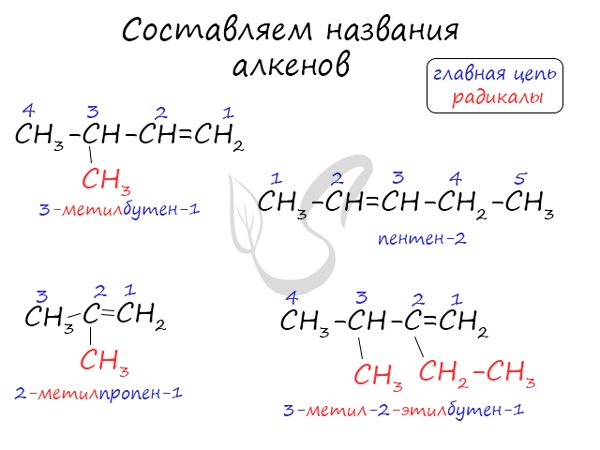
Алгоритм составления названий непредельных углеводородов
Алкены
Номенклатура и изомерия алкенов
Названия алкенов формируются путем добавления суффикса «ен» к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
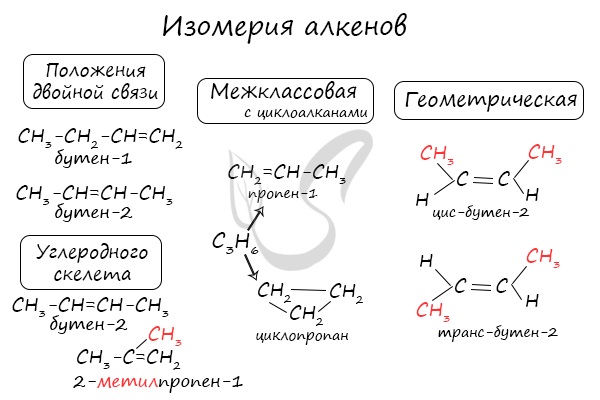
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Получение алкенов
В результате крекинга нефти образуется один алкан и один алкен.
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.
Химические свойства алкенов
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
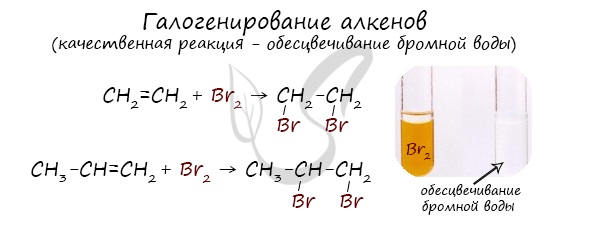
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
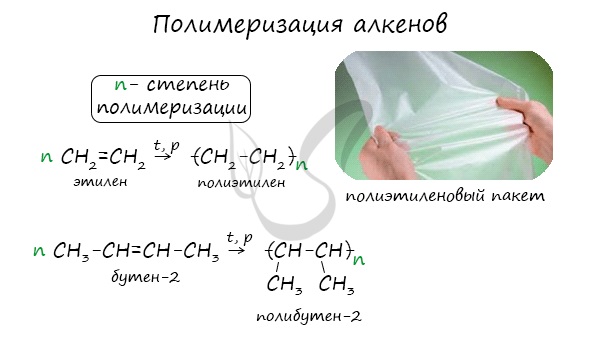
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Урок №61. Непредельные (ненасыщенные) углеводороды
АЛКЕНЫ
Углеводородами ряда этилена, или этиленовыми углеводородами ( олефинами или алкенами ) называют ненасыщенные углеводороды, строение которых отличается наличием в их молекулах одной двойной связи между углеродными атомами
Этиленовые углеводороды образуют гомологический ряд, состав каждого члена которого выражается общей эмпирической формулой
C n H 2n
Гомологический ряд алкенов
Структурная формула этилена
Физические свойства алкенов
С 5 – С 18 (жидкости)
Алкены не растворяются в воде, растворимы в органических растворителях (бензин, бензол и др.)
С увеличением Mr температуры плавления и кипения увеличиваются
Реакции присоединения алкенов
Химические свойства алкенов
Как и предельные углеводороды, алкены горят на воздухе :
Применение алкенов
Этилен является одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек синтеза.
Этилен используют для ускорения созревания плодов — например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая.
АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ
Ацетиленовыми углеводородами ( алкинами ) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу
C n H 2n-2
Родоначальником гомологического ряда этих углеводородов является ацетилен
H-C≡C-H
Физические свойства
С 2 Н 2 – газ без цвета и почти без запаха, легче воздуха, мало растворим в воде
Получение в лаборатории
Из карбида кальция гидролизом ( взаимодействие с водой )
CaC 2 + 2H 2 O → Ca(OH) 2 + H-C≡C-H
Получение в промышленности
Термическим разложением метана (пиролиз)
2CH 4 1500˚С → HC≡CH + 3H 2
Применение
Из всех ацетиленовых углеводородов большое промышленное значение имеет ацетилен, который является важнейшим химическим сырьём.
При горении ацетилена выделяется много тепла, что используется для резки и сварки металлов в ацетилен-кислородной сварке (расходуется до 30 % всего производимого ацетилена).
для газовой сварки и резки металлов,
как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды ( см. карбидная лампа ),
для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
для получения технического углерода,
в атомно-абсорбционной спектрофотометрии при пламенной атомизации,
в начале XX века широкое распространение имели автомобильные ацетиленовые фары, которые только в 1920-е были вытеснены электрическими.
В конце 19-го — начале 20-го века широкой популярностью пользовались многочисленные ацетиленовые светильники ( источником ацетилена служил дешевый карбид кальция ), используемые на железнодорожном и водном транспорте, для освещения улиц, в быту. Несмотря на то, что сегодня массовое использование ацетиленовых фонарей ушло в прошлое, их выпуск и потребление не прекратились. Они производятся в небольших количествах как походное снаряжение.
ДИЕНЫ
Общая формула алкадиенов
C n H 2n-2
Наибольший интерес представляют углеводороды с сопряженными двойными связями, их используют для производства синтетических каучуков.
Наиболее массовое применение каучуков — это производство резин для автомобильных, авиационных и велосипедных шин.
Из каучуков изготавливаются специальные резины огромного разнообразия уплотнений для целей тепло- звуко- воздухо- гидроизоляции разъёмных элементов зданий, в санитарной и вентиляционной технике, в гидравлической, пневматической и вакуумной технике.
Каучуки применяют для электроизоляции, производства медицинских приборов.
ЦИКЛОАЛКАНЫ (ЦИКЛОПАРАФИНЫ)
В отличие от предельных углеводородов, характеризующихся наличием открытых углеродных цепей, существуют углеводороды с замкнутыми цепями (циклами). По своим свойствам они напоминают обычные предельные углеводороды алканы (парафины), отсюда и произошло их название – циклоалканы (циклопарафины).
Общая формула гомологического ряда циклоалканов
C n H 2n
Циклоалканы изомерны этиленовым углеводородам. В природе встречаются в составе нефти.
Представителями этого ряда соединений являются циклопропан, циклопентан, циклогексан.
Наибольшее практическое значение имеют циклогексан, этилциклогексан. Циклогексан используется в химическом синтезе, а также в качестве растворителя. Циклопропан используется в медицинской практике в качестве ингаляционного анестезирующего средства.
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ)
Типичными представителями ароматических углеводородов являются производные бензола, т.е. такие карбоциклические соединения, в молекулах которых имеется особая циклическая группировка из шести атомов углерода, называемая бензольным или ароматическим ядром.
Общая формула ароматических углеводородов
С 6 H 5 – CH 3 – толуол (метилбензол)
С 6 H 5 – CH=СH 2 – стирол (винилбензол)
Физические свойства :
1. Бензол – легкокипящая (t кип = 80,1°С), бесцветная жидкость, не растворяется в воде
3. Большинство ароматических углеводородов опасны для жизни, токсичны.
Применение
Ароматические углеводороды являются важным сырьем для производства различных синтетических материалов, красителей, физиологически активных веществ. Так, бензол – продукт для получения красителей, медикаментов, средств защиты растений и др. Толуол используется как сырье в производстве взрывчатых веществ, фармацевтических препаратов, а также в качестве растворителя. Винилбензол (стирол) применяется для получения полимерного материала – полистирола.
Химия. 10 класс
Конспект урока
Урок № 3 Непредельные углеводороды – алкены
Перечень вопросов, рассматриваемых в теме
Урок посвящён непредельным углеводородам, их номенклатуре, физическим и химическим свойствам, а также роли в жизни человека. В ходе урока учащиеся познакомятся с представителями данного класса органических веществ.
Алкены – непредельные углеводороды ряда этилена, имеющие одну двойную углерод-углеродную связь
Гибридизация – процесс взаимодействия разных, но близких по энергии электронных орбиталей, приводящий к их выравниванию по форме и энергии.
Гомология – явление сходства по составу, строению, химическим свойствам и принадлежности к тому же классу одного вещества с другим веществом, но различающиеся дуг от друга на одну или несколько групп СН2. Группу СН2 называют гомологической разностью.
Горение – быстро протекающий процесс окисления вещества, сопровождающийся большим выделением тепла и ярким свечением.
Полимеризация – реакция, при которой одинаковые молекулы соединяются между собой в более крупную молекулу
Изомерия – явление существования веществ, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и вследствие этого по физическим и химическим свойствам. Такие вещества называются изомерами.
Формула структурная – изображение молекулы, в котором показан порядок связывания атомов между собой. Химические связи в таких формулах обозначаются черточками.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Алкены – непредельные углеводороды, в молекулах которых между атомами углерода имеется одна двойная углерод-углеродная связь. Общая формула алкенов СnH2n, где n≥2.
Простейшим представителем алкенов является этен, или этилен С2Н4.
Структурная формула этилена:
Особенности пространственного и электронного строения алкенов на примере молекулы этилена
Каждый атом углерода в молекуле этилена имеет треугольное строение.
Особенности номенклатуры алкенов заключаются в следующем:
1. Нумерация углеродной цепи начинается с того конца, где ближе расположена двойная связь
1. Нумерация главной цепи начинается слева направо, так как двойная связь ближе к левой части молекулы.
2. Называем радикал, расположенный у второго атома углерода: 2-метил
3. В главной цепи находится четыре атома углерода, следовательно, она соответствует предельному углеводороду – бутану.
5. Соединяем суффикc с корнем и получаем название 2-матилбутен-1.
Гомология алкенов и изомерия алкенов.
Ближайшие гомологи этилена:
Для алкенов характерны следующие виды изомерии:
1. Изомерия углеродного скелета
2. Изомерия положения кратной связи
3. Пространственная геометрическая изомерия
4. Межклассовая (с циклоалканами)
Рассмотрим каждый вид изомерии на примере вещества состава С4Н8:
При построении структурной формулы данного вещества возможно расположение двойной связи как между первым и вторым атомами углерода, так и между вторым и третьим, тогда возможно получить две структурные формулы
Данный вид изомерии называется изомерией положения кратных связей.
Для данного вещества возможно построить единственный разветвлённый изомер – изомер углеродного скелета – 2-метилпропен:
Межклассовый изомер бутена – циклобутан:
Физические свойства алкенов
Этилен – бесцветный газ, почти без запаха, легче воздуха, плохо растворим в воде. Пропен и бутен – также газы. От пентена до октадецена – жидкости. Остальные – твердые вещества. Все агрегатные состояния указаны при нормальных условиях.
Способы получения алкенов
1. Внутримолекулярная дегидратация спиртов:
Данный способ является основным способом получения этилена в лабораторных условиях. Реакция протекает при температуре выше 140 градусов и в присутствии концентрированной серной кислоты, выполняющей роль катализатора. При дегидратации этанола получают этилен, а при дегидратации пропанола – пропилен:
2. Дегидрирование предельных углеводородов.
Данная реакция протекает при нагревании в присутствии катализаторов: никеля, платины, оксида хрома (III). При этом получают соответствующие алкены:
Химические свойства алкенов
Химические свойства алкенов обусловлены наличием в их молекулах двойных углерод-углеродных связей. Дело в том, что пи-связь, как было сказано ранее, является менее устойчивой, чем сигма связь. Поэтому при атаке её каким-либо реагентом она легко разрывается. Это объясняет основные химические свойства алкенов: они способны вступать в реакции присоединения и окисления.
Гидрирование – присоединение водорода
Протекает при нагревании в присутствии катализаторов: платина, никель, оксид хрома (III). Продуктом реакции всегда является алкан.
Галогенирование – присоединение галогенов
Признак реакции – обесцвечивание раствора брома, поэтому данную реакцию используют как качественную на двойную связь.
Гидрогалогенирование – присоединение галогенводородов
Продукт реакции – галогеналкан (хлорэтан)
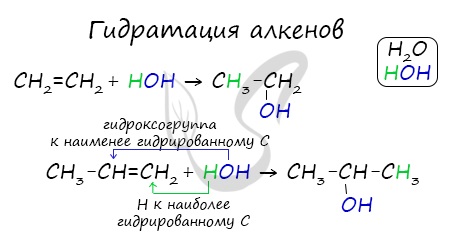
Гидратация – присоединение воды
Полимеризация – реакция, при которой одинаковые молекулы соединяются в более крупные молекулы.
Условия реакции – высокая температура и давление
Продукт реакции – полимер (полиэтилен)
Продукты реакции полимеризации используются для производства пластмасс и синтетических волокон
Продукт реакции – многоатомный спирт (этиленгликоль)
Каталитическое – окисление кислородом в присутствии катализаторов
Продукт реакции – оксид алкена (оксид этилена)
Продуктами полного горения алкенов являются углекислый газ и вода
Особенности реакций гидрогалогенирования и гидратации у пропилена и других гомологов этилена
Реакции присоединения галогеналканов и воды у гомологов этилена протекают по правилу Марковникова: водород присоединяется по месту разрыва двойной связи к более гидрированному атому углерода. Например, при присоединении хлороводорода к молекуле пропилена, образуется не 1-хлорпропан, а 2-хлорпропан:
Аналогично протекает реакция гидратации:
Применение этилена и его соединений
Производство пластмасс, взрывчатых веществ, антифриза, растворителей, синтетического каучука, ацетальдегида, для ускорения созревания плодов.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
Масса 2%-го раствора бромной воды, которая вступает в реакцию с 2,24 л пропилена равна
Шаг второй: Находим количество вещества пропилена по формуле n=V\Vm= 2,24 л / 22,4 л/моль = 0,1 моль
Шаг третий: По уравнению реакции количество вещества пропилена равно количеству вещества брома: n(С2Н4)=n(Br2)=0,1 моль
Шаг четвёртый: Находим массу брома по формуле: m=Mn=160 г/моль*0,1 моль= 16 г
Шаг пятый: Находим массу раствора бромной воды по формуле: m (раствора)=m/ω = 16г / 0,02 = 800г
Вставьте в таблицу пропущенные продукты реакции
Варианты ответов: этан, пропан, бутан, 1,2-дибромэтан, 1,2-дибромпропан, 1,3-дибромпропан, этанол, пропанол-1, пропанол-2, хлорэтан, 1-хлорпропан, 2-хлорпропан.
Первый шаг: При гидрировании алкенов водородом образуются предельные углеводороды – алканы с соответствующим числом атомов углерода. Поэтому первая колонка заполняется продуктами реакции – этан и пропан:
Второй шаг: При галогенировании алкенов галогены, в данном случае бром, присоединяются по месту разрыва двойной связи, образуя дигалогенпроизводные, например:
Поэтому второй столбец заполняется следующими веществами: 1,2-дибромэтан, 1,2-дибромпропан.
Третий шаг: При гидратации (присоединении воды) образуются спирты. При реакции пропилена с водой важно помнить о правиле Марковникова, поэтому продуктами реакции будут этанол и пропанол-2:
4. При гидрогалогенировании алкенов продуктом реакции будут галогеналканы. И опять нужно помнить о правиле Марковникова для гидрогалогенирования пропилена:
Поэтому правильный ответ в этом задании: хлорэтан и 2-хлорпропан
Химические свойства алкенов
Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
Химические свойства алкенов
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С-С | 348 | 0,154 |
| С=С | 620 | 0,133 |
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
1.1. Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
| Например, при гидрировании бутена-2 образуется бутан. |
| Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление. |
1.2. Галогенирование алкенов
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан. |
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
| Например, при взаимодействии этилена с бромоводородом образуется бромэтан. |
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. |
1.4. Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
| Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2. |
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен. |
2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
| Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида) |
| Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида |
2.2. Мягкое окисление
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
| Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2) |
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:
При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:
При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
| Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия: |
| Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон: |
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
| Например, уравнение сгорания пропилена: |
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.
При взаимодействии алкенов с хлором или бромом при нагревании до 500 о С или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
| Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1 |
4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.