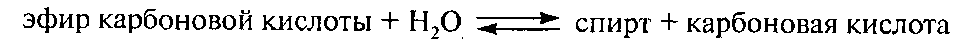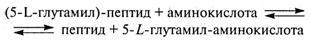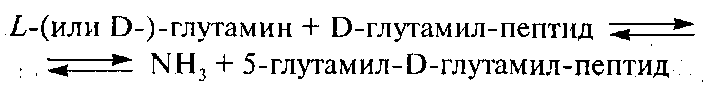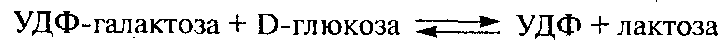какие реакции катализируют трансферазы
ГК «Униконс»
Продвижение и реализация комплексных пищевых добавок, антисептиков и др. продукции.
«Антисептики Септоцил»
Септоцил. Бытовая химия, антисептики.
«Петритест»
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
«АльтерСтарт»
Закваски, стартовые культуры. Изготовление любых заквасок для любых целей.
1.4. Трансферазы (2-й класс)
Трансферазы – это ферменты, которые осуществляют перенос различных химических групп от субстрата к акцептору. В зависимости от вида химической группы природа кофермента трансфераз различна. Число ферментов этого класса, а именно некоторые из ацил-, аминоацил-, гексозил-, амино-, фосфо- и сульфидтрансфераз, в молоке достигает 20. Трансферазы играют важную роль в обмене веществ клеток молочной железы, в основном, являются нативными ферментами молока.
Ацилтрансферазы. В молоке в качестве составляющей полиферментного комплекса пируватдегидрогеназы (1.2.4.1.) находится дигидролипоамидацетилтрансфераза (2.3.1.12), которая катализирует следующую реакцию:
Аминоацилтрансферазы. В молоке обнаружены γ- и D-глутамилтрансферазы.
γ-Глутамилтрансфераза (2.3.2.2)[1] является нативным ферментом. Его источником служит плазмалемма секреторных клеток молочной железы.
γ-Глутамилтрансфераза выделена из оболочек шариков жира молока. Молекула фермента состоит из двух субъединиц (димер) с молекулярной массой 57 000 и 25 500 Да. Обе субъединицы представляют собой гликопротеины. Доказано сходство кинетических характеристик очищенного фермента, выделенного из молока и ткани лактирующей молочной железы (Baumrucker C.R., 1980). Фермент имеет три изоформы. Оптимальные рН и температура – 8. 9 и 45 °С соответственно. Изоэлектрическая точка – при рН 3,85.
Ниже приведены данные по относительному распределению активности γ-глутамилтрансферазы в различных фракциях молока.
Распределение активности фермента[2], %
Сырое цельное молоко
Обезжиренное молоко (центрифугирование молока
при 5000 g в течение 15 мин при 4 °С)
Казеин (осадок после центрифугирования обезжиренного
молока, после внесения уксусной кислоты – рН 4,6
и встряхивания в течение 1 ч, при 5000 g
в течение 15 мин при 4°С)
Сыворотка (супернатант после центрифугирования
обезжиренного молока)
молочная сыворотка (супернатант после центрифугирования
сыворотки при 120 000 g в течение 30 мин при 4°С)
оболочки шариков жира (в осадке после
центрифугирования сыворотки)
Сливки (жир 35 % – после центрифугирования молока)
пахта (после замораживания и оттаивания сливок при 40 °С)
оболочки шариков жира (в осадке после центрифугирования пахты при 120 000 g в течение 30 мин при 4°С)
Отмечают, что γ-глутамилтрансфераза относительно непрочно связана с ОШЖ молока. Следовательно, при механическом воздействии на молоко возможен значительный переход этого фермента в водную фазу молока.
γ-Глутамилтрансфераза осуществляет перенос ацильной группы на пептид:
Фермент участвует в аминокислотном транспорте при лактации коров, катализируя перенос остатка γ-глутамила из глутатиона или других компонентов на аминокислоты или пептиды. Располагаясь на внешней поверхности секреторных клеток молочной железы, γ-глутамилтрансфераза играет важную роль в переносе аминокислот из крови в секреторную клетку для использования в синтезе белков молока.
Активность фермента в молоке непостоянна. Так, например, в молоке коров чешской красно-пестрой породы она составляет 16,5. 72,0 ед. (1 ед. соответствует количеству фермента, вызывающего образование 1 мкмоль продукта в течение 1 ч при 37 °С). Отмечают прямую зависимость между содержанием жира и активностью этого фермента в молоке. Ингибиторами фермента являются ионы меди и железа. Лактоза и лимонная кислота слегка ингибируют фермент, а хлориды кальция, магния и калия, фосфат натрия, протеозо-пептонная фракция молока практически не влияют на него (Majumder G. С, Ganguli N. С., Kitchen В. J., 1985).
D-Глутамилтрансфереза (2.3.2.1) по происхождению и связи с ОШЖ молока подобна γ-глутамилтрансферазе. Она также осуществляет перенос ацильной группы, но по другому уравнению:
Таким образом, γ- и D-глутамилтрансферазы участвуют в перегруппировке небелковых азотистых веществ, а D-глутамилтрансфераза дополнительно может быть причиной повышения содержания в молоке аммиака.
Белок-глутамин-γ-глутамилтрансфераза (2.3.2.13) (трансглутаминаза). Этот фермент имеет нативное и микробное происхождение и подобно γ- и D-глутамилтрансферазам катализирует реакцию переноса ацильной группы, но с созданием ковалентно-поперечной связи между белками с образованием высокомолекулярных полимеров.
Трансглутаминаза выделена из молочной железы и некоторых бактерий с достаточной степенью очистки (Kuraishi С., Yamazaki К., Susa Y., 2001). Из обезжиренного коровьего молока выделен ингибитор этого фермента, который обнаружен также в овечьем и козьем молоке (De Jong G. А. Н., Wijngaards G., Koppelman S. J., 2003).
Гексозилтрансферазы. Из этого подкласса, осуществляющих перенос гликозильных групп, в молоке обнаружены некоторые ферменты.
Лактозосинтаза (2.4.1.22) (галактозилтрансфераза) является нативным ферментом (первое сообщение появилось в 1964 г.) и катализирует синтез лактозы в секреторных клетках молочной железы. По данным В. Ярмоленко и В. Вайткуса (1982), механизм регуляции образования лактозосинтазы включает α-лактальбульмин и как дополнительный компонент – ионы кальция.
Лактозосинтаза обнаружена в мембранах частиц аппарата Гольджи молочной железы. Она выделена из молока и хроматографически разделена на две фракции – А (гликопротеин-4-β-галактозилтрансфераза 2.4.1.38) и Б (α-лактальбумин). Точное количественное содержание ее в молоке не установлено, полагают – 0,3. 0,4 мг%. Молекулярная масса лактозосинтазы составляет около 43 000 Да. Удельная активность очищенной фракции А фермента составляет 14 мкмоль/мин/мг белка при 37°С и нейтральном рН, а активность в молоке – 0,040. 0,060 Е/мл (
0,67. 1,0 нкат). Лактозосинтаза получена в кристаллической форме (см. рис. 13).
Лактозосинтаза содержит 12. 13 % карбогидрата, состоящего из ≈ 8% нейтральных сахаров, 1 % глюкозамина, 1 % галактозамина и 2 % сиаловой кислоты. Показано, что трипсин или плазмин расщепляют молекулу фермента до 42 000 Да и действие плазмина после секреции молока является вероятно причиной нахождения фермента в молоке с такой молекулярной массой (Jennes R., Walstra R, 1984).
Рис. 13. Кристаллическая форма лактосинтазы коровьего молока х750 (по Диксон М., Уэбб. Э., 1982)
Лактозосинтаза осуществляет перенос галактозильной группы от УДФ-галактозы на глюкозу:
В отсутствие α-лактальбумина фермент катализирует перенос галактозы с УДФ-галактозы на N-ацетилглюкозамин, что происходит при синтезе гликопротеинов и олигосахаридов молока. Оптимальными условиями его действия являются рН 7,5 и температура 37. 42°С. Активаторами фермента служат ионы марганца (в небольших концентрациях), ингибиторами – ионы марганца, магния и фосфаты (высокие концентрации).
В табл. 4 приведены гексозилтрансферазы, обнаруженные в молоке, которые используют другие субстраты и акцепторы гликозильных групп. Некоторые из них выделены из молока и их свойства изучены, но сведения об их происхождении и местонахождении в молоке практически отсутствуют (Kitchen В. J. 1984; Grün Е., 1985).
1) Компонент лактозосинтазы.
2) Переносит другие гликозильные группы, чем ферменты под №№ 2.4.1.38, 2.4.1.40 и 2.4.1.86.
Аминотрансферазы. Эти ферменты осуществляют перенос азотистых групп, а именно аминогрупп с аминокислот на кетокислоты. Реакции, катализируемые аминотрансферазами (или трансаминазами), носят название «транспереаминирование». Многие ферменты из аминотрансфераз играют большую роль в процессах синтеза и распада аминокислот в молочной железе. Наиболее активны в этом отношении аспартат- и аланинаминотрансферазы.
Аспартатаминотрансфераза и аланинаминотрансфераза (2.6.1.1 и 2.6.1.2) в молоке имеют как нативное происхождение, попадая в него из секреторных клеток молочной железы (источником служит цитоплазма), так и микробное. Источником этих ферментов в молоке является и плазма крови. Более 83 и 100% ферментов соответственно было обнаружено в молочной сыворотке.
Аспартат и аланинаминотрансферазы представляют собой ПФ-протеины. Путем переноса аминогрупп они катализируют следующие реакции транспереаминирования:
Имеются данные, что активность аспартатаминотрансферазы в молоке составляет 14,64 ед., а аланинаминотрансферазы – 8,33 ед. (1 ед. соответствует количеству фермента, вызывающего превращение 1 мг аминокислоты в 100 мл обезжиренного молока за 1 ч при 37 °С). По данным Sonneck R. (1979), активность этих ферментов в коровьем молоке невысока и составляет 0,010. 0,030 Е/мл (
Фосфотрансферазы (фосфокиназы). Эти ферменты катализируют перенос фосфорсодержащих групп. Реакции протекают с участием АДФ и АТФ, и таким образом происходит перенос энергии с одной системы на другую.
В молоке имеется несколько фосфотрансфераз нативного и микробного происхождений (микроорганизмы, сбраживающие лактозу). На нативное происхождение этих ферментов в молоке указывает наличие их в цитоплазме секреторных клеток молочной железы (Грачев И. И., Попов С.М., Скопичев В. Т.).
Из фосфотрансфераз в молоке обнаружены: глюкокиназа (2.7.1.2), галактокиназа (2.7.1.6), 6-фосфофруктокиназа (2.7.1.11), рибофлавинкиназа (2.7.1.26), глицеролкиназа (2.7.1.30) и пируваткиназа (2.7.1.40), которые в качестве акцептора используют спиртовую группу; фосфоглицераткиназа (2.7.2.3), использующая в качестве акцептора карбоксильную группу.
В табл. 5 приведены реакции, катализируемые этими фосфотрансферазами.
Эти ферменты принимают участие в ключевых реакциях гликолиза бактериальных клеток до образования пировиноградной кислоты вслед за первой стадией гликолиза молока – расщепления лактозы лактазой на D-глюкозу и D-галактозу. Реально наличие в молоке и протеинкиназы (2.7.1.37) (казеинкиназа), катализирующей фосфорилирование казеина в эндоплазматическом ретикулуме и компонентах аппарата Гольджи секреторных клеток молочной железы (Bingam Е. V., 1979), которое происходит следующим образом:
Нуклеотидилтрансферазы. Из этих трансфераз отмечено наличие в молоке ФМН-аденилтрансферазы (2.7.7.2), которая катализирует реакцию:
Другие сведения об этом ферменте молока отсутствуют.
Сульфиттрансферазы. Из этих ферментов в молоке обнаружена только тиосульфатсульфиттрансфераза (2.8.1.1) (роданаза). Первое сообщение об этом ферменте отмечено в 1933 г. Происхождение ее в молоке неизвестно. Фермент катализирует реакцию переноса групп, содержащих серу, в результате которой образуется тиоцианат, являющийся одним из факторов, обусловливающих действие лактопероксидазо-антибактериальной системы молока (субстратом могут служить и другие соединения, содержащие серу):
Активность тиосульфатсульфиттрансферазы в молоке обычно составляет 0,034 Е/мл (≈ 0,6 нкат).
[1] 2.3.2.2 – здесь и далее по классу трансфераз первое число означает класс фермента; второе число указывает на природу переносимой группы; третье число означает тип переносимой группы (в подклассе 2.7 третье число указывает на природу акцептора); четвертое число – порядковый номер фермента в его подподклассе.
[2] За единицу активности фермента принято образование 1 мкмоль n-нитроанилида в 1 мин при 37°С.
Трансферазные биологические процессы, функции, номенклатура и подклассы
трансферазы являются ферментами, ответственными за перенос функциональных групп субстрата, который действует как донор, другому, который действует как рецептор. Большинство жизненно важных метаболических процессов включают ферменты трансферазы.
Первое наблюдение реакций, катализируемых этими ферментами, было задокументировано в 1953 году доктором Р. К. Мортоном, который наблюдал перенос фосфатной группы из щелочной фосфатазы в β-галактозидазу, которая действовала как рецептор для фосфатной группы..
Номенклатура ферментов трансферазы обычно проводится в соответствии с природой молекулы, которая принимает функциональную группу в реакции, например: ДНК-метилтрансфераза, глутатион-трансфераза, 1,4-α-глюкан 6-α-глюкозилтрансфераза, среди других.
Трансферазы представляют собой ферменты, имеющие биотехнологическое значение, особенно в пищевой и фармацевтической промышленности. Их гены могут быть изменены, чтобы выполнять определенные действия в организмах, таким образом внося непосредственный вклад в здоровье потребителя, помимо пользы для питания.
Пребиотические препараты для кишечной флоры богаты трансферазами, поскольку они участвуют в образовании углеводов, которые способствуют росту и развитию полезных микроорганизмов в кишечнике..
Недостатки, структурные повреждения и перебои в процессах, катализируемых трансферазами, вызывают накопление продуктов внутри клетки, поэтому многие энзимы связаны с такими заболеваниями и патологиями..
Неисправность трансфераз вызывает такие заболевания, как галактоземия, болезнь Альцгеймера, болезнь Хантингтона и другие..
Биологические процессы, в которых они участвуют
Фермент глюкотрансфераза отвечает за конъюгацию антигенов А и В на поверхности эритроцитов. Эти изменения в связывании антигенов происходят из-за полиморфизма аминокислот Pro234Ser исходной структуры B-трансфераз.
Глутатион-S-трансфераза в печени участвует в детоксикации клеток печени, помогая защитить их от активных форм кислорода (АФК), свободных радикалов и перекисей водорода, которые накапливаются в цитоплазме клетки и являются высокотоксичный.
Аспартат-карбамоилтрансфераза катализирует биосинтез пиримидинов в метаболизме нуклеотидов, основных компонентов нуклеиновых кислот и молекул высоких энергий, используемых во множественных клеточных процессах (таких как, например, АТФ и ГТФ).
Трансферазы непосредственно участвуют в регуляции многих биологических процессов, заставляя эпигенетические механизмы заглушать последовательности ДНК, которые кодируют информацию, необходимую для синтеза клеточных элементов..
Гистонацетилтрансферазы ацетилируют консервативные остатки лизина в гистонах путем переноса ацетильной группы из молекулы ацетил-КоА. Это ацетилирование стимулирует активацию транскрипции, связанную с развитием или релаксацией эухроматина.
Фосфотрансферазы катализируют перенос фосфатных групп, вероятно, во всех клеточных метаболических контекстах. Он играет важную роль в фосфорилировании углеводов.
Аминотрансферазы катализируют обратимый перенос аминогрупп от аминокислот к оксикислотам, одну из многих трансформаций аминокислот, опосредованных витамин B6-зависимыми ферментами.
функции
Трансферазы катализируют движение химических групп, выполняя реакцию, показанную ниже. В следующем уравнении буква «X» представляет собой молекулу донора функциональной группы «Y», а «Z» действует как акцептор.
Это ферменты с сильными электроотрицательными и нуклеофильными элементами в своем составе; эти элементы отвечают за способность фермента к переносу.
Группы, мобилизованные трансферазами, обычно представляют собой альдегидные и кетоновые остатки, ацильные, глюкозильные, алкильные, азотные и обогащенные азотом группы, фосфор, серосодержащие группы и другие..
номенклатура
Классификация трансфераз следует общим правилам классификации ферментов, предложенным Комиссией по ферментам в 1961 году. По данным комитета, каждый фермент получает числовой код для своей классификации.
Положение цифр в коде указывает на каждое из подразделений или категорий в классификации, и этим цифрам предшествуют буквы «ЕС»..
В классификации трансфераз первое число представляет ферментативный класс, второе число обозначает тип группы, которую они переносят, а третье число относится к субстрату, на который они действуют.
Номенклатура класса трансфераз EC.2. У этого есть десять подклассов, таким образом, ферменты найдены с кодом от Eq.2.1 до EC.2.10. Каждое обозначение подкласса в основном делается в соответствии с типом группы, которая передает фермент.
подклассы
Десять классов ферментов в семействе трансфераз:
EC.2.1. Передаточные группы атома углерода
Они переносят группы, которые включают один углерод. Метилтрансфераза, например, переносит метильную группу (СН3) на азотистые основания ДНК. Ферменты этой группы напрямую регулируют трансляцию генов.
EC.2.2 Перенос альдегидных или кетоновых групп
Они мобилизуют альдегидные группы и кетоновые группы, содержащие сахариды в качестве рецепторных групп. Карбамилтрансфераза представляет собой механизм регуляции и синтеза пиримидинов.
EC.2.3 Ацилтрансферазы
Эти ферменты переносят ацильные группы в производные аминокислот. Пептидилтрансфераза выполняет существенное образование пептидных связей между соседними аминокислотами в процессе трансляции.
EC.2.4 Гликозилтрансферазы
Они катализируют образование гликозидных связей с использованием фосфатных сахарных групп в качестве донорных групп. Все живые существа представляют последовательности ДНК для гликозилтрансфераз, так как они участвуют в синтезе гликолипидов и гликопротеинов.
EC.2.5 Перенос алкильных или арильных групп, кроме метильных групп
Они мобилизуют, например, алкильные или арильные группы (кроме СН3) в виде диметильных групп. Среди них глутатионтрансфераза, которая была упомянута выше.
EC.2.6 Перенос азотных групп
EC.2.7 Трансферные группы, содержащие фосфатные группы
Они катализируют фосфорилирование субстратов. Обычно субстратами этих фосфорилирований являются сахара и другие ферменты. Фосфотрансферазы транспортируют сахара внутрь клетки, фосфорилируя их одновременно.
EC.2.8 Трансферные группы, содержащие серу
Они характеризуются катализом переноса серосодержащих групп в их структуре. Кофермент А-трансфераза относится к этому подклассу.
EC.2.9 Трансферные группы, содержащие селен
Они широко известны как селениотрансферазы. Они мобилизуют L-серильные группы вплоть до переноса РНК.
EC.2.10 Передачи групп, содержащих либо молибден, либо вольфрам
Трансферазы этой группы мобилизуют группы, содержащие молибден или вольфрам, в молекулы, которые имеют в качестве акцепторов сульфидные группы..
А трансфераза является одним из класса ферменты которые предписывают передачу конкретных функциональные группы (например, метил или же гликозил группа) от одного молекула (называется донором) другому (называется акцептором). [2] Они задействованы в сотнях различных биохимические пути на протяжении всей биологии и являются неотъемлемой частью некоторых из самых важных жизненных процессов.
Механически фермент, который катализирует следующую реакцию, будет трансферазой:
Икс грамм р о ты п + Y → т р а п s ж е р а s е Икс + Y грамм р о ты п < displaystyle Xgroup + Y < xrightarrow [
Содержание
История
Некоторые из наиболее важных открытий, касающихся трансфераз, были сделаны еще в 1930-х годах. Самые ранние открытия активности трансферазы произошли в других классификациях ферменты, включая бета-галактозидаза, протеаза, и кислота / основание фосфатаза. До осознания того, что отдельные ферменты способны выполнять такую задачу, считалось, что два или более ферментов осуществляют перенос функциональных групп. [8]
Трансаминирование, или передача амин (или NH2) группу от аминокислоты до кетокислота по аминотрансфераза (также известная как «трансаминаза»), была впервые отмечена в 1930 г. Дороти М. Нидхэм, после наблюдения исчезновения глютаминовая кислота добавлен в грудную мышцу голубя. [9] Это наблюдение было позже подтверждено открытием механизма его реакции Браунштейном и Крицманном в 1937 году. [10] Их анализ показал, что эту обратимую реакцию можно применить и к другим тканям. [11] Это утверждение было подтверждено Рудольф Шёнхаймерработает с радиоизотопы в качестве трассеры в 1937 г. [12] [13] Это, в свою очередь, открыло бы путь к возможности того, что подобные переносы были основным средством производства большинства аминокислот посредством переноса аминокислот. [14]
Другой такой пример ранних исследований трансферазы и более поздней реклассификации связан с открытием уридилтрансферазы. В 1953 г. фермент UDP-глюкозопирофосфорилаза было показано, что это трансфераза, когда было обнаружено, что она может обратимо производить UTP и G1P из UDP-глюкоза и органический пирофосфат. [15]
Классификация трансфераз продолжается и по сей день, при этом часто обнаруживаются новые. [17] [18] Примером этого является Pipe, сульфотрансфераза, участвующая в формировании дорсально-вентрального паттерна Дрозофилия. [19] Первоначально точный механизм Пайпа был неизвестен из-за отсутствия информации о его подложке. [20] Исследования каталитической активности Pipe исключили вероятность того, что это гликозаминогликан сульфата гепаран. [21] Дальнейшие исследования показали, что Пайп нацелен на сульфатирование структур яичников. [22] Труба в настоящее время классифицируется как Дрозофилия гепарансульфат 2-O-сульфотрансфераза. [23]
Номенклатура
Классификация
Описываемые в основном на основе типа переносимой биохимической группы, трансферазы можно разделить на десять категорий (на основе Номер ЕС классификация). [29] Эти категории включают более 450 различных уникальных ферментов. [30] В системе нумерации ЕС трансферазы классифицируются как EC2. Водород не считается функциональной группой, когда речь идет о мишенях трансферазы; вместо этого перенос водорода включен в оксидоредуктазы, [30] из-за соображений переноса электронов.
| Номер ЕС | Примеры | Группа (ы) переданы |
|---|---|---|
| EC 2.1 | метилтрансфераза и формилтрансфераза | Один-углерод группы |
| EC 2.2 | транскетолаза и трансальдолаза | альдегид или же кетон группы |
| EC 2.3 | ацилтрансфераза | ацил группы или группы, которые становятся алкил группы во время трансфера |
| EC 2.4 | гликозилтрансфераза, гексозилтрансфераза, и пентозилтрансфераза | гликозил группы, а также гексозы и пентозы |
| EC 2.5 | рибофлавинсинтаза и хлорофиллсинтаза | алкил или же арил группы, кроме метильных групп |
| EC 2.6 | трансаминаза, и оксиминотрансфераза | азотистый группы |
| EC 2.7 | фосфотрансфераза, полимераза, и киназа | фосфор-содержащие группы; подклассы основаны на акцепторе (например, алкоголь, карбоксил, так далее.) |
| EC 2.8 | серотрансфераза и сульфотрансфераза | сера-содержащие группы |
| 2.9 по К.Э. | селотрансфераза | селен-содержащие группы |
| 2.10 по К.Э. | молибдентрансфераза и вольфрамтрансфераза | молибден или же вольфрам |
Реакции
EC 2.1: одноуглеродные трансферазы
EC 2.2: трансферазы альдегидов и кетонов
EC 2.3: ацилтрансферазы
EC 2.4: гликозил, гексозил и пентозилтрансферазы
EC 2.5: алкил- и арилтрансферазы
EC 2.6: азотистые трансферазы
Группировка соответствует передаче азотистый группы EC 2.6. Это включает ферменты, такие как трансаминаза (также известная как «аминотрансфераза») и очень небольшое количество оксиминотрансферазы и другие ферменты, переносящие азотные группы. EC 2.6 ранее включался амидинотрансфераза но с тех пор он был переклассифицирован в подкатегорию EC 2.1 (одноуглеродные ферменты). [45] В случае аспартат трансаминаза, который может действовать на тирозин, фенилаланин, и триптофан, он обратимо передает амино- группа от одной молекулы к другой. [46]
EC 2.7: трансферазы фосфора
В то время как EC 2.7 включает ферменты, которые переносят фосфор-содержащие группы, он также включает нуклеотидилтрансферазы. [48] Подкатегория фосфотрансфераза делится на категории в зависимости от типа группы, которая принимает перевод. [24] Группы, которые классифицируются как акцепторы фосфата, включают: спирты, карбоксильные группы, азотистые группы и фосфатные группы. [29] Другими составляющими этого подкласса трансфераз являются различные киназы. Известная киназа циклин-зависимая киназа (или CDK), который включает подсемейство протеинкиназы. Как следует из названия, CDK сильно зависят от конкретных циклин молекулы для активация. [49] После объединения комплекс CDK-циклин способен выполнять свою функцию в клеточном цикле. [50]
EC 2.8: трансферазы серы
EC 2.9: трансферазы селена
EC 2.9 включает ферменты, переносящие селен-содержащие группы. [59] Эта категория содержит только две трансферазы и, таким образом, является одной из самых маленьких категорий трансфераз. Селеноцистеинсинтаза, которая была впервые добавлена в систему классификации в 1999 году, превращает серил-тРНК (Sec UCA) в селеноцистеил-тРНК (Sec UCA). [60]
EC 2.10: трансферазы металлов
Роль в гисто-группе крови
Это возможно для Homo sapiens иметь любой из четырех разных группы крови: Тип A (экспрессируют антигены A), тип B (экспрессируют антигены B), тип AB (экспрессируют антигены A и B) и тип O (не экспрессируют антигены A или B). [67] Ген трансфераз A и B расположен на хромосома 9. [68] Ген содержит семь экзоны и шесть интроны [69] а сам ген имеет размер более 18 КБ. [70] Аллели трансфераз A и B очень похожи. Полученные ферменты различаются только 4 аминокислотными остатками. [66] Разные остатки расположены в положениях 176, 235, 266 и 268 ферментов. [66] : 82–83
Недостатки
Трансфераза недостатки лежат в основе многих общих болезни. Наиболее частым результатом дефицита трансферазы является накопление сотовый продукт.
Дефицит SCOT
Сукцинил-КоА: 3-кетокислотный КоА дефицит трансферазы (или Дефицит SCOT) приводит к накоплению кетоны. [71] Кетоны создаются при расщеплении жиров в организме и являются важным источником энергии. [72] Неспособность использовать кетоны приводит к прерывистому кетоацидоз, который обычно впервые проявляется в младенчестве. [72] Больные заболеваниями испытывают тошноту, рвоту, неспособность есть и затрудненное дыхание. [72] В крайних случаях кетоацидоз может привести к коме и смерти. [72] Дефицит вызван мутация в гене OXCT1. [73] Лечение в основном зависит от диеты пациента. [74]
CPT-II дефицит
Галактоземия
Галактоземия возникает из-за неспособности перерабатывать галактозу, простой сахар. [77] Этот дефицит возникает, когда ген галактозо-1-фосфат уридилилтрансфераза (GALT) имеет любое количество мутаций, приводящих к дефициту количества продуцируемого GALT. [78] [79] Есть две формы галактоземии: классическая и дуарте. [80] Галактоземия Дуарте обычно менее серьезен, чем классическая галактоземия, и вызван дефицитом галактокиназа. [81] Галактоземия делает младенцев неспособными перерабатывать сахар в грудном молоке, что приводит к рвоте и анорексия в течение дней после рождения. [81] Большинство симптомов болезни вызвано накоплением галактоза-1-фосфат в организме. [81] Общие симптомы включают печеночную недостаточность, сепсис, неспособность расти и психические расстройства, среди прочего. [82] Накопление второго токсичного вещества, галактитол, происходит в хрусталиках глаз, вызывая катаракта. [83] В настоящее время единственным доступным лечением является ранняя диагностика с последующим соблюдением диеты, не содержащей лактозы, и назначением антибиотиков для инфекций, которые могут развиться. [84]
Дефицит холинацетилтрансферазы
Болезнь Альцгеймера
Боковой амиотрофический склероз (БАС или болезнь Лу Герига)
Пациенты с ALS показывают заметное снижение активности ChAT в мотонейронах в спинной мозг и мозг. [93] Низкие уровни активности ChAT являются ранним признаком заболевания и выявляются задолго до того, как моторные нейроны начинают умирать. Это можно обнаружить даже до того, как пациент симптоматический. [94]
болезнь Хантингтона
Пациенты с Хантингтона также показывают заметное снижение производства ChAT. [95] Хотя конкретная причина снижения продукции не ясна, считается, что гибель мотонейронов среднего размера с шипами дендриты приводит к более низким уровням продукции ChAT. [89]
Шизофрения
У пациентов с шизофренией также наблюдается снижение уровня ChAT, локализованного в мезопонтинский перегородок мозга [96] и прилежащее ядро, [97] что, как полагают, коррелирует со снижением когнитивных функций у этих пациентов. [89]
Синдром внезапной детской смерти (СВДС)
Недавние исследования показали, что СВДС у младенцев наблюдается снижение уровня ChAT как в гипоталамус и полосатое тело. [89] Младенцы с СВДС также демонстрируют меньше нейронов, способных продуцировать ChAT в системе блуждающего нерва. [98] Эти дефекты в мозговом веществе могут привести к неспособности контролировать важные автономный такие функции, как сердечно-сосудистый и респираторный системы. [98]
Врожденный миастенический синдром (ВМС)
CMS это семейство болезней, которые характеризуются дефектами в нервно-мышечная передача что приводит к повторяющимся приступам апноэ (неспособность дышать), что может быть фатальным. [99] Дефицит ChAT связан с синдромами миастении, при которых возникает проблема перехода. пресинаптически. [100] Эти синдромы характеризуются неспособностью пациентов к повторному синтезу ацетилхолин. [100]
Использование в биотехнологии
Терминальные трансферазы
Трансферазы глутатиона
Семейство глутатионовых трансфераз (GST) чрезвычайно разнообразно, и поэтому их можно использовать для ряда биотехнологических целей. Растения используют трансферазы глутатиона как средство отделения токсичных металлов от остальной части клетки. [102] Эти трансферазы глутатиона можно использовать для создания биосенсоры для обнаружения загрязняющих веществ, таких как гербициды и инсектициды. [103] Трансферазы глутатиона также используются в трансгенных растениях для повышения устойчивости как к биотическому, так и к абиотическому стрессу. [103] Трансферазы глутатиона в настоящее время исследуются как цели для противораковые препараты из-за их роли в устойчивость к лекарству. [103] Кроме того, гены глутатионтрансферазы были исследованы на предмет их способности предотвращать окислительное повреждение и показали улучшенное сопротивление в трансгенный cultigens. [104]
Резиновые трансферазы
В настоящее время единственный доступный коммерческий источник натурального резинка это Гевея растение (Hevea brasiliensis). Натуральный каучук превосходит синтетическая резина в ряде коммерческих применений. [105] Прилагаются усилия для получения трансгенных растений, способных синтезировать натуральный каучук, в том числе табак и подсолнечник. [106] Эти усилия сосредоточены на секвенировании субъединиц ферментного комплекса каучуковой трансферазы с целью трансфекции этих генов в другие растения. [106]
Мембранно-ассоциированные трансферазы
Многие трансферазы ассоциируются с биологические мембраны в качестве белки периферической мембраны или прикреплены к мембранам через один трансмембранная спираль, [107] например многочисленные гликозилтрансферазы в аппарат Гольджи. Некоторые другие многопролетные трансмембранные белки, например, некоторые олигосахарилтрансферазы или микросомальный глутатион S-трансфераза из Семья MAPEG.