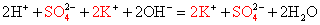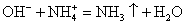какие реакции называют ионными
Реакции обмена в водных растворах электролитов. Ионные реакции и уравнения
Так как молекулы электролитов в растворах распадаются на ионы, то и реакции в растворах электролитов происходят между ионами.
Реакции, протекающие между ионами, называются ионными реакциями.
С участием ионов могут протекать как обменные, так и окислительно-восстановительные реакции. Рассмотрим реакции ионного обмена, например взаимодействие между растворами двух солей:
Это уравнение является молекулярным уравнением, так как формулы всех веществ записаны в виде молекул. Исходные вещества Na2SО4 и ВаCl2 являются сильными электролитами, т. е. в растворе находятся в виде ионов. Сульфат бария — нерастворимая соль, которая выпадает в осадок, следовательно, ионы Ва 2+ и SО4 2- уходят из раствора. Хлорид натрия NaCl — растворимая соль, сильный электролит, в растворе находится в виде ионов (Na + + Сl — ). Таким образом, с учетом диссоциации сильных электролитов уравнение реакции можно записать так:
Такое уравнение называется полным ионным уравнением.

Ионы Na + и Cl — имеются и в левой, и в правой частях уравнения, т. е. эти ионы в реакции участия не принимают, их можно исключить из уравнения:
Сокращенное ионное уравнение (3) выражает сущность не только реакции (1). Напишем уравнения нескольких реакций:
Как видим, сущность реакций (4) и (5), как и реакции (1), заключается в связывании ионов SO4 2- и Ва 2+ с образованием нерастворимой соли BaSО4.
В ионных уравнениях формулы веществ записывают в виде ионов или в виде молекул.
В виде ионов записывают формулы:
В виде молекул записывают формулы:
— малорастворимых солей(↓) AgCl, BaSO4, СаСО3, FeS и др.;
Большая часть молекул слабых электролитов в растворе не диссоциирует на ионы.
В виде молекул также записывают:
В уравнениях реакций ставят знак ↓, если среди продуктов реакции есть осадок — нерастворимые или малорастворимые вещества. Знак ↑ показывает газообразные и летучие соединения.
Реакции обмена в водных растворах электролитов могут быть:
1) практически необратимыми, т. е. протекать до конца;
2) обратимыми, т. е. протекать одновременно в двух противоположных направлениях.
1) Реакции обмена между сильными электролитами в растворах протекают до конца, или практически необратимы, когда ионы соединяются друг с другом и образуют:
а) малорастворимые вещества;
б) малодиссоциирующие вещества — слабые электролиты;
в) газообразные или летучие вещества.
Рассмотрим эти случаи.
а) Реакции с образованием малорастворимых веществ, выпадающих в осадок (↓).
Составим молекулярное и ионное уравнения реакции между нитратом серебра (I) AgNO3 и хлоридом натрия NaCl:
Эта реакция обмена необратима, потому что один из продуктов уходит из сферы реакции в виде нерастворимого вещества.
б) Реакции, идущие с образованием малодиссоциирующих веществ (слабых электролитов).
Составим молекулярное и ионное уравнения реакции нейтрализации между растворами гидроксида натрия NaOH и серной кислоты H2SO4:
или, сокращая коэффициенты, получим: ОН — + Н + = Н2О.
В результате реакции нейтрализации ионы водорода Н + и гидроксид-ионы ОН — образуют малодиссоциирующие молекулы воды. Процесс нейтрализации идет до конца, т. е. эта реакция необратима.
в) Реакции, протекающие с образованием газообразных веществ.
Составим молекулярное и ионное уравнения реакции между растворами гидроксида кальция и хлорида аммония NH4Cl:
Эта реакция обмена необратима, потому что образуются газ аммиак NH3 и малодиссоциирующее вещество вода.
2) Если среди исходных веществ имеются слабые электролиты или малорастворимые вещества, то такие реакции являются обратимыми, т. е. до конца не протекают. Например:
Если исходными веществами реакций обмена являются сильные электролиты, которые при взаимодействии не образуют малорастворимых или малодиссоциирующих веществ, то такие реакции не протекают. При смешивании их растворов образуется смесь ионов, которые не соединяются друг с другом. Например:
Урок №10. Реакции ионного обмена и условия их протекания
РЕАКЦИИ ИОННОГО ОБМЕНА
Правила написания уравнений реакций в ионном виде
1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
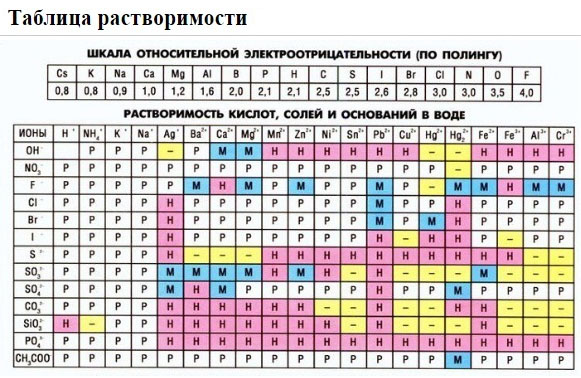
2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ (солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
5. При написании полных и кратких ионных уравнений используйте следующие памятку и алгоритм :
Памятка для написании полных и кратких ионных уравнений
Алгоритм действий при составлении реакций ионного обмена
Реакции в растворах электролитов всегда идут в сторону образования наименее диссоциированных или наименее растворимых веществ .
Из этого, в частности, следует, что сильные кислоты вытесняют слабые из растворов их солей
CH 3 COONa + HCl = CH 3 COOH + NaCl
Суть этой реакции более точно отражается ионно-молекулярным уравнением, где формулы слабых электролитов записаны в виде молекул, а сильных – в виде ионов
CH 3 COO – + Na + + H + + Cl – = CH 3 COOH + Na + + Cl –
или в сокращенном виде
CH 3 COO – + H + = CH 3 COOH
Взаимодействие кислой соли и щелочи приводит к образованию средней соли и воды. Например, KHCO 3 + KOH = K 2 CO 3 + H 2 O
Запишем полное ионно-молекулярное уравнение
K + + HCO 3 – + K + + OH – = 2K + + CO 3 2– + H 2 O
Исключив одинаковые ионы (не участвующие в реакции) в левой и правой частях уравнения, получаем сокращенное ионно-молекулярное уравнение:
HCO 3 – + OH – = CO 3 2– + H 2 O
При взаимодействии основной соли и кислоты образуется средняя соль и вода. Например, NiOHNO 3 + HNO 3 = Ni(NO 3 ) 2 + H 2 O.
Запишем полное и сокращенное ионно-молекулярное уравнения
NiOH + + NO 3 – + H + + NO 3 – = Ni 2+ + 2NO 3 – + H 2 O
NiOH + + H + = Ni 2+ + H 2 O
Амфотерные гидроксиды [Zn(OH) 2 , Be(OH) 2 , Al(OH) 3 , Cr(OH) 3 и др.] растворяются в растворах щелочей с образованием комплексных солей.
Например, Zn(OH) 2 + 2KOH = K 2 [Zn(OH) 4 ]
Запишем полное и сокращенное ионно-молекулярное уравнения
Zn(OH) 2 + 2K + + 2OH – =2K + + [Zn(OH) 4 ] 2–
Zn(OH) 2 + 2OH – = [Zn(OH) 4 ] 2–
В сокращенном ионно-молекулярном уравнении сумма электрических зарядов левой части уравнения всегда равна сумме электрических зарядов правой части уравнения.
Фосфорная кислота — электролит средней силы, диссоциирует преимущественно по первой ступени. Записывая ионные уравнения, нужно помнить особенности диссоциации этой кислоты.
H 3 PO 4 + NaOH = NaH 2 PO 4 + H 2 O, образуется кислая, а не средняя соль.
Какие реакции называют ионными
Урок посвящен изучению темы «Реакции ионного обмена». На нём вы рассмотрите сущность реакций, протекающих между растворами кислот, солей и щелочей. На уроке будет дано определение новому понятию реакции ионного обмена.
Также будут рассмотрены условия протекания реакций ионного обмена до конца. Чтобы лучше понять, какие необходимо соблюдать условия протекания реакций ионного обмена до конца, будет проведено повторение, что собой представляют эти реакции, их сущность. Приводятся примеры на закрепление этих понятий.
Урок поможет закрепить умение составлять уравнения реакций ионного обмена в молекулярной и ионной формах, научит составлять по сокращенному ионному уравнению молекулярные.
I. Сущность реакций ионного обмена
Реакциями ионного обмена называют реакции между растворами электролитов, в результате которых они обмениваются своими ионами.
Реакции ионного обмена протекают до конца (являются практически необратимыми) в тех случаях, если образуются слабый электролит, осадок (нерастворимое или малорастворимое вещество), газ.
AgNO3 + HCl = AgCl
Реакция протекает до конца, так как выпадает осадок хлорида серебра
Сu(OH)2 + 2HCl = CuCl2 + 2H2O
Реакция идет до конца, так как образуется слабый электролит вода
Na2CO3 + 2H2SO4 = Na2SO4 + CO2
Реакция протекает до конца, так как образуется углекислый газ
Правила написания уравнений реакций в ионном виде
1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ (солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
На ионы диссоциируют
Реагенты (исходные вещества)
Растворимые (P) в воде (см. ТР):
(включая Ca(OH)2 – M)
Растворимые (P) в воде (см. ТР):
Исключения – неустойчивые вещества не диссоциируют, а разлагаются на газ и воду:
Алгоритм составления реакций ионного обмена (РИО)
в молекулярном, полном и кратком ионном виде
1) Записываем уравнение РИО в молекулярном виде:
Взаимодействие сульфата меди (II) и гидроксида натрия:
2) Используя ТР указываем растворимость веществ воде:
— Если продукт является М или Н – оно выпадает в осадок, справа от химической формулы ставим знак ↓
— Если продукт является газом, справа от химической формулы ставим знак ↑
4) Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции.
Помните! РИО необратима и практически осуществима, если в продуктах образуются:
Краткий ионный вид
Вывод – данная реакция необратима, т.е. идёт до конца, т.к. образовался осадок Cu(OH)2↓
Заишем еще несколько примеров РИО, идущих с образованием осадка:
Пример №1
а) Молекулярное уравнение реакции двух растворимых солей:
б) Полное ионное уравнение реакции:
в) Cокращенное ионное уравнение реакции:
Пример №2
а) Молекулярное уравнение реакции нерастворимого основания с кислотой:
б) Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода (IV).
Заишем еще несколько примеров РИО, идущих с образованием газа:
Пример №1
Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
Полное ионное уравнение реакции:
2K + + S 2– + 2H + + 2Cl – = 2K + + 2Cl – + H2S↑
Cокращенное ионное уравнение реакции:
Пример №2
Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
Посмотрите видео-опыт: “Реакция нейтрализации”
Пример №1
Молекулярное уравнение реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + H2O (мд)
Полное ионное уравнение реакции:
K + + OH – + H + + Cl – = K + + Cl – + H2O
Cокращенное ионное уравнение реакции:
Пример №2
Молекулярное уравнение реакции основного оксида с кислотой:
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca 2+ + H2O.
Пример №3
Молекулярное уравнение реакции нерастворимого основания с кислотой:
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
V. Выполнение заданий
Задание №1. Определите, может ли осуществляться взаимодействие между растворами гидроксида калия и хлорида аммония, записать реакциив молекулярном, полном, кратком ионном виде.
— Составляем химические формулы веществ по их названиям, используя валентности и записываем РИО в молекулярном виде (проверяем растворимость веществ по ТР):
так как NH4OH неустойчивое вещество и разлагается на воду и газ NH3уравнение РИО примет окончательный вид
— Cоставляем полное ионное уравнение РИО, используя ТР (не забывайте в правом верхнем углу записывать заряд иона):
— Cоставляем краткое ионное уравнение РИО, вычёркивая одинаковые ионы до и после реакции:
Взаимодействие между растворами следующих веществ может осуществляться, так как продуктами данной РИО являются газ (NH3 ↑) и малодиссоциирующее вещество вода (H2O).
Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращёнными уравнениями. Составьте соответствующие молекулярное и полное ионное уравнения.
— Составляем молекулярное уравнение РИО:
так как угольная кислота – неустойчивое вещества, она разлагается на углекислый газ CO2 ↑ и воду H2O, уравнение примет окончательный вид:
— Составляем полное ионное уравнение РИО:
— Составляем краткое ионное уравнение РИО:
Сокращаем коэффициенты на три и получаем:
В конечном итоге мы получили искомое сокращённое ионное уравнение, следовательно, задание выполнено верно.
Задание №3. Запишите реакцию обмена между оксидом натрия и фосфорной кислотой в молекулярном, полном и кратком ионном виде.
1. Составляем молекулярное уравнение, при составлении формул учитываем валентности (см. ТР)
2. Составляем полное ионное уравнение:
3. Сокращаем одинаковые ионы и получаем краткое ионное уравнение:
Данная реакция необратима, т.е. идёт до конца, так как в продуктах образуется малодиссоциирующее вещество вода.
VI. Задания для самостоятельной работы
Задание №1. Посмотрите следующий эксперимент:
Составьте уравнение реакции ионного обмена карбоната натрия с серной кислотой в молекулярном, полном и кратком ионном виде.
Задание №2. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Задание №3. Посмотрите следующий эксперимент:
Составьте уравнение реакции ионного обмена хлорида бария с сульфатом магния в молекулярном, полном и кратком ионном виде.
Задание №4. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Ионные уравнения
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации. Разберем историю вопроса, алгоритм составления ионных уравнений и примеры задач.
ИСТОРИЯ ВОПРОСА
Еще древние алхимики, проводя нехитрые химические реакции в поисках философского камня и записывая в толстые фолианты результаты своих исследований, использовали определенные знаки для химических веществ. У каждого ученого была своя система, что неудивительно: каждый хотел защитить свои тайные знания от происков завистников и конкурентов. И лишь в VIII веке появляются единые обозначения для некоторых элементов.
В 1615 году Жан Бегун в своей книге «Начала химии», что по праву считается одним из первых учебников в этом разделе естествознания, предложил использовать условные обозначения для записи химических уравнений. И лишь в 1814 году шведский химик Йонс Якоб Берцелиус создал систему химических символов на основе одной или двух первых букв латинского названия элемента, подобную той, с которой ученики знакомятся на уроках.
В восьмом классе (параграф 12, учебник «Химия. 8 класс» под редакцией В.В. Еремина) ребята научились составлять молекулярные уравнения реакций, где и реагенты, и продукты реакций представлены в виде молекул.
Однако это упрощенный взгляд на химические превращения. И об этом задумывались ученые уже в XVIII веке.
Аррениус в результате своих экспериментов выяснил, что растворы некоторых веществ проводят электрический ток. И доказал, что вещества, обладающие электропроводностью, в растворах находятся в виде ионов: положительно заряженных катионов и отрицательно заряженных анионов. И именно эти заряженные частицы вступают в реакции.
ЧТО ТАКОЕ ИОННЫЕ УРАВНЕНИЯ
Ионные уравнения реакций — это химические равенства, в которых вещества, вступающие в реакцию, и продукты реакций обозначены в виде диссоциированных ионов. Уравнения данного типа подходят для записи химических реакций замещения и обмена в растворах.
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации (тема подробно разбирается в параграфе 10, учебник «Химия. 9 класс» под редакцией В.В. Еремина). В виде молекул записывают газы, вещества, выпадающие в осадок, и слабые электролиты, которые практически не диссоциируют. Газы обозначаются стрелкой вверх (↑), субстанции, выпадающие в осадок, стрелкой вниз (↓).
ОСОБЕННОСТИ ИОННЫХ УРАВНЕНИЙ
1. Реакции ионного обмена, в отличие от окислительно-восстановительных реакций, протекают без нарушения валентности веществ, вступающих в химические превращения.

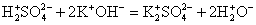
2. Реакции между ионами протекают при условии образования в ходе реакции плохорастворимого осадка, выделения летучего газа или образования слабых электролитов.
Удивительно, что реакции обмена могут проходить даже с нерастворимыми солями слабых кислот. В этом случае сильная кислота вытесняет слабую из ее солей. В качестве примера можно привести сокращенное ионное уравнение разведения карбоната кальция в сильных кислотах.
АЛГОРИТМ СОСТАВЛЕНИЯ ИОННОГО УРАВНЕНИЯ
Записываем молекулярное уравнение химического процесса.
Балансируем молекулярное уравнение с помощью коэффициентов.
Чтобы правильно сбалансировать равенство, нужно вспомнить закон сохранения массы веществ (параграф 12, «Химия. 8 класс» под редакцией В.В. Еремина), согласно которому в ходе химических превращений новые атомы не появляются, а старые не разрушаются. Т.е. число атомов в продуктах реакции равно числу атомов в исходных веществах. Помним, что водород и кислород уравниваем в последнюю очередь.
Определяем, какие вещества в химической реакции диссоциируют, т.е. распадаются на ионы.
Записываем в виде ионов:
Записываем в виде молекул:
Если есть сомнения в растворимости реагента или продукта реакции, можно проверить по специальной таблице, которая является справочным материалом, ей можно пользоваться на различных экзаменах.
В таблице, помимо растворимости соединений, представлены также заряды катионов и анионов, участвующих в реакциях.
Определяем многоатомные ионы.
Это необходимо сделать, т.к. данные соединения не разлагаются на отдельные атомы и имеют свой заряд. Чаще всего в химических превращениях участвуют следующие многоатомные ионы:
Записываем равенство таким образом, чтобы все диссоциирующие субстанции были представлены в виде катионов и анионов.
Проверяем, чтобы уравнение было сбалансировано, т.е. количество различных атомов в частях с реагентами и продуктами реакции совпадало.
На данном этапе мы получили полное ионное уравнение.
Вычеркиваем идентичные ионы в обеих частях равенства, т.е. катионы и анионы с одинаковыми нижними индексами и зарядами, и переписываем равенство без данных ионов.
Проверяем, чтобы количество атомов элементов совпадало в правой и левой частях уравнения. Таким образом получаем краткое ионное уравнение.
ПРИМЕРЫ
Задача 1
Выясните, произойдет ли химическое взаимодействие между растворами гидроксида калия и хлорида аммония. (Записать для реакции молекулярное, полное ионное и сокращенное ионное уравнение.)
Записываем молекулярное уравнение, проверяем коэффициенты.
Помним, что гидроксид аммония — нестабильное соединение и разлагается на аммиак и воду.
Записываем окончательное уравнение:
NB! Благодаря летучести и резкому раздражающему запаху 3%-й раствор NH3 называется «нашатырный спирт» и используется в медицине.
Подсматривая в таблицу растворимости, помечаем полное ионное уравнение, не забывая о зарядах ионов.
Вычеркивая идентичные катионы и анионы в обеих частях реакции, составляем краткое ионное уравнение.
Делаем вывод: химическая реакция между гидроксидом калия и хлоридом аммония протекает с образованием воды и выделением аммиака — летучего газа с резким запахом.
Задача 2
А сейчас выполним задание из учебника «Химия. 9 класс» под редакцией В.В. Еремина.
Налейте в пробирку 1 мл раствора карбоната натрия и аккуратно прилейте к нему пару капелек соляной кислоты.
Составьте уравнение реакции, напишите полное и сокращенное ионные уравнения.
Записываем реакцию в молекулярном виде, расставляем коэффициенты, если это необходимо.
Подсматривая в таблицу растворимости, записываем полное ионное уравнение, не забывая отмечать заряды ионов.
Вычеркивая одинаковые катионы и анионы в правой и левой частях равенства, составляем краткое ионное уравнение.
Вопрос «Что происходит?» остался без ответа. К сожалению, в домашних условиях этот опыт осуществить трудновато, так как стиральной содой уже давно никто не пользуется, да и соляную кислоту в аптеке уже не продают. Но примерно такой же визуальный эффект можно наблюдать, если смешать раствор пищевой соды с раствором уксусной кислоты.