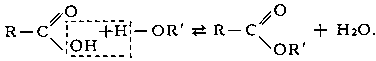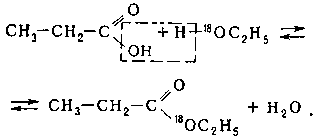какие реакции называются реакциями этерификации
Реакции этерификации карбоновых кислот



Реакцией этерификации называется взаимодействие спиртов с карбоновыми кислотами, приводящее к образованию сложных эфиров (алкоголиз карбоновых кислот). В этой реакции молекула спирта выступает в роли нуклеофильного агента, атакующего электронодефицитный атом углерода карбонильной группы.
R = алкил, арил, гетерил; R’ = алкил
Реакция этерификации обратима и, следовательно, ограничена состоянием равновесия (обратная реакция называется гидролизом сложного эфира). Превращение эквимолярных количеств кислоты и спирта в теоретически вычисленное количество сложного эфира невозможно. В результате реакции образуется некоторое максимальное количество сложного эфира (которое всегда ниже теоретически вычисленного), и остаются не вступившие в реакцию кислота и спирт.
По мере того, как кислота и спирт реагируют друг с другом и происходит накопление продуктов их взаимодействия (сложного эфира и воды), скорость обратной реакции, вначале незначительная, возрастает; при этом скорость прямой реакции постепенно уменьшается. Наконец, наступает динамическое равновесие, когда в единицу времени в сложный эфир превращается столько молекул кислоты и спирта, сколько молекул сложного эфира распадается на кислоту и спирт. Постоянный состав смеси обусловлен одинаковыми скоростями этих двух противоположных процессов.
Реакция этерификации протекает очень медленно. Основная причина заключается в том, что на атакуемом атоме углерода карбоксильной группы происходит уменьшение частичного положительного заряда вследствие влияния положительного мезомерного эффекта гидроксильной группы.
Для быстрейшего достижения равновесия реакцию этерификации проводят в присутствии катализаторов: минеральных кислот (серной или фосфорной кислот), сухого газообразного хлористого водорода, арилсульфокислот (например, п-толуолсульфокислоты, 4-СН3С6Н4SO3H), которые протонируют атом кислорода карбоксильной группы и тем самым увеличивают частичный положительный заряд (d + ) на атакуемом атоме углерода. Если при проведении реакции нежелательно присутствие кислот в реакционной смеси, то в качестве катализаторов используют ионообменные смолы (катиониты КУ-2, КУ-23). Следует иметь в виду, что катализаторы повышают скорость реакции этерификации, но не влияют на равновесие.
Для изменения состояния равновесия и повышения выхода сложных эфиров (т.е. смещения равновесия вправо) применяют следующие способы:
· использование значительного избытка по сравнению со стехиометрическим количеством одного из исходных веществ. Обычно увеличивают концентрацию более доступного реагента (как правило, таким реагентом является спирт);
т.кип. 118 0 С т.кип. 78 0 С т.кип. 77 0 С
При получении высококипящих сложных эфиров удобнее отгонять воду в процессе реакции. Вода в этом случае отгоняется в виде азеотропной смеси с парами соответствующего спирта.
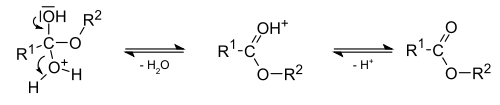
| В большинстве случаев температуры кипения реагентов и продукта близки, что затрудняет удаление воды в виде азеотропной смеси с одним из компонентов реакции, поэтому для удаления воды в реакционную смесь добавляют инертный растворитель, который образует с водой низкокипящую азеотропную смесь (бензол, толуол, тетрахлорметан, хлороформ и др.). При конденсации азеотропной смеси образуется два слоя – водный и органический, так как в жидкой фазе растворитель с водой не смешивается. При этом растворитель возвращается в реакционную смесь, а вода накапливается в водоотделителе. В случае растворителей, имеющих плотность меньше, чем у воды, в качестве водоотделителя используется насадка Дина-Старка (см. рисунок). Минеральные кислоты (H2SO4, H3PO4) действуют не только каталитически в реакциях этерификации, но и как водоотнимающие средства, поэтому иногда их применяют в количествах, превышающих каталитические (обычно используют 5-10% минеральной кислоты от массы карбоновой кислоты). В настоящее время для реакции этерификации принят следующий механизм: |  Прибор для азеотропного отделения воды с использованием насадки Дина-Старка. Прибор для азеотропного отделения воды с использованием насадки Дина-Старка. |
1. На первой стадии происходит электрофильное присоединение протона (от катализатора) по кратной С-О связи с образованием резонансно-стабилизированного карбениевого иона (I).
2. Далее катион (I) взаимодействует с молекулой спирта по неподеленной электронной паре атома кислорода, образуя интермедиат (II) (оксониевый ион).
3. Затем происходит перегруппировка оксониевого иона (II) в оксониевый ион (III).
4. Оксониевый ион (III) последовательно выделяет молекулу воды и протон, давая сложный эфир.
электроноакцепторные заместители, напротив, делают кислоту более реакционноспособной:
Достаточно сильные кислоты, такие, как муравьиная, трифторуксусная и щавелевая, быстро реагируют со спиртами даже без добавок минеральной кислоты в качестве катализатора.
Ароматические кислоты, особенно содержащие в ароматическом кольце электронодонорные заместители, взаимодействуют со спиртами значительно труднее и требуют больших количеств катализатора.
По этим же причинам 2,4,6-триметилбензойная кислота (β-изодуриловая кислота) в обычных условиях с трудом образует сложные эфиры, в то время как 2,4,6-триметилфенилуксусная кислота (мезитилуксусная кислота) даёт сложные эфиры с хорошим выходом:
 2,4,6-триметилбензойная кислота 2,4,6-триметилбензойная кислота | 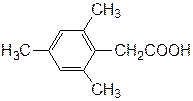 2,4,6-триметилфенилуксусная кислота 2,4,6-триметилфенилуксусная кислота |
Для прямой этерификации пространственно-затрудненных кислот используют метод, заключающийся в растворении карбоновой кислоты в 100%-ной серной кислоте с последующей обработкой раствора спиртом. При растворении кислот такого типа в безводной серной кислоте образуется ацилий-катион, который и участвует в реакции:
Аналогичные пространственные затруднения оказывают и алкильные группы, находящиеся рядом с гидроксильной группой в спиртах. По этой причине первичные спирты при прочих равных условиях образуют сложные эфиры легче, чем вторичные и, тем более, чем третичные спирты, и по реакционной способности спирты можно расположить в следующий ряд:
При проведении этерификации третичными спиртами следует также учитывать возможность изменения механизма реакции и протекания конкурирующей реакции элиминирования с образованием алкенов:
В лабораторной практике для получения сложных эфиров реакцией прямой этерификации используют следующие методики.
Этерификация
Этерификация (от др.-греч. αἰθήρ — эфир и лат. facio — делаю) — реакция образования сложных эфиров при взаимодействии кислот и спиртов:
RCOOH + R’OH ⇔ RCOOR’ + Н2О
Механизм реакции
Реакция протекает в условиях кислотного катализа и проходит по механизму нуклеофильного замещения. На первой стадии происходит протонирование атома кислорода карбонильной группы карбоновой кислоты с образованием резонансно стабилизированого карбокатиона:
после чего происходит нуклеофильная атака атома кислорода гидроксильной группы спирта на карбониевый центр с образованием алкилоксониевого иона, эта стадия является лимитирующей. Затем в алкилоксониевом ионе происходит миграция протона на один из гидроксилов с образованием уходящей группы —O + H2:
Завершающей стадией является отщепление промежуточного продукта присоединения воды и протона — катализатора с образованием сложного эфира:
Механизм реакции подтвержден экспериментом с использованием изотопных меток: при использовании спирта, меченного изотопом 18 O, метка оказывается в составе сложного эфира:
Применение в органическом синтезе
Этерификацию обычно проводят в присутствии катализаторов — сильных кислот (серная кислота, толуолсульфоновая кислота и т. п.).
Реакция этерификации обратима (гидролиз сложных эфиров называется омылением), положение равновесия зависит от строения и концентраций спирта и карбоновой кислоты, то есть для реакционной смеси существует предел этерификации, при котором устанавливается равновесие, характеризующееся определенным соотношением концентраций исходных спирта и кислоты и продукта их реакции — сложного эфира. Так, например, при эквимолярном соотношении этанола и уксусной кислоты в исходной реакционной смеси равновесие устанавливается, когда
2/3 спирта и кислоты прореагируют с образованием этилацетата.
Для повышения выхода сложного эфира используют либо избыток одного из реагентов (обычно спирта), либо отгонку образующейся при этерификации воды в виде азеотропной смеси с добавляемым в реакционную смесь бензолом.
См. также
Полезное
Смотреть что такое «Этерификация» в других словарях:
этерификация — и, ж. éthérificatrion f. хим. Подвергание действию эфира. Этерификация желатина. ЭСХ 1900 2 1026. Этерификация этилового спирта уксусной кислотой. Природа 1935 7 9. Лекс. БСЭ 3: этерифика/ция … Исторический словарь галлицизмов русского языка
этерификация — сущ., кол во синонимов: 1 • эфиризация (1) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
этерификация — Образование эфира из низкомолекулярных исходных соединений, сопровождающееся выделением простейших веществ. [ГОСТ 27244 93] Тематики волокна химические … Справочник технического переводчика
этерификация — esterinimas statusas T sritis chemija apibrėžtis Rūgšties ir alkoholio pavertimas esteriu. atitikmenys: angl. esterification rus. эстерификация; этерификация ryšiai: sinonimas – esterifikacija … Chemijos terminų aiškinamasis žodynas
этерификация — eterinimas statusas T sritis chemija apibrėžtis Alkoholio pavertimas eteriu. atitikmenys: angl. etherification rus. этерификация ryšiai: sinonimas – eterifikacija … Chemijos terminų aiškinamasis žodynas
Этерификация — При действии кислот на алкоголь одновременно происходит 2 реакции: 1) Сначала образование сложного эфира по уравнению: RCO2H + R OH = RCO2R + H2O. 2) Тотчас же разложение эфира водой, образующейся при реакции, по обратному уравнению: RCO2R + Н2O … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Сложные эфиры: способы получения и свойства
Сложные эфиры: способы получения, химические и физические свойства, строение.
Общая формула предельных сложных эфиров: СnH2nO2
Классификация сложных эфиров
По числу карбоксильных групп:
Номенклатура сложных эфиров
В названии сложного эфира сначала указывают алкильную группу, связанную с кислородом, затем кислоту, заменяя суффикс в названии кислоты (-овая кислота) на суффикс -оат.
| Название сложного эфира | Тривиальное название | Формула эфира |
| Метилметаноат | Метилформиат | HCOOCH3 |
| Этилметаноат | Этилформиат | HCOOC2H5 |
| Метилэтаноат | Метилацетат | CH3COOCH3 |
| Этилэтаноат | Этилацетат | CH3COOC2H5 |
| Пропилэтаноат | Пропилацетат | CH3COOCH2CH2CH3 |
Химические свойства сложных эфиров
| Сложные эфиры устойчивы в нейтральной среде, но легко разлагаются при нагревании в присутствии кислот или в присутствии щелочей. |
В присутствии кислот гидролиз сложных эфиров протекает как реакция, обратная этерификации. при гидролизе сложных эфиров образуются спирты и карбоновые кислоты.
R-COO-R’ + H2O = R-COOH + R’-OH
При щелочном гидролизе сложных эфиров образуются соли карбоновых кислот и спирты.
При щелочном гидролизе этилацетата образуются ацетат и этанол:
Щелочной гидролиз сложных эфиров — реакция, имеющая промышленное значение. Гидролиз жиров в присутствии оснований — древнейший способ получения мыла. Первые способы получения мыла связаны со смешиванием жира с золой. Один из основных компонентов животного жира — тристеарат глицерина. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:
2. Переэтерификация
Переэтерификация — это реакция превращения одного сложного эфира в другой под действием соответствующих спиртов в присутствии катализатора (кислоты или основания)
R-COO-CH3 + R’-OH = R-COOR’ + CH3-OH
3.Восстановление сложных эфиров
Сложные эфиры восстанавливаются с разрывом связи С-О карбоксильной группы. При этом образуется смесь спиртов.
| Например, этилбензоат восстанавливается литийалюминийгидридом до бензилового спирта и этанола |
Получение сложных эфиров
1. Этерификация карбоновых кислот спиртами
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2. Соли карбоновых кислот с галогеналканами
При взаимодействии солей карбоновых кислот с галогеналканами образуются сложные эфиры.
| Например, при взаимодействии ацетата натрия с хлорметаном образуется метилацетат. |
CH3-COONa + CH3-Cl = CH3-COOH + NaCl
Этерификация
Полезное
Смотреть что такое «Этерификация» в других словарях:
этерификация — и, ж. éthérificatrion f. хим. Подвергание действию эфира. Этерификация желатина. ЭСХ 1900 2 1026. Этерификация этилового спирта уксусной кислотой. Природа 1935 7 9. Лекс. БСЭ 3: этерифика/ция … Исторический словарь галлицизмов русского языка
Этерификация — (от др. греч. αἰθήρ эфир и лат. facio делаю) реакция образования сложных эфиров при взаимодействии кислот и спиртов: RCOOH + R’OH ⇔ RCOOR + Н2О Механизм реакции Реакция протекает в условиях кислотного катализа и проходит по … Википедия
этерификация — сущ., кол во синонимов: 1 • эфиризация (1) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
этерификация — Образование эфира из низкомолекулярных исходных соединений, сопровождающееся выделением простейших веществ. [ГОСТ 27244 93] Тематики волокна химические … Справочник технического переводчика
этерификация — esterinimas statusas T sritis chemija apibrėžtis Rūgšties ir alkoholio pavertimas esteriu. atitikmenys: angl. esterification rus. эстерификация; этерификация ryšiai: sinonimas – esterifikacija … Chemijos terminų aiškinamasis žodynas
этерификация — eterinimas statusas T sritis chemija apibrėžtis Alkoholio pavertimas eteriu. atitikmenys: angl. etherification rus. этерификация ryšiai: sinonimas – eterifikacija … Chemijos terminų aiškinamasis žodynas
Этерификация — При действии кислот на алкоголь одновременно происходит 2 реакции: 1) Сначала образование сложного эфира по уравнению: RCO2H + R OH = RCO2R + H2O. 2) Тотчас же разложение эфира водой, образующейся при реакции, по обратному уравнению: RCO2R + Н2O … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Какие реакции называются реакциями этерификации
Итак, реакцией этерификации называется взаимодействие спиртов с карбоновыми кислотами, приводящее к образованию сложных эфиров:
В этой реакции молекула спирта выступает в роли нуклеофильного агента, атакующего бедный электронами углеродный атом карбонильной группы.
Реакции этерификации обратимы и, следовательно, ограничены состоянием равновесия. Превращение эквимолекулярных количеств кислоты и спирта в теоретически вычисленное количество сложного эфира по причине обратимости реакции невозможно. В результате реакции образуется некоторое максимальное количество эфира (которое всегда ниже теоретического) и остаются непрореагировавшие спирт и кислота. Например, при нагревании с обратным холодильником эквимолекулярных количеств уксусной кислоты и этилового спирта в реакцию вступает лишь 2/3 г-мол каждого компонента, поэтому максимальный выход эфира в этих условиях составляет лишь 2/3 теоретического, т. е. 66,7%.
По мере того как кислота и спирт реагируют друг с другом и происходит накопление продуктов их взаимодействия (эфира и воды), скорость обратной реакции, вначале незначительная, возрастает. При этом скорость прямой реакции постепенно умень-шается. Наконец, наступает динамическое равновесие, когда в единицу времени в сложный эфир превращается столько же молекул кислоты и спирта, сколько молекул сложного эфира распадается на кислоту и спирт. Одинаковой скоростью этих противоположно протекающих процессов обусловлен постоянный состав системы. Поскольку скорость бимолекулярной реакции пропорциональна произведению концентраций реагирующих веществ, мы можем для скоростей прямой и обратной реакций написать уравнения:
Частное К2/К1 является константой равновесия и обозначается буквой К.
Из полученного уравнения следует, что в состоянии равновесия отношение произведений концентраций реагирующих веществ обратно отношению констант скоростей реакций. В случае реакции образования уксусноэтилового эфира в состоянии равновесия, как упомянуто выше, в реакционной смеси содержится по 1/3 моля кислоты и спирта и по 2/3 моля эфира и воды. Поэтому
После решения этого уравнения находим, что х = 0,85 моля, то есть выход эфира равен 85% теоретического.
Карбоновые кислоты, как видно из вышесказанного, реаги-руют со спиртами относительно медленно. Это объясняется слабой активностью карбонильной группы в кислотах по отношению к нуклеофильным агентам по сравнению с активностью той же группы в ангидридах и хлорангидридах кислот, поскольку +М-эффект гидроксильной группы приводит к уменьшению положительного заряда карбонильного углерода
Реакцию этерификации можно проводить и в паровой фазе над твердыми катализаторами. Пары спирта и кислоты при 280—300° С пропускают через трубку с катализатором (ThO2 или TiO2). Выходы сложных эфиров в этом случае такие же, как и при реакциях в гомогенной фазе.
В результате этерификации в этих условиях эфиры также получаются в виде солей. Например, из аминоуксусной кислоты (гликоколя) и абсолютного этилового спирта образуется хлористоводородная соль эфира гликоколя
Свободный эфир из соли можно получить, удаляя хлористый водород окисью серебра: