какие реакции являются гомогенными и гетерогенными
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
В химии существуют такие термины как гетерогенная реакция и гомогенная реакция. Для понимания этих явлений, нужно обратиться к значению слов.
«Гетерогенность» трактуется как разнородность по структуре. Гомогенные вещества наоборот составляют единое целое, то есть однородность.
Примером гетерогенной смеси является вода и жир, а раствор поваренной соли относится к гомогенному соединению.
Что такое гетерогенные реакции
Гетерогенными реакциями ученые называют взаимодействия разнородных составляющих, то есть находящихся в различных фазах.
где известняк (карбонат кальция) разлагается на оксид кальция и углекислый газ.
Другие примеры: восстановление оксидов металлов при помощи углерода или водорода:
Растворение в кислоте металла записана формулой:
Для гетерогенных реакций характерным моментом является участие конденсированных фаз (то есть образований, которые, в зависимости от входящих в состав атомов или молекул, можно смоделировать разными способами).
Это создает трудности перемешивания и кинетики полученных продуктов. При этом возможно получение такого состояния, когда молекулы реагентов активируются на границе раздела фаз.
Одним из примеров гетерогенных процессов – разложение паров этилового спирта. Это первая реакция из органической химии, которая была изучена.
Как отличить гомогенную от гетерогенной реакции
Для гетерогенной реакции характерно следующее явление: реагенты, участвующие в процессе, состоят в разных фазах.
Это значит что в объеме, где находятся две или несколько фаз, взаимодействие протекает на границе раздела.
В гомогенном процессе вещества находятся в одной из фаз (жидкой, твердой либо газообразной), и зоной протекания служит весь объем.
Гетерогенные реакции, в зависимости от агрегатного состояния исходных веществ, бывают следующих типов:
Скорость гетерогенной реакции и влияющие на нее факторы
На скорость гетерогенных химических процессов влияют разные факторы.
Рассмотрим их подробнее.
Концентрация реагентов
С повышением концентрации веществ они сильнее взаимодействуют. Концентрированная кислота реагирует с цинком намного быстрее, чем разбавленная.
Природа реагирующих веществ
Скорость протекания химических процессов зависит от природы реагентов. По-другому можно сказать, что разные вещества взаимодействуют между собой с разной скоростью.
К примеру, цинк мгновенно вступает в реакцию с соляной кислотой, а железо будет реагировать с ней гораздо медленнее.
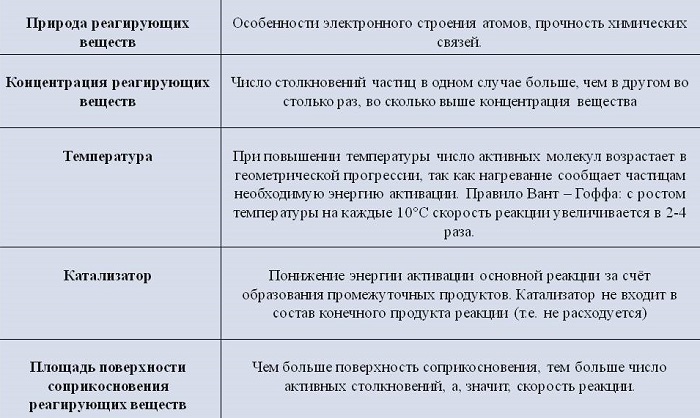
Увеличение поверхности реагентов повышает скорость гетерогенных реакций. Для этого твердые элементы измельчают. Пример: чтобы железо и сера вступили во взаимодействие, железо превращают в опилки.
Температура исходных веществ
Температура существенно повышает скорость реакции. Некоторые вещества при повышении температуры всего на 10 градусов начинают вступать в реакцию быстрее от 2 до 4 раз.
Наличие катализатора
Для повышения скорости протекания процессов применяют катализаторы. При этом они сами не расходуются.
Например, при добавлении оксида марганца происходит бурный распад перекиси водорода 2H2O2 = 2H2O + O2↑
Остающийся на дне оксид марганца можно использовать еще раз.
Ингибиторами называются вещества, которые, в отличие от катализаторов, замедляют скорость взаимодействия.
Катализаторами биологических процессов являются белки. Их еще называют энзимами.
Примеры решения задач
Задача 1
Твердый малорастворимый электролит, растворяясь, устанавливает равновесие:
По закону действующих масс, для этого состояния составляется уравнение, чтобы найти произведение растворимости (ПР):
Задача 2
Определить процессы, происходящие в растворе с ионами Cl, Br, J при добавлении катиона Ag.
Гетерогенные реакции — формулы, особенности протекания и примеры задач
В химии существуют такие термины как гетерогенная реакция и гомогенная реакция. Для понимания этих явлений, нужно обратиться к значению слов.
«Гетерогенность» трактуется как разнородность по структуре. Гомогенные вещества наоборот составляют единое целое, то есть однородность.
Примером гетерогенной смеси является вода и жир, а раствор поваренной соли относится к гомогенному соединению.
Что такое гетерогенные реакции
Гетерогенными реакциями ученые называют взаимодействия разнородных составляющих, то есть находящихся в различных фазах.
Термическое разложение солей на газообразные и твердые продукты — типичный пример гетерогенной реакции:
где известняк (карбонат кальция) разлагается на оксид кальция и углекислый газ.
Другие примеры: восстановление оксидов металлов при помощи углерода или водорода:
Растворение в кислоте металла записана формулой:
Для гетерогенных реакций характерным моментом является участие конденсированных фаз (то есть образований, которые, в зависимости от входящих в состав атомов или молекул, можно смоделировать разными способами).
Это создает трудности перемешивания и кинетики полученных продуктов. При этом возможно получение такого состояния, когда молекулы реагентов активируются на границе раздела фаз.
Одним из примеров гетерогенных процессов – разложение паров этилового спирта. Это первая реакция из органической химии, которая была изучена.
Как отличить гомогенную от гетерогенной реакции
Для гетерогенной реакции характерно следующее явление: реагенты, участвующие в процессе, состоят в разных фазах.
Это значит что в объеме, где находятся две или несколько фаз, взаимодействие протекает на границе раздела.
В гомогенном процессе вещества находятся в одной из фаз (жидкой, твердой либо газообразной), и зоной протекания служит весь объем.
Гетерогенные реакции, в зависимости от агрегатного состояния исходных веществ, бывают следующих типов:
Скорость гетерогенной реакции и влияющие на нее факторы
На скорость гетерогенных химических процессов влияют разные факторы.
Рассмотрим их подробнее.
Концентрация реагентов
С повышением концентрации веществ они сильнее взаимодействуют. Концентрированная кислота реагирует с цинком намного быстрее, чем разбавленная.
Природа реагирующих веществ
Скорость протекания химических процессов зависит от природы реагентов. По-другому можно сказать, что разные вещества взаимодействуют между собой с разной скоростью.
К примеру, цинк мгновенно вступает в реакцию с соляной кислотой, а железо будет реагировать с ней гораздо медленнее.
Увеличение поверхности реагентов повышает скорость гетерогенных реакций. Для этого твердые элементы измельчают. Пример: чтобы железо и сера вступили во взаимодействие, железо превращают в опилки.
Температура исходных веществ
Температура существенно повышает скорость реакции. Некоторые вещества при повышении температуры всего на 10 градусов начинают вступать в реакцию быстрее от 2 до 4 раз.
Наличие катализатора
Для повышения скорости протекания процессов применяют катализаторы. При этом они сами не расходуются.
Например, при добавлении оксида марганца происходит бурный распад перекиси водорода 2H2O2 = 2H2O + O2↑
Остающийся на дне оксид марганца можно использовать еще раз.
Ингибиторами называются вещества, которые, в отличие от катализаторов, замедляют скорость взаимодействия.
Катализаторами биологических процессов являются белки. Их еще называют энзимами.
Примеры решения задач
Задача 1
Твердый малорастворимый электролит, растворяясь, устанавливает равновесие:
По закону действующих масс, для этого состояния составляется уравнение, чтобы найти произведение растворимости (ПР):
ПР = [Са 2+ ] 3 [PO4 3- ] 2 / [Са3(РО4)2 ].
Задача 2
Определить процессы, происходящие в растворе с ионами Cl, Br, J при добавлении катиона Ag.
Какие реакции являются гомогенными и гетерогенными
§9.5 Реакции гомогенные и гетерогенные. Факторы, влияющие на скорость химической реакции.
Кинетические уравнения, рассмотренные в предыдущем параграфе, справедливы только для гомогенных реакций, т.е. для таких реакций, которые идут в какой-нибудь одной фазе – газовой или жидкой. Например, это могут быть реакции между двумя газами, либо реакции, протекающие при сливании растворов:
NaOH(р-р) + HCl(р-р) = NaCl(р-р) + H2O.
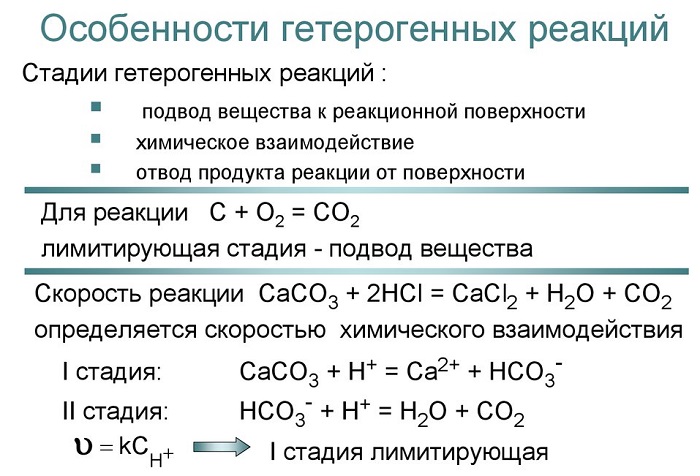
Но существует и множество других реакций, происходящих на границах раздела фаз – между газообразным веществом и раствором, между раствором и твердым веществом, между твердым и газообразным веществами. Такие реакции называются гетерогенными. В качестве типичного примера гетерогенной реакции рассмотрим лабораторный метод получения водорода из металлического цинка и разбавленной серной кислоты:
Рис. 9-11. Разная скорость реакции в опытах с одной крупной или несколькими мелкими гранулами цинка в серной кислоте.
Цинк в виде гранул (кусочки металла неправильной формы и разной величины) помещают в разбавленный раствор серной кислоты и собирают выделяющийся газообразный водород. В пробирке с одной крупной гранулой реакция идет заметно медленнее (рис. 9-11). При одинаковой массе цинка в пробирках количество выделившегося водорода в обоих опытах будет одинаковым, но в пробирке с мелкими гранулами реакция закончится быстрее. Причина в том, что реакция между цинком и раствором серной кислоты идет только на поверхности контакта гранул с раствором (граница раздела фаз), а общая поверхность у нескольких мелких гранул больше, чем у одной крупной гранулы той же массы. Цинк в виде порошка для этой реакции использовать просто опасно – реакция начинает идти настолько быстро, что смесь выплескивается из пробирки.
Для такой гетерогенной реакции уже нельзя записать кинетическое уравнение вида:
** Но и такое уравнение не сможет достаточно хорошо описывать скорость нашей реакции. Во-первых, в ходе реакции гранулы постепенно уменьшаются в размерах, площадь их поверхности меняется и константа скорости реакции k уже не может учитывать это изменение. Если использовать гранулы из очень чистого цинка, то к ним «прилипает» образующийся водород (как это ни удивительно) и площадь контакта реагентов меняется непредсказуемо. Во-вторых, на поверхности раздела фаз концентрация серной кислоты совсем не такая, как в верхних слоях раствора. В зоне реакции активно образуется раствор соли ZnSO4, который вытесняет раствор серной кислоты с поверхности гранул.
Итак, мы видим, что в общем случае скорость гетерогенной реакции зависит от:
а) скорости подвода реагентов к границе раздела фаз;
б) скорости реакции на поверхности раздела фаз, которая зависит от площади этой поверхности;
в) скорости отвода продуктов реакции от границы раздела фаз.
Стадии (а) и (в) называются диффузионными, (см. словарь терминов) а стадия (б) – кинетической. Та стадия, которая протекает наиболее медленно, называется лимитирующей – именно она определяет скорость реакции в целом.
Универсального выражения для скорости гетерогенных реакций не существует, поскольку каждая из стадий (а-в) при определенных условиях может быть лимитирующей. Но в некоторых случаях, когда диффузионные стадии заведомо не являются лимитирующими из-за активного перемешивания реагентов, а площадь поверхности раздела фаз меняется медленно, можно экспериментально получить кинетические уравнения типа (2), удовлетворительно описывающие протекание гетерогенных реакций. Это имеет важное значение для химического производства, где большинство используемых реакций – гетерогенные.
Когда на экзамене абитуриента просят перечислить факторы, влияющие на скорость химической реакции, то обычно ожидают такого ответа:
— природа реагирующих веществ,
— концентрация реагентов,
— температура,
— наличие катализатора.
** На самом деле этот перечень шире: мы уже знаем, что на скорость гетерогенных реакций сильное влияние оказывает площадь поверхности раздела фаз и диффузия. Однако полезно обобщить перечисленные выше четыре фактора, понимая при этом, что они имеют отношение главным образом к гомогенным реакциям.
Под влиянием природы реагирующих веществ обычно подразумевают то простое обстоятельство, что разные вещества реагируют по-разному. Это тривиальное наблюдение можно сделать более ценным, если анализировать примеры разной реакционной способности сходных по строению веществ в однотипных реакциях. Например, реакция газообразного иодистого водорода с кислородом при комнатной температуре идет с заметной скоростью:
Аналогичная реакция газообразных HCl и O2 с образованием хлора и воды при комнатной температуре идет очень медленно. Обе реакции – окислительно-восстановительные и для их протекания атом галогена в молекулах HCl или HI должен передать электрон кислороду (убедитесь в этом, расставив степени окисления над атомами в уравнении реакции). Иод в молекуле HI – более подходящий донор электрона, т.к. его валентная оболочка находится существенно дальше от ядра, чем у атома хлора в молекуле HCl. Таким образом, знание электронного строения атомов и молекул реагирующих веществ часто позволяет качественно оценить относительные скорости некоторых реакций. Также под природой реагирующих веществ иногда могут подразумевать степень их раздробленности в гетерогенных реакциях.
Влияние концентрации реагентов на скорость реакций мы уже достаточно подробно обсудили – кинетические уравнения количественно учитывают этот фактор.
Что касается влияния температуры, то этот фактор действует одинаково как на скорость реакции v, так и на константу скорости k – обе эти величины быстро возрастают с повышением температуры. Полезно рассмотреть влияние температуры именно на константу скорости – в этом случае нашу задачу не осложняют постоянно меняющиеся в ходе реакции концентрации реагирующих веществ.
Еще в XIX веке голландский физикохимик Вант-Гофф опытным путем обнаружил, что при повышении температуры на 10 о С скорости многих реакций возрастают в 2-4 раза. На языке химической кинетики правило Вант-Гоффа можно выразить следующим соотношением:
Температурные коэффициенты используют главным образом в учебной литературе – для нужд химической кинетики они мало пригодны, поскольку не сохраняют строго постоянных значений в разных интервалах температур. Но нам с вами температурные коэффициенты позволят наглядно разобраться в характере зависимости скорости реакции от температуры. Эта зависимость нелинейная, т.е. скорость реакции возрастает гораздо быстрее, чем температура.
Где n – число 10-градусных интервалов в заданном интервале повышения температуры. В нашем примере при повышении температуры от 50 о до 100 о таких интервалов 5. При этом мгновенная скорость реакции и константа скорости реакции возрастут примерно в 595 раз:
** Правило Вант-Гоффа используется для приближенной оценки изменения константы скорости реакции при повышении или понижении температуры. Более точное соотношение между константой скорости и температурой установил шведский химик Сванте Аррениус:
Здесь k – константа скорости, e – важное в математике число (равное приблизительно 2,71 и возникающее во многих математических преобразованиях), R – газовая постоянная, T – абсолютная температура в Кельвинах (об R и T см. в §5.6 книги 1), Ea – энергия активации. Еще одна постоянная А – «константа Аррениуса» или «предэкспонента» определяется для каждой конкретной реакции и имеет ту же размерность, что и константа скорости k.
Многие наши читатели пока не знакомы с логарифмами, поэтому здесь мы не будем приводить способ решения такого уравнения. Для нас сейчас важен общий нелинейный характер зависимости константы скорости k от температуры, а также характер связи между скоростью реакции и энергией активации. Если левую и правую части уравнения Аррениуса разделить на постоянную А и записать число e его приближенным численным значением, то уравнение примет вид:
Напомним, что Ea – величина примерно постоянная для каждой реакции, не зависящая от температуры. В полученном выражении она входит в показатель степени при 2,71. Чем больше Ea конкретной реакции, тем больше будет знаменатель дроби и тем меньше (при данной температуре) будет константа скорости k (и скорость) этой реакции. Если же рассматривать какую-нибудь одну реакцию (с фиксированной Ea) при разных температурах, то повышение Т быстро уменьшает нижнюю часть дроби и, следовательно, измеряемая k будет быстро расти.
9.21 (ФМШ). Температурный коэффициент газовой реакции 2А + В = С равен 3. Как изменится константа скорости реакции при повышении температуры от 20 о С до 80 о С и одновременном увеличении давления в 2 раза?
Какие реакции являются гомогенными и гетерогенными
ХимTeam | ЕГЭ ХИМИЯ 2022 запись закреплена
ГОМОГЕННЫЕ И ГЕТЕРОГЕННЫЕ РЕАКЦИИ
Это однозначно встретится вам в задании 19, и здесь не все так очевидно
Гомогенные (однородные) реакции идут в какой-нибудь одной фазе – газовой или жидкой.

NO₂ (г) + CO(г) = NO(г) + CO₂ (г)

NaOH(р-р) + HCl(р-р) = NaCl(р-р) + H₂O.
В гомогенных реакциях мы не видим границу раздела фаз.
Но существует и множество других реакций, происходящих на границах раздела фаз – такие реакции называются гетерогенными (неоднородными).
Гетерогенные реакции в зависимости от агрегатного состояния исходных веществ бывают следующих типов:

C(тв.) + O₂ (г.)=CO₂

C₂H₂ (г.) + H₂O (ж.) = CH3COH

ZnO (тв.) + 2HCl (р-р) = ZnCl₂ + H2O

Fe (тв.) + S (тв.) = FeS

При этом реагенты и продукты могут и не находиться в разных фазах.
Например, при реакции N₂ + ЗН₂ ⇄ 2NH₃, протекающей на поверхности железного катализатора, реагенты и продукт реакции находятся в газовой фазе и образуют гомогенную систему, однако реакция относится к гетерогенным