какие самые большие антитела на коронавирус могут быть
Из какого теста: зачем проверять антитела и как делать это правильно
Для чего сдают тесты на антитела?
Тесты выполняются на наличие антител (иммуноглобулинов) IgA, IgM и IgG.
— Антитела IgG начинают вырабатываться примерно через 10-14 дней после появления симптомов. Их появление указывает на то, что у человека сформировался долговременный иммунитет. То есть речь идет либо о поздней фазе заболевания, когда больной уже выздоравливает, либо о том, что человек переболел COVID-19 раньше.
Какой тест можно сделать перед прививкой?
Сейчас тесты на антитела IgG чаще всего выполняют люди, которые собираются пройти вакцинацию, чтобы убедиться, что они не перенесли COVID-19 раньше бессимптомно и у них нет иммунитета, полученного естественным путем. Если тест показывает положительный титр антител IgG, вакцинацию можно отложить.
А если человек хочет проверить уровень антител после прививки? Сейчас многие сравнивают свои показатели.
Надо понимать, что тесты, которые используют в лабораториях, разные и шкалы у них используются тоже разные. Поэтому если пытаться сравнивать результаты (хотя большого смысла в этом нет), то надо по меньшей мере быть уверенным, что вы выполняли тестирование одним и тем же тестом.
Что такое «коэффициент позитивности»?
При этом еще раз отмечу, что у других производителей тестов шкала может быть другой и показатели, соответственно, тоже. При этом, получая результат теста в лаборатории, вы всегда можете увидеть на бланке референсные значения и сравнить результат с ними.
Каким тестом можно проверить поствакцинальный иммунитет?
Такой тест называется «Количественное определение антител к RBD домену S1 белка коронавируса (антитела IgG)» (выполняется методом хемилюминесцентного иммуноанализа сыворотки и плазмы крови, Abbot).
Это количественный анализ на IgG-антитела. Он поможет оценить иммунный ответ и в случае заражения (или перенесенного COVID-19), и для контроля поствакцинального иммунитета.
Когда делать:
— на текущую или перенесенную инфекцию не ранее чем через три недели после появления симптомов или получения положительного результата ПЦР-теста;
— для оценки поствакцинального иммунитета через три недели после второй дозы вакцины.
О чем говорят результаты:
Для чего нужно сдавать ПЦР-тест на COVID-19?
Этот тест сдается, чтобы проверить, болен ли человек или, возможно, является носителем вируса (даже если у него нет никаких симптомов нездоровья), выделяет ли он в настоящий момент вирус из верхних дыхательных путей, то есть является источником инфекции для окружающих.
Это единственный и ставший уже стандартным тест для туристов: при въезде практически все страны требуют предъявить справку о тесте, сданном перед отъездом. После возвращения из поездки тест придется сдать еще дважды и результат загрузить на портал госуслуг.
Кроме того, можно сдать ПЦР-тест, чтобы убедиться, что вы здоровы, то есть исключить бессимптомное течение заболевания. Это может понадобиться, если, например, вам предстоит встреча с пожилыми родственниками и вы не хотите рисковать их здоровьем. Кроме того, с помощью такого тестирования можно проверить, не заразились ли вы коронавирусом, если вы точно знаете, что контактировали с заболевшим.
Как правильно сдавать тесты?
Для теста ПЦР: берется мазок биоматериала со слизистой носоглотки. Анализ сдается натощак либо через три часа (или позже) после еды. За три часа до взятия мазка нельзя чистить зубы, полоскать рот, пить, жевать жевательную резинку, применять антисептические таблетки, полоскания и спреи.
Для теста на антитела: берется кровь из вены. Сдавать кровь нужно натощак утром или днем не менее чем через четыре часа после последнего приема пищи.
Антитела. Что нужно знать
Сейчас это слово у всех на слуху. Но какова роль антител в защите организма? Действительно ли анализ на антитела снимает все вопросы о том, сталкивались ли вы с вирусом? Насколько он точен? Почему антитела могут усугубить болезнь? Читайте в нашем разборе
Коротко
Антитела создаются клетками иммунитета для борьбы с конкретным вредителем: вирусом, бактерией или паразитом.
Они появляются не сразу, потому что организму нужно время на изучение вредителя (патогена).
Чем больше антител, тем сильнее защита. Со временем они могут исчезнуть, но клетки способны создавать их вновь при столкновении со знакомой опасностью.
Вариантов антител для одного патогена может быть много. Тесты могут «увидеть» не все, поэтому их точность не абсолютна.
Вирус может мутировать, и тогда старые антитела не смогут его распознать. Или, распознав, не смогут обезвредить и сами станут его проводниками в клетки.
Как антитела связаны с иммунитетом?
Это один из главных его инструментов в борьбе с угрозами. Антитела — не самостоятельные клетки, а белковые структуры, которые создаются защитными клетками (лимфоцитами) под определенную мишень. Бывает, что ею оказываются и вполне безобидные вещества — например, пыльца или белок куриных яиц. Так возникает аллергическая реакция. Но чаще всего антитела борются с вирусами, бактериями, паразитами и прочими «диверсантами».
Антитела могут вырабатываться и против собственных клеток организма — их называют аутоиммунными. На каждой клетке тела есть специальные белковые молекулы — опознавательные знаки, которые говорят, что она «своя». Но если клетка состарилась, погибла или переродилась в злокачественную, против нее тоже высылают «наряд» на уничтожение.
То есть антитела уничтожают вирусы и бактерии?
Не совсем. Задача антител в том, чтобы обезвредить «нарушителя», чтобы он не мог размножаться, или пометить его для уничтожения. Например, они налипают на вирусные частицы, мешая им проникать в клетку. Так как вирус не способен размножаться вне клеток, он погибает. Также антитела могут склеивать бактерии в комочки, которые затем пожираются фагоцитами, или активировать систему иммунных белков, которые прорвут мембрану бактерии и убьют ее.
Антитело работает как молекулярная отмычка: оно рождается на свет уже заточенным под определенную особенность строения чужеродного тела. Например, это может быть участок (шип) на поверхности вирусной частицы, с помощью которого она связывается с клеткой. Антитело блокирует шип, и вирус не может заразить клетку. У родственных вирусов могут быть схожие элементы строения, и тогда антитела к одному представителю семейства будут эффективны против другого. Например, некоторые люди, переболевшие в прошлом атипичной пневмонией (ее вызывает вирус SARS-CoV-1), уже имеют эффективные антитела против его родственника — SARS-CoV-2, который вызывает инфекцию COVID-19.
Почему антитела во время болезни образуются не сразу?
Чтобы создать нужное антитело, иммунной системе сначала нужно изучить нарушителя. Для этого в организме сотрудничают разные «ведомства». Сначала клетки-перехватчики (макрофаги) поглощают и переваривают чужеродные частицы. Затем знакомят с их строением клетки-«лаборатории» (B-лимфоциты). Те, в свою очередь, образуют множество своих копий с разными вариантами «отмычек». Подходящие варианты отправляются на конвейер.
Весь процесс занимает несколько дней, а устойчивый иммунитет достигается за неделю-две. Например, на 14-й день заболевания COVID-19 антитела появляются у половины зараженных, а спустя 20–24 дня — почти у всех пациентов. А тесты на наличие антител к коронавирусу специалисты советуют сдавать только через одну-две недели через одну-три недели с момента возникновения первых симптомов.
Если нет антител, значит, не было заражения?
Возможно, было, но иммунитет не успел отреагировать выработкой антител. Такое случается, например, когда в организм попало мало возбудителей или ему активно помогали с помощью лекарств. С одной стороны, это хорошо, ведь такие люди обычно переносят инфекцию в легкой форме. С другой стороны, в иммунной системе не остается следов — так называемой антительной памяти. А значит, во второй раз заражение может протекать так же, как и в первый. Или даже серьезнее.
У меня нашли антитела. Я больше не заболею?
Есть связь между концентрацией в крови антител и устойчивостью к заражению. Чем выше концентрация, тем сильнее иммунитет. Особенно важно содержание антител класса G — они вырабатываются на последней стадии, когда организм уже победил инфекцию. Людей с высокой концентрацией таких антител даже призывают стать донорами плазмы. С помощью их крови врачи пытаются помочь тем, кто переносит инфекцию особенно тяжело. Хотя эффективность лечения COVID-19 с помощью донорской плазмы пока не доказана.
Другой вопрос, что концентрация антител со временем падает. Для разных инфекций это происходит с разной скоростью. Например, после кори они остаются в организме на всю жизнь, а после сальмонеллеза — только полгода-год. Если говорить о коронавирусе, данные обследования 20 тыс. человек говорят о том, что у большинства переболевших стойкий антительный иммунитет сохраняется как минимум три месяца.
Иммунитет зависит только от антител?
Не только. Хорошая новость в том, что «память» иммунитета держится не на одних антителах. Ею обладают и клетки. Лимфоциты, которые производят антитела, пребывают в спящем состоянии до повторной встречи с вредителем. В нужный момент они могут быстро наделать новых «снарядов». Правда, у такой подготовки есть и обратная сторона, которая мешает создавать эффективные вакцины от некоторых вирусов.
Сталкиваясь со знакомым вирусом, организм бросает в бой в первую очередь клетки, которые были натасканы на него. Разработку новых антител он приостанавливает, чтобы сэкономить силы. Но вирус может мутировать таким образом, что его уязвимые места окажутся защищенными, а иммунитет этого не распознает. Даже хуже: вирус может использовать прикрепленное к нему антитело, чтобы проникнуть в иммунную клетку и заразить ее.
Как делается тест на антитела?
Для выявления антител в тестах используются антигены — участки с поверхности вируса, с которыми связываются эти самые антитела. Их закрепляют в лунках специальных планшетов, или плашек, а в лунки добавляют кровь пациента. Затем с помощью окрашивания выявляют антитела, которые должны были прикрепиться к антигенам. Если проба меняет цвет, это должно означать, что антитела есть.
Быстрые тесты на антитела, как правило, используются для получения простого результата «да/нет». В них две полоски, как в тесте на беременность. Есть и такие, которые ищут отдельно белки классов M (которые образуются во время болезни) и G (которые остаются в крови после выздоровления). В этом случае в тесте полосок уже три.
Есть и количественные тесты. Они уже позволяют определить не только наличие антител, но и их концентрацию. По ней можно судить и о состоянии иммунитета, и о стадии инфекционного процесса: находится он в острой форме или дело идет к выздоровлению. Для проведения количественных тестов разработчики отталкиваются от устоявшейся нормы антител, которая соответствует разными стадиям.
Стоит ли всегда доверять результатам тестов?
Результат во многом зависит от набора антигенов, которые использовали разработчики. Если выбранные антигены недостаточно специфичны, к ним прицепятся белки, вырабатываемые в ответ на другие патогены, например, родственные коронавирусы, вызывающие обычную простуду. В этом случае тест дает ложноположительный результат.
Бывают и ложноотрицательные результаты — когда у человека есть антитела к тому антигену, который в тесте не представлен. Например, так бывает с вирусами, которые открыли недавно, как в случае с SARS-CoV-2. Ложноотрицательный результат может быть и тогда, когда кровь взяли слишком рано и в ней еще недостаточно антител.
Как выбрать качественный тест на антитела?
Смотрите на показатели чувствительности и специфичности. Чувствительность — это совпадение положительных результатов теста и реальных диагнозов. Специфичность — это способность теста выявлять именно те антитела, которые относятся к конкретному патогену. Недостаточно чувствительный тест может «прозевать» часть случаев, а недостаточно специфичный — заподозрить вирус у тех, у кого его нет.
По результатам недавнего метаанализа самым надежным в определении антител к SARS-CoV-2 оказался тест ИФА — иммуноферментный тест. Его специфичность равна 99%, а чувствительность — 90–94%. Он делается в лабораторных условиях и занимает один-два дня. Менее точен экспресс-тест ИХА (иммунохроматографический), зато он занимает минут десять. На разные типы антител показатели чувствительности/специфичности могут быть разные.
Важно помнить, что тест на антитела показывает не наличие вируса, а лишь возможную реакцию организма на него. Самым точным и надежным методом диагностики вирусной инфекции ВОЗ (Всемирная организация здравоохранения) считает ПЦР-тест. Он позволяет выявить присутствие генетического материала вируса в крови. Помните, что в постановке окончательного диагноза определяющим служит не тест, а клиническая картина.
Иммунный ответ на коронавирус SARS-CoV‑2 у больных COVID‑19
Академик Российской академии наук, д.м. н., президент
ФБГУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
В статье представлен анализ результатов исследований иммунного ответа и памяти к SARS-CoV‑2, включая все ветви адаптивного иммунитета, иммуноглобулины, В-клетки памяти, CD8+- и CD4+-T-клетки у больных в динамике в течение 6–8 месяцев после начала заболевания.
Гуморальное звено
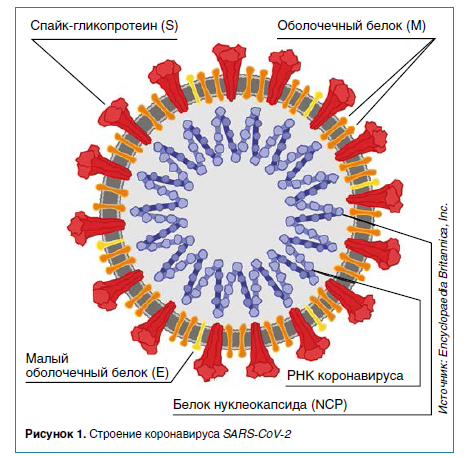
Факт первичного иммунного ответа слизистых на COVID‑19 необычен и требует объяснения. Обсуждаются две гипотезы.
Первая: вирусы контаминируют слизистые дыхательных путей и ЖКТ за 7–14 дней до появления системного ответа и клинических проявлений инфекции, поражая клетки микробиоты — используют их для репродукции вируса.
Вторая: кросс-реактивная продукция антител, предпосылкой которой являются Spike-реактивные CD4+-Т-клетки, обнаруженные у большинства пациентов с COVID‑19 и более чем у 34 % неинфицированных людей. Это подтверждает существование общих эпитопов эндемичных коронавирусов, вызывающих банальные ОРВИ и COVID‑19.
Важно, что изотипы иммуноглобулинов (либо IgG, либо IgA) конкурировали за нейтрализующую активность по отношению к SARS-CoV‑2 в зависимости от локализации. Сывороточные антитела IgG сильно коррелировали с величиной IgG-ответа и тяжестью заболевания. У пациентов, например, с IgA-назальным ответом определялась высокая активность нейтрализации вирусов. Инфекция у таких больных протекала бессимптомно.
Это, с одной стороны, предполагает возможность нейтрализации вируса с помощью IgA слизистых без системного ответа, что имеет отношение к исходам заболевания. А с другой стороны, из-за множества корреляций, наблюдаемых между типами антител и их активностью в разных анатомических участках, клиническая интерпретация гуморального ответа существенно затруднена.
Кроме того, эти данные имеют важное значение для нашего понимания защиты вакцинации, индуцирующей системный ответ на вакцинные гены или белки коронавируса по классическому пути и обеспечивающей иммунный ответ слизистых оболочек на 3–6‑й неделе после вакцинации. В идеале вакцина должна не только защитить реципиента от неизбежной болезни, но и предотвратить бессимптомное носительство, что закрыло бы проблему бессимптомных носителей в популяции.
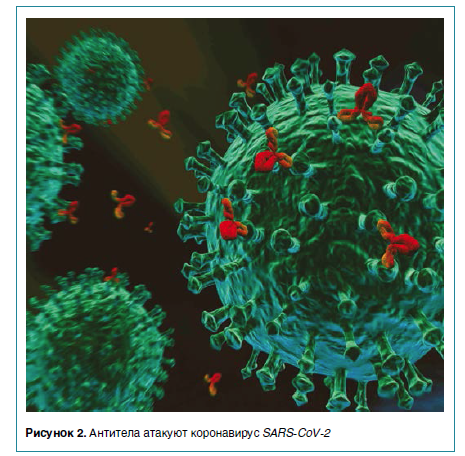
Титры Spike IgА и RBD IgА сохранялись на стабильном уровне на протяжении всего периода наблюдения t1/2— 210 дней, но у отдельных пациентов уровень специфических IgА-антител достоверно снижался через 90 дней.
Нельзя дать однозначный ответ в отношении серонегативных случаев COVID‑19. По-видимому, кроме протективного эффекта иммунитета слизистых, ответ напрямую связан с уровнем вирусной нагрузки SARS-CoV‑2. С одной стороны, высокие вирусные нагрузки связаны с более ранним ответом антител, в то время как у пациентов с низкой вирусной нагрузкой не может быть сероконверсии. С другой стороны, кинетика иммунного ответа может быть показателем скорости элиминации вируса у больного.
Идентификация специфичных В-клеток памяти к Spike, RBD и NCP с использованием флюоресцентно окрашенных зондов на IgD– и (или) CD27+ c последующей дифференцировкой по изотипам поверхностных IgM, IgG или IgA показала следующее. Количество специфических В-клеток увеличивалось в течение 120 дней после начала заболевания с последующим выходом на плато, в то время как Spike-специфические В-клетки памяти у людей, не заболевших COVID‑19, практически не встречались. RBD-специфические В-клетки появлялись на 16‑й день, и их количество увеличивалось в течение последующих 4–5 месяцев. Интересно, что только 10–30 % Spike-специфических В-клеток памяти было специфично для домена RBD через 6 месяцев после выздоровления больных.
NCP-специфичные В-клетки памяти также стабильно увеличивались в те же сроки и определялись спустя 5–6 месяцев после заболевания. Представленность изотипов иммуноглобулинов Spike-специфических В-клеток имела следующую динамику. В ранней фазе (20–60 дней) после заболевания IgM+ и IgG+ на В-клетках были представлены одинаково. В период после 60 дней до 240‑х суток преобладали IgG+ Spike-специфические В-клетки. Частота IgА+ Spike-специфических клеток составляла примерно 5 %, и они равномерно распределялись в течение всего периода наблюдения в 8 месяцев. Корреляция между сывороточным IgA и IgA слизистых оболочек не проводилась.
Сходная картина динамики наблюдалась и в случае IgG+, IgM+ и IgА+ к эпитопам RBD и NCP коронавируса. В то же время долгосрочное присутствие циркулирующих В-клеток памяти, направленных как против основных SARS-CoV‑2‑нейтрализующих таргетов (Spike и RBD), так и против не нейтрализующего таргета (NCP), свидетельствует о клеточной памяти, сохраняющейся после естественного воздействия вируса. Это может быть использовано для планирования ревакцинации. Тот факт, что почти все RBD- специфические IgG+-В-клетки памяти экспрессировали CD27, свидетельствует о долгосрочной иммунной памяти.
Анализ полученных данных говорит о том, что снижение нейтрализующих и других антител к SARS-CoV‑2 после клинического выздоровления вовсе мунитета. Просто с развитием и сохра- нением памяти В-клеток, способных активизироваться при встрече с новыми штаммами коронавируса, уровень антител в сыворотке снижается, в то время как IgА-ответ слизистых сохраняется на постоянном уровне в течении всего периода наблюдения.
Клеточный ответ
Процент больных с обнаруживаемыми циркулирующими CD8+-Т-клетками памяти через месяц после возникновения симптомов составил 70 %. К 6–9 месяцам клетки обнаруживались у 50 % выздоровевших пациентов. Фенотипические маркеры показали, что большинство SARS-CoV‑2‑специфичных CD8+-Т-клеток представлены терминально дифференцированными клетками памяти.
Циркулирующие SARS-CoV‑2‑специфичные CD4+-Т-клетки памяти через месяц после начала заболевания обнаруживались у 93 % пациентов. Через 6–9 месяцев уровень этих клеток был стабильным, а сами они выявлялись у более чем у 90 % пациентов, перенесших COVID‑19. Причем это касалось как Spike-специфичных, так и мембраноспецифичных CD4+-Т-клеток памяти.
Интересно, что при сравнении параметров иммунного ответа у больных с тяжелым и легким течением инфекции гуморальные показатели были более высокими у тяжелых больных, в то время как CD8+-Т-клетки были стабильными, а CD4+ — более низкими в тяжелых случаях заболевания. Объяснений этому феномену нет, важно, что слабый ответ Т-клеток наблюдается в острой фазе заболевания. Кроме того, важна и методология исследования клеточного им-мунитета.
Нарушения клеточного ответа проиллюстрированы дефицитом интерферонов I и II типов у пациентов с тяжелыми и среднетяжелыми формами COVID‑19 по сравнению с легкими и бессимптомными случаями заболевания. Это может быть связано с подавлением воспаления интерлейкином‑12 (IL‑12) и развитием вторичного дефекта клеточного иммунитета.
Иммунное взаимодействие
Большой интерес представляет изучение взаимодействия гуморального и клеточного ответа на SARS-Cov‑2. В исследованиях RBD-IgG, Spike IgА, RBD-В-клеток памяти, CD8+- и CD4+-Т-клеток в динамике у одних и тех же пациентов установлено, что у большинства из них (64 %) положительные показатели отмечались через 1–2 месяц после начала заболевания. Через 5–8 месяцев число реконвалесцентов, позитивных на пять тестов, снизилось до 43 %. В то же время как минимум три из пяти тестов были положительными спустя 6–9 месяцев. Важно отметить, что IgG на Spike дает на порядок больше положительных ответов, чем на RBD-антиген. Попытки связать гуморально- клеточные взаимодействия не привели к успеху из-за неоднородности участников исследования и методик оценки иммунного ответа.
Неопределенный результат
В метаанализе 22 исследований (4969 пациентов) установлены неблагоприятные признаки тяжелых форм болезни и летальных исходов, такие как лимфопения и нейтрофилез. Поскольку CD4+-Т-клетки необходимы для сбалансированного и эффективного иммунного ответа, неудивительно, что низкий уровень лимфоцитов может отражать гипервоспалительные процессы и способствовать более тяжелому течению заболевания и повышенной смертности.
Нейтрофилы как неотъемлемая часть врожденной защиты контролируют баланс микробиоты и элиминацию продуктов клеточной деструкции за счет производства активных форм кислорода и высвобождения нейтрофильных внеклеточных ловушек в венозном кровотоке. Лимфопения (менее 500 клеток в 1 мкл) указывает на повышение риска тяжелой формы заболевания и смертельных исходов при COVID‑19 в 3 раза. Стойкий нейтрофилез со сдвигом влево свидетельствует об истощении костномозгового резерва, а при сдвиге вправо отражает нарушения выхода клеток в ткани. Этот легко контролируемый анализом крови параметр указывает на более чем семикратное увеличение для пациента риска заболеть тяжело и погибнуть от COVID‑19.
Попытки выявить закономерности иммунного ответа на SARS-CoV‑2 оказались пока безуспешными.
Во-первых, можно сделать вывод, что переболевшие коронавирусной инфекцией сохраняют иммунную память в последующие 6–9 месяцев. Дальнейшие динамические исследования покажут, в какие сроки наступает снижение иммунного ответа, требующее профилактической вакцинации и (или) ревакцинации.
Во-вторых, и это очень интересно, каждый изученный компонент иммунного ответа и иммунной памяти демонстрирует различную кинетику. Это связано с индивидуальным ответом на инфекцию, наличием преморбида и частого превращения моноинфекции в смешанные инфекции SARS-CoV‑2 с активизировавшейся микробиотой больного.
В-третьих, неоднородность ответа может быть центральным признаком, характеризующим иммунную память к SARSCoV‑2. Биологические специфические IgG имеют 21 день периода полураспада, уровень антител с течением времени отражает продукцию короткоживущих, а потом и долгоживущих плазматических клеток. С точки зрения исчезновения возбудителя в течение нескольких дней после появления клиники, процесс наработки антител должен быть снижен к 6 месяцам, но, если SARS-CoV‑2 Spike и RBD IgG сохраняются дольше 8 месяцев, это означает, что вирус персистирует в организме хозяина или его микробиоте. Нельзя исключать и связь с пролонгированным иммунным ответом естественной реиммунизации циркулирующими эпидемическими альфа-коронавирусами, поддерживающими иммунный ответ.
В-четвертых, выявление и анализ SARSCoV‑2‑специфических В-клеток памяти потенциально могут применяться в качестве маркера гуморального ответа при вакцинации. Сейчас исследования поствакцинального иммунного ответа проводятся с использованием иммунофлуоресцентного анализа с оценкой IgM- и IgG-антител в качестве маркеров эффективности вакцины (рис. 3). Методы ИФА-диагностики, к сожалению, не стандартизованы едиными белками S, RBD, NCP, качество которых зависит от очистки антигена. Поскольку количество В-клеток памяти стабильно с течением времени, они могут представлять собой более надежный маркер продолжительности гуморальных иммунных реакций, чем иммуноглобулины сыворотки крови.
Таким образом, из результатов исследований иммунного ответа у больных COVID‑19 невозможно сделать какие-либо выводы о защитном иммунитете при новой коронавирусной инфекции. Ведь изучение антител и клеток памяти при этом заболевании пока еще не завершено. А значит, обсуждаемые механизмы защитного иммунитета против SARS-CoV‑2 у людей окончательно не определены.
Источник: Газета «Педиатрия сегодня» №6, 2021
